18.8: Termodinámica y Vida
- Page ID
- 78118
- Comprender la importancia de la termodinámica en los sistemas bioquímicos.
En un sentido termodinámico, una célula viva puede ser vista como un sistema de baja entropía que no está en equilibrio con su entorno y es capaz de replicarse. Se necesita un aporte constante de energía para mantener la estructura altamente organizada de la célula, su amplia gama de biomoléculas plegadas con precisión y su intrincado sistema de miles de reacciones químicas. Una célula también necesita energía para sintetizar moléculas complejas a partir de precursores simples (por ejemplo, para hacer proteínas a partir de aminoácidos), crear y mantener diferencias en las concentraciones de diversas sustancias dentro y fuera de la célula, y hacer trabajo mecánico (por ejemplo, contracción muscular). En esta sección, examinamos la naturaleza del flujo de energía entre una célula y su entorno, así como algunas de las estrategias químicas que utilizan las células para extraer energía de su entorno y almacenar esa energía.
Flujo de energía entre una célula y su entorno
Una implicación de la primera y segunda leyes de la termodinámica es que cualquier sistema cerrado debe alcanzar eventualmente el equilibrio. Sin entrada externa, un reloj se agotará, una batería perderá su carga y una mezcla de un ácido acuoso y una base acuosa logrará un valor de pH intermedio uniforme. En contraste, una célula es un sistema abierto que puede intercambiar materia con su entorno así como absorber energía de su entorno en forma de calor o luz. Las células utilizan la energía obtenida de estas maneras para mantener el estado de no equilibrio que es esencial para la vida.
Debido a que las células son sistemas abiertos, no pueden describirse utilizando los conceptos de termodinámica clásica que hemos discutido en este capítulo, que se han centrado en procesos reversibles que ocurren en sistemas químicos cerrados que pueden intercambiar energía, pero no importa, con su entorno. En consecuencia, se ha desarrollado una subdisciplina relativamente nueva llamada termodinámica de no equilibrio para describir cuantitativamente sistemas abiertos como las células vivas.
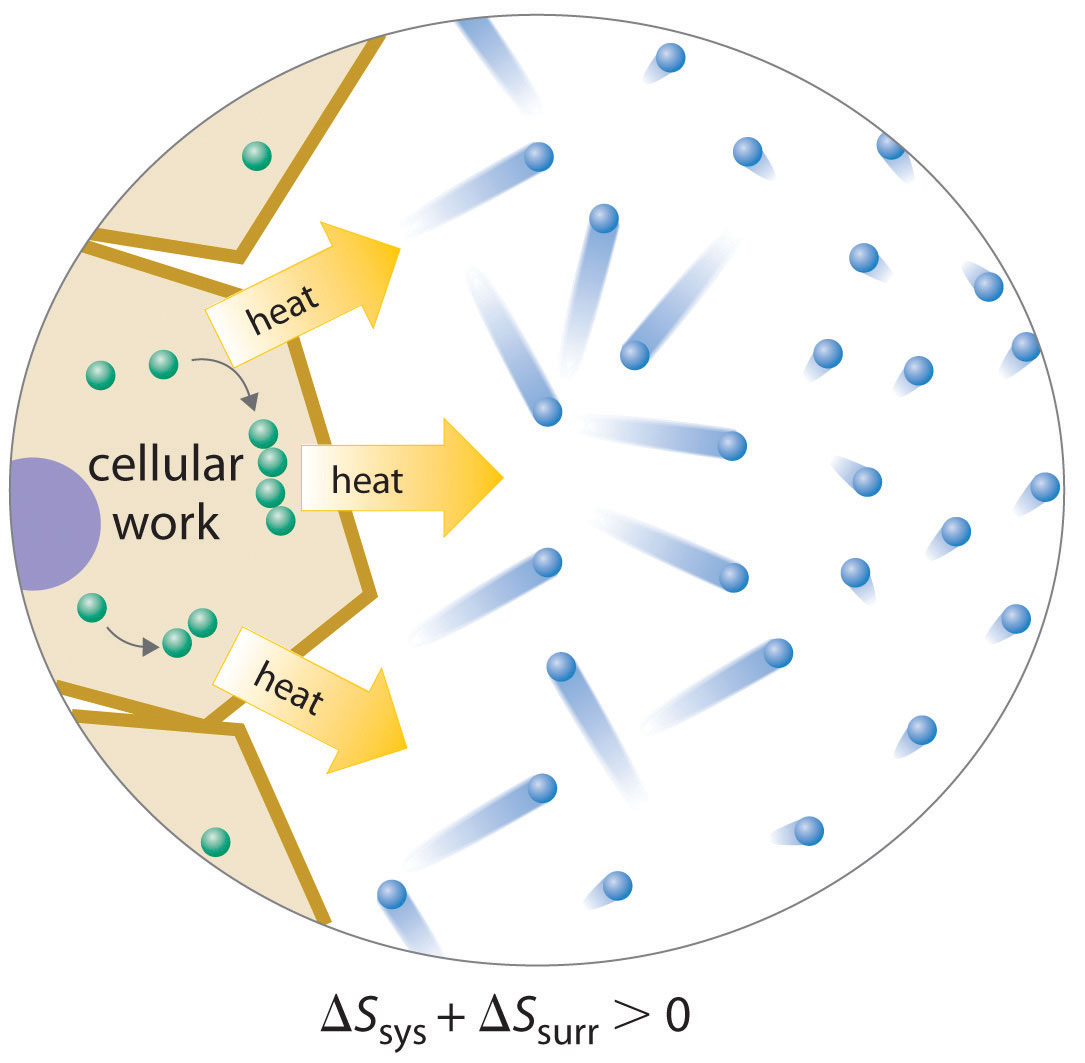
Debido a que una célula no puede violar la segunda ley de la termodinámica, la única forma en que puede mantener un estado de baja entropía, no equilibrio caracterizado por un alto grado de organización estructural es aumentar la entropía de su entorno. Una célula libera parte de la energía que obtiene de su entorno como calor que se transfiere a su entorno, lo que resulta en un incremento de S surr (Figura 18.8.1). Mientras Δ S surr sea positivo y mayor que Δ S sys, la entropía del universo aumenta, por lo que no se viola la segunda ley de la termodinámica. Liberar calor al entorno es necesario pero no suficiente para la vida: la liberación de energía debe acoplarse a procesos que aumenten el grado de orden dentro de una celda. Por ejemplo, un fuego de leña libera calor a su entorno, pero a menos que la energía de la leña que se quema también se utilice para hacer el trabajo, no hay aumento en el orden de ninguna porción del universo.
Figura 18.8.1 Vida y Entropía Una célula viva se encuentra en un estado de baja entropía, no equilibrio caracterizado por un alto grado de organización estructural. Para mantener este estado, una célula debe liberar parte de la energía que obtiene de su entorno en forma de calor, incrementando con ello S surr suficientemente para que no se viole la segunda ley de la termodinámica. En este ejemplo, la celda combina componentes más pequeños en estructuras más grandes y ordenadas; la liberación de calor que acompaña aumenta la entropía del ambiente circundante para que S univ > 0.
Tenga en cuenta el patrón
Cualquier organismo en equilibrio con su entorno está muerto.
Extracción de Energía del Medio Ambiente
Aunque los organismos emplean una amplia gama de estrategias específicas para obtener la energía que necesitan para vivir y reproducirse, generalmente se pueden dividir en dos categorías: los organismos son fototrofos (de las fotos griegas, que significa “luz”, y trofos, que significa “alimentador”), cuya fuente de energía es la luz solar, o quimiótrofos, cuya fuente de energía son compuestos químicos, generalmente obtenidos consumiendo o descomponiendo otros organismos. Los fototrofos, como plantas, algas y bacterias fotosintéticas, utilizan la energía radiante del sol directamente, convirtiendo el agua y el dióxido de carbono en compuestos orgánicos ricos en energía, mientras que los quimiótrofos, como animales, hongos y muchas bacterias no fotosintéticas, obtienen compuestos orgánicos ricos en energía de sus medio ambiente. Independientemente de la naturaleza de sus fuentes de energía y carbono, todos los organismos utilizan reacciones de oxidación-reducción o redox para impulsar la síntesis de biomoléculas complejas. Los organismos que solo pueden usar O 2 como oxidante (un grupo que incluye a la mayoría de los animales) son organismos aeróbicos que no pueden sobrevivir en ausencia de O 2. Muchos organismos que utilizan otros oxidantes (como SO 4 2−, NO 3 −, o CO 3 2−) o compuestos orgánicos oxidados pueden vivir solo en ausencia de O 2, que es un veneno mortal para ellos; tales especies se llaman organismos anaerobios.
La reacción fundamental por la cual todas las plantas verdes y algas obtienen energía de la luz solar es la fotosíntesis La reacción fundamental por la cual todas las plantas verdes y algas obtienen energía de la luz solar en la que el CO 2 se reduce fotoquímicamente a un compuesto de carbono tal como glucosa. El oxígeno en el agua se oxida simultáneamente a O 2, la reducción fotoquímica de CO 2 a un compuesto de carbono como la glucosa. Al mismo tiempo, el oxígeno en el agua se oxida a O 2 (recuerde que h ν es energía de la luz):
\( 6CO_{2} + 6H_{2}O \xrightarrow[photosynthesis]{h\nu} C_{6}H_{12}O_{6} +6O_{2} \tag{18.8.1}\)
Esta reacción no es un proceso espontáneo como está escrito, por lo que la energía de la luz solar se utiliza para impulsar la reacción. La fotosíntesis es fundamental para la vida en la Tierra; produce todo el oxígeno de nuestra atmósfera.
En muchos sentidos, los quimiótrofos son más diversos que los fototrofos porque la naturaleza tanto del reductor (el nutriente) como del oxidante pueden variar. La estrategia quimiotrófica más familiar utiliza compuestos como la glucosa como reductor y el oxígeno molecular como oxidante en un proceso llamado respiración Un proceso por el cual los quimiótrofos obtienen energía de su entorno; la reacción global de la respiración es la inversa de fotosíntesis. La respiración es la combustión de un compuesto de carbono como glucosa a CO 2 y agua. La reacción general de la respiración es la inversa de la fotosíntesis:
\( C_{6}H_{12}O_{6} + 6O_{2} \rightarrow 6CO_{2} + 6H_{2}O \tag{18.8.2}\)
Una estrategia alternativa utiliza la fermentación Un proceso utilizado por algunos quimiótrofos para obtener energía de su ambiente; una reacción química en la que tanto el oxidante como el reductor son compuestos orgánicos. reacciones, en las que un compuesto orgánico es oxidado y reducido simultáneamente. Ejemplos comunes son la fermentación alcohólica, utilizada en la elaboración de vino, cerveza y pan, y la fermentación con ácido láctico, utilizada en la elaboración de yogur:
\( C_{6}H_{12}O_{6} \rightarrow \underset{alcohol fermentation}{2CO_{2} + 2CH_{3}CH_{2}OH} \tag{18.8.3}\)
\( C_{6}H_{12}O_{6} \rightarrow \underset{lactic acid fermentation}{ 2CH_{3}CH\left ( OH \right )CO_{2}H} \tag{18.8.4} \)
En estas reacciones, algunos de los átomos de carbono de la glucosa se oxidan, mientras que otros se reducen. Recordemos que una reacción en la que una sola especie se oxida y se reduce se denomina reacción de desproporción.
El papel del NADH y el ATP en el Metabolismo
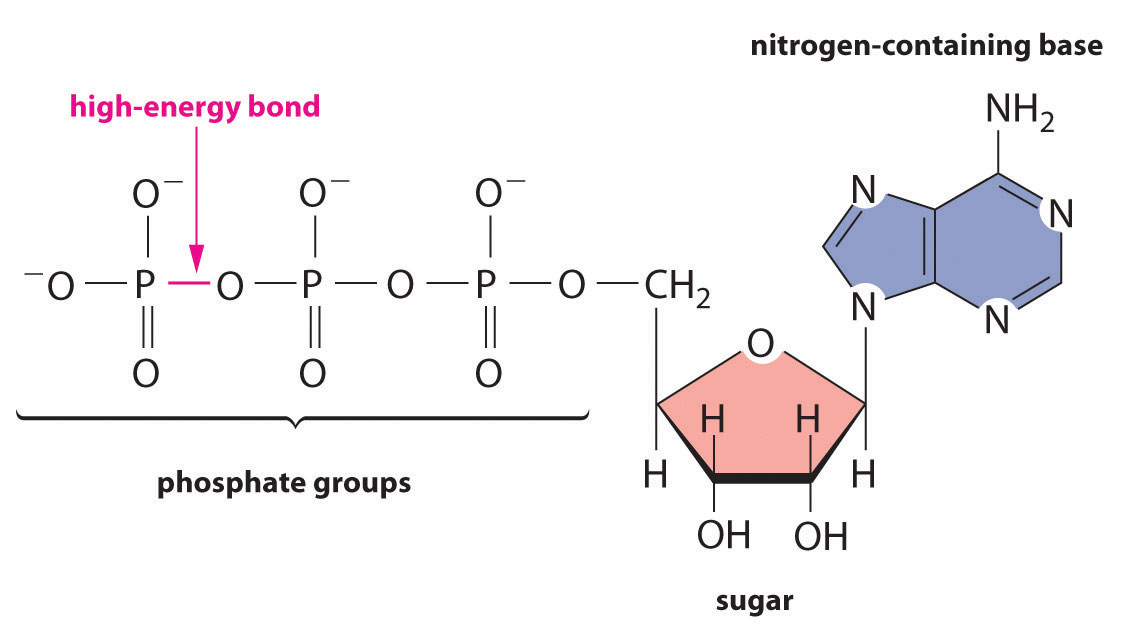
Independientemente de la identidad de las sustancias de las que un organismo obtiene energía, la energía debe liberarse en incrementos muy pequeños para que sea útil para la célula. De lo contrario, la temperatura de la célula subiría a niveles letales. Las células almacenan parte de la energía que se libera como ATP (trifosfato de adenosina), un compuesto que es la moneda energética universal de todos los organismos vivos (Figura 18.8.2).
Figura 18.8.2 ATP, la Moneda Energética Universal de Todas las Células La molécula de ATP contiene una base que contiene nitrógeno, un azúcar y tres grupos fosfato, así como dos enlaces anhídrido de ácido fosfórico de alta energía.
La mayoría de los organismos utilizan varias especies intermedias para transportar electrones entre el reductor terminal (como la glucosa) y el oxidante terminal (como O 2). En prácticamente todos los casos, una especie intermedia oxida el compuesto reducido rico en energía, y el intermedio ahora reducido migra a otro sitio donde se oxida. El más importante de estos intermedios portadores de electrones es NAD + (nicotinamida adenina dinucleótido; Figura 18.19), cuya forma reducida, que contiene formalmente H −, es NADH (nicotinamida adenina dinucleótido reducido). La reducción de NAD + a NADH se puede escribir de la siguiente manera:
\( NAD^{+} + H^{+} \rightarrow NADH \tag{18.8.5} \)
Figura 18.8.3 NAD + y su forma reducida (NADH) Este portador de electrones es utilizado por sistemas biológicos para transferir electrones de una especie a otra. La forma oxidada (NAD +) se reduce a NADH por nutrientes ricos en energía como la glucosa, y la forma reducida (NADH), se oxida a NAD + por O 2 durante la respiración.
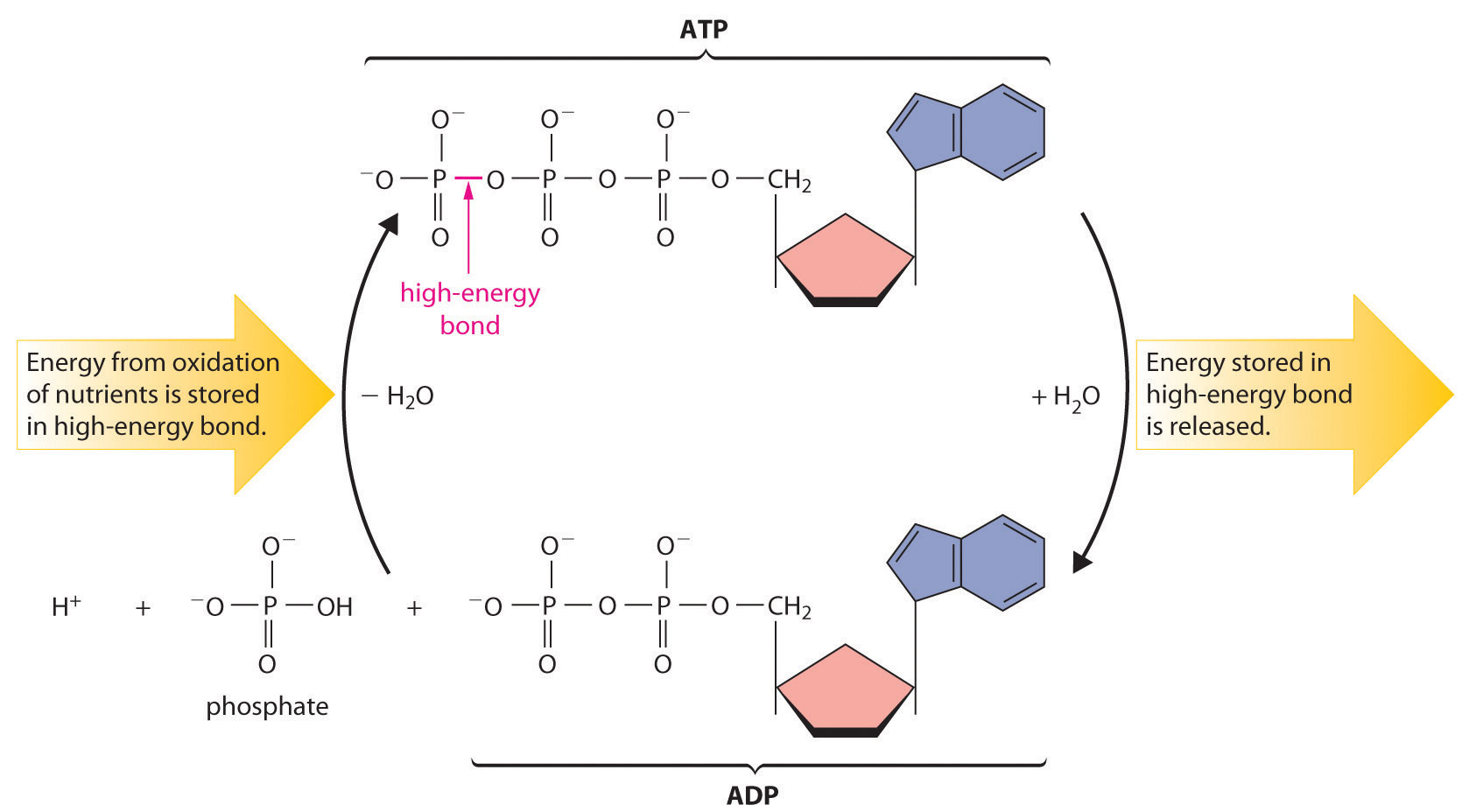
La mayoría de los organismos utilizan NAD + para oxidar nutrientes ricos en energía como glucosa a CO 2 y agua; luego el NADH se oxida a NAD + usando un oxidante como O 2. Durante la oxidación, una fracción de la energía obtenida de la oxidación del nutriente se almacena como ATP. Los enlaces de anhídrido de ácido fosfórico en ATP pueden ser hidrolizados por agua, liberando energía y formando ADP (adenosina difosfato). Es a través de esta secuencia de reacciones que la energía de la oxidación de los nutrientes se pone a disposición de las células. Así, el ATP tiene un papel central en el metabolismo: es sintetizado por la oxidación de nutrientes, y su energía es utilizada entonces por las células para impulsar reacciones sintéticas y realizar trabajos (Figura 18.8.4).
Figura 18.8.5 El ciclo de ATP El enlace anhídrido de ácido fosfórico de alta energía en ATP almacena la energía liberada durante la oxidación de nutrientes. La hidrólisis del enlace de alta energía en ATP libera energía, formando adenosina difosfato (ADP) y fosfato.
Bajo condiciones estándar en reacciones bioquímicas, todos los reactivos están presentes en concentraciones acuosas de 1 M a una presión de 1 atm. Para H +, esto corresponde a un pH de cero, pero muy poca bioquímica ocurre a pH = 0. Para las reacciones bioquímicas, los químicos han definido un nuevo estado estándar en el que la concentración de H + es de 1 × 10 −7 M (pH 7.0), y todos los demás reactivos y productos están presentes en sus condiciones habituales de estado estándar (1 M o 1 atm). El cambio de energía libre y la constante de equilibrio correspondiente para una reacción bajo estas nuevas condiciones estándar se denotan mediante la adición de un signo primo (′) al símbolo convencional: Δ G °′ y K′. Si los protones no participan en una reacción biológica, entonces Δ G °′ = Δ G°. De lo contrario, la relación entre Δ G °′ y Δ G° es la siguiente:
\( {\Delta G^{o}}'= \Delta G^{o} +RTln\left ( 10^{-7} \right )^{n} \tag{18.8.6} \)
donde Δ G °′ y Δ G° están en kilojulios por mol y n es el número de protones producidos en la reacción. A 298 K, esto simplifica a
\( {\Delta G^{o}}'= \Delta G^{o} -39.96n \tag{18.8.7} \)
Así, cualquier reacción que implique la liberación de protones es termodinámicamente más favorable a pH 7 que a pH 0.
La ecuación química que corresponde a la hidrólisis de ATP a ADP y fosfato es la siguiente:
\( ATP^{4-} + H_{2}O \rightleftharpoons \rightarrow ATP^{3-} + HPO_{4}^{2-} + H^{+} \tag{18.8.8} \)
Esta reacción tiene un ΔG °′ de −34.54 kJ/mol, pero bajo condiciones fisiológicas típicas (o bioquímicas), el valor real de Δ G' para la hidrólisis de ATP es de aproximadamente −50 kJ/mol. Los organismos utilizan esta energía para impulsar reacciones que son energéticamente cuesta arriba, acoplando así las reacciones a la hidrólisis del ATP. Un ejemplo se encuentra en la vía bioquímica de la glucólisis, en la que la glucosa de azúcar de 6 carbonos (C 6 H 12 O 6) se divide en dos fragmentos de 3 carbonos que luego se utilizan como combustible para la celda. Inicialmente, se agrega un grupo fosfato a la glucosa para formar un éster fosfato, glucosa-6-fosfato (abreviado glucosa-6-P), en una reacción análoga a la de un alcohol y ácido fosfórico:
\( glucose\left ( aq \right ) + HPO_{4}^{2-}\left ( aq \right ) \rightleftharpoons glucose-6-P^{2-}\left ( aq \right ) + H_{2}O\left ( l \right ) \tag{18.8.9} \)
\( ROH\left ( aq \right ) + HOPO_{3}^{2-}\left ( aq \right ) \rightleftharpoons ROPO_{3}^{2-}\left ( aq \right ) + H_{2}O\left ( l \right ) \)
Debido a su carga eléctrica, el éster de fosfato es incapaz de escapar de la célula al difundirse de nuevo a través de la membrana que rodea la célula, asegurando que permanezca disponible para futuras reacciones. Para la reacción en la Ecuación 18.57, Δ G° es 17.8 kJ/mol y K es 7.6 × 10 −4, lo que indica que el equilibrio se encuentra lejos a la izquierda. Para obligar a que esta reacción se produzca tal como está escrito, se acopla a una reacción termodinámicamente favorable, la hidrólisis de ATP a ADP:
\ (\ begin {matriz}
glucosa +\ cancel {HPO_ {4} ^ {2-}} &\ derecho-izquierdoglucosa-6-p^ {2-} +\ cancel {H_ {2} O} & {\ Delta G^ {o}} '& =17.8\; kJ/mol & K_ {1}\\
& & & & &\
ATP^ {4-} +\ cancel {H_ {2} O} &\ derechaizquierderpoones ATP^ {3-} +\ cancel {HPO_ {4} ^ {2-}} + H^ {+} & {\ Delta G^ {o}} '& =-34.54\; kJ/mol & K_ {2}\\
& & & & & &\
glucosa + ATP^ {4-} &\ derechatharpoons glucosa-6-p^ {2-} + ATP^ {3-} + H^ {+} y {Delta\ G^ {o}}' & =-16.7\; kJ/mol & K_ {3}
\ final {matriz}\)
Así, la formación de glucosa-6-fosfato es termodinámicamente espontánea si se usa ATP como fuente de fosfato.
Tenga en cuenta el patrón
Los organismos utilizan la energía de la hidrólisis del ATP para impulsar reacciones termodinámicamente no espontáneas.
La formación de glucosa-6-fosfato es solo uno de los muchos ejemplos de cómo las células usan ATP para impulsar una reacción bioquímica no espontánea. Bajo condiciones fisiológicas no estándar, cada ATP hidrolizado realmente resulta en aproximadamente un aumento de 10 8 en la magnitud de la constante de equilibrio, en comparación con la constante de equilibrio de la reacción en ausencia de ATP. Así, una reacción en la que dos moléculas de ATP se convierten en ADP aumenta K en aproximadamente 10 16, tres moléculas de ATP en 10 24, y así sucesivamente. Prácticamente cualquier reacción energéticamente desfavorable o secuencia de reacciones puede hacerse que ocurra espontáneamente acoplándola a la hidrólisis de un número suficientemente grande de moléculas de ATP.
Almacenamiento de energía en celdas
Aunque todos los organismos utilizan el ATP como fuente inmediata de energía libre en las reacciones bioquímicas, el ATP no es una forma eficiente para almacenar energía a largo plazo. Si la ingesta calórica de un humano adulto en reposo promedio se almacenara como ATP, dos tercios del peso corporal tendrían que consistir en ATP. En cambio, un humano adulto típico de 70 kg tiene un total de solo unos 50 g tanto de ATP como de ADP, y, lejos de ser utilizada para almacenamiento a largo plazo, cada molécula de ATP es volteada aproximadamente 860 veces al día. Todo el suministro de ATP se agotaría en menos de 2 minutos si no se regenerara continuamente.
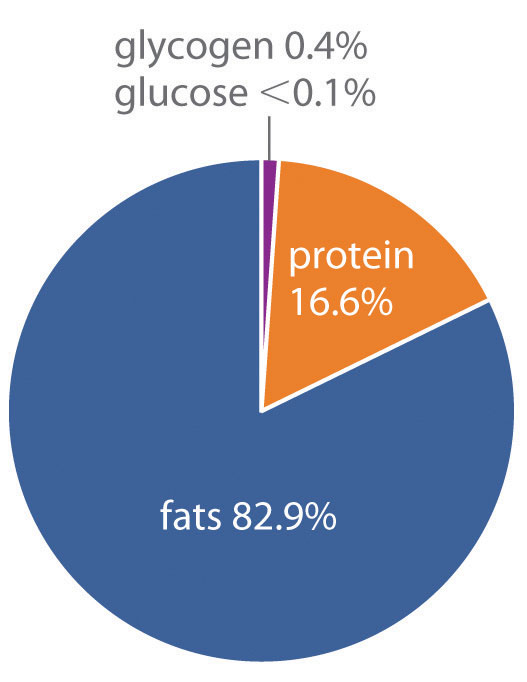
¿Cómo almacena el cuerpo energía para la eventual producción de ATP? Tres medias primarias son como azúcares, proteínas y grasas. La combustión de azúcares y proteínas produce alrededor de 17 kJ de energía por gramo, mientras que la combustión de grasas produce más del doble de energía por gramo, aproximadamente 39 kJ/g, además, los azúcares y las proteínas son hidrófilos y contienen alrededor de 2 g de agua por gramo de combustible, incluso en forma muy concentrada. Por el contrario, las grasas son hidrofóbicas y pueden almacenarse en forma esencialmente anhidra. Como resultado, los organismos pueden almacenar aproximadamente seis veces más energía por gramo como grasas que en cualquier otra forma. Un humano adulto típico de 70 kg tiene alrededor de 170 kJ de energía en forma de glucosa circulante en la sangre, aproximadamente 2600 kJ de energía almacenada en los músculos y el hígado como glucógeno (una forma polimérica de glucosa), aproximadamente 100,000 kJ almacenados en forma de proteína (principalmente tejido muscular), y casi 500,000 kJ en forma de grasas (Figura 18.21). Así, las grasas constituyen con mucho la mayor reserva de energía, mientras que representan sólo alrededor de 12 kg de la masa corporal de 70 kg. Para almacenar esta cantidad de energía en forma de azúcares se requeriría una masa corporal total de unos 144 kg, de los cuales más de la mitad serían azúcar.
Figura 18.8.6 Porcentajes de formas de almacenamiento de energía en humanos adultos Un adulto promedio de 70 kg almacena aproximadamente 6 × 10 5 kJ de energía en glucosa, glucógeno, proteínas y grasas. Las grasas son la forma más abundante y eficiente para almacenar energía.
Ejemplo 18.8.1
La glucosa es una forma en la que el cuerpo almacena energía.
- Calcular Δ G °′ para la respiración de glucosa a CO 2 y H 2 O usando estos valores de Δ G f°: −910.4 kJ/mol para glucosa, −394.4 kJ/mol para CO 2 (g) y −237.1 kJ/mol para H 2 O (l).
- Suponiendo 50% de eficiencia en la conversión de la energía liberada a ATP, ¿cuántas moléculas de ATP se pueden sintetizar por la combustión de una molécula de glucosa? A 298.15 K, Δ G °′ para la hidrólisis de ATP es −34.54 kJ/mol.
Dado: ecuación química equilibrada (Ecuación 18.50), valores de Δ G f°, eficiencia de conversión y Δ G °′ para hidrólisis de ATP
Preguntado por: Δ G °′ para la reacción de combustión y el número de moléculas de ATP que se pueden sintetizar
Estrategia:
A Utilizando la regla de “productos menos reactivos”, se calcula Δ G rxn° para la reacción de respiración.
B Multiplique el valor calculado de Δ G rxn° por la eficiencia para obtener el número de kilojulios disponibles para la síntesis de ATP. Luego divida este valor por Δ G °′ para la hidrólisis de ATP para encontrar el número máximo de moléculas de ATP que se pueden sintetizar.
Solución:
- A Los protones no se liberan ni se consumen en la reacción, por lo que Δ G °′ = Δ G°. Comenzamos usando la ecuación química balanceada en la Ecuación 18.50:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O
A partir de los valores dados de Δ G f° (recuerde que Δ G f° es cero para un elemento como O 2 en su estado estándar), podemos calcular Δ G rxn°
\( \Delta G_{rxn}^{o}=\sum m \Delta G_{f}^{o}\left ( products \right )-\sum n \Delta G_{f}^{o}\left ( reactants- \right ) \)
\(=\left [ 6\left ( -394.4\; kJ/mol \right )+ 6\left ( -237.1\; kJ/mol \right )\right ]-\left [ \left ( 910.4 \; kJ/mol \right ) + 0 \; kJ/mol\right ] \)
\(=-2879 \; kJ/mol\; of \; glucose \)
- B Si asumimos que solo se usa el 50% de la energía disponible, entonces aproximadamente 1440 kJ/mol de glucosa está disponible para la síntesis de ATP. El valor de Δ G °′ para la hidrólisis de ATP en condiciones bioquímicas es de −34.54 kJ/mol, por lo que en principio un organismo podría sintetizar
\( \dfrac{1440\; \cancel{kJ/mol\; glucose}}{34.54 \cancel{kJ/mol\; ATP}}=41.7 \approx 42\; ATP/glucose \)
La mayoría de los organismos aerobios realmente sintetizan alrededor de 32 moléculas de ATP por molécula de glucosa, para una eficiencia de aproximadamente 45%.
Ejercicio
Algunas bacterias sintetizan metano usando la siguiente reacción redox:
CO 2 (g) + 4H 2 (g) → CH 4 (g) + 2H 2 O (g)
- Calcular Δ G° para esta reacción usando valores de Δ G f° en la Tabla T1.
- Calcular cuántas moléculas de ATP podrían sintetizarse por mol de CO 2 reducido si la eficiencia del proceso fuera del 100%.
Contestar
- −86.6 kJ/mol CO 2
- 2.5 ATP/mol CO 2
Resumen
Una célula viva es un sistema que no está en equilibrio con su entorno; requiere un aporte constante de energía para mantener su estado de no equilibrio. Las células mantienen un estado de baja entropía al aumentar la entropía de su entorno. Los organismos aeróbicos no pueden sobrevivir en ausencia de O 2, mientras que los organismos anaeróbicos pueden vivir solo en ausencia de O 2. Las plantas verdes y las algas son fototrofos, que extraen energía del ambiente a través de un proceso llamado fotosíntesis, la reducción fotoquímica de CO 2 a un compuesto de carbono reducido. Otras especies, llamadas quimiótrofos, extraen energía de compuestos químicos. Uno de los principales procesos que utilizan los quimiótrofos para obtener energía es la respiración, que es el reverso de la fotosíntesis. Alternativamente, algunos quimiótrofos obtienen energía por fermentación, en la que un compuesto orgánico es tanto el oxidante como el reductor. Los intermedios utilizados por los organismos para transportar electrones entre el reductor y el oxidante incluyen NAD + y NADH. La energía de la oxidación de los nutrientes se pone a disposición de las células a través de la síntesis de ATP, la moneda de energía de la célula. Su energía es utilizada por las células para sintetizar sustancias a través de reacciones acopladas y para realizar trabajos. El cuerpo almacena energía como azúcares, proteínas o grasas antes de usarla para producir ATP.
Problema Conceptual
-
El ciclo del ácido tricarboxílico (TCA) en organismos aeróbicos es una de las cuatro vías responsables de la oxidación gradual de los intermedios orgánicos. La reacción final en el ciclo de TCA tiene Δ G° = 29.7 kJ/mol, por lo que no debe ocurrir espontáneamente. Sugerir una explicación de por qué esta reacción procede en la dirección de avance en las células vivas.
Contestar
-
Se acopla a otra reacción que es espontánea, que impulsa esta reacción hacia adelante (principio de Le Chatelier).