19.3: Potenciales estándar
- Page ID
- 78410
- Utilizar potenciales redox para predecir si una reacción es espontánea.
- Para equilibrar las reacciones redox usando medias reacciones.
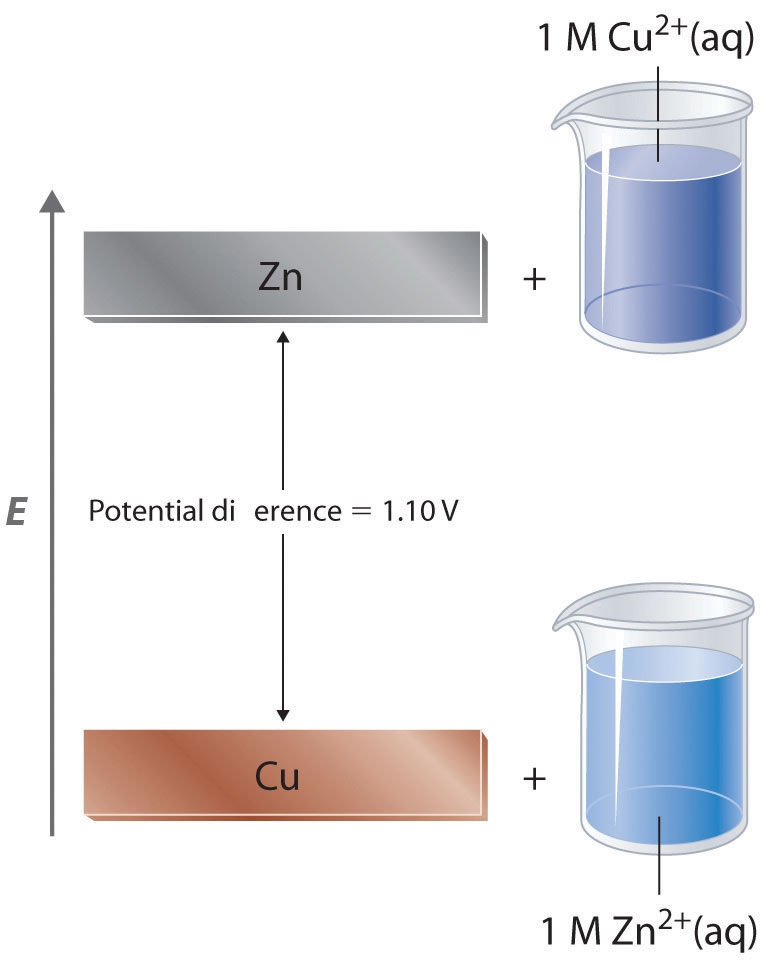
En una celda galvánica, la corriente se produce cuando los electrones fluyen externamente a través del circuito desde el ánodo al cátodo debido a una diferencia en la energía potencial entre los dos electrodos en la celda electroquímica. En el sistema Zn/Cu, los electrones de valencia en zinc tienen una energía potencial sustancialmente mayor que los electrones de valencia en cobre debido al blindaje de los electrones s de zinc por los electrones en orbitales d llenos. (Para mayor información sobre los orbitales atómicos, véase la Sección 2.5.) De ahí que los electrones fluyan espontáneamente de iones de zinc a cobre (II), formando iones de zinc (II) y cobre metálico (Figura 19.2.1). Al igual que el agua que fluye espontáneamente cuesta abajo, que se puede hacer funcionar forzando una rueda hidráulica, el flujo de electrones de una energía potencial más alta a una más baja también se puede aprovechar para realizar el trabajo.
Figura 19.2.1 Diferencia de Energía Potencial en el Sistema Zn/Cu La energía potencial de un sistema que consiste en iones Zn metálico y Cu 2+ acuosos es mayor que la energía potencial de un sistema que consiste en Cu metálico y iones Zn 2+ acuosos. Gran parte de esta diferencia de energía potencial se debe a que los electrones de valencia del Zn metálico son más altos en energía que los electrones de valencia del Cu metálico. Debido a que el sistema Zn (s) + Cu 2+ (aq) es mayor en energía en 1.10 V que el sistema Cu (s) + Zn 2+ (aq), la energía se libera cuando los electrones se transfieren de Zn a Cu 2+ para formar Cu y Zn 2+.
Debido a que la energía potencial de los electrones de valencia difiere mucho de una sustancia a otra, el voltaje de una celda galvánica depende en parte de la identidad de las sustancias reaccionantes. Si construimos una celda galvánica similar a la de la parte (a) de la Figura 19.1.3 pero en lugar de cobre utilizamos una tira de metal cobalto y 1 M de Co 2+ en el compartimiento catódico, el voltaje medido no es de 1.10 V sino de 0.51 V. Así podemos concluir que la diferencia de energía potencial entre los electrones de valencia de cobalto y zinc es menor que la diferencia entre los electrones de valencia de cobre y zinc en 0.59 V.
El potencial medido de una célula también depende fuertemente de las concentraciones de las especies reaccionantes y de la temperatura del sistema. Para desarrollar una escala de potenciales relativos que permita predecir la dirección de una reacción electroquímica y la magnitud de la fuerza impulsora de la reacción, los potenciales de oxidaciones y reducciones de diferentes sustancias deben medirse en condiciones comparables. Para ello, los químicos utilizan el potencial de celda estándar El potencial de una celda electroquímica medido en condiciones estándar (1 M para soluciones, 1 atm para gases, y sólidos puros o líquidos puros para otras sustancias) y a una temperatura fija (generalmente 298 K). (celda E°), definido como el potencial de una celda medido en condiciones estándar, es decir, con todas las especies en sus estados estándar (1 M para soluciones, Las soluciones concentradas de sales (aproximadamente 1 M) generalmente no presentan un comportamiento ideal, y el estado estándar real corresponde a una actividad de 1 más que a una concentración de 1 M. Las correcciones por comportamiento no ideal son importantes para el trabajo cuantitativo preciso pero no para el enfoque más cualitativo que estamos tomando aquí. 1 atm para gases, sólidos puros o líquidos puros para otras sustancias) y a una temperatura fija, generalmente 25°C.
Tenga en cuenta el patrón
Los potenciales redox medidos dependen de la energía potencial de los electrones de valencia, las concentraciones de las especies en la reacción y la temperatura del sistema.
Medición de potenciales de electrodos estándar
Es físicamente imposible medir el potencial de un solo electrodo: solo se puede medir la diferencia entre los potenciales de dos electrodos. (Esto es análogo a medir entalpías absolutas o energías libres. Recordemos del Capítulo 18 que solo se pueden medir las diferencias en entalpía y energía libre.) Sin embargo, podemos comparar los potenciales de celda estándar para dos celdas galvánicas diferentes que tienen un tipo de electrodo en común. Esto nos permite medir la diferencia de potencial entre dos electrodos diferentes. Por ejemplo, el potencial celular estándar medido (E°) para el sistema Zn/Cu es de 1.10 V, mientras que E° para el sistema Zn/Co correspondiente es de 0.51 V. Esto implica que la diferencia de potencial entre los electrodos de Co y Cu es de 1.10 V − 0.51 V = 0.59 V. De hecho, esa es exactamente la potencial medido en condiciones estándar si una celda se construye con el siguiente diagrama de celdas:
\( Co \left (s \right ) \mid Co^{2+} \left (aq,\;1M \right ) \parallel Cu ^{2+} \left (aq,\;1M \right ) \mid Cu \left (s \right ) \tag{19.2.1} \)
Este diagrama de celdas corresponde a la oxidación de un ánodo de cobalto y la reducción de Cu 2+ en solución en el cátodo de cobre.
Todos los valores tabulados de potenciales de electrodo estándar por convención se enumeran para una reacción escrita como una reducción, no como una oxidación, para poder comparar potenciales estándar para diferentes sustancias. (Los potenciales de electrodo estándar para diversas reacciones de reducción se dan en la Tabla P1.) El potencial celular estándar (celda E°) es, por lo tanto, la diferencia entre los potenciales de reducción tabulados de las dos medias reacciones, no su suma:
\( E^{o}_{cell} = E^{o}_{cathode} - E^{o}_{anode} \tag{19.2.2} \)
En contraste, recordemos que las medias reacciones se escriben para mostrar las reacciones de reducción y oxidación que realmente ocurren en la célula, por lo que la reacción celular general se escribe como la suma de las dos medias reacciones. De acuerdo con la Ecuación 19.2.1, cuando conocemos el potencial estándar para cualquier media reacción, podemos obtener el valor del potencial estándar de muchas otras medias reacciones midiendo el potencial estándar de la celda correspondiente.
Tenga en cuenta el patrón
La reacción celular global es la suma de las dos medias reacciones, pero el potencial celular es la diferencia entre los potenciales de reducción: E° celda = E° cátodo − E° ánodo.
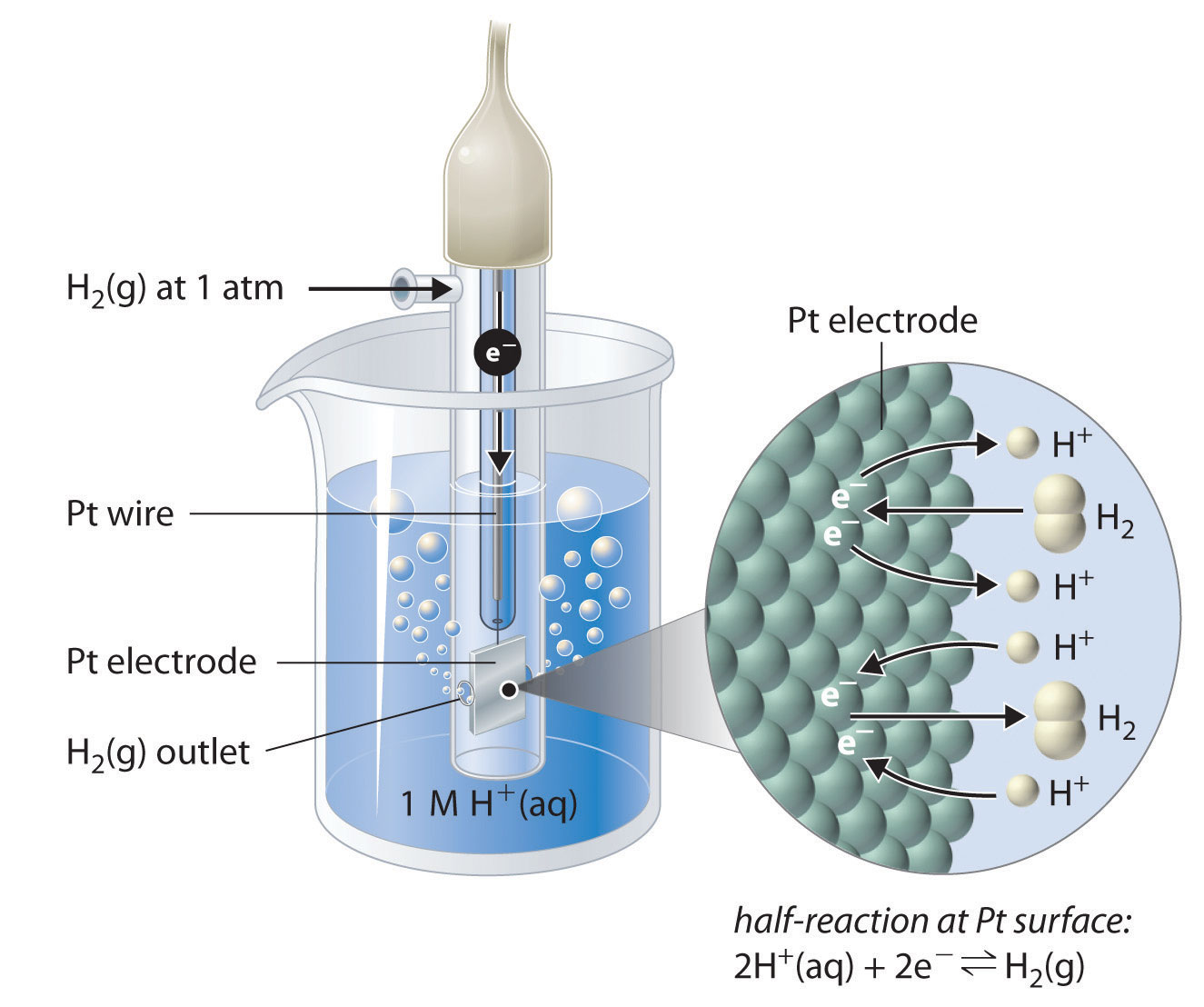
Aunque es imposible medir el potencial de cualquier electrodo directamente, podemos elegir un electrodo de referencia cuyo potencial se define como 0 V bajo condiciones estándar. El electrodo de hidrógeno estándar (SHE) El electrodo elegido como referencia para todos los demás electrodos, al que se le ha asignado un potencial estándar de 0 V y consiste en un hilo de Pt en contacto con una solución acuosa que contiene 1 M H + en equilibrio con H 2 gases a una presión de 1 atm en la interfaz de solución PT. se usa universalmente para este propósito y se le asigna un potencial estándar de 0 V. Consiste en una tira de alambre de platino en contacto con una solución acuosa que contiene 1 M H +. El [H +] en solución está en equilibrio con el gas H 2 a una presión de 1 atm en la interfaz Pt-solución (Figura 19.2.2). Los protones se reducen o las moléculas de hidrógeno se oxidan en la superficie de Pt de acuerdo con la siguiente ecuación:
\( 2H^{+}\left ( aq \right ) + 2e^{-} \rightleftharpoons H_{2}\left ( g \right ) \tag{19.2.3} \)
Una característica especialmente atractiva de la SHE es que el electrodo de metal Pt no se consume durante la reacción.
Figura 19.2.2 El Electrodo de Hidrógeno Estándar El SHE consiste en alambre de platino que está conectado a una superficie de Pt en contacto con una solución acuosa que contiene 1 M H + en equilibrio con gas H 2 a una presión de 1 atm. Desde el punto de vista molecular, la superficie de Pt cataliza la oxidación de moléculas de hidrógeno a protones o la reducción de protones a gas hidrógeno. (El agua se omite para mayor claridad). Al potencial estándar de la SHE se le asigna arbitrariamente un valor de 0 V.
La Figura 19.2.3 muestra una celda galvánica que consiste en un SHE en un vaso de precipitados y una tira de Zn en otro vaso de precipitados que contiene una solución de iones Zn 2+. Cuando el circuito está cerrado, el voltímetro indica un potencial de 0.76 V. El electrodo de zinc comienza a disolverse para formar Zn 2+, y los iones H + se reducen a H 2 en el otro compartimento. Así, el electrodo de hidrógeno es el cátodo, y el electrodo de zinc es el ánodo. El diagrama de esta celda galvánica es el siguiente:
\( Zn\left (s \right )\mid Zn^{2+}\left (aq \right )\parallel H^{+}\left (aq,\; 1M \right )\mid H_{2}\left (g, 1\; atm \right )\mid Pt\left (s \right ) \tag{19.2.4} \)
Las medias reacciones que realmente ocurren en la celda y sus potenciales de electrodo correspondientes son las siguientes:
\( cathode: 2H^{+}\left (aq,\; 1M \right ) + 2e^{-} \rightarrow H_{2}\left ( g \right ) \;\;\; E_{cathode}^{o} = 0\;V \tag{19.2.5} \)
\( anode: Zn\left (s \right )\rightarrow Zn^{2+}\left (aq \right )+2e^{-} \;\;\; E_{anode}^{o} = -0.76\;V \tag{19.2.6} \)
\( overall: Zn\left (s \right ) + 2H^{+}\left (aq \right )\rightarrow Zn^{2+}\left (aq \right ) + H_{2}\left ( g \right ) \tag{19.2.7} \)
\( E_{cell}^{o} = E_{cathode}^{o}-E_{anode}^{o} = 0.76 \)
Figura 19.2.3 Determinación de un potencial de electrodo estándar usando un electrodo de hidrógeno estándar El voltímetro muestra que el potencial de celda estándar de una celda galvánica que consiste en un par SHE y un par Zn/Zn 2+ es E° celda = 0.76 V. Debido a que el zinc el electrodo en esta celda se disuelve espontáneamente para formar iones Zn 2+ (ac) mientras que los iones H + (aq) se reducen a H2 en la superficie de platino, el potencial de electrodo estándar del par Zn 2+ /Zn es de −0.76 V.
Aunque la reacción en el ánodo es una oxidación, por convención su valor tabulado de E° se reporta como un potencial de reducción. El potencial de una media reacción medido contra la SHE en condiciones estándar se denomina potencial de electrodo estándar El potencial de una media reacción medido contra la SHE en condiciones estándar. para esa media reacción.En este ejemplo, el potencial de reducción estándar para Zn 2+ (aq) + 2e − → Zn (s) es −0.76 V, lo que significa que el potencial de electrodo estándar para la reacción que ocurre en el ánodo, la oxidación de Zn a Zn 2+, a menudo llamado Zn El par redox /Zn 2+, o el par Zn/Zn 2+, es − (−0.76 V) = 0.76 V. Por lo tanto, debemos restar el ánodo E° del cátodo E° para obtener E° celda: 0 − (−0.76 V) = 0.76 V.
Debido a que el potencial eléctrico es la energía necesaria para mover una partícula cargada en un campo eléctrico, los potenciales de electrodo estándar para las medias reacciones son propiedades intensivas y no dependen de la cantidad de sustancia involucrada. En consecuencia, los valores de E° son independientes de los coeficientes estequiométricos para la media reacción y, lo más importante, los coeficientes utilizados para producir una reacción global equilibrada no afectan el valor del potencial celular.
Tenga en cuenta el patrón
Los valores de E° no dependen de los coeficientes estequiométricos para una media reacción.
Para medir el potencial del par Cu/Cu 2+, podemos construir una celda galvánica análoga a la mostrada en la Figura 19.2.3 pero que contenga un par Cu/Cu 2+ en el compartimento de muestra en lugar de Zn/Zn 2+. Cuando cerramos el circuito esta vez, el potencial medido para la celda es negativo (−0.34 V) en lugar de positivo. El valor negativo de la celda E° indica que la dirección del flujo espontáneo de electrones es la opuesta a la del par Zn/Zn 2+. De ahí que las reacciones que ocurren espontáneamente, indicadas por una celda E° positiva, son la reducción de Cu 2+ a Cu en el electrodo de cobre. El electrodo de cobre gana masa a medida que avanza la reacción, y H 2 se oxida a H + en el electrodo de platino. En esta celda, la tira de cobre es el cátodo, y el electrodo de hidrógeno es el ánodo. Por lo tanto, el diagrama de celdas se escribe con la SHE a la izquierda y la pareja Cu 2+ /Cu a la derecha:
\( Pt\left (s \right ) \mid H_{2}\left (g, 1\; atm \right ) \mid H^{+}\left (aq,\; 1M \right ) \parallel Cu^{2+}\left (aq \right ) \mid Cu\left (s \right ) \tag{19.2.8} \)
Las reacciones semicelulares y los potenciales de la reacción espontánea son los siguientes:
\( cathode: Cu^{2+}\left (aq \right )+2e^{-} \rightarrow Cu \left (s \right ) \;\;\; E_{cathode}^{o} = 0.34\;V \tag{19.2.9} \)
\( anode: H_{2}\left ( g \right ) \rightarrow 2H^{+} \left ( aq \right ) + 2e^{-} \;\;\; E_{anode}^{o} = 0\;V \tag{19.2.10} \)
\( overall: H_{2}\left ( g \right )+ Cu^{2+}\left (aq \right ) \rightarrow Cu\left (s \right ) + 2H^{+}\left (aq \right ) \tag{19.2.11} \)
\( E_{cell}^{o} = E_{cathode}^{o}-E_{anode}^{o} = 0.34 \)
Así, el potencial de electrodo estándar para el par Cu 2+ /Cu es de 0.34 V.
Equilibrar las reacciones redox usando el método de media reacción
En el Capítulo 8, describimos un método para equilibrar reacciones redox usando números de oxidación. Se asignaron números de oxidación a cada átomo en una reacción redox para identificar cualquier cambio en los estados de oxidación. Aquí presentamos un enfoque alternativo para equilibrar las reacciones redox, el método de media reacción, en el que la reacción redox global se divide en una semi-reacción de oxidación y una semi-reacción de reducción, cada una equilibrada para masa y carga. Este método refleja más de cerca los eventos que tienen lugar en una celda electroquímica, donde las dos medias reacciones pueden estar físicamente separadas entre sí.
Podemos ilustrar cómo equilibrar una reacción redox usando medias reacciones con la reacción que ocurre cuando Drano, un limpiador de drenaje sólido comercial, se vierte en un drenaje obstruido. Drano contiene una mezcla de hidróxido de sodio y aluminio en polvo, que en solución reacciona para producir hidrógeno gaseoso:
\( Al\left (s \right ) + OH^{-}\left (aq \right ) \rightarrow Al\left (OH \right )_{4}^{-}\left (aq \right ) + H_{2}\left (g \right ) \tag{19.2.12} \)
En esta reacción, el Al (s) se oxida a Al 3+, y el H + en agua se reduce a gas H 2, que burbujea a través de la solución, agitándola y rompiendo las obstrucciones.
La reacción redox global está compuesta por una semirreacción de reducción y una semi-reacción de oxidación. A partir de los potenciales de electrodo estándar enumerados en la Tabla P1, encontramos las medias reacciones correspondientes que describen la reducción de iones H + en agua a H 2 y la oxidación de Al a Al 3+ en solución básica:
\( reduction: \; 2H_{2}O \left (l \right ) + 2e^{-} \rightarrow 2OH^{-}\left (aq \right ) + H_{2}\left (g \right ) \tag{19.2.13} \)
\( oxidation: \; Al \left (s \right ) + 4OH^{-}\left (aq \right ) \rightarrow Al(OH)_{4}^{-}\left (aq \right ) + 3e^{-} \tag{19.2.14} \)
Las medias reacciones elegidas deben reflejar exactamente las condiciones de reacción, como las condiciones básicas que se muestran aquí. Además, los estados físicos de los reactivos y los productos deben ser idénticos a los dados en la reacción global, ya sean gaseosos, líquidos, sólidos o en solución.
En la Ecuación 19.2.13, dos iones H + ganan un electrón cada uno en la reducción; en la Ecuación 19.2.14, el átomo de aluminio pierde tres electrones en la oxidación. Las cargas se equilibran multiplicando la semirreacción de reducción (Ecuación 19.2.13) por 3 y la semirreacción de oxidación (Ecuación 19.2.14) por 2 para dar el mismo número de electrones en ambas medias reacciones:
\( reduction: \; 6H_{2}O \left (l \right ) + 6e^{-} \rightarrow 6OH^{-}\left (aq \right ) + 3H_{2}\left (g \right ) \tag{19.2.15} \)
\( oxidation: \; 2Al \left (s \right ) + 8OH^{-}\left (aq \right ) \rightarrow 2Al(OH)_{4}^{-}\left (aq \right ) + 6e^{-} \tag{19.2.16} \)
\( 6H_{2}O \left (l \right ) + 2Al \left (s \right ) + 8OH^{-}\left (aq \right ) \rightarrow 2Al(OH)_{4}^{-}\left (aq \right )+ 6OH^{-}\left (aq \right ) + 3H_{2}\left (g \right ) \tag{19.2.17} \)
Simplificando cancelando las sustancias que aparecen en ambos lados de la ecuación,
\( 6H_{2}O \left (l \right ) + 2Al \left (s \right ) + 2OH^{-}\left (aq \right ) \rightarrow 2Al(OH)_{4}^{-}\left (aq \right )+ 3H_{2}\left (g \right ) \tag{19.2.18} \)
Tenemos una carga −2 en el lado izquierdo de la ecuación y una carga −2 en el lado derecho. Así las cargas están equilibradas, pero también hay que comprobar que los átomos están equilibrados:
\( 2Al + 8O + 14H = 2Al + 8O + 14H \tag{19.2.19} \)
Los átomos también se equilibran, por lo que la Ecuación 19.2.18 es una ecuación química equilibrada para la reacción redox representada en la Ecuación 19.20.
Tenga en cuenta el patrón
El método de semi-reacción requiere que las semirreacciones reflejen exactamente las condiciones de reacción, y los estados físicos de los reactivos y los productos deben ser idénticos a los de la reacción global.
También podemos equilibrar una reacción redox equilibrando primero los átomos en cada media reacción y luego equilibrando las cargas. Con este método alternativo, no es necesario utilizar las medias reacciones enumeradas en la Tabla P1 sino enfocarnos en los átomos cuyos estados de oxidación cambian, como se ilustra en los siguientes pasos:
Paso 1: Escribe la media reacción de reducción y la semirreacción de oxidación.
Para la reacción mostrada en la Ecuación 19.213, el hidrógeno se reduce de H + en OH − a H 2, y el aluminio se oxida de Al 0 a Al 3+:
\( reduction: \; OH^{-}(aq) \rightarrow H_{2}(g) \tag{19.2.20} \)
\( oxidation: \; Al \left (s \right ) \rightarrow Al(OH)_{4}^{-}\left (aq \right ) \tag{19.2.21} \)
Paso 2: Equilibrar los átomos equilibrando elementos distintos de O y H. Luego equilibrar los átomos de O agregando H 2 O y equilibrando los átomos de H agregando H +.
Elementos distintos a O y H en las dos ecuaciones anteriores se equilibran tal como están escritos, por lo que procedemos a equilibrar los átomos de O. Podemos hacer esto agregando agua al lado apropiado de cada media reacción:
\( reduction: \; OH^{-}(aq) \rightarrow H_{2}(g)+ H_{2}O\left ( l \right ) \tag{19.2.22} \)
\( oxidation: \; Al \left (s \right ) + 4H_{2}O\left ( l \right ) \rightarrow Al(OH)_{4}^{-}\left (aq \right ) \tag{19.2.23} \)
Equilibrando los átomos de H añadiendo H +, obtenemos lo siguiente:
\( reduction: \; OH^{-}(aq) + 3H^{+}\left (aq \right ) \rightarrow H_{2}(g)+ H_{2}O\left ( l \right )\tag{19.2.24} \)
\( oxidation: \; Al \left (s \right ) + 4H_{2}O\left ( l \right ) \rightarrow Al(OH)_{4}^{-}\left (aq \right ) + 4H^{+}\left ( aq \right ) \tag{19.2.25} \)
Ahora hemos equilibrado los átomos en cada media reacción, pero las cargas no están equilibradas.
Paso 3: Equilibrar las cargas en cada media reacción añadiendo electrones.
Se ganan dos electrones en la reducción de iones H + a H 2, y tres electrones se pierden durante la oxidación de Al 0 a Al 3+:
\( reduction: \; OH^{-}(aq) + 3H^{+}\left (aq \right ) + 2e^{-} \rightarrow H_{2}(g)+ H_{2}O\left ( l \right )\tag{19.2.26} \)
\( oxidation: \; Al \left (s \right ) + 4H_{2}O\left ( l \right ) \rightarrow Al(OH)_{4}^{-}\left (aq \right ) + 4H^{+}\left ( aq \right ) + 3e^{-} \tag{19.2.27} \)
Paso 4: Multiplicar las medias reacciones reductivas y oxidativas por números enteros apropiados para obtener el mismo número de electrones en ambas medias reacciones.
En este caso, multiplicamos la Ecuación 19.2.26 (la semirreacción reductiva) por 3 y la Ecuación 19.2.27 (la semirreacción oxidativa) por 2 para obtener el mismo número de electrones en ambas medias reacciones:
\( reduction: \; 3OH^{-}(aq) + 9H^{+}\left (aq \right ) + 6e^{-} \rightarrow 3H_{2}(g)+ 3H_{2}O\left ( l \right )\tag{19.2.28} \)
\( oxidation: \; 2Al \left (s \right ) + 8H_{2}O\left ( l \right ) \rightarrow 2Al(OH)_{4}^{-}\left (aq \right ) + 8H^{+}\left ( aq \right ) + 6e^{-} \tag{19.2.29} \)
Paso 5: Sumar las dos medias reacciones y cancelar las sustancias que aparecen en ambos lados de la ecuación.
Agregar y, en este caso, cancelar 8H +, 3H 2 O y 6e −,
\( oxidation: \; 2Al \left (s \right ) + 5H_{2}O\left ( l \right ) +3OH^{-}\left (aq \right )+ H^{+}\left ( aq \right ) \rightarrow 2Al(OH)_{4}^{-}\left (aq \right ) + 3H_{2}\left (g \right ) \tag{19.2.30} \)
Tenemos tres OH − y uno H + en el lado izquierdo. Neutralizar el H + nos da un total de 5H 2 O + H 2 O = 6H 2 O y deja 2OH − en el lado izquierdo:
\( oxidation: \; 2Al \left (s \right ) + 6H_{2}O\left ( l \right ) + 2OH^{-}\left (aq \right ) \rightarrow 2Al(OH)_{4}^{-}\left (aq \right ) + 3H_{2}\left (g \right ) \tag{19.2.31} \)
Paso 6: Verifique para asegurarse de que todos los átomos y cargas estén equilibrados.
La Ecuación 19.2.31 es idéntica a la Ecuación 19.2.18, obtenida usando el primer método, por lo que las cargas y números de átomos en cada lado de la ecuación se equilibran.

Figura 19.2.4 La Reacción de Dicromato con Iodido e La reacción de una solución amarilla de dicromato de sodio con una solución incolora de yoduro de sodio produce una solución ámbar profundo que contiene un complejo Cr 3+ (ac) verde e iones marrones I2 (ac).
Ejemplo 19.2.1
En solución ácida, la reacción redox del ion dicromato (Cr 2 O 7 2−) y yoduro (I −) se puede monitorear visualmente. La solución de dicromato amarillo reacciona con la solución de yoduro incoloro para producir una solución que es de color ámbar profundo debido a la presencia de un complejo Cr 3+ (ac) verde e iones marrones I 2 (ac) (Figura 19.2.4. ):
\( Cr_{2}O_{7}^{2-} \left (aq \right ) + I^{-}\left (aq \right ) \rightarrow Cr^{3+}\left (aq \right ) + 3I_{2}\left (aq \right ) \)
Equilibrar esta ecuación usando medias reacciones.
Dado: reacción redox y Tabla P1
Preguntado por: ecuación química equilibrada usando medias reacciones
Estrategia:
Siga los pasos para equilibrar la reacción redox usando el método de media reacción.
Solución:
A partir de los potenciales de electrodo estándar enumerados en la Tabla P1, encontramos las semi-reacciones correspondientes a la reacción global:
\( reduction: \; Cr_{2}O_{7}^{2-} \left (aq \right ) + 14 H^{+}\left (aq \right ) + 6e^{-} \rightarrow 2Cr^{3+}\left (aq \right ) + 7H_{2}O \left (l \right ) \)
\( oxidation: \; 2I^{-}\left (aq \right ) \rightarrow I_{2}\left (aq \right )+ 2e^{-} \)
Equilibrar el número de electrones multiplicando la reacción de oxidación por 3,
\( oxidation: \; 6I^{-}\left (aq \right ) \rightarrow 3I_{2}\left (aq \right )+6e^{-} \)
oxidación: 6I − (aq) → 3I 2 (aq) + 6e −Añadiendo las dos medias reacciones y cancelando electrones,
\( Cr_{2}O_{7}^{2-} \left (aq \right ) + 14 H^{+}\left (aq \right ) + 6I^{-}\left (aq \right ) \rightarrow 2Cr^{3+}\left (aq \right ) + 7H_{2}O \left (l \right ) + 3I_{2}\left (aq \right ) \)
Ahora debemos verificar para asegurarnos de que las cargas y los átomos en cada lado de la ecuación estén equilibrados:
\ (\ comenzar {matriz}
\ izquierda (-2\ derecha) +14 +\ izquierda (-6\ derecha) & = +6\\
+6 & = +6\\
2Cr + 7O + 14H + 6I & 2Cr + 7O + 14H + 6I
\ final {matriz}\)
Las cargas y los átomos se equilibran, por lo que nuestra ecuación está equilibrada.
También podemos utilizar el procedimiento alternativo, que no requiere las medias reacciones enumeradas en la Tabla P1.
Paso 1: El cromo se reduce de Cr 6+ en Cr 2 O 7 2− a Cr 3+, y los iones I − se oxidan a I 2. Dividiendo la reacción en dos medias reacciones,
\( reduction: \; Cr_{2}O_{7}^{2-} \left (aq \right ) \rightarrow Cr^{3+}\left (aq \right ) \)
\( oxidation: \; I^{-}\left (aq \right ) \rightarrow I_{2}\left (aq \right ) \)
Paso 2: Equilibrar los átomos distintos del oxígeno y el hidrógeno,
\( reduction: \; Cr_{2}O_{7}^{2-} \left (aq \right ) \rightarrow 2Cr^{3+}\left (aq \right ) \)
\( oxidation: \; 2I^{-}\left (aq \right ) \rightarrow I_{2}\left (aq \right ) \)
Ahora equilibramos los átomos de O agregando H 2 O, en este caso, al lado derecho de la media reacción de reducción. Debido a que la semi-reacción de oxidación no contiene oxígeno, puede ignorarse en esta etapa.
A continuación equilibramos los átomos de H añadiendo H + al lado izquierdo de la media reacción de reducción. Nuevamente, podemos ignorar la semireacción de oxidación.
\( reduction: \; Cr_{2}O_{7}^{2-} \left (aq \right ) \rightarrow 2Cr^{3+}\left (aq \right ) + 7H_{2}O \left (l \right )\)
Paso 3: Ahora debemos sumar electrones para equilibrar las cargas. La media reacción de reducción (2Cr +6 a 2Cr +3) tiene una carga +12 a la izquierda y una carga +6 a la derecha, por lo que se necesitan seis electrones para equilibrar la carga. La semi-reacción de oxidación (2I − a I 2) tiene una carga −2 en el lado izquierdo y una carga 0 en el lado derecho, por lo que necesita dos electrones para equilibrar la carga:
\( reduction: \; Cr_{2}O_{7}^{2-} \left (aq \right )+ 14 H^{+}\left (aq \right ) + 6e^{-}\rightarrow 2Cr^{3+}\left (aq \right ) + 7H_{2}O \left (l \right )\)
Paso 4: Para tener el mismo número de electrones en ambas medias reacciones, debemos multiplicar la semirreacción de oxidación por 3:
\( oxidation: \; 6I^{-}\left (aq \right ) \rightarrow 3I_{2}\left (aq \right )+6e^{-} \)
Paso 5: Añadiendo las dos medias reacciones y cancelando las sustancias que aparecen en ambas reacciones,
\( Cr_{2}O_{7}^{2-} \left (aq \right )+ 14 H^{+}\left (aq \right ) + 6I^{-} \rightarrow 2Cr^{3+}\left (aq \right ) + 7H_{2}O \left (l \right ) + 3I_{2}\left (aq \right ) \)
Paso 6: Esta es la misma ecuación que obtuvimos usando el primer método. Así, las cargas y átomos a cada lado de la ecuación se equilibran.
Ejercicio
El cobre se encuentra comúnmente como la covellita mineral (CuS). El primer paso para extraer el cobre es disolver el mineral en ácido nítrico (HNO 3), que oxida sulfuro a sulfato y reduce el ácido nítrico a NO:
\( CuS\left ( s \right ) + HNO_{3}\rightarrow NO\left ( g \right ) + CuSO_{4} \)
Equilibrar esta ecuación usando el método de media reacción.
Respuesta:\( 3CuS\left ( s \right ) +8 HNO_{3} \rightarrow 8NO\left ( g \right ) + 3CuSO_{4} +4H_{2}O\left ( l \right ) \)
Cálculo de potenciales de celda estándar
El potencial de celda estándar para una reacción redox (celda E°) es una medida de la tendencia de los reactivos en sus estados estándar a formar productos en sus estados estándar; en consecuencia, es una medida de la fuerza impulsora de la reacción, que antes llamamos voltaje. Podemos usar los dos potenciales de electrodo estándar que encontramos anteriormente para calcular el potencial estándar para la celda Zn/Cu representada por el siguiente diagrama de celdas:
\( Zn\left (s \right )\mid Zn^{2+}\left (aq, 1 M \right )\parallel Cu^{2+}\left (aq, 1 M \right )\mid Cu\left (s \right ) \tag{19.2.32}\)
Conocemos los valores de ánodo E° para la reducción de Zn 2+ y cátodo de E° para la reducción de Cu 2+, por lo que podemos calcular la celda de E°:
\( cathode: \; Cu^{2+}\left (aq, 1 M \right )+2e^{-} \rightarrow Cu\left (s \right )\;\;\; E_{cathode}^{o}=0.34\;V \tag{19.2.33}\)
\( anode: \; Zn\left (s \right ) \rightarrow Zn^{2+}\left (aq, 1 M \right ) + 2e^{-} \;\;\; E_{anode}^{o}=-0.76\;V \tag{19.2.34}\)
\( overall \; Zn\left (s \right ) + Cu^{2+}\left (aq, 1 M \right ) \rightarrow Zn^{2+}\left (aq, 1 M \right ) + Cu\left (s \right ) \tag{19.2.35}\)
\( E_{cell}=E_{cathode}^{o}-E_{anode}=1.10\;V \)
Este es el mismo valor que se observa experimentalmente. Si el valor de E° cell es positivo, la reacción ocurrirá espontáneamente como está escrito. Si el valor de E° cell es negativo, entonces la reacción no es espontánea, y no ocurrirá como está escrito en condiciones estándar; sin embargo, procederá espontáneamente en sentido contrario. Como veremos en la Sección 19.7, esto no significa que no se pueda hacer que la reacción ocurra en absoluto bajo condiciones estándar. Con una entrada suficiente de energía eléctrica, prácticamente cualquier reacción puede ser forzada a ocurrir. El Ejemplo 4 y su ejercicio correspondiente ilustran cómo podemos usar potenciales celulares medidos para calcular potenciales estándar para parejas redox.
Tenga en cuenta el patrón
Una celda E° positiva significa que la reacción ocurrirá espontáneamente como está escrito. Una celda E° negativa significa que la reacción procederá espontáneamente en sentido contrario.
Ejemplo 19.2.2
Se construye una celda galvánica con un potencial de celda estándar medido de 0.27 V usando dos vasos de precipitados conectados por un puente salino. Un vaso de precipitados contiene una tira de metal de galio sumergida en una solución 1 M de GACl 3, y el otro contiene un trozo de níquel sumergido en una solución 1 M de NiCl 2. Las medias reacciones que ocurren cuando los compartimentos están conectados son las siguientes:
\( cathode: \; Ni^{2+}\left (aq \right ) + 2e^{-} \rightarrow Ni\left (s \right )\)
\( anode: \; Ga\left (s \right ) \rightarrow Ga^{3+}\left (aq \right ) + 3e^{-} \)
Si el potencial de oxidación de Ga a Ga 3+ es de 0.55 V en condiciones estándar, ¿cuál es el potencial para la oxidación de Ni a Ni 2+?
Dado: celda galvánica, medias reacciones, potencial de celda estándar y potencial para la semirreacción de oxidación en condiciones estándar
Preguntado por: potencial de electrodo estándar de reacción que ocurre en el cátodo
Estrategia:
A Escriba la ecuación para la semirreacción que ocurre en el ánodo junto con el valor del potencial de electrodo estándar para la semirreacción.
B Utilice la Ecuación 19.2.2 para calcular el potencial de electrodo estándar para la media reacción que ocurre en el cátodo. A continuación, invertir el signo para obtener el potencial de la media reacción de oxidación correspondiente en condiciones estándar.
Solución:
A Se nos ha dado el potencial de oxidación de Ga a Ga 3+ en condiciones estándar, pero para reportar el potencial de electrodo estándar, debemos revertir el signo. Para la reacción de reducción Ga 3+ (aq) + 3e − → Ga (s), E° ánodo = −0.55 V.
B Usando el valor dado para la celda E° y el valor calculado de ánodo E°, podemos calcular el potencial estándar para la reducción de Ni 2+ a Ni a partir de la Ecuación 19.2.2:
\ (\ begin {matriz}
E_ {celda} & = &E_ {cátodo} ^ {o} -E_ {ánodo}\\
0.27\; V & = & E_ {cátodo} ^ {o} -\ izquierda (-0.55\; V\ derecha)\\
E_ {cátodo} ^ {o} & = & -0.28\; V
\ end {matriz}\)
Este es el potencial de electrodo estándar para la reacción Ni 2+ (aq) + 2e − → Ni (s). Debido a que se nos pide el potencial de oxidación de Ni a Ni 2+ en condiciones estándar, debemos revertir el signo del cátodo E°. Así E° = − (−0.28 V) = 0.28 V para la oxidación. Con tres electrones consumidos en la reducción y dos producidos en la oxidación, la reacción global no se equilibra. Recordemos, sin embargo, que los potenciales estándar son independientes de la estequiometría.
Ejercicio
Se construye una celda galvánica con un compartimento que contiene un electrodo de mercurio sumergido en una solución acuosa 1 M de acetato mercúrico [Hg (CH 3 CO 2) 2] y un compartimento que contiene una tira de magnesio sumergida en una solución acuosa 1 M de MgCl 2. Cuando los compartimentos están conectados, se mide un potencial de 3.22 V y se producen las siguientes medias reacciones:
\( cathode: \; Hg^{2+}\left (aq \right ) + 2e^{-} \rightarrow Hg\left (l \right )\)
\( anode: \; Mg\left (s \right ) \rightarrow Mg^{2+}\left (aq \right ) + 2e^{-} \)
Si el potencial de oxidación de Mg a Mg 2+ es de 2.37 V en condiciones estándar, ¿cuál es el potencial de electrodo estándar para la reacción que ocurre en el ánodo?
Respuesta: 0.85 V
Electrodos de referencia y concentraciones de medición
Al usar una celda galvánica para medir la concentración de una sustancia, generalmente nos interesa el potencial de solo uno de los electrodos de la celda, el llamado electrodo indicador El electrodo de una celda galvánica cuyo potencial está relacionado con la concentración de la sustancia siendo medidos. , cuyo potencial está relacionado con la concentración de la sustancia que se está midiendo. Asegurar que cualquier cambio en el potencial medido de la celda se deba únicamente a la sustancia que se está analizando, el potencial del otro electrodo, el electrodo de referencia Un electrodo en una celda galvánica cuyo potencial no se ve afectado por las propiedades de la solución. , debe ser constante. Ya estás familiarizado con un ejemplo de electrodo de referencia: el SHE. El potencial de un electrodo de referencia no debe verse afectado por las propiedades de la solución, y si es posible, debe aislarse físicamente de la solución de interés. Para medir el potencial de una solución, seleccionamos un electrodo de referencia y un electrodo indicador apropiado. El hecho de que se produzca la reducción u oxidación de la sustancia que se analiza depende del potencial de la media reacción para la sustancia de interés (la muestra) y del potencial del electrodo de referencia.
Tenga en cuenta el patrón
El potencial de cualquier electrodo de referencia no debe verse afectado por las propiedades de la solución a analizar, y también debe aislarse físicamente.
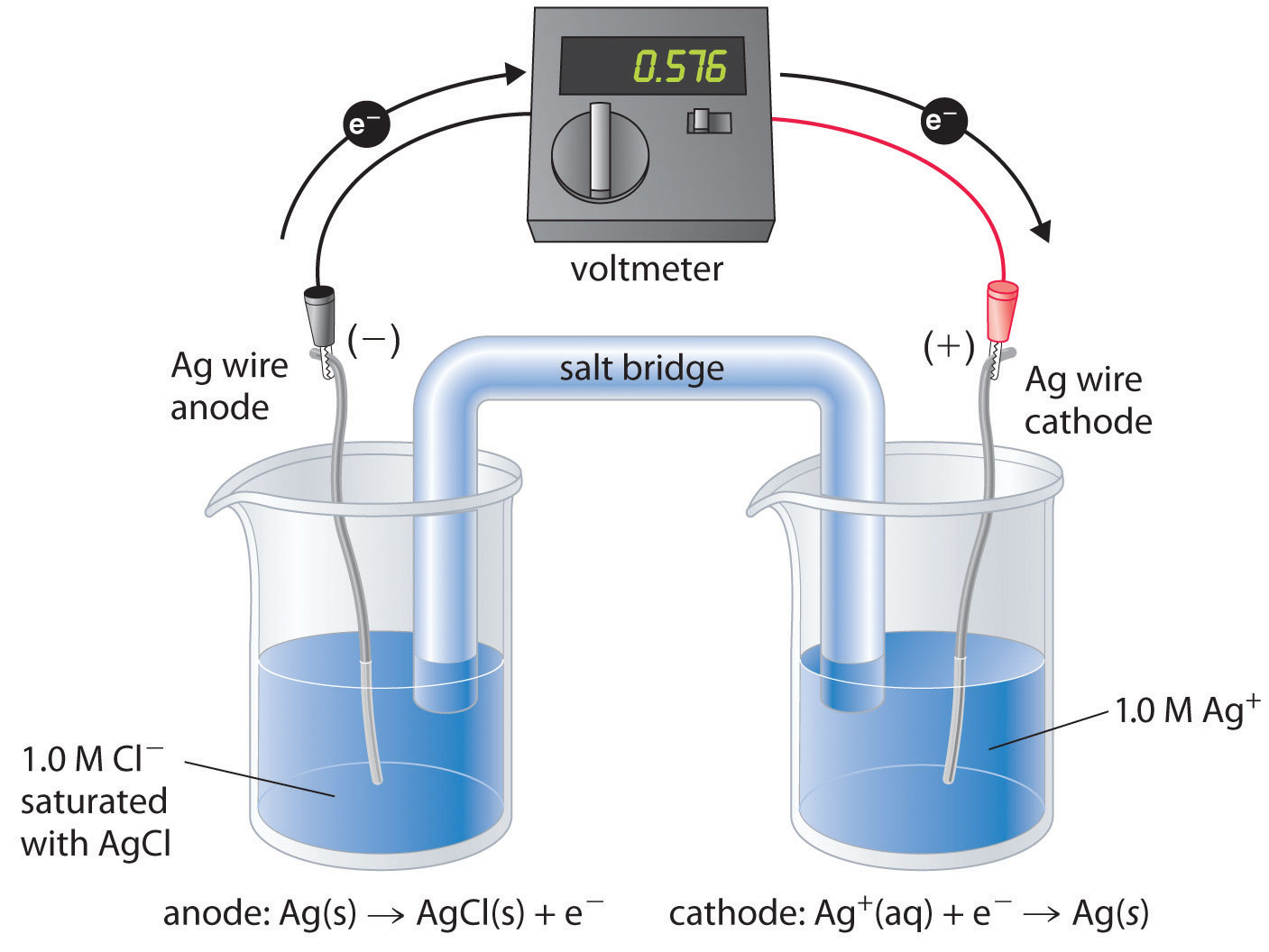
Hay muchas opciones posibles de electrodo de referencia además del SHE. El SHE requiere un flujo constante de gas hidrógeno altamente inflamable, lo que hace que sea inconveniente de usar. En consecuencia, se eligen comúnmente otros dos electrodos como electrodos de referencia. Uno es el electrodo de plata-cloruro de plata Un electrodo de referencia que consiste en un alambre de plata recubierto con una capa muy delgada de AgCl y sumergido en una solución de iones cloruro con una concentración fija. , que consiste en un alambre de plata recubierto con una capa muy delgada de AgCl que se sumerge en una solución de iones cloruro con una concentración fija. El diagrama celular y la media reacción de reducción son los siguientes:
\( Cl^{-}\left (aq \right ) \mid AgCl\left (s \right ) \mid Ag\left (s \right ) \tag{19.2.36} \)
\( AgCl\left (s \right ) + e^{-} \rightarrow Ag\left (s \right ) + Cl^{-}\left (aq \right ) \)
Si se usa una solución saturada de KCl como solución de cloruro, el potencial del electrodo de plata-cloruro de plata es de 0.197 V frente al SHE. Es decir, se deben restar 0.197 V del valor medido para obtener el potencial de electrodo estándar medido contra la SHE.
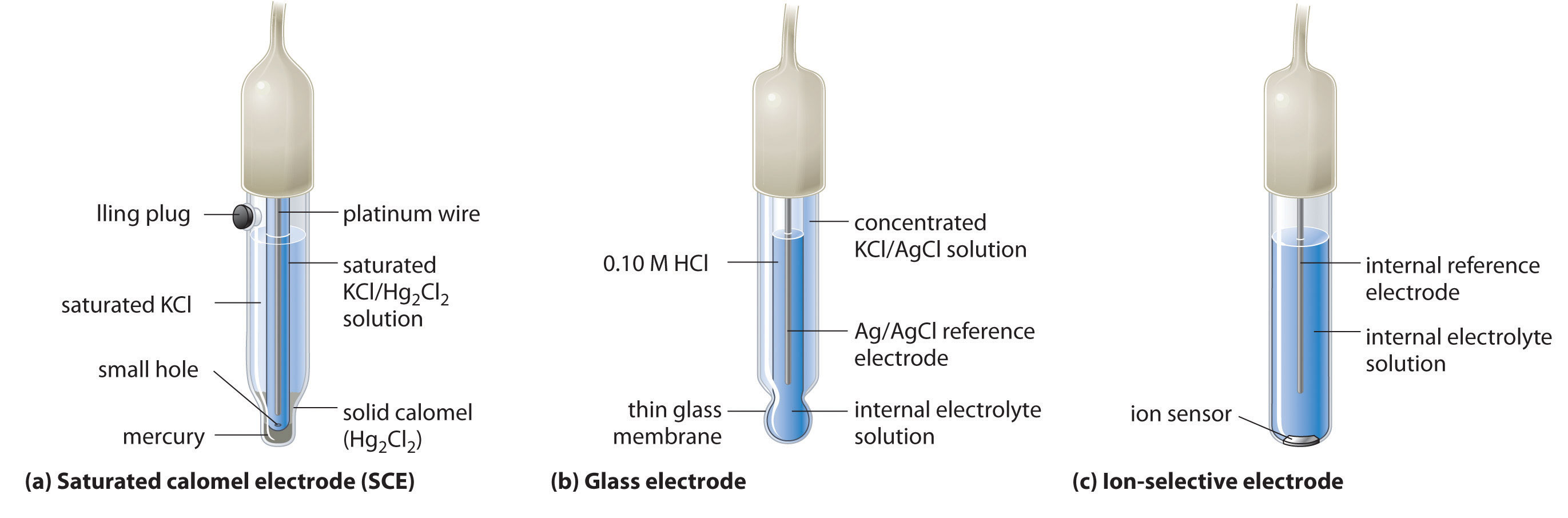
Un segundo electrodo de referencia común es el electrodo de calomel saturado (SCE) Un electrodo de referencia que consiste en un alambre de platino insertado en una pasta húmeda de mercurio líquido (calomel; <math display="inline” xml:id="av_1.0-19_m021"> <semantics><mrow><msub><mrow><mtext>Hg< /mtext ></mrow> <mn>2</mn></msub> <msub><mrow><mtext>Cl</mtext></mrow> <mn>2</mn></msub></mrow></semantics></math>) y KCl en una celda interior, la cual está rodeada por una solución acuosa de KCl. , que tiene la misma forma general que el electrodo de plata-cloruro de plata. El SCE consiste en un alambre de platino insertado en una pasta húmeda de mercurio líquido (Hg 2 Cl 2; llamado calomel en la literatura química antigua) y KCl. Esta celda interior está rodeada por una solución acuosa de KCl, que actúa como un puente salino entre la celda interior y la solución exterior (parte (a) en la Figura 19.2.5). Aunque suene y parezca compleja, esta celda es realmente fácil de preparar y mantener, y su potencial es altamente reproducible. El diagrama de celdas SCE y la media reacción correspondiente son los siguientes:
\( Pt\left (s \right ) \mid Hg_{2}Cl_{2}\left (s \right ) \mid KCl\left (aq, sat \right ) \tag{19.2.37} \)
\( Hg_{2}Cl_{2}\left (s \right ) + 2e^{-} \rightarrow 2Hg\left (l \right ) + 2Cl^{-}\left (aq \right ) \tag{19.2.38} \)
Figura 19.2.5 Tres Tipos Comunes de Electrodos: (a) El SCE es un electrodo de referencia que consiste en un alambre de platino insertado en una pasta húmeda de mercurio líquido (calomel; Hg 2 Cl 2) y KCl. La celda interior está rodeada por una solución acuosa de KCl, que actúa como un puente salino entre la celda interior y la solución exterior. (b) En un electrodo de vidrio, se sumerge un electrodo interno de Ag/AgCl en una solución de HCl 1 M que se separa de la solución de muestra por una membrana de vidrio muy delgada. El potencial del electrodo depende de la concentración de iones H + de la muestra. c) El potencial de un electrodo selectivo de iones depende de la concentración de una sola especie iónica en solución.
A 25°C, el potencial del SCE es de 0.2415 V frente al SHE, lo que significa que se deben restar 0.2415 V del potencial frente a un SCE para obtener el potencial de electrodo estándar.
Uno de los usos más comunes de la electroquímica es medir la concentración de iones H + de una solución. Un electrodo de vidrio</math> Un electrodo utilizado para medir la <math display="inline” xml:id="av_1.0-19_m022"> Concentración de iones <semantics><mrow><msup><mtext>H</mtext> <mo>+</mo></msup></mrow></semantics> de una solución y que consiste en un electrodo interno de Ag/AgCl sumergido en una solución de HCl 1 M que se separa de la solución por una membrana de vidrio muy delgada. se usa generalmente para este propósito, en el cual un electrodo interno de Ag/AgCl se sumerge en una solución de HCl 0.10 M que se separa de la solución por una membrana de vidrio muy delgada (parte (b) en la Figura 19.2.5). La membrana de vidrio absorbe protones, lo que afecta el potencial medido. La extensión de la adsorción en el lado interno es fija porque [H +] se fija dentro del electrodo, pero la adsorción de protones en la superficie externa depende del pH de la solución. El potencial del electrodo de vidrio depende de [H +] de la siguiente manera (recuerde que pH = −log [H +]:
\( E_{glass} = E' + \left ( 0.0591 \; V \times log\left [H^{+} \right ] \right ) = E'- 0.0591 \; V \times pH \tag{19.2.39}\)
El voltaje E ′ es una constante que depende de la construcción exacta del electrodo. Si bien se puede medir, en la práctica se calibra un electrodo de vidrio; es decir, se inserta en una solución de pH conocido, y la visualización en el pHmetro se ajusta al valor conocido. Una vez que el electrodo está correctamente calibrado, puede colocarse en una solución y usarse para determinar un pH desconocido.
Electrodos selectivos de iones Electrodo cuyo potencial depende únicamente de la concentración de una especie particular en solución. se utilizan para medir la concentración de una especie particular en solución; se diseñan de manera que su potencial dependa únicamente de la concentración de la especie deseada (parte (c) en la Figura 19.2.5). Estos electrodos suelen contener un electrodo de referencia interno que está conectado por una solución de un electrolito a un material inorgánico cristalino o una membrana, que actúa como sensor. Por ejemplo, un tipo de electrodo selectivo de iones utiliza un solo cristal de LaF 3 dopado con EU como material inorgánico. Cuando los iones fluoruro en solución se difunden a la superficie del sólido, el potencial del electrodo cambia, dando como resultado un llamado electrodo de fluoruro. Se utilizan electrodos similares para medir las concentraciones de otras especies en solución. Algunas de las especies cuyas concentraciones se pueden determinar en solución acuosa usando electrodos selectivos de iones y dispositivos similares se listan en la Tabla 19.2.1.
Tabla 19.2.1 Algunas especies cuyas concentraciones acuosas pueden medirse mediante métodos electroquímicos
| Especies | Tipo de Muestra |
|---|---|
| H + | muestras de laboratorio, sangre, suelo y agua subterránea y superficial |
| NH 3 /NH 4 + | aguas residuales y aguas de escorrentía |
| K + | sangre, vino y tierra |
| CO 2 /HCO 3 − | sangre y agua subterránea |
| F − | agua subterránea, agua potable y suelo |
| Br − | granos y extractos de plantas |
| I - | leche y productos farmacéuticos |
| NO 3 − | agua subterránea, agua potable, suelo y fertilizantes |
Resumen
El flujo de electrones en una celda electroquímica depende de la identidad de las sustancias reaccionantes, la diferencia en la energía potencial de sus electrones de valencia y sus concentraciones. El potencial de la celda en condiciones estándar (1 M para soluciones, 1 atm para gases, sólidos puros o líquidos para otras sustancias) y a una temperatura fija (25°C) se denomina potencial de celda estándar (celda E °). Solo se puede medir la diferencia entre los potenciales de dos electrodos. Por convención, todos los valores tabulados de potenciales de electrodo estándar se enumeran como potenciales de reducción estándar. El potencial celular global es el potencial de reducción de la media reacción reductora menos el potencial de reducción de la semirreacción oxidativa (E° celda = E° cátodo − E° ánodo). El potencial del electrodo de hidrógeno estándar (SHE) se define como 0 V en condiciones estándar. El potencial de una media reacción medida contra la SHE en condiciones estándar se denomina potencial de electrodo estándar. El potencial celular estándar es una medida de la fuerza impulsora para una reacción redox dada. Todos los valores de E° son independientes de los coeficientes estequiométricos para la media reacción. Las reacciones redox se pueden equilibrar utilizando el método de media reacción, en el que la reacción redox global se divide en una semi-reacción de oxidación y una semi-reacción de reducción, cada una equilibrada para masa y carga. Las semi-reacciones seleccionadas de listas tabuladas deben reflejar exactamente las condiciones de reacción. En un método alternativo, los átomos en cada media reacción se equilibran, y luego se equilibran las cargas. Siempre que se invierte una media reacción, también se debe revertir el signo de E° correspondiente a esa reacción. Si la célula E° es positiva, la reacción se producirá espontáneamente en condiciones estándar. Si la célula E° es negativa, entonces la reacción no es espontánea en condiciones estándar, aunque procederá espontáneamente en sentido contrario. El potencial de un electrodo indicador está relacionado con la concentración de la sustancia que se mide, mientras que el potencial del electrodo de referencia se mantiene constante. Si se produce reducción u oxidación depende del potencial de la muestra versus el potencial del electrodo de referencia. Además del SHE, otros electrodos de referencia son el electrodo de plata-cloruro de plata; el electrodo de calomelano saturado (SCE); el electrodo de vidrio, que se usa comúnmente para medir el pH; y los electrodos selectivos de iones, que dependen de la concentración de una sola especie iónica en solución. Se deben incluir diferencias de potencial entre los electrodos SHE y otros electrodos de referencia al calcular los valores para E°.
Claves para llevar
- Las reacciones redox se pueden equilibrar usando el método de media reacción.
- El potencial celular estándar es una medida de la fuerza impulsora de la reacción.
Problemas conceptuales
-
¿Un electrodo de hidrógeno es químicamente inerte? ¿Cuál es la principal desventaja de usar un electrodo de hidrógeno?
-
Enumere dos factores que afectan el potencial medido de una celda electroquímica y explique su impacto en las mediciones.
-
¿Cuál es la relación entre el flujo de electrones y la energía potencial de los electrones de valencia? Si los electrones de valencia de la sustancia A tienen una energía potencial mayor que los de la sustancia B, ¿cuál es la dirección del flujo de electrones entre ellos en una celda galvánica?
-
Si los componentes de una celda galvánica incluyen aluminio y bromo, ¿cuál es la dirección prevista del flujo de electrones? ¿Por qué?
-
Escriba un diagrama de celdas que represente una celda que contenga el par Ni/Ni 2+ en un compartimento y el SHE en el otro compartimento. ¿Cuáles son los valores de cátodo E°, ánodo E° y celda E°?
-
Explicar por qué los valores de E° son independientes de los coeficientes estequiométricos en la media reacción correspondiente.
-
Identificar los oxidantes y los reductores en cada reacción redox.
- Cr (s) + Ni 2+ (aq) → Cr 2+ (aq) + Ni (s)
- Cl 2 (g) + Sn 2+ (aq) → 2Cl − (aq) + Sn 4+ (aq)
- H 3 ASO 4 (aq) + 8H + (aq) + 4Zn (s) → Ash 3 (g) + 4H 2 O (l) + 4Zn 2+ (aq)
- 2NO 2 (g) + 2OH − (aq) → NO 2 − (aq) + NO 3 − (aq) + H 2 O (l)
-
Identificar los oxidantes y los reductores en cada reacción redox.
- Br 2 (l) + 2I − (aq) → 2Br − (aq) + I 2 (s)
- Cu 2+ (aq) + 2Ag (s) → Cu (s) + 2Ag + (aq)
- H + (aq) + 2MnO 4 − (aq) + 5H 2 SO 3 (aq) → 2Mn 2+ (aq) + 3H 2 O (l) + 5HSO 4 − (aq)
- IO 3 − (aq) + 5I − (aq) + 6H + (aq) → 3I 2 (s) + 3H 2 O (l)
-
Todos los electrodos de referencia deben cumplir con ciertos requisitos. Enumerar los requisitos y explicar su significación.
-
Para cada aplicación, describe el electrodo de referencia que usarías y explica por qué. En cada caso, ¿cómo se compararía el potencial medido con el E° correspondiente?
- medir el potencial de un par Cl − /Cl 2
- medir el pH de una solución
- medir el potencial de un par MnO 4− /Mn 2+
RESPUESTAS
-
\( Ni\left (s \right )\mid Ni^{2+}\left (aq \right ) \parallel H^{+} \left (aq, 1\;M \right ) \mid H_{2}\left ( g, 1 \; atm \right )\mid Pt\left (s \right ) \)
\ (\ begin {matriz}
E_ {ánodo} ^ {o} &\;\;\; & Ni^ {2+}\ izquierda (aq\ derecha) + 2e^ {-}\ fila derecha Ni\ izquierda (s\ derecha) &\;\; -0.257\; V\\
E_ {cátodo} ^ {o} &\;\;\; & 2H^ {+}\ izquierda (aq\ derecha) +2e^ {-}\ fila derecha H_ {2}\ izquierda (g,\ derecha) &\;\;\; 0.000\; V\\
E_ {celda} ^ {o} &\;\;\; & 2H^ {+}\ izquierda (aq\ derecha) + Ni\ izquierda (s\ derecha)\ fila derecha H_ {2}\ izquierda (g,\ derecha) + Ni^ {2+}\ izquierda (aq\ derecha) &\;\; 0.257\; V
\ end {matriz}\) -
- oxidante: Ni 2+ (aq); reductor: Cr (s)
- oxidante: Cl 2 (g); reductor: Sn 2+ (aq)
- oxidante: H 3 AsO 4 (aq); reductor: Zn (s)
- oxidante: NO 2 (g); reductor: NO 2 (g)
Problemas numéricos
-
Dibuje el diagrama de celdas para una celda galvánica con una SHE y un electrodo de cobre que lleve a cabo esta reacción general:
H 2 (g) + Cu 2+ (aq) → 2H + (aq) + Cu (s).
-
Dibuje el diagrama de celdas para una celda galvánica con una SHE y un electrodo de zinc que lleve a cabo esta reacción general:
Zn (s) + 2H + (aq) → Zn 2+ (aq) + H 2 (g).
-
Equilibrar cada reacción y calcular el potencial de electrodo estándar para cada una. Asegúrese de incluir el estado físico de cada producto y reactivo.
- Cl 2 (g) + H 2 (g) → 2Cl − (aq) + 2H + (aq)
- Br 2 (aq) + Fe 2+ (aq) → 2Br − (aq) + Fe 3+ (aq)
- Fe 3+ (aq) + Cd (s) → Fe 2+ (aq) + Cd 2+ (aq)
-
Equilibrar cada reacción y calcular el potencial de reducción estándar para cada una. Asegúrese de incluir el estado físico de cada producto y reactivo.
- Cu + (aq) + Ag + (aq) → Cu 2+ (aq) + Ag (s)
- Sn (s) + Fe 3+ (aq) → Sn 2+ (aq) + Fe 2+ (aq)
- Mg (s) + Br 2 (l) → 2Br − (aq) + Mg 2+ (aq)
-
Escriba una ecuación química equilibrada para cada reacción redox.
- H 2 PO 2 − (aq) + SbO 2 − (aq) → HPO 3 2− (aq) + Sb (s) en solución básica
- HNO 2 (aq) + I − (aq) → NO (g) + I 2 (s) en solución ácida
- N 2 O (g) + ClO − (aq) → Cl − (aq) + NO 2 − (aq) en solución básica
- Br 2 (l) → Br − (aq) + BrO 3 − (aq) en solución básica
- Cl (CH 2) 2 OH (ac) + K 2 Cr 2 O 7 (ac) → ClCH 2 CO 2 H (ac) + Cr 3+ (ac) en solución ácida
-
Escriba una ecuación química equilibrada para cada reacción redox.
- I − (aq) + HClO 2 (aq) → IO 3 − (aq) + Cl 2 (g) en solución ácida
- Cr 2+ (ac) + O 2 (g) → Cr 3+ (ac) + H 2 O (l) en solución ácida
- CrO 2 − (aq) + ClO − (aq) → CrO 4 2− (aq) + Cl − (aq) en solución básica
- S (s) + HNO 2 (aq) → H 2 SO 3 (ac) + N 2 O (g) en solución ácida
- F (CH 2) 2 OH (ac) + K 2 Cr 2 O 7 (aq) → FCH 2 CO 2 H (ac) + Cr 3+ (ac) en solución ácida
-
El potencial celular estándar para la oxidación de Pb a Pb 2+ con la reducción concomitante de Cu + a Cu es de 0.39 V. Usted sabe que E° para el par Pb 2+ /Pb es −0.13 V. ¿Qué es E° para la pareja Cu + /Cu?
-
Se ha construido una celda galvánica similar a la de la Figura 19.2.3 utilizando un clavo de hierro, una solución de FeCl 2, y un SHE. Cuando la celda está conectada, se nota que el clavo de hierro comienza a corroerse. ¿Qué más observas? En condiciones estándar, ¿qué es la célula E?
-
El carbono se utiliza para reducir el mineral de hierro a hierro metálico. La reacción global es la siguiente:
2Fe 2 O 3 · x H 2 O (s) + 3C (s) → 4Fe (l) + 3CO 2 (g) + 2 x H 2 O (g)
Escribe las dos medias reacciones para esta reacción general.
-
¿Cada reacción ocurrirá espontáneamente en condiciones estándar?
- Cu (s) + 2H + (aq) → Cu 2+ (aq) + H 2 (g)
- Zn 2+ (aq) + Pb (s) → Zn (s) + Pb 2+ (aq)
-
Cada reacción se lleva a cabo en solución ácida. Equilibrar cada reacción y luego determinar si ocurre espontáneamente como se escribe en condiciones estándar.
- Se (s) + Br 2 (l) → H 2 SeO 3 (aq) + Br − (aq)
- NO 3 − (aq) + S (s) → HNO 2 (aq) + H 2 SO 3 (aq)
- Fe 3+ (aq) + Cr 3+ (aq) → Fe 2+ (aq) + Cr 2 O 7 2− (aq)
-
Calcular E° celda y Δ G° para la reacción redox representada por el diagrama celular Pt (s) Cl 2 (g, 1 atm) ZnCl 2 (aq, 1 M) Zn (s). ¿Esta reacción ocurrirá espontáneamente?
-
Si colocas tachuelas recubiertas de Zn (galvanizadas) en un vaso y agregas una solución acuosa de yodo, el color marrón de la solución de yodo se desvanece a un amarillo pálido. ¿Qué ha pasado? Escriba las dos medias reacciones y la ecuación química equilibrada general para esta reacción. ¿Qué es la celda E°?
-
Su compañero de laboratorio quiere recuperar plata sólida del cloruro de plata usando una solución 1.0 M de HCl y 1 atm H 2 en condiciones estándar. ¿Funcionará este plan?
RESPUESTAS
-
Pt (s) H 2 (g, 1 atm) | H + (aq, 1M) Cu 2+ (aq) Cu (s)
-
- Cl 2 (g) + H 2 (g) → 2Cl − (aq) + 2H + (aq); E° = 1.358 V
- Br 2 (l) + 2Fe 2+ (aq) → 2Br − (aq) + 2Fe 3+ (aq); E° = 0.316 V
- 2Fe 3+ (aq) + Cd (s) → 2Fe 2+ (aq) + Cd 2+ (aq); E° = 1.174 V
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern