19.7: Corrosión
- Page ID
- 78397
- Entender el proceso de corrosión.
Corrosión Proceso galvánico por el cual los metales se deterioran a través de la oxidación, generalmente pero no siempre a sus óxidos. es un proceso galvánico por el cual los metales se deterioran a través de la oxidación, generalmente pero no siempre a sus óxidos. Por ejemplo, cuando se exponen al aire, las oxidaciones de hierro, los deslustrados de plata y el cobre y el latón adquieren una superficie de color verde azulado llamada pátina. De los diversos metales sometidos a corrosión, el hierro es, con mucho, el más importante comercialmente. Se estima que solo en Estados Unidos se gastan 100 mil millones de dólares anuales para reemplazar objetos que contienen hierro destruidos por la corrosión. En consecuencia, el desarrollo de métodos para proteger las superficies metálicas de la corrosión constituye un área muy activa de investigación industrial. En esta sección, describimos algunos de los procesos químicos y electroquímicos responsables de la corrosión. También examinamos la base química de algunos métodos comunes para prevenir la corrosión y tratar metales corroídos.
Tenga en cuenta el patrón
La corrosión es un proceso galvánico.
En condiciones ambientales, la oxidación de la mayoría de los metales es termodinámicamente espontánea, con la notable excepción del oro y el platino. De ahí que en realidad sea algo sorprendente que cualquier metal sea útil en la atmósfera húmeda y rica en oxígeno de la Tierra. Algunos metales, sin embargo, son resistentes a la corrosión por razones cinéticas. Por ejemplo, el aluminio en latas de refrescos y aviones está protegido por una fina capa de óxido metálico que se forma en la superficie del metal y actúa como una barrera impenetrable que evita una mayor destrucción. Las latas de aluminio también tienen una fina capa plástica para evitar la reacción del óxido con el ácido en el refresco. El cromo, el magnesio y el níquel también forman películas protectoras de óxido. Los aceros inoxidables son notablemente resistentes a la corrosión porque generalmente contienen una proporción significativa de cromo, níquel o ambos.
A diferencia de estos metales, cuando el hierro se corroe, forma un óxido metálico hidratado rojo-marrón (Fe 2 O 3 · x H 2 O), comúnmente conocido como óxido, que no proporciona una película protectora apretada (Figura 19.17). En cambio, el óxido se descama continuamente para exponer una superficie metálica fresca vulnerable a la reacción con el oxígeno y el agua. Debido a que tanto el oxígeno como el agua son necesarios para que se forme óxido, un clavo de hierro sumergido en agua desoxigenada no se oxidará, incluso durante un período de varias semanas. De igual manera, una uña sumergida en un disolvente orgánico como queroseno o aceite mineral saturado de oxígeno no se oxidará por la ausencia de agua.
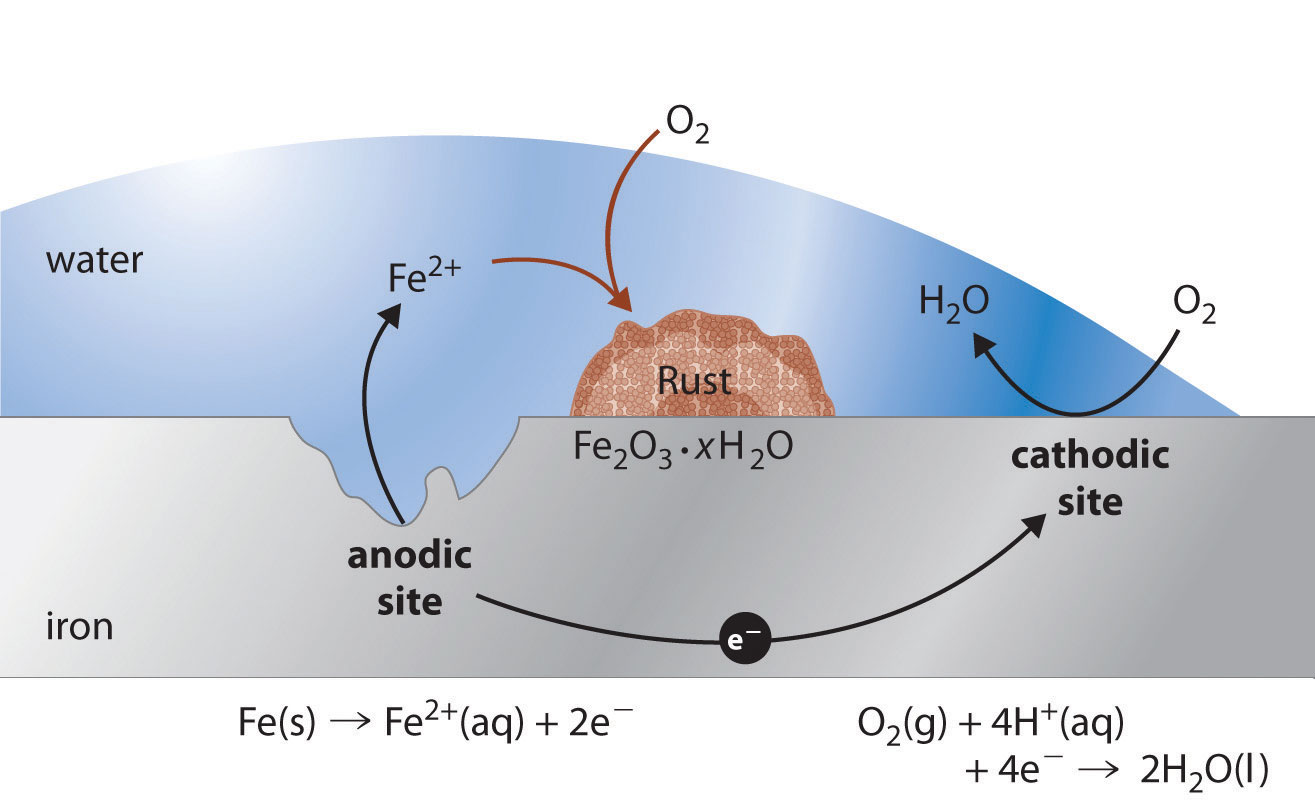
Figura 19.6.1 Roya, el Resultado de la Corrosión del Hierro Metálico El hierro se oxida a Fe 2+ (aq) en un sitio anódico en la superficie del hierro, que a menudo es una impureza o un defecto reticular. El oxígeno se reduce a agua en un sitio diferente en la superficie del hierro, que actúa como cátodo. Los electrones se transfieren del ánodo al cátodo a través del metal eléctricamente conductor. El agua es un disolvente para el Fe 2+ que se produce inicialmente y actúa como puente salino. La roya (Fe 2 O 3 · x H 2 O) se forma por la posterior oxidación de Fe 2+ por oxígeno atmosférico.
En el proceso de corrosión, el hierro metálico actúa como ánodo en una celda galvánica y se oxida a Fe 2+; el oxígeno se reduce a agua en el cátodo. Las reacciones relevantes son las siguientes:
\(cathode:\; O_{2}\left ( g \right )+ 4H^{+}\left ( aq \right ) +4 e^{-} \rightarrow 2H_{2}O\left ( l \right ) \;\;\; E^{o}=1.23 \; V \tag{19.6.1} \)
\(anode:\; Fe\left ( s \right )\rightarrow Fe^{2+} \left ( aq \right ) +2e^{-} \;\;\; E^{o}=-0.24 \; V \tag{19.6.2} \)
\(overall:\; 2Fe\left ( s \right ) + O_{2}\left ( g \right )+ 4H^{+}\left ( aq \right ) \rightarrow 2Fe^{2+} \left ( aq \right ) + 2H_{2}O \left ( l \right ) \;\;\; E^{o}=1.68 \; V \tag{19.6.3} \)
Los iones Fe 2+ producidos en la reacción inicial son luego oxidados por oxígeno atmosférico para producir el óxido hidratado insoluble que contiene Fe 3+, como se representa en la siguiente ecuación:
\( 4Fe^{2+} \left ( aq \right ) + O_{2}\left ( g \right ) + \left ( 2+4x \right )H_{2}O \left ( l \right )\rightarrow 2Fe_{2}O_{3}\cdot x H_{2}O +4H^{+} \tag{19.6.4} \)
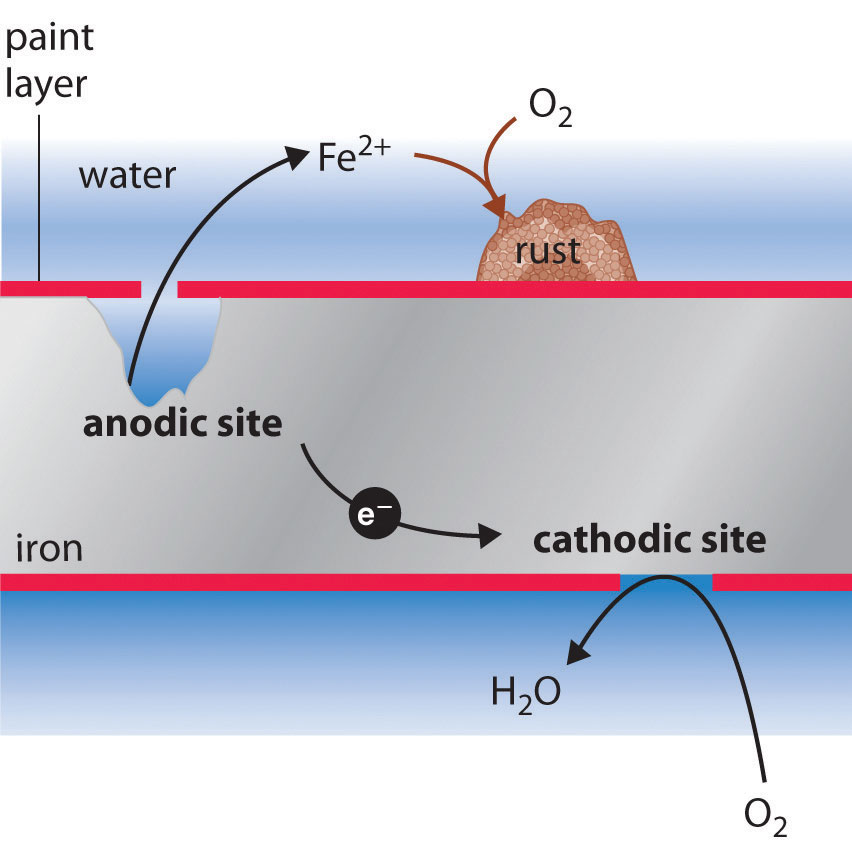
El signo y magnitud de E° para el proceso de corrosión (Ecuación 19.6.3) indican que existe una fuerte fuerza impulsora para la oxidación del hierro por O 2 en condiciones estándar (1 M H +). En condiciones neutras, la fuerza motriz es algo menor pero aún apreciable (E = 1.25 V a pH 7.0). Normalmente, la reacción del CO 2 atmosférico con agua para formar H + y HCO 3 − proporciona un pH lo suficientemente bajo para mejorar la velocidad de reacción, al igual que la lluvia ácida. Los fabricantes de automóviles dedican mucho tiempo y dinero desarrollando pinturas que se adhieren firmemente a la superficie metálica del automóvil para evitar que el agua oxigenada, el ácido y la sal entren en contacto con el metal subyacente. Desafortunadamente, incluso la mejor pintura está sujeta a rasguños o abolladuras, y la naturaleza electroquímica del proceso de corrosión significa que dos rasguños relativamente remotos entre sí pueden operar juntos como ánodo y cátodo, lo que lleva a fallas mecánicas repentinas (Figura 19.6.2).
Figura 19.6.2 Los pequeños arañazos en una capa protectora de pintura pueden conducir a la rápida corrosión de los orificios de hierro en un recubrimiento protector permiten reducir el oxígeno en la superficie con la mayor exposición al aire (el cátodo), mientras que el hierro metálico se oxida a Fe 2+ (aq) en el sitio menos expuesto (el ánodo). El óxido se forma cuando el Fe 2+ (aq) se difunde a un lugar donde puede reaccionar con el oxígeno atmosférico, que a menudo está alejado del ánodo. La interacción electroquímica entre sitios catódicos y anódicos puede provocar que se forme un gran pozo bajo una superficie pintada, resultando eventualmente en fallas repentinas con poca advertencia visible de que se ha producido corrosión.
Una de las técnicas más comunes utilizadas para prevenir la corrosión del hierro es aplicar una capa protectora de otro metal que es más difícil de oxidar. Los grifos y algunas partes externas de los automóviles, por ejemplo, suelen estar recubiertos con una fina capa de cromo mediante un proceso electrolítico que se discutirá en la Sección 19.7. Sin embargo, con el aumento del uso de materiales poliméricos en los automóviles, el uso del acero cromado ha disminuido en los últimos años. De igual manera, las “latas” que contienen sopas y otros alimentos en realidad están hechas de acero recubiertas con una fina capa de hojalata. Ni el cromo ni el estaño son intrínsecamente resistentes a la corrosión, pero ambos forman recubrimientos protectores de óxido.
Al igual que con una pintura protectora, rayar una capa metálica protectora permitirá que ocurra la corrosión. En este caso, sin embargo, la presencia del segundo metal realmente puede aumentar a la rata que el Fe se oxida más fácilmente que el Sn. Como resultado, el metal más resistente a la corrosión (en este caso, el estaño) acelera la corrosión del hierro al actuar como cátodo y proporcionar una gran superficie para la reducción de oxígeno (Figura 19.6.3). Este proceso se ve en algunas casas antiguas donde las tuberías de cobre y hierro se han conectado directamente entre sí. El cobre menos fácilmente oxidado actúa como cátodo, haciendo que el hierro se disuelva rápidamente cerca de la conexión y ocasionalmente resulta en una falla catastrófica de la plomería.
Figura 19.6.3 Corrosión Galvánica Si el hierro está en contacto con un metal más resistente a la corrosión como el estaño, el cobre o el plomo, el otro metal puede actuar como un cátodo grande que incrementa en gran medida la tasa de reducción de oxígeno. Debido a que la reducción de oxígeno se acopla a la oxidación del hierro, esto puede resultar en un aumento dramático en la velocidad a la que el hierro se oxida en el ánodo. Es probable que se produzca corrosión galvánica siempre que dos metales diferentes se conecten directamente, permitiendo que los electrones se transfieran de uno a otro.
Una forma de evitar estos problemas es usar un metal más fácilmente oxidado para proteger el hierro de la corrosión. En este enfoque, llamado protección catódica, un metal más reactivo como el Zn (E° = −0.76 V para Zn 2+ + 2e − → Zn) se convierte en el ánodo, y el hierro se convierte en el cátodo. Esto evita la oxidación del hierro y protege el objeto de hierro de la corrosión. Las reacciones que ocurren bajo estas condiciones son las siguientes:
\(cathode:\; O_{2}\left ( g \right )+ 4H^{+}\left ( aq \right ) +4 e^{-} \rightarrow 2H_{2}O\left ( l \right ) \tag{19.6.5} \)
\(anode:\; Zn\left ( s \right )\rightarrow Zn^{2+} \left ( aq \right ) +2e^{-} \;\;\; E^{o}=-0.24 \; V \tag{19.6.6} \)
\(overall:\; 2Zn\left ( s \right ) + O_{2}\left ( g \right )+ 4H^{+}\left ( aq \right ) \rightarrow 2Zn^{2+} \left ( aq \right )+ 2H_{2}O \left ( l \right ) \ \tag{19.6.7} \)
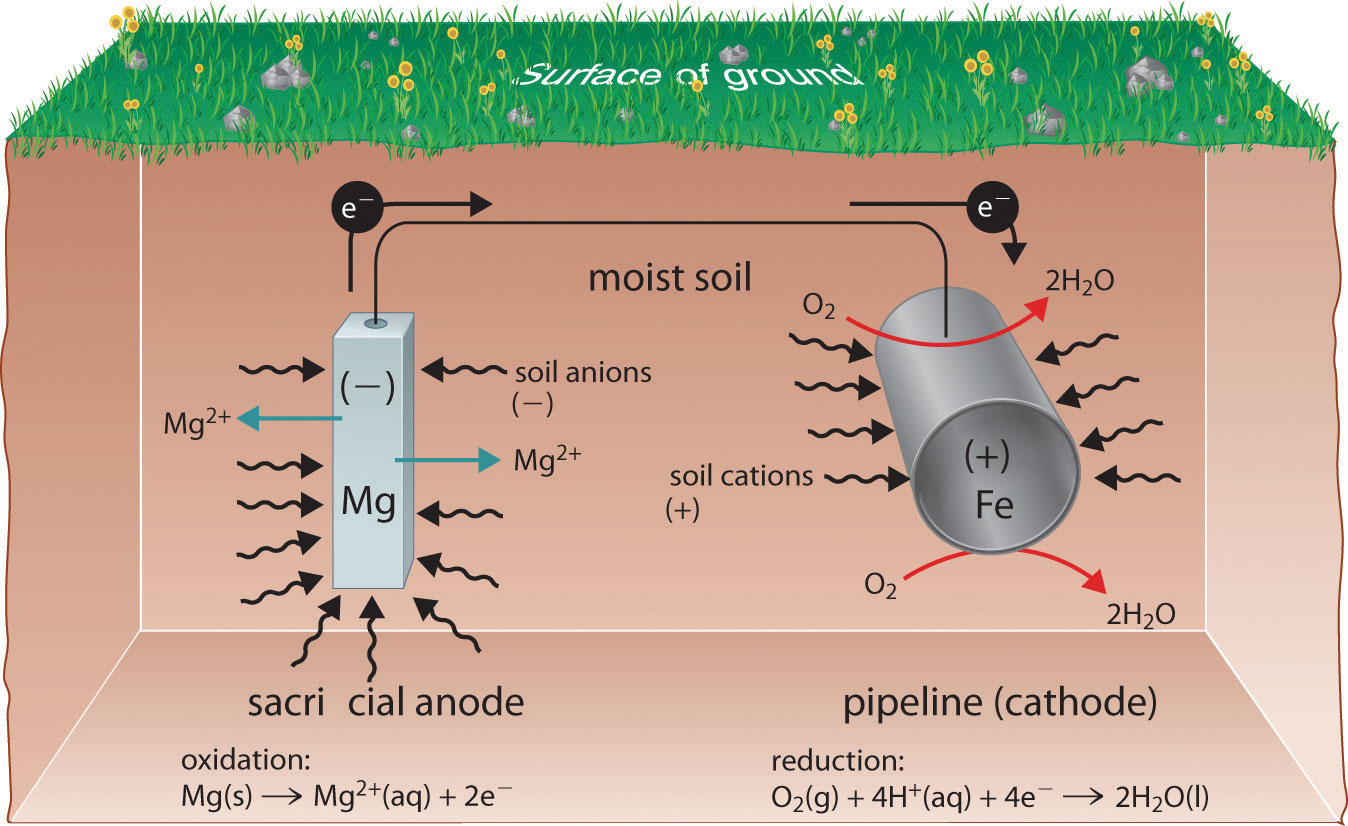
El metal más reactivo reacciona con el oxígeno y eventualmente se disolverá, “sacrificándose” para proteger el objeto de hierro. La protección catódica es el principio subyacente al acero galvanizado, que es acero protegido por una fina capa de zinc. El acero galvanizado se utiliza en objetos que van desde clavos hasta botes de basura. En una estrategia similar, electrodos de sacrificio Un electrodo que contiene un metal más reactivo que se une a un objeto metálico para inhibir la corrosión de ese objeto. utilizando magnesio, por ejemplo, se utilizan para proteger tanques o tuberías subterráneas (Figura 19.20). Reemplazar los electrodos de sacrificio es más rentable que reemplazar los objetos de hierro que están protegiendo.
Figura 19.6.4 El Uso de un Electrodo de Sacrificio para Proteger Contra la Corrosión Conectar una varilla de magnesio a una tubería subterránea de acero protege la tubería de la corrosión. Debido a que el magnesio (E° = −2.37 V) se oxida mucho más fácilmente que el hierro (E° = −0.45 V), la varilla de Mg actúa como ánodo en una celda galvánica. Por lo tanto, la tubería se ve obligada a actuar como el cátodo en el que se reduce el oxígeno. El suelo entre el ánodo y el cátodo actúa como un puente salino que completa el circuito eléctrico y mantiene la neutralidad eléctrica. A medida que el Mg (s) se oxida a Mg 2+ en el ánodo, los aniones en el suelo, como el nitrato, se difunden hacia el ánodo para neutralizar la carga positiva. Simultáneamente, los cationes en el suelo, como H + o NH 4 +, se difunden hacia el cátodo, donde reponen los protones que se consumen a medida que se reduce el oxígeno. Una estrategia similar utiliza muchos kilómetros de alambre de zinc algo menos reactivo para proteger el oleoducto de Alaska.
Ejemplo 19.6.1
Supongamos que un viejo velero de madera, unido con tornillos de hierro, tiene una hélice de bronce (recordemos que el bronce es una aleación de cobre que contiene aproximadamente 7% — 10% de estaño).
- Si el barco está sumergido en agua de mar, ¿qué reacción de corrosión ocurrirá? ¿Qué es la celda E°?
- ¿Cómo podría evitar que se produjera esta corrosión?
Dado: identidad de metales
Preguntado por: reacción a la corrosión, celda E° y medidas preventivas
Estrategia:
A Escribe las reacciones que ocurren en el ánodo y el cátodo. A partir de estos, escribir la reacción celular global y calcular E° celda.
B Con base en la actividad redox relativa de diversas sustancias, sugieren posibles medidas preventivas.
Solución:
- A De acuerdo con el Cuadro 19.3.1, tanto el cobre como el estaño son metales menos activos que el hierro (es decir, tienen valores positivos mayores de E° que el hierro). Así, si el estaño o el cobre se ponen en contacto eléctrico por el agua de mar con hierro en presencia de oxígeno, se producirá corrosión. Por lo tanto, anticipamos que la hélice de bronce actuará como el cátodo en el que se reduce O 2, y los tornillos de hierro actuarán como ánodos en los que el hierro se disuelve:
\(cathode:\; O_{2}\left ( g \right )+ 4H^{+}\left ( aq \right ) +4 e^{-} \rightarrow 2H_{2}O\left ( l \right ) \;\;\; E_{cathode}^{o} = 1.23 \; V \)
\(anode:\; Fe\left ( s \right )\rightarrow Fe^{2+} \left ( aq \right ) + 2e^{-} \;\;\; E_{anode}^{o}=-0.45 \; V \)
\(overall:\; 2Fe\left ( s \right ) + O_{2}\left ( g \right )+ 4H^{+}\left ( aq \right ) \rightarrow 2Fe^{2+} \left ( aq \right )+ 2H_{2}O \left ( l \right ) \;\; E_{cell}^{o}=1.68 \; V\)
Con el tiempo, los tornillos de hierro se disolverán y el bote se desmoronará.
- B Las posibles formas de prevenir la corrosión, en orden de disminuir el costo y los inconvenientes, son las siguientes: desmontar la embarcación y reconstruirla con tornillos de bronce; retirar la embarcación del agua y almacenarla en un lugar seco; o unir una pieza económica de zinc metálico al eje de la hélice para actuar como electrodo de sacrificio y reemplazarlo una o dos veces al año. Debido a que el zinc es un metal más activo que el hierro, actuará como ánodo de sacrificio en la celda electroquímica y se disolverá (Ecuación 19.102).
Ejercicio
Supongamos que las tuberías de agua que conducen a su casa están hechas de plomo, mientras que el resto de la plomería de su casa es de hierro. Para eliminar la posibilidad de envenenamiento por plomo, llama a un plomero para reemplazar las tuberías de plomo. Te cita un precio muy bajo si puede agotar su suministro existente de tubería de cobre para hacer el trabajo.
- ¿Aceptas su propuesta?
- ¿Qué más deberías hacer que haga el plomero mientras estés en tu casa?
Contestar
- No a menos que planee vender la casa muy pronto porque las juntas de tubería Cu/Fe provocarán una rápida corrosión.
- Cualquier junta Pb/Fe existente debe examinarse cuidadosamente para detectar la corrosión de las tuberías de hierro debido a la unión Pb—Fe; el Pb menos activo habrá servido como cátodo para la reducción de O 2, promoviendo la oxidación del Fe más activo cercano.
Resumen
El deterioro de los metales a través de la oxidación es un proceso galvánico llamado corrosión. Los recubrimientos protectores consisten en un segundo metal que es más difícil de oxidar que el metal que se está protegiendo. Alternativamente, se puede aplicar un metal más fácilmente oxidado a una superficie metálica, proporcionando así protección catódica de la superficie. Una fina capa de zinc protege el acero galvanizado. Los electrodos de sacrificio también se pueden unir a un objeto para protegerlo.
Llave para llevar
- La corrosión es un proceso galvánico que se puede prevenir con protección catódica.
Problemas conceptuales
-
¿Esperas que una uña doblada se corroa más o menos rápidamente que una uña recta? ¿Por qué?
-
¿Qué significa cuando un metal se describe como recubierto con una capa de sacrificio? ¿Esto es diferente de la protección galvánica?
-
¿Por qué es importante que los fabricantes de automóviles apliquen pintura a la superficie metálica de un automóvil? ¿Por qué este proceso es particularmente importante para los vehículos en climas del norte, donde la sal se usa en carreteras heladas?
Contestar
-
La pintura evita que el oxígeno y el agua entren en contacto directo con el metal, lo que evita la corrosión. La pintura es más necesaria porque la sal es un electrolito que aumenta la conductividad del agua y facilita el flujo de corriente eléctrica entre sitios anódicos y catódicos.