19.6: Celdas Galvánicas Comerciales
- Page ID
- 78390
- Aprender cómo funcionan las celdas galvánicas comerciales.
Debido a que las celdas galvánicas pueden ser autónomas y portátiles, se pueden usar como baterías y celdas de combustible. Una batería (celda de almacenamiento) Una celda galvánica (o serie de celdas galvánicas) que contiene todos los reactivos necesarios para producir electricidad. es una celda galvánica (o una serie de celdas galvánicas) que contiene todos los reactivos necesarios para producir electricidad. En contraste, una pila de combustible Una celda galvánica que requiere un suministro externo constante de uno o más reactivos para generar electricidad. es una celda galvánica que requiere un suministro externo constante de uno o más reactivos para generar electricidad. En esta sección, describimos la química detrás de algunos de los tipos más comunes de baterías y pilas de combustible.
Baterías
Existen dos tipos básicos de baterías: baterías desechables, o primarias, en las que las reacciones de los electrodos son efectivamente irreversibles y que no pueden recargarse; y baterías recargables, o secundarias, que forman un producto insoluble que se adhiere a los electrodos. Estas baterías se pueden recargar aplicando un potencial eléctrico en la dirección inversa. El proceso de recarga convierte temporalmente una batería recargable de una celda galvánica a una celda electrolítica.
Las baterías son dispositivos ingeniosamente diseñados que se basan en las mismas leyes fundamentales que las celdas galvánicas. La principal diferencia entre las baterías y las celdas galvánicas que hemos descrito anteriormente es que las baterías comerciales utilizan sólidos o pastas en lugar de soluciones como reactivos para maximizar la salida eléctrica por unidad de masa. El uso de reactivos altamente concentrados o sólidos tiene otro efecto beneficioso: las concentraciones de los reactivos y los productos no cambian mucho a medida que se descarga la batería; en consecuencia, el voltaje de salida permanece notablemente constante durante el proceso de descarga. Este comportamiento contrasta con el de la celda Zn/Cu, cuya producción disminuye logarítmicamente a medida que avanza la reacción (Figura 19.4.3). Cuando una batería consiste en más de una celda galvánica, las celdas suelen estar conectadas en serie, es decir, con el terminal positivo (+) de una celda conectado al terminal negativo (−) de la siguiente, y así sucesivamente. El voltaje total de la batería es, por lo tanto, la suma de los voltajes de las celdas individuales.
Célula Seca Leclanché
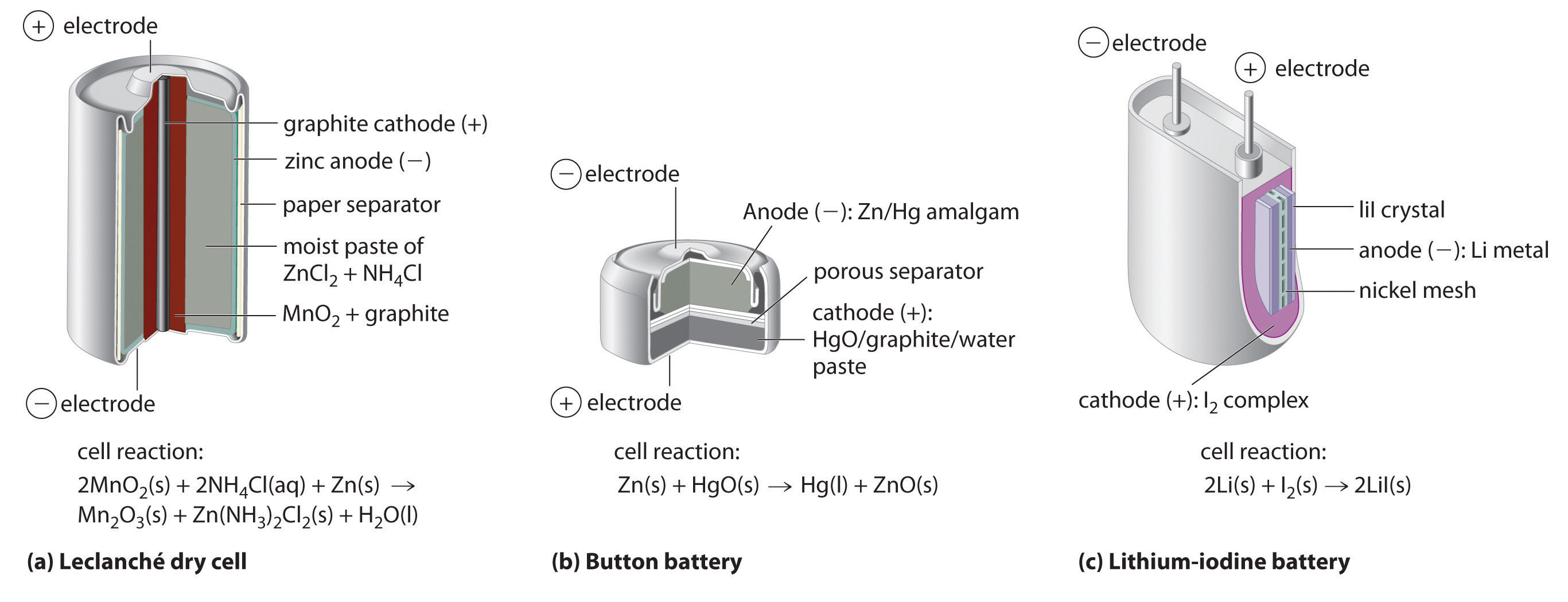
La celda seca, con mucho el tipo de batería más común, se utiliza en linternas, dispositivos electrónicos como el Walkman y Game Boy, y muchos otros dispositivos. Si bien la celda seca fue patentada en 1866 por el químico francés Georges Leclanché y cada año se venden más de 5 mil millones de células de este tipo, los detalles de su química de electrodos aún no se entienden completamente. A pesar de su nombre, la batería Leclanché de celda seca A consiste en un electrolito que es una pasta ácida a base de agua que contiene MnO 2, NH 4 Cl, ZnCl 2, grafito y almidón. es en realidad una “celda húmeda”: el electrolito es una pasta ácida a base de agua que contiene MnO 2, NH 4 Cl, ZnCl 2, grafito y almidón (parte (a) en la Figura 19.5.1). Las semi-reacciones en el ánodo y el cátodo se pueden resumir de la siguiente manera:
\( cathode:\; 2MnO_{2}\left (s \right ) + 2NH_{4}^{+}\left ( aq \right ) + 2e^{-} \rightarrow Mn_{2}O_{3}\left ( s \right ) + 2NH_{3}\left (aq \right ) + H_{2}O\left (l \right ) \tag{19.5.1} \)
\( anode:\; Zn\left (s \right ) \rightarrow Zn^{2+}\left ( aq \right ) + 2e^{-} \tag{19.5.2} \)
Los iones Zn 2+ formados por la oxidación de Zn (s) en el ánodo reaccionan con NH 3 formado en el cátodo y los iones Cl − presentes en solución, por lo que la reacción celular global es la siguiente:
\( overall:\; 2MnO_{2}\left (s \right ) + 2NH_{4}Cl\left ( aq \right ) + Zn\left (s \right ) \rightarrow Mn_{2}O_{3}\left ( s \right ) + Zn\left (NH_{3} \right )_{2}Cl_{2}\left (s \right ) + H_{2}O\left (l \right ) \tag{19.5.13} \)
La celda seca produce alrededor de 1.55 V y es barata de fabricar. Sin embargo, no es muy eficiente en la producción de energía eléctrica porque solo la fracción relativamente pequeña del MnO 2 que está cerca del cátodo se reduce realmente y solo una pequeña fracción del cátodo de zinc se consume realmente a medida que la celda se descarga. Además, las celdas secas tienen una vida útil limitada debido a que el ánodo de Zn reacciona espontáneamente con NH 4 Cl en el electrolito, provocando que la caja se corroa y permitiendo que el contenido se escape.
La pila alcalina Una batería que consiste en una pila Leclanché adaptada para operar bajo condiciones alcalinas (básicas). es esencialmente una celda Leclanché adaptada para operar bajo condiciones alcalinas o básicas. Las medias reacciones que ocurren en una batería alcalina son las siguientes:
\( cathode:\; 2MnO_{2}\left (s \right ) + H_{2}O \left ( l \right ) + 2e^{-} \rightarrow Mn_{2}O_{3}\left ( s \right ) + 2OH^{-}\left (aq \right ) \tag{19.5.4} \)
\( anode:\; Zn\left (s \right ) + 2OH^{-}\left (aq \right ) \rightarrow ZnO \left ( S \right ) + H_{2}O \left ( l \right ) + 2e^{-} \tag{19.5.5} \)
\( overall:\; 2MnO_{2}\left (s \right ) + Zn\left (s \right ) \rightarrow Mn_{2}O_{3}\left ( s \right ) + ZnO \left (s \right ) \tag{19.5.6} \)
Esta batería también produce alrededor de 1.5 V, pero tiene una vida útil más larga y un voltaje de salida más constante ya que la celda se descarga que la celda seca Leclanché. Aunque la pila alcalina es más cara de producir que la pila seca Leclanché, el rendimiento mejorado hace que esta batería sea más rentable.
Baterías de Botón
Aunque algunas de las pequeñas baterías de botón utilizadas para alimentar relojes, calculadoras y cámaras son celdas alcalinas en miniatura, la mayoría se basan en una química completamente diferente. En estas baterías, el ánodo es una amalgama de cinc-mercurio en lugar de zinc puro, y el cátodo usa HgO o Ag 2 O como oxidante en lugar de MnO 2 (parte (b) en la Figura 19.13). Las reacciones catódica y general y la salida de celdas para estos dos tipos de baterías de botón son las siguientes:
\( cathode \left ( Hg \right ):\; HgO\left (s \right ) + H_{2}O \left ( l \right ) + 2e^{-} \rightarrow Hg\left ( l \right ) + 2OH^{-}\left (aq \right ) \tag{19.5.7} \)
\( overall \left ( Hg \right ):\; HgO\left (s \right ) + Zn\left (s \right ) \rightarrow Hg\left (l \right ) + ZnO \left (s \right ) \;\;\; E_{cell}=1.35 \; V \tag{19.5.8} \)
\( cathode \left ( Ag \right ):\; Ag_{2}O\left (s \right ) + H_{2}O \left ( l \right ) + 2e^{-} \rightarrow 2Ag\left ( s \right ) + 2OH^{-}\left (aq \right ) \tag{19.5.9} \)
\( overall \left ( Ag \right ):\; Ag_{2}O\left (s \right ) + Zn\left (s \right ) \rightarrow 2Ag\left (s \right ) + ZnO \left (s \right ) \;\;\; E_{cell}=1.6 \; V \tag{19.5.10} \)
Las principales ventajas de las celdas de mercurio y plata son su fiabilidad y su alta relación producción-masa. Estos factores los hacen ideales para aplicaciones donde el tamaño pequeño es crucial, como en cámaras y audífonos. Las desventajas son el gasto y los problemas ambientales causados por la eliminación de metales pesados, como el Hg y el Ag.
Batería de Litio-Yodo
Ninguna de las baterías descritas anteriormente está realmente “seca”. Todos contienen pequeñas cantidades de agua líquida, lo que agrega una masa significativa y causa posibles problemas de corrosión. En consecuencia, se ha realizado un esfuerzo sustancial para desarrollar baterías libres de agua.
Una de las pocas baterías libres de agua comercialmente exitosas es la batería de litio-yodo Una batería que consiste en un ánodo de metal de litio y un cátodo que contiene un complejo sólido de I 2, con una capa de LiI sólido en el medio que permite la difusión de Iones Li +. El ánodo es de metal de litio, y el cátodo es un complejo sólido de I 2. Separándolos se encuentra una capa de LiI sólido, que actúa como electrolito al permitir la difusión de iones Li +. Las reacciones de los electrodos son las siguientes:
\( cathode:\; I_{2}\left (s \right ) + 2e^{-} \rightarrow 2I^{-}\left ( LiI \right ) \tag{19.5.11} \)
\( anode:\; 2Li\left (s \right ) \rightarrow 2Li^{+}\left ( LiI \right )+ 2e^{-} \tag{19.5.12} \)
\( overall:\; 2Li\left (s \right ) + I_{2}\left (s \right ) \rightarrow 2LiI\left (s \right ) \;\;\; E_{cell}=3.5 \; V \tag{19.5.13} \)
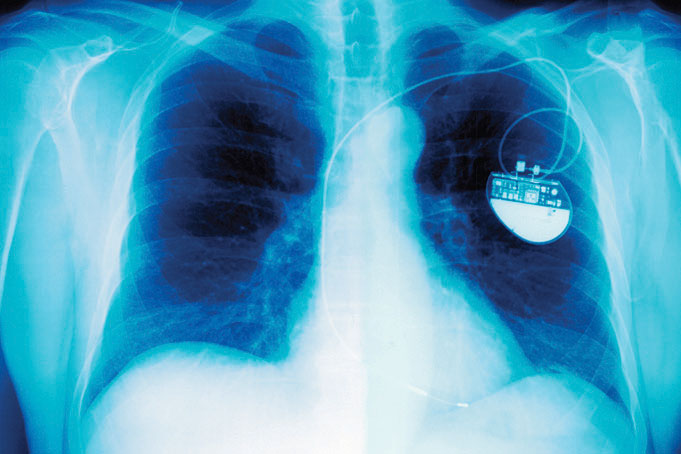
Marcapasos cardiacos. Radiografía de un paciente que muestra la ubicación y el tamaño de un marcapasos alimentado por una batería de litio-yodo.
Como se muestra en la parte (c) de la Figura 19.5.1, una batería típica de litio-yodo consiste en dos celdas separadas por una malla metálica de níquel que recoge la carga del ánodo. Debido a la alta resistencia interna causada por el electrolito sólido, solo se puede extraer una corriente baja. Sin embargo, tales baterías han demostrado ser de larga duración (hasta 10 años) y confiables. Por lo tanto, se utilizan en aplicaciones donde el reemplazo frecuente es difícil o indeseable, como en marcapasos cardíacos y otros implantes médicos y en computadoras para la protección de la memoria. Estas baterías también se utilizan en transmisores de seguridad y alarmas de humo. Otras baterías basadas en ánodos de litio y electrolitos sólidos están en desarrollo, utilizando TiS 2, por ejemplo, para el cátodo.
Figura 19.5.1 Tres tipos de baterías primarias (no recargables) (a) Una pila seca leclanché es en realidad una “celda húmeda”, en la que el electrolito es una pasta ácida a base de agua que contiene MnO 2, NH 4 Cl, ZnCl 2, grafito y almidón. Aunque es económica de fabricar, la celda no es muy eficiente en la producción de energía eléctrica y tiene una vida útil limitada. (b) En una batería de botón, el ánodo es una amalgama de cinc-mercurio, y el cátodo puede ser HgO (mostrado aquí) o Ag 2 O como oxidante. Las baterías de botón son confiables y tienen una alta relación de salida a masa, lo que les permite ser utilizadas en aplicaciones como calculadoras y relojes, donde su pequeño tamaño es crucial. c) Una batería de litio-yodo consta de dos celdas separadas por una malla metálica de níquel que recoge la carga de los ánodos. El ánodo es de metal de litio, y el cátodo es un complejo sólido de I 2. El electrolito es una capa de LiI sólido que permite que los iones Li + se difundan del cátodo al ánodo. Aunque este tipo de batería produce sólo una corriente relativamente pequeña, es altamente confiable y de larga duración.
Las celdas secas, las pilas de botón y las baterías de litio-yodo son desechables y no se pueden recargar una vez que se descargan. Las baterías recargables, por el contrario, ofrecen importantes ventajas económicas y ambientales porque pueden recargarse y descargarse en numerosas ocasiones. Como resultado, los costos de fabricación y eliminación disminuyen drásticamente durante un número determinado de horas de uso de la batería. Dos baterías recargables comunes son la batería de níquel-cadmio y la batería de plomo-ácido, que describimos a continuación.
Batería de Níquel-Cadmio (NiCad)
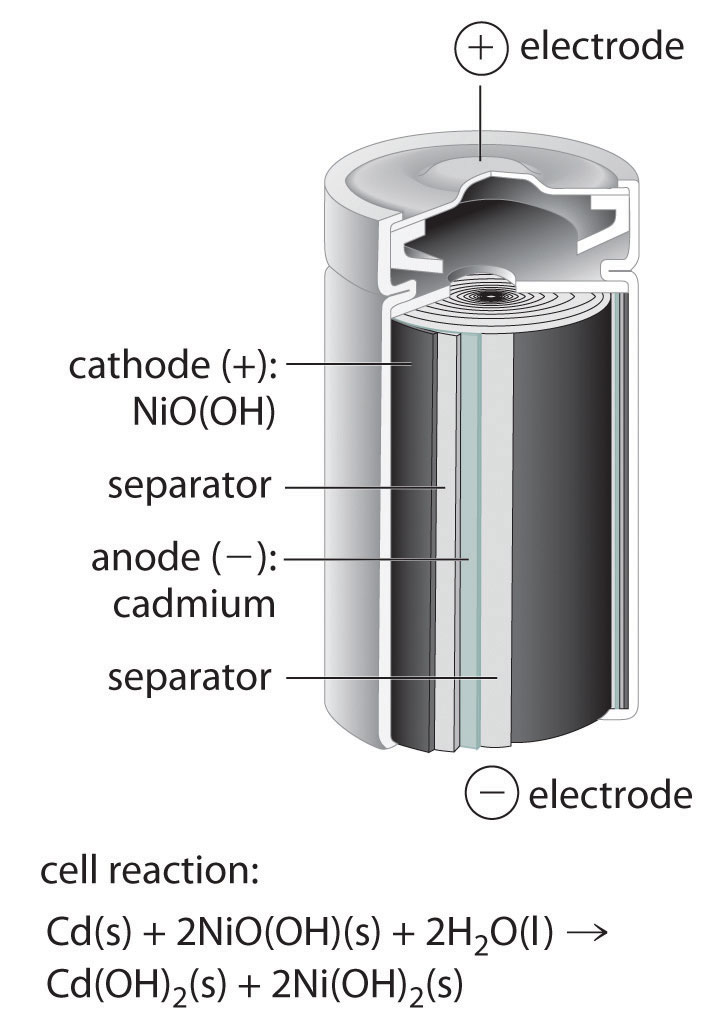
La batería de tipo níquel-cadmio A que consiste en una celda a base de agua con un ánodo de cadmio y un cátodo de níquel altamente oxidado. , o NiCad, la batería se utiliza en pequeños aparatos eléctricos y dispositivos como taladros, aspiradoras portátiles y sintonizadores digitales AM/FM. Se trata de una celda a base de agua con un ánodo de cadmio y un cátodo de níquel altamente oxidado que generalmente se describe como el oxo-hidróxido de níquel (III), NiO (OH). Como se muestra en la Figura 19.5.2, el diseño maximiza la superficie de los electrodos y minimiza la distancia entre ellos, lo que disminuye la resistencia interna y hace posible una corriente de descarga bastante alta.
Figura 19.5.2 La Batería de Níquel-Cadmio (NiCad), una Batería Recargable Las baterías de NiCad contienen un ánodo de cadmio y un cátodo de níquel altamente oxidado. Este diseño maximiza la superficie de los electrodos y minimiza la distancia entre ellos, lo que le da a la batería tanto una alta corriente de descarga como una alta capacidad.
Las reacciones de los electrodos durante la descarga de una batería NiCad son las siguientes:
\( cathode:\; 2NiO\left ( OH \right )\left (s \right ) + 2H_{2}O\left ( l \right ) + 2e^{-} \rightarrow 2Ni\left ( OH \right )_{2}\left (s \right )+ 2OH^{-}\left ( aq \right ) \tag{19.5.14} \)
\( anode:\; Cd \left (s \right )+ 2OH^{-}\left ( aq \right )\rightarrow Cd\left ( OH \right )_{2} \left ( s \right )+ 2e^{-} \tag{19.5.15} \)
\( overall:\; Cd \left (s \right ) + 2NiO\left ( OH \right )\left (s \right )+2H_{2}O\left ( l \right ) \rightarrow Cd\left ( OH \right )_{2} \left ( s \right ) + 2Ni\left ( OH \right )_{2}\left (s \right )\;\;\; E_{cell}=1.4 \; V \tag{19.5.16} \)
Debido a que los productos de las semi-reacciones de descarga son sólidos que se adhieren a los electrodos [Cd (OH) 2 y 2Ni (OH) 2], la reacción global se invierte fácilmente cuando se recarga la celda. Aunque las celdas NiCad son livianas, recargables y de alta capacidad, tienen ciertas desventajas. Por ejemplo, tienden a perder capacidad rápidamente si no se les permite que se descarguen completamente antes de recargarse, no se almacenan bien durante largos periodos cuando están completamente cargados, y presentan importantes problemas ambientales y de eliminación debido a la toxicidad del cadmio.
Una variación de la batería NiCad es la batería de níquel-hidruro metálico (NiMH) utilizada en automóviles híbridos, dispositivos de comunicación inalámbrica y computación móvil. La ecuación química general para este tipo de batería es la siguiente:
\( NiO\left ( OH \right )\left ( s \right )+MH \rightarrow Ni\left ( OH \right )_{2}\left ( s \right ) + M\left ( s \right ) \)
La batería NiMH tiene una mejora de 30% a 40% en la capacidad con respecto a la batería NiCad; es más respetuosa con el medio ambiente, por lo que el almacenamiento, el transporte y la eliminación no están sujetos a control ambiental; y no es tan sensible a la recarga de memoria. Sin embargo, está sujeta a una tasa de autodescarga 50% mayor, una vida útil limitada y mayor mantenimiento, y es más costosa que la batería NiCad.
Batería de plomo-ácido (almacenamiento de plomo)
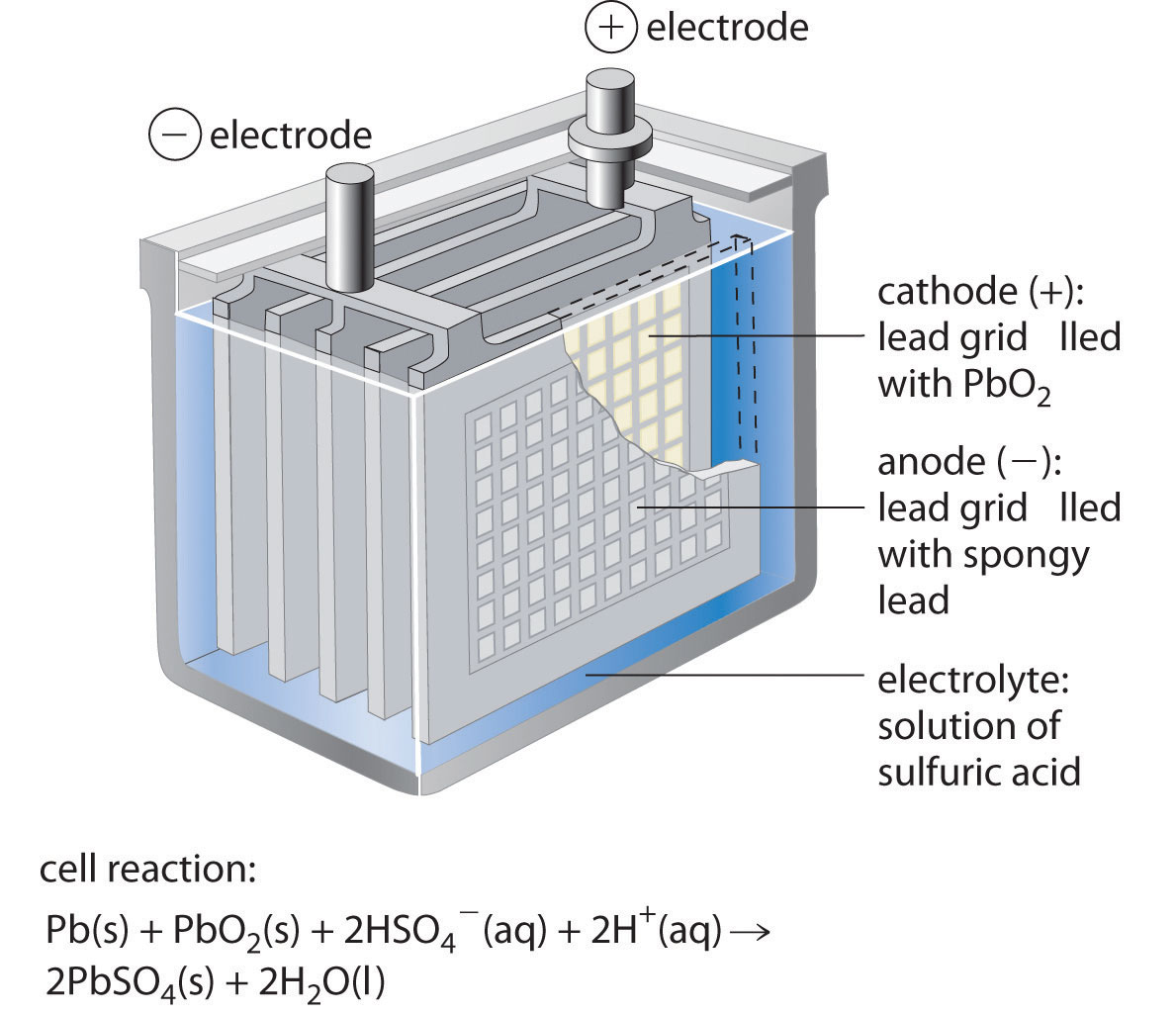
La batería de plomo-ácido Se utiliza una batería que consiste en una placa o rejilla de metal de plomo esponjoso, un cátodo que contiene PbO 2 en polvo y un electrolito que generalmente es una solución acuosa de H 2 SO 4 para proporcionar el arranque potencia en prácticamente todos los automóviles y motores marinos del mercado. Las baterías marinas y de automóvil generalmente consisten en múltiples celdas conectadas en serie. El voltaje total generado por la batería es el potencial por celda (celda E°) multiplicado por el número de celdas. Como se muestra en la Figura 19.5.3, el ánodo de cada celda en una batería de almacenamiento de plomo es una placa o rejilla de plomo metálico esponjoso, y el cátodo es una rejilla similar que contiene dióxido de plomo en polvo (PbO 2). El electrolito suele ser una solución aproximadamente 37% (en masa) de ácido sulfúrico en agua, con una densidad de 1.28 g/mL (aproximadamente 4.5 M H 2 SO 4). Debido a que las especies activas redox son sólidas, no hay necesidad de separar los electrodos. Las reacciones de los electrodos en cada celda durante la descarga son las siguientes:
\( cathode:\; 2PbO_{2}\left (s \right ) + HSO_{4}^{-}\left ( aq \right ) + 3H^{+}\left ( aq \right ) +2e^{-} \rightarrow PbSO_{4}\left (s \right )+ 2H_{2}O\left ( l \right ) \;\;\; E_{cathode}=1.685 \; V\tag{19.5.17} \)
\( anode:\; PbS \left (s \right )+ HSO_{4}^{-}\left ( aq \right ) \rightarrow PbSO_{4}\left (s \right )+ H^{+}\left ( aq \right ) + 2e^{-} \;\;\; E_{anode}=-0.356 \; V\tag{19.5.18} \)
\( overall:\; 2PbO_{2}\left (s \right ) + 2HSO_{4}^{-}\left ( aq \right ) + 2H^{+}\left ( aq \right ) \rightarrow 2bSO_{4}\left (s \right )+ 2H_{2}O\left ( l \right ) \;\;\; E_{cell}=2.041 \; V \tag{19.5.19} \)
Figura 19.5.3 Una celda de una batería de plomo-ácido Los ánodos en cada celda de una batería recargable son placas o rejillas de plomo que contienen plomo metálico esponjoso, mientras que los cátodos son rejillas similares que contienen dióxido de plomo en polvo (PbO 2). El electrolito es una solución acuosa de ácido sulfúrico. El valor de E° para una celda de este tipo es de aproximadamente 2 V. La conexión de tres celdas de este tipo en serie produce una batería de 6 V, mientras que una batería típica de automóvil de 12 V contiene seis celdas en serie. Cuando se trata adecuadamente, este tipo de batería de alta capacidad se puede descargar y recargar muchas veces.
A medida que se descarga la celda, se forma un polvo de PbSO 4 en los electrodos. Además, se consume ácido sulfúrico y se produce agua, disminuyendo la densidad del electrolito y proporcionando una manera conveniente de monitorear el estado de una batería simplemente midiendo la densidad del electrolito.

Fuente: Foto cortesía de Mitchclanky2008, http://www.flickr.com/photos/25597837@N05/2422765479/.
Cuando se aplica un voltaje externo superior a 2.04 V por celda a una batería de plomo-ácido, las reacciones de los electrodos se invierten y el PbSO 4 se convierte de nuevo en plomo metálico y PbO 2. Sin embargo, si la batería se recarga demasiado vigorosamente, puede ocurrir la electrólisis del agua, lo que resulta en la evolución de gas hidrógeno potencialmente explosivo. (Para mayor información sobre electrólisis, consulte la Sección 19.7.) Las burbujas de gas formadas de esta manera pueden desalojar algunas de las partículas de PbSO 4 o PbO 2 de las rejillas, permitiendo que caigan al fondo de la celda, donde pueden acumularse y provocar un cortocircuito interno. Por lo tanto, el proceso de recarga debe ser monitoreado cuidadosamente para optimizar la vida útil de la batería. Sin embargo, con el cuidado adecuado, una batería de plomo-ácido se puede descargar y recargar miles de veces. En los automóviles, el alternador suministra la corriente eléctrica que hace que la reacción de descarga se invierta.
Pilas de combustible
Una pila de combustible es una celda galvánica que requiere un suministro externo constante de reactivos debido a que los productos de la reacción se eliminan continuamente. A diferencia de una batería, no almacena energía química o eléctrica; una pila de combustible permite que la energía eléctrica se extraiga directamente de una reacción química. En principio, este debería ser un proceso más eficiente que, por ejemplo, quemar el combustible para accionar un motor de combustión interna que hace girar un generador, que suele ser menos de 40% eficiente, y de hecho, la eficiencia de una pila de combustible generalmente está entre 40% y 60%. Desafortunadamente, importantes problemas de costos y confiabilidad han obstaculizado la adopción a gran escala de celdas de combustible. En la práctica, su uso se ha restringido a aplicaciones en las que la masa puede ser un factor de costo significativo, como los vehículos espaciales tripulados de Estados Unidos.
Estos vehículos espaciales utilizan una pila de combustible de hidrógeno/oxígeno que requiere una entrada continua de H 2 (g) y O 2 (g), como se ilustra en la Figura 19.5.4. Las reacciones de los electrodos son las siguientes:
\( cathode:\; O_{2} \left (g \right )+ 4H^{+} +4e^{-} \rightarrow 2H_{2}O\left ( g \right ) \tag{19.5.20} \)
\( anode:\; 2H_{2} \left (g \right ) \rightarrow 4H^{+} + 4e^{-} \tag{19.5.21} \)
\( overall:\; 2H_{2} \left (g \right ) + O_{2}\left ( g \right ) \rightarrow 2H_{2}O\left ( g \right ) \tag{19.5.22} \)
Figura 19.5.4 Una pila de combustible de hidrógeno produce energía eléctrica directamente a partir de una reacción química El hidrógeno se oxida a protones en el ánodo, y los electrones se transfieren a través de un circuito externo al cátodo, donde el oxígeno se reduce y se combina con H + para formar agua. Un electrolito sólido permite que los protones se difundan del ánodo al cátodo. Aunque las pilas de combustible son un medio esencialmente libre de contaminación para obtener energía eléctrica, su costo y complejidad tecnológica han limitado hasta ahora sus aplicaciones.
La reacción global representa una conversión esencialmente libre de contaminación de hidrógeno y oxígeno en agua, que en los vehículos espaciales es luego recolectada y utilizada. Si bien este tipo de pila de combustible debe producir 1.23 V en condiciones estándar, en la práctica el dispositivo alcanza solo alrededor de 0.9 V. Una de las principales barreras para lograr una mayor eficiencia es el hecho de que la reducción de cuatro electrones de O 2 (g) en el cátodo es intrínsecamente bastante lenta, lo que limita corriente que se puede lograr. Todos los principales fabricantes de automóviles cuentan con importantes programas de investigación que involucran pilas de combustible: uno de los objetivos más importantes es el desarrollo de un mejor catalizador para la reducción de O 2.
Resumen
Una batería es una unidad contenida que produce electricidad, mientras que una celda de combustible es una celda galvánica que requiere un suministro externo constante de uno o más reactivos para generar electricidad. Un tipo de batería es la pila seca Leclanché, que contiene un electrolito en una pasta ácida a base de agua. Esta batería se denomina batería alcalina cuando está adaptada para funcionar en condiciones alcalinas. Las baterías de botón tienen una relación salida-masa alta; las baterías de litio-yodo consisten en un electrolito sólido; la batería de níquel-cadmio (NiCad) es recargable; y la batería de plomo-ácido, que también es recargable, no requiere que los electrodos estén separados compartimientos. Una pila de combustible requiere un suministro externo de reactivos ya que los productos de la reacción se eliminan continuamente. En una pila de combustible, la energía no se almacena; la energía eléctrica es proporcionada por una reacción química.
Llave para llevar
- Las baterías comerciales son celdas galvánicas que utilizan sólidos o pastas como reactivos para maximizar la salida eléctrica por unidad de masa.
Problemas conceptuales
-
¿Qué ventaja tiene usar una batería alcalina en lugar de una pila seca Leclanché?
-
¿Por qué disminuye la densidad del fluido en las baterías de plomo-ácido cuando se descarga la batería?
-
¿Qué tipo de batería utilizarías para cada aplicación y por qué?
- alimentar un scooter de motor eléctrico
- una batería de respaldo para un smartphone
- alimentación de un iPod
-
¿Por qué se utilizan las pilas galvánicas como pilas y pilas de combustible? ¿Cuál es la diferencia entre una batería y una pila de combustible? ¿Cuál es la ventaja de usar reactivos altamente concentrados o sólidos en una batería?
Contestar
-
- batería de almacenamiento de plomo
- batería de litio-yodo
- NiCad, NiMH o batería de iones de litio (recargable)
Problema Numérico
-
Esta reacción es característica de una batería de almacenamiento de plomo:
Pb (s) + PbO 2 (s) + 2H 2 SO 4 (aq) → 2PbSO 4 (s) + 2H 2 O (l)Si tienes una batería con un electrolito que tiene una densidad de 1.15 g/cm 3 y contiene 30.0% de ácido sulfúrico en masa, ¿el potencial es mayor o menor que el de la celda estándar?
Contestar
-
[H 2 SO 4] = 3.52 M; E > E°
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern