20.3: La Química del Hidrógeno
- Page ID
- 78332
- Describir las propiedades físicas y químicas del hidrógeno y predecir su reactividad.
Pasamos ahora de una visión general de las tendencias periódicas a una discusión de los elementos del bloque s, primero centrándonos en el hidrógeno, cuya química es suficientemente distinta e importante para ser discutida en una categoría propia. La mayoría de las versiones de la tabla periódica colocan hidrógeno en la esquina superior izquierda inmediatamente por encima del litio, lo que implica que el hidrógeno, con una configuración de 1s 1 electrón, es miembro del grupo 1. De hecho, la química del hidrógeno no se parece mucho a la de los metales del Grupo 1. En efecto, algunas versiones de la tabla periódica sitúan al hidrógeno por encima del flúor en el Grupo 17 porque la adición de un solo electrón a un átomo de hidrógeno completa su capa de valencia.
Aunque el hidrógeno tiene una configuración de ns 1 electrón, su química no se parece a la de los metales del Grupo 1.
Isótopos de hidrógeno
El hidrógeno, el elemento más abundante del universo, es la fuente última de todos los demás elementos por el proceso de fusión nuclear. El cuadro\(\PageIndex{1}\) “Los isótopos del hidrógeno” compara los tres isótopos de hidrógeno, todos los cuales contienen un protón y un electrón por átomo. El isótopo más común es el protio (1 H o H), seguido del deuterio (2 H o D), el cual tiene un neutrón adicional. El isótopo más raro del hidrógeno es el tritio (3 H o T), que se produce en la atmósfera superior por una reacción nuclear cuando los rayos cósmicos golpean el nitrógeno y otros átomos; luego es lavado en los océanos por la lluvia. El tritio es radiactivo, descomponiéndose a 3 He con una vida media de sólo 12.32 años. En consecuencia, la atmósfera y los océanos contienen sólo un nivel muy bajo de tritio en estado estacionario. El término hidrógeno y el símbolo H normalmente se refieren a la mezcla natural de los tres isótopos.
| Protium | Deuterio | Tritio | |
|---|---|---|---|
| símbolo | \(\mathrm{_1^1H}\) | \(\mathrm{_1^2H}\) | \(\mathrm{_1^3H}\) |
| neutrones | 0 | 1 | 2 |
| masa (amu) | 1.00783 | 2.0140 | 3.01605 |
| abundancia (%) | 99.9885 | 0.0115 | ~10 −17 |
| vida media (años) | — | — | 12.32 |
| punto de ebullición de X 2 (K) | 20.28 | 23.67 | 25 |
| punto de fusión/punto de ebullición de X 2 O (°C) | 0.0/100.0 | 3.8/101.4 | 4.5/? |
Las diferentes masas de los tres isótopos de hidrógeno hacen que tengan diferentes propiedades físicas. Así, H 2, D 2 y T 2 difieren en sus puntos de fusión, puntos de ebullición, densidades y calores de fusión y vaporización. En 1931, Harold Urey y sus compañeros de trabajo descubrieron deuterio evaporando lentamente varios litros de hidrógeno líquido hasta que quedó un volumen de aproximadamente 1 mL. Cuando se vaporizó ese líquido restante y se examinó su espectro de emisión, observaron nuevas líneas de absorción además de las previamente identificadas como originarias del hidrógeno. La abundancia natural de tritio, en contraste, es tan baja que no pudo ser detectada por experimentos similares; se preparó por primera vez en 1934 por una reacción nuclear.
Urey ganó el Premio Nobel de Química en 1934 por su descubrimiento del deuterio (2H). Urey nació y se educó en la zona rural de Indiana. Después de obtener una licenciatura en zoología por la Universidad de Montana en 1917, Urey cambió de rumbo profesional. Obtuvo su doctorado en química en Berkeley con G. N. Lewis y posteriormente trabajó con Niels Bohr en Copenhague. Durante la Segunda Guerra Mundial, Urey fue el director de investigación de guerra para el Proyecto Bomba Atómica en la Universidad de Columbia. En años posteriores, su investigación se centró en la evolución de la vida. En 1953, él y su estudiante de posgrado, Stanley Miller, demostraron que los compuestos orgánicos, incluidos los aminoácidos, podrían formarse pasando una descarga eléctrica a través de una mezcla de compuestos que se cree que están presentes en la atmósfera de la Tierra primitiva.
Debido a que el punto de ebullición normal de D 2 O es 101.4°C (comparado con 100.0°C para H 2 O), la evaporación o destilación fraccionada se puede utilizar para aumentar la concentración de deuterio en una muestra de agua mediante la eliminación selectiva de los más volátiles H 2 O. Así, cuerpos de agua que no tienen salida, como el Gran Lago Salado y el Mar Muerto, que mantienen su nivel únicamente por evaporación, tienen concentraciones significativamente mayores de agua deuterada que las del lago o agua de mar con al menos una salida. Una forma más eficiente de obtener agua altamente enriquecida en deuterio es mediante la electrólisis prolongada de una solución acuosa. Debido a que un deuterón (D +) tiene el doble de masa de un protón (H +), se difunde más lentamente hacia la superficie del electrodo. En consecuencia, el gas desprendido en el cátodo se enriquece en H, la especie que se difunde más rápidamente, favoreciendo la formación de H 2 sobre D 2 o HD. En tanto, la solución se enriquece en deuterio. El agua rica en deuterio se llama agua pesada porque la densidad de D 2 O (1.1044 g/cm 3 a 25°C) es mayor que la de H 2 O (0.99978 g/cm 3). El agua pesada fue un componente importante de los primeros reactores nucleares.
Debido a que los deuterones se difunden mucho más lentamente, D 2 O no soportará la vida y en realidad es tóxico si se administra a mamíferos en grandes cantidades. El paso limitante de la velocidad en muchas reacciones importantes catalizadas por enzimas implica la transferencia de protones. La transferencia de D + es tan lenta comparada con la de H + porque los enlaces a D se rompen más lentamente que los de H, por lo que se interrumpe el delicado equilibrio de reacciones en la célula. Sin embargo, el deuterio y el tritio son importantes herramientas de investigación para los bioquímicos. Al incorporar estos isótopos en posiciones específicas en moléculas seleccionadas, donde actúan como marcadores, o trazadores, los bioquímicos pueden seguir el camino de una molécula a través de un organismo o una célula. Los trazadores también se pueden utilizar para proporcionar información sobre el mecanismo de las reacciones enzimáticas.
Enlace en hidrógeno y compuestos que contienen hidrógeno
La configuración del electrón 1s 1 del hidrógeno indica un solo electrón de valencia. Debido a que el orbital 1s tiene una capacidad máxima de dos electrones, el hidrógeno puede formar compuestos con otros elementos de tres maneras (Figura\(\PageIndex{1}\)):
- Perdiendo su electrón para formar un protón (H +) con un orbital 1s vacío. El protón es un ácido de Lewis que puede aceptar un par de electrones de otro átomo para formar un enlace de par de electrones. En las reacciones ácido-base, el protón siempre se une a un par solitario de electrones en un átomo en otra molécula para formar un enlace covalente polar. Si el par solitario de electrones pertenece a un átomo de oxígeno de una molécula de agua, el resultado es el ion hidronio (H 3 O +).
- Aceptando un electrón para formar un ion hidruro (H −), que tiene un orbital 1s 2 lleno. El hidrógeno reacciona con metales relativamente electropositivos, como los metales alcalinos (grupo 1) y los metales alcalinotérreos (grupo 2), para formar hidruros iónicos, que contienen cationes metálicos e iones H −.
- Compartiendo su electrón con un electrón en otro átomo para formar un enlace de par de electrones. Con un orbital 1s 1 medio lleno, el átomo de hidrógeno puede interactuar con orbitales ocupados por separado en otros átomos para formar un enlace de par de electrones covalente o polar covalente, dependiendo de la electronegatividad del otro átomo.
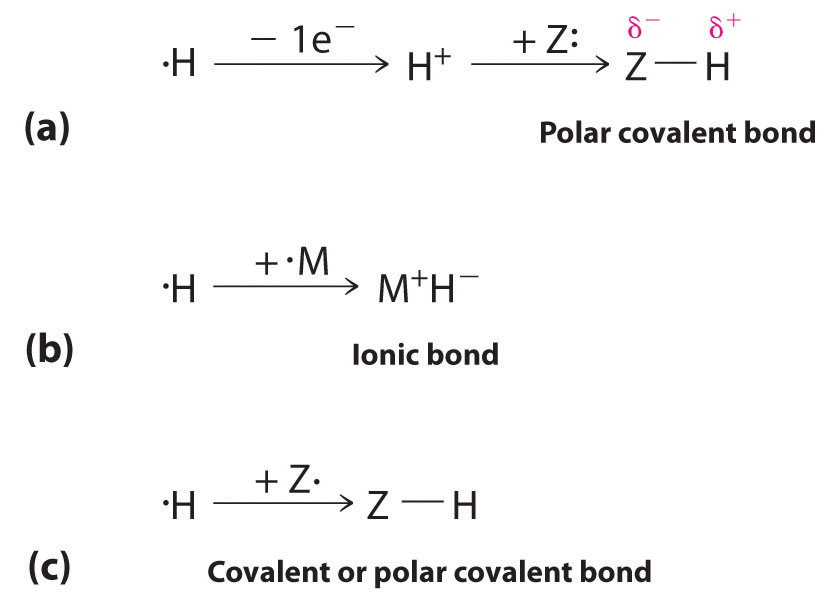
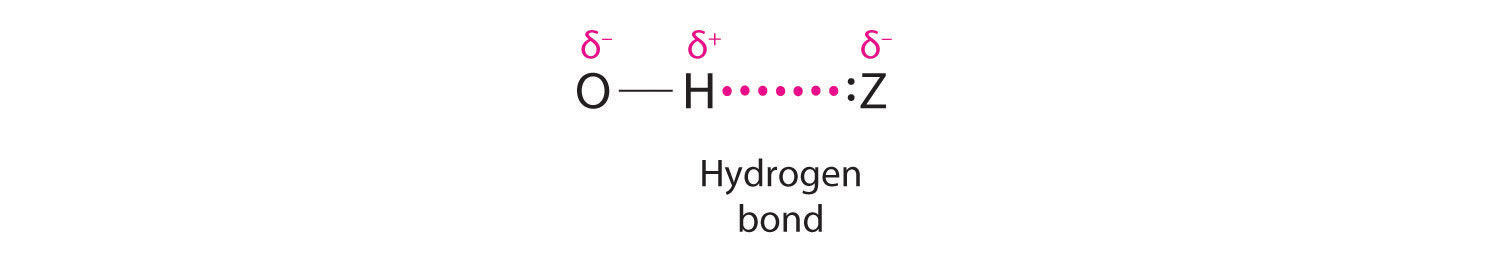
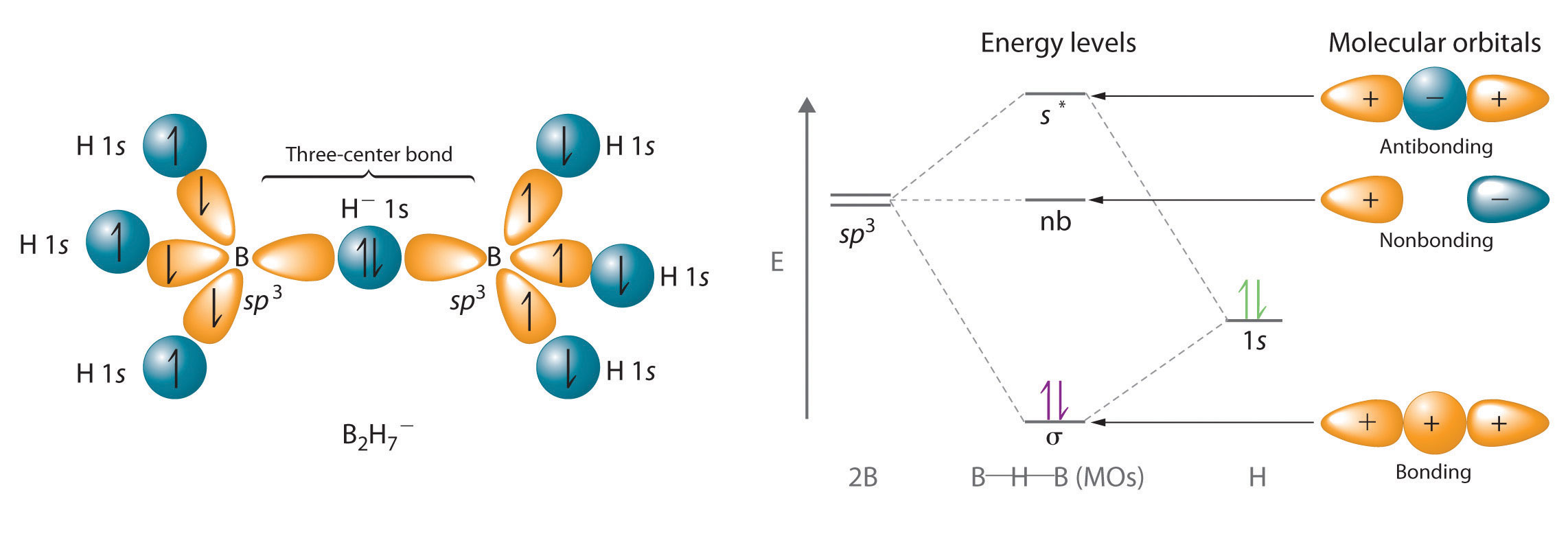
El hidrógeno también puede actuar como puente entre dos átomos. Un ejemplo familiar es el enlace de hidrógeno, una interacción electrostática entre un hidrógeno unido a un átomo electronegativo y un átomo que tiene uno o más pares solitarios de electrones (Figura\(\PageIndex{2}\)). Un ejemplo de este tipo de interacción es la red de enlaces de hidrógeno que se encuentra en el agua (Figura\(\PageIndex{2}\)). El hidrógeno también puede formar un enlace de tres centros (o enlace deficiente en electrones), en el que un hidruro une dos átomos electropositivos. Los compuestos que contienen hidrógeno unido al boro y elementos similares suelen tener este tipo de enlaces. Las unidades B-H—B que se encuentran en los hidruros de boro no pueden describirse en términos de enlaces de pares de electrones localizados.
Debido a que el átomo de H en el medio de dicha unidad puede acomodar un máximo de solo dos electrones en su orbital 1s, la unidad B-H—B puede describirse como que contiene un hidruro que interactúa simultáneamente con orbitales sp 3 vacíos en dos átomos de boro (Figura\(\PageIndex{3}\)). En estos enlaces, solo se utilizan dos electrones de enlace para mantener juntos tres átomos, convirtiéndolos en enlaces deficientes en electrones. Se encontró con un fenómeno similar en la discusión del enlace π en el ozono y el ion nitrito. Recordemos que en ambos casos, se utilizó la presencia de dos electrones en un orbital molecular π que se extiende sobre tres átomos para explicar el hecho de que las dos distancias de enlace O—O en ozono y las dos distancias de enlace N-O en nitrito son las mismas, lo que de otro modo sólo puede explicarse por el uso de estructuras de resonancia.
El hidrógeno puede perder su electrón para formar H +, aceptar un electrón para formar H −, compartir su electrón, enlace de hidrógeno o formar un enlace de tres centros.
Síntesis, reacciones y compuestos de hidrógeno
La primera preparación conocida de hidrógeno elemental fue en 1671, cuando Robert Boyle disolvió hierro en ácido diluido y obtuvo un producto incoloro, inodoro, gaseoso. El hidrógeno finalmente fue identificado como elemento en 1766, cuando Henry Cavendish demostró que el agua era el único producto de la reacción del gas con el oxígeno. Las propiedades explosivas de las mezclas de hidrógeno con aire no fueron descubiertas hasta principios del siglo XVIII; provocaron parcialmente la espectacular explosión del dirigible lleno de hidrógeno Hindenburg en 1937 (Figura\(\PageIndex{4}\)). Debido a su masa molecular extremadamente baja, el gas hidrógeno es difícil de condensar a líquido (punto de ebullición = 20.3 K), y el hidrógeno sólido tiene uno de los puntos de fusión más bajos conocidos (13.8 K).

La forma más común de producir pequeñas cantidades de gas hidrógeno altamente puro en el laboratorio fue descubierta por Boyle: hacer reaccionar un metal activo (M), como hierro, magnesio o zinc, con ácido diluido:
\[M_{(s)} + 2H^+_{(aq)} \rightarrow H_{2(g)} + M^{2+}_{(aq)} \label{21.1}\]
El gas hidrógeno también se puede generar haciendo reaccionar metales como el aluminio o el zinc con una base fuerte:
\[\mathrm{Al(s)}+\mathrm{OH^-(aq)}+\mathrm{3H_2O(l)}\rightarrow\frac{3}{2}\mathrm{H_2(g)}+\mathrm{[Al(OH)_4]^-(aq)} \label{21.2}\]
Los limpiadores de drenaje comerciales sólidos como Drano utilizan esta reacción para generar burbujas de gas que ayudan a romper las obstrucciones en un tubo de drenaje. El gas hidrógeno también se produce haciendo reaccionar hidruros iónicos con agua. Debido a que los hidruros iónicos son caros, sin embargo, esta reacción se usa generalmente solo para fines especializados, como producir gas HD haciendo reaccionar un hidruro con D 2 O:
\[MH_{(s)} + D_2O(l) \rightarrow HD_{(g)} + M^+(aq) + OD^−_{(aq)} \label{21.3}\]
A escala industrial, H 2 se produce a partir de metano por medio de reformado catalítico con vapor, método utilizado para convertir hidrocarburos en una mezcla de CO y H 2 conocida como gas de síntesis, o gas de síntesis. El proceso se lleva a cabo a temperaturas elevadas (800°C) en presencia de un catalizador de níquel:
\[\mathrm{CH_4(g)}+\mathrm{H_2O(g)}\xrightarrow{\mathrm{Ni}}\mathrm{CO(g)}+\mathrm{3H_2(g)} \label{21.4}\]
La mayoría de los elementos de la tabla periódica forman compuestos binarios con hidrógeno, los cuales se denominan colectivamente hidruros. Los hidruros binarios a su vez se pueden clasificar en una de tres formas, cada una con sus propias propiedades características. Los hidruros covalentes contienen hidrógeno unido a otro átomo a través de un enlace covalente o un enlace covalente polar. Los hidruros covalentes suelen ser sustancias moleculares que son relativamente volátiles y tienen bajos puntos de fusión. Los hidruros iónicos contienen el ion hidruro como anión con cationes derivados de metales electropositivos. Como la mayoría de los compuestos iónicos, son típicamente sólidos no volátiles que contienen celosías tridimensionales de cationes y aniones. A diferencia de la mayoría de los compuestos iónicos, sin embargo, a menudo se descomponen a H 2 (g) y al metal padre después del calentamiento. Los hidruros metálicos están formados por hidrógeno y metales menos electropositivos como los metales de transición. Las propiedades de los hidruros metálicos suelen ser similares a las del metal padre. En consecuencia, los hidruros metálicos son mejor vistos como metales que contienen muchos átomos de hidrógeno presentes como impurezas intersticiales.
Los hidruros covalentes son relativamente volátiles y tienen bajos puntos de fusión; los hidruros iónicos son generalmente sólidos no volátiles en una estructura reticular.
Resumen y llave para llevar
El hidrógeno puede perder un electrón para formar un protón, ganar un electrón para formar un ion hidruro, o formar un enlace covalente o un enlace polar covalente de par de electrones. Los tres isótopos de hidrógeno, protio (1 H o H), deuterio (2 H o D) y tritio (3 H o T), tienen diferentes propiedades físicas. El deuterio y el tritio pueden ser utilizados como trazadores, sustancias que permiten a los bioquímicos seguir el camino de una molécula a través de un organismo o una célula. El hidrógeno puede formar compuestos que contienen un protón (H +), un ion hidruro (H −), un enlace de par de electrones a H, un enlace de hidrógeno o un enlace de tres centros (o enlace deficiente en electrones), en el que dos electrones se comparten entre tres átomos. El gas hidrógeno se puede generar haciendo reaccionar un metal activo con ácido diluido, haciendo reaccionar Al o Zn con una base fuerte, o industrialmente mediante reformado catalítico con vapor, que produce gas de síntesis, o gas de síntesis.


