20.4: Los metales alcalinos (Grupo 1)
- Page ID
- 78324
- Describir cómo se aíslan los metales alcalinos.
- Estar familiarizado con las reacciones, compuestos y complejos de los metales alcalinos.
Los metales alcalinos son tan reactivos que nunca se encuentran en la naturaleza en forma elemental. Aunque algunos de sus minerales son abundantes, aislarlos de sus minerales es algo difícil. Por estas razones, los elementos del grupo 1 fueron desconocidos hasta principios del siglo XIX, cuando Sir Humphry Davy preparó por primera vez sodio (Na) y potasio (K) pasando una corriente eléctrica a través de álcalis fundidos. (Las cenizas producidas por la combustión de la madera están compuestas en gran parte por carbonato de potasio y sodio). El litio (Li) fue descubierto 10 años después cuando el químico sueco Johan Arfwedson estaba estudiando la composición de un nuevo mineral brasileño. El cesio (Cs) y el rubidio (Rb) no se descubrieron hasta la década de 1860, cuando Robert Bunsen realizó una búsqueda sistemática de nuevos elementos. Conocido por los estudiantes de química como el inventor del quemador Bunsen, los estudios espectroscópicos de Bunsen sobre minerales mostraron líneas de emisión azul cielo y rojo profundo que atribuyó a dos nuevos elementos, Cs y Rb, respectivamente. Francium (Fr) se encuentra en solo trazas en la naturaleza, por lo que nuestro conocimiento de su química es limitado. Todos los isótopos de Fr tienen semividas muy cortas, en contraste con los otros elementos del grupo 1.
Davy nació en Penzance, Cornualles, Inglaterra. Era un hombre un poco salvaje en el laboratorio, a menudo oliendo y probando los productos de sus experimentos, lo que casi con certeza acortó su vida. Descubrió los efectos fisiológicos que hacen que el óxido nitroso se llame “gas de la risa” (¡y se volvió adicto a él!) , y casi pierde la vista en una explosión de tricloruro de nitrógeno (NCl 3), que fue el primero en preparar. Davy fue uno de los primeros en reconocer la utilidad de los “pilotes eléctricos” (baterías) de Alessandro Volta. Al conectar varias “pilas” en serie e insertar electrodos en sales fundidas de los metales alcalinos y metales alcalinotérreos, pudo aislar seis elementos previamente desconocidos como metales puros: sodio, potasio, calcio, estroncio, bario y magnesio. También descubrió boro y fue el primero en preparar fosfina (PH 3) y telururo de hidrógeno (H 2 Te), ambos altamente tóxicos.
Bunsen nació y se educó en Gotinga, Alemania. Sus primeros trabajos trataron de compuestos orgánicos de arsénico, cuya naturaleza altamente tóxica y tendencias explosivas casi lo matan y sí le costó un ojo. Diseñó el quemador Bunsen, un quemador de gas confiable, y lo utilizó y los espectros de emisión para descubrir el cesio (llamado así por su línea azul) y el rubidio (llamado así por su línea roja).
Preparación de los Metales Alcalis
Debido a que los metales alcalinos se encuentran entre los reductores más potentes conocidos, obtenerlos en forma pura requiere un aporte considerable de energía. El litio puro y el sodio, por ejemplo, se preparan típicamente mediante la reducción electrolítica de cloruros fundidos:
\[\mathrm{LiCl(l)}\rightarrow\mathrm{Li(l)}+\frac{1}{2}\mathrm{Cl_2(g)} \label{21.15}\]
En la práctica, el CaCl 2 se mezcla con LiCl para disminuir el punto de fusión de la sal de litio. La electrólisis se lleva a cabo en una atmósfera de argón en lugar de la atmósfera de nitrógeno típicamente utilizada para sustancias que son altamente reactivas con O 2 y agua porque Li reacciona con gas nitrógeno para formar nitruro de litio (Li 3 N). El sodio metálico se produce por la electrólisis de una mezcla fundida de NaCl y CaCl 2. En contraste, el potasio se produce comercialmente a partir de la reducción de KCl por Na, seguido de la destilación fraccionada de K (g). Aunque el rubidio y el cesio también se pueden producir por electrólisis, generalmente se obtienen haciendo reaccionar sus sales de hidróxido con un reductor como Mg:
\[2RbOH_{(s)} + Mg_{(s)} \rightarrow 2Rb_{(l)} + Mg(OH)_{2(s)} \label{21.6}\]
Los depósitos masivos de NaCl y KCl esencialmente puros se encuentran en la naturaleza y son las principales fuentes de sodio y potasio. Los otros metales alcalinos se encuentran en bajas concentraciones en una amplia variedad de minerales, pero los minerales que contienen altas concentraciones de estos elementos son relativamente raros. No se conocen fuentes concentradas de rubidio, por ejemplo, a pesar de que es el decimosexto elemento más abundante de la Tierra. El rubidio se obtiene comercialmente aislando el 2% — 4% de Rb presente como impureza en micas, minerales que están compuestos por láminas de silicatos complejos de potasio-aluminio hidratados.
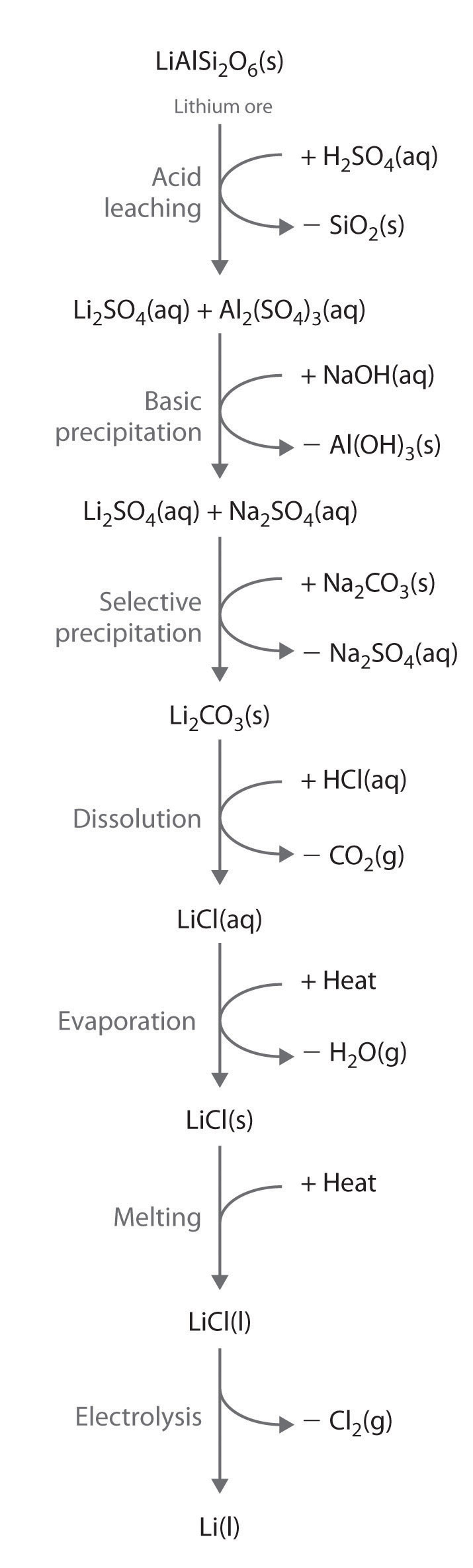
Los metales alcalinos se recuperan de minerales de silicato en un proceso multietapa que aprovecha la solubilidad dependiente del pH de sales seleccionadas de cada ion metálico. Las etapas en este proceso son la lixiviación, que utiliza ácido sulfúrico para disolver el ion de metal alcalino deseado y Al 3 + del mineral; precipitación básica para eliminar Al 3 + de la mezcla como Al (OH) 3; precipitación selectiva del álcali insoluble carbonato metálico; disolución de la sal nuevamente en ácido clorhídrico; y aislamiento del metal por evaporación y electrólisis. La Figura\(\PageIndex{1}\) ilustra el aislamiento de litio líquido de un mineral de silicato de litio mediante este proceso.
Propiedades generales de los metales alcalinos
Diversas propiedades de los elementos del grupo 1 se resumen en la Tabla\(\PageIndex{1}\). De acuerdo con las tendencias periódicas generales, los radios atómicos e iónicos aumentan suavemente de Li a Cs, y las primeras energías de ionización disminuyen a medida que los átomos se hacen más grandes. Como resultado de sus bajas energías de primera ionización, los metales alcalinos tienen una tendencia abrumadora a formar compuestos iónicos donde tienen una carga +1. Todos los metales alcalinos tienen afinidades electrónicas relativamente altas porque la adición de un electrón produce un anión (M−) con una configuración de electrones ns 2. Las densidades de los elementos generalmente aumentan de Li a Cs, reflejando otra tendencia común: debido a que las masas atómicas de los elementos aumentan más rápidamente que los volúmenes atómicos a medida que baja un grupo, los elementos más densos están cerca de la parte inferior de la tabla periódica. Una tendencia inusual en los elementos del grupo 1 es la suave disminución de los puntos de fusión y ebullición de Li a Cs. Como resultado, Cs (punto de fusión = 28.5°C) es uno de sólo tres metales (los otros son Ga y Hg) que son líquidos a temperatura corporal (37°C).
| Litio | Sodio | Potasio | Rubidio | Cesio | Francium | |
|---|---|---|---|---|---|---|
| *Los valores citados son para iones de cuatro coordenadas excepto para Rb + y Cs +, cuyos valores se dan para el ion de seis coordenadas. | ||||||
| símbolo atómico | Li | Na | K | Rb | Cs | Fr |
| número atómico | 3 | 11 | 19 | 37 | 55 | 87 |
| masa atómica | 6.94 | 22.99 | 39.10 | 85.47 | 132.91 | 223 |
| configuración de electrones de valencia | 2s 1 | 3s 1 | 4s 1 | 5s 1 | 6s 1 | 7s 1 |
| punto de fusión/punto de ebullición (°C) | 180.5/1342 | 97.8/883 | 63.5/759 | 39.3/688 | 28.5/671 | 27/— |
| densidad (g/cm 3) a 25°C | 0.534 | 0.97 | 0.89 | 1.53 | 1.93 | — |
| radio atómico (pm) | 167 | 190 | 243 | 265 | 298 | — |
| primera energía de ionización (kJ/mol) | 520 | 496 | 419 | 403 | 376 | 393 |
| estado de oxidación más común | +1 | +1 | +1 | +1 | +1 | +1 |
| radio iónico (pm) * | 76 | 102 | 138 | 152 | 167 | — |
| afinidad electrónica (kJ/mol) | −60 | −53 | −48 | −47 | −46 | — |
| electronegatividad | 1.0 | 0.9 | 0.8 | 0.8 | 0.8 | 0.7 |
| potencial de electrodo estándar (E°, V) | −3.04 | −2.71 | −2.93 | −2.98 | −3.03 | — |
| producto de reacción con O 2 | Li 2 O | Na 2 O 2 | KO 2 | RbO 2 | CSO 2 | — |
| tipo de óxido | básico | básico | básico | básico | básico | — |
| producto de reacción con N 2 | Li 3 N | ninguno | ninguno | ninguno | ninguno | — |
| producto de reacción con X 2 | LiX | NaX | KX | RBx | CSx | — |
| producto de reacción con H 2 | LiH | Nah | KH | RbH | CSh | — |
Los potenciales de reducción estándar (E°) de los metales alcalinos no siguen la tendencia basada en las energías de ionización. Inesperadamente, el litio es el reductor más fuerte, y el sodio es el más débil (Tabla\(\PageIndex{1}\)). Debido a que Li + es mucho más pequeño que los otros cationes de metales alcalinos, su energía de hidratación es la más alta. La alta energía de hidratación de Li + compensa con creces su mayor energía de ionización, lo que convierte al litio metálico en el reductor más fuerte en solución acuosa. Esta aparente anomalía es un ejemplo de cómo los comportamientos físicos o químicos de los elementos en un grupo a menudo están determinados por la sutil interacción de tendencias periódicas opuestas.
Reacciones y compuestos de los metales alcalinos
Todos los metales alcalinos son elementos electropositivos con una configuración de electrones de valencia ns 1, formando la monocación (M +) al perder el electrón de valencia simple. Debido a que eliminar un segundo electrón requeriría irrumpir en la capa cerrada (n − 1), que es energéticamente prohibitiva, la química de los metales alcalinos es en gran parte la de los compuestos iónicos que contienen iones M +. Sin embargo, como discutimos más adelante, los elementos más ligeros del grupo 1 también forman una serie de compuestos organometálicos que contienen enlaces M-C covalentes polares.
Todos los metales alcalinos reaccionan vigorosamente con los halógenos (grupo 17) para formar los haluros iónicos correspondientes, donde\(X\) es un halógeno:
\[2M_{(s)} + X_{2(s, l, g)} \rightarrow 2M^+X^−_{(s)} \label{21.7}\]
De manera similar, los metales alcalinos reaccionan con los calcógenos más pesados (azufre, selenio y teluro en el grupo 16) para producir calcogenuros metálicos, donde Y es S, Se o Te:
\[2M_{(s)} + Y_{(s)} \rightarrow M_2Y_{(s)} \label{21.8}\]
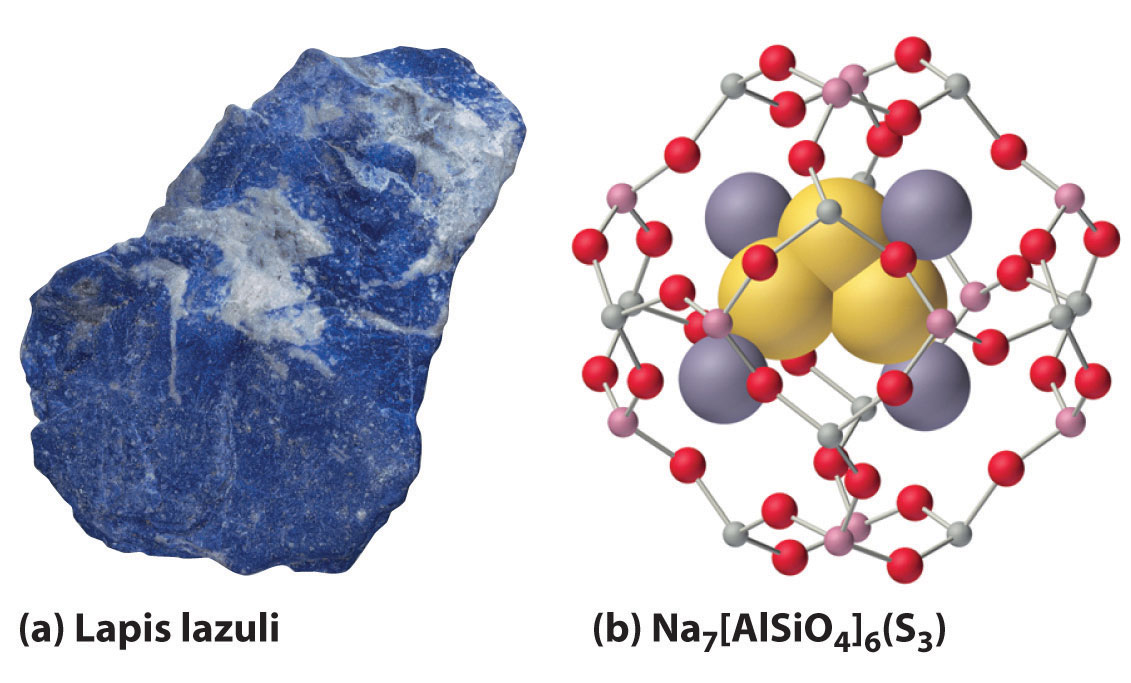
Sin embargo, cuando se usa calcógeno en exceso, se pueden obtener una variedad de productos que contienen cadenas de átomos de calcógeno, como los polisulfuros de sodio (Na 2 S n, donde n = 2—6). Por ejemplo, Na 2 S 3 contiene el ion S 3 2−, que tiene forma de V con un ángulo S-S-S de aproximadamente 103°. El producto de oxidación de un electrón del ion trisulfuro (S 3 −) es responsable del intenso color azul de las piedras preciosas lapislázuli y azul ultramarino (Figura\(\PageIndex{2}\)).
Reaccionar los metales alcalinos con oxígeno, el elemento más ligero del grupo 16, es más complejo, y la estequiometría del producto depende tanto de la relación metal:oxígeno como del tamaño del átomo de metal. Por ejemplo, cuando los metales alcalinos se queman en el aire, los productos observados son Li 2 O (blanco), Na 2 O 2 (amarillo pálido), KO 2 (naranja), RbO 2 (marrón) y CsO 2 (naranja). Solo Li 2 O tiene la estequiometría esperada para una sustancia que contiene dos cationes M + y un ion O 2−. En contraste, Na 2 O 2 contiene el anión O 2 2− (peróxido) más dos cationes Na +. Las otras tres sales, con estequiometría MO 2, contienen el catión M + y el ion O 2 − (superóxido). Debido a que O 2− es el más pequeño de los tres aniones de oxígeno, forma una red iónica estable con el catión de metal alcalino más pequeño (Li +). En contraste, los metales alcalinos más grandes —potasio, rubidio y cesio— reaccionan con el oxígeno en el aire para dar los superóxidos metálicos. Debido a que el catión Na + es de tamaño intermedio, el sodio reacciona con el oxígeno para formar un compuesto con una estequiometría intermedia: el peróxido de sodio. En condiciones específicas de reacción, sin embargo, es posible preparar las sales de óxido, peróxido y superóxido de los cinco metales alcalinos, excepto el superóxido de litio (LiO 2).

La química de los metales alcalinos es en gran parte la de los compuestos iónicos que contienen los iones M +.
Los peróxidos y superóxidos de metales alcalinos son potentes oxidantes que reaccionan, a menudo vigorosamente, con una amplia variedad de agentes reductores, como el carbón vegetal o el aluminio metálico. Por ejemplo, Na 2 O 2 se utiliza industrialmente para blanquear papel, pulpa de madera y telas como lino y algodón. En los submarinos, Na 2 O 2 y KO 2 se utilizan para purificar y regenerar el aire eliminando el CO 2 producido por la respiración y reemplazándolo por O 2. Ambos compuestos reaccionan con CO 2 en una reacción redox en la que O 2 - o O 2 − se oxida y reduce simultáneamente, produciendo el carbonato metálico y O 2:
\[2Na_2O_{2(s)} + 2CO_{2(g)} \rightarrow 2Na_2CO_{3(s)} + O_{2(g)} \label{21.9}\]
\[4KO_{2(s)} + 2CO_{2(g)} \rightarrow 2K_2CO_{3(s)} + 3O_{2(g)} \label{21.10}\]
La presencia de vapor de agua, el otro producto de la respiración, hace que KO 2 sea aún más efectivo para eliminar CO 2 porque se forma bicarbonato de potasio, en lugar de carbonato de potasio:
\[4KO_{2(s)} + 4CO_{2(g)} + 2H_2O_{(g)} \rightarrow 4KHCO_{3(s)} + 3O_{2(g)} \label{21.11}\]
Observe que en esta reacción se eliminan 4 moles de CO 2, en lugar de 2 moles en la Ecuación 21.10.
El litio, el metal alcalino más ligero, es el único que reacciona con el nitrógeno atmosférico, formando nitruro de litio (Li 3 N). Las energías de celosía explican nuevamente por qué los metales alcalinos más grandes como el potasio no forman nitruros: empaquetar tres cationes K + grandes alrededor de un solo anión relativamente pequeño es energéticamente desfavorable. En contraste, todos los metales alcalinos reaccionan con el grupo mayor de 15 elementos fósforo y arsénico para formar fosfuros y arseniuros metálicos (donde Z es P o As):
\[12M_{(s)} + Z_{4(s)} \rightarrow 4M_3Z_{(s)} \label{21.12}\]
Debido a las energías de la red, solo el litio forma un óxido y nitruro estables.
Los metales alcalinos reaccionan con todos los elementos del grupo 14, pero las composiciones y propiedades de los productos varían significativamente. Por ejemplo, la reacción con los elementos más pesados del grupo 14 da materiales que contienen aniones poliatómicos y estructuras de jaula tridimensionales, como K 4 Si 4 cuya estructura se muestra aquí. Por el contrario, el litio y el sodio se oxidan por carbono para producir un compuesto con la estequiometría M 2 C 2 (donde M es Li o Na):
\[ 2M_{(s)} + 2C_{(s)} \rightarrow M_2C_{2(s)} \label{21.13}\]
Los mismos compuestos se pueden obtener haciendo reaccionar el metal con acetileno (C 2 H 2). En esta reacción, el metal se oxida nuevamente y se reduce el hidrógeno:
\[ 2M_{(s)} + C_2H_{2(g)} \rightarrow M_2C_{2(s)} + H_{2(g)} \label{21.14}\]
El ion acetiluro (C 2 2−), derivado formalmente del acetileno por la pérdida de ambos hidrógenos como protones, es una base muy fuerte. La reacción de las sales de acetiluro con agua produce acetileno y MOH (ac).
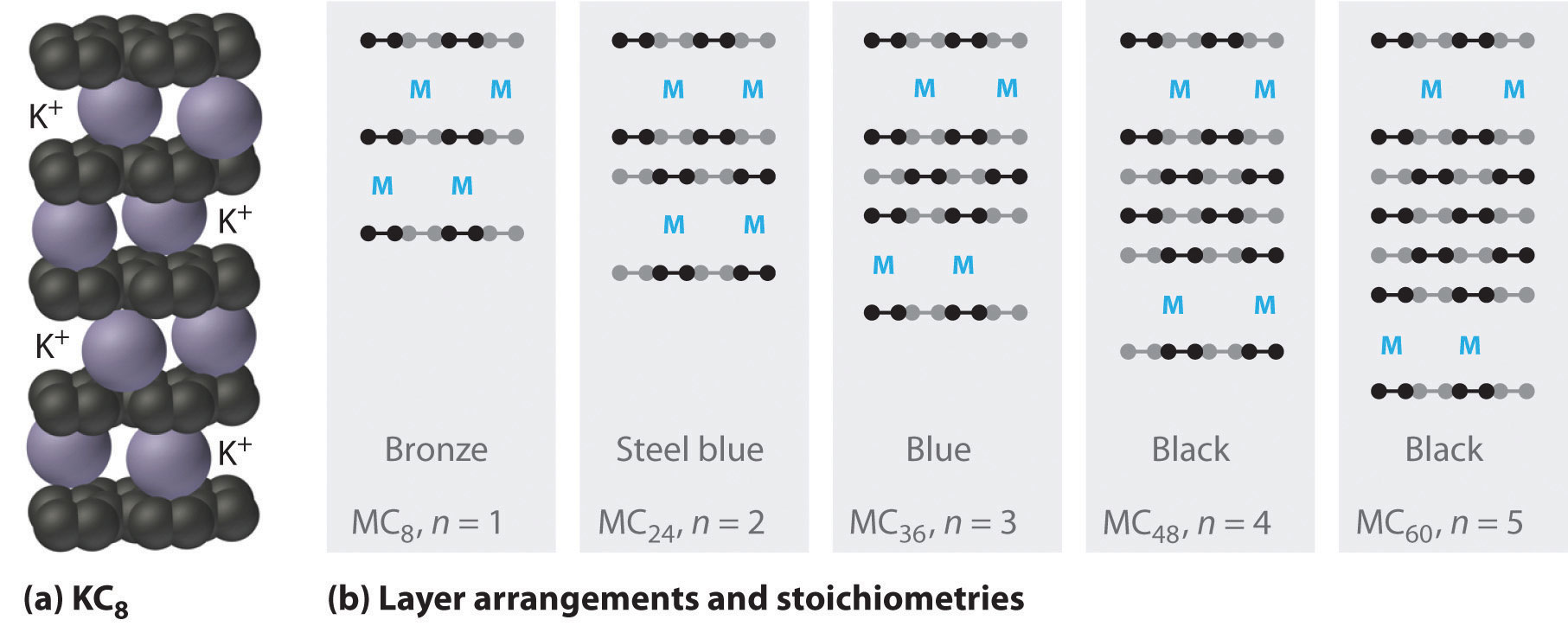
Los metales alcalinos más pesados (K, Rb y Cs) también reaccionan con el carbono en forma de grafito. En lugar de alterar las láminas hexagonales de átomos de carbono, sin embargo, los metales se insertan entre las láminas de átomos de carbono para dar nuevas sustancias llamadas compuestos de intercalación de grafito (parte (a) en la Figura\(\PageIndex{3}\)). Las estequiometrías de estos compuestos incluyen MC 60 y MC 48, que son negro/gris; MC 36 y MC 24, que son azules; y MC 8, que es bronce (parte (b) en la Figura\(\PageIndex{3}\)). La conductividad eléctrica notablemente alta de estos compuestos (aproximadamente 200 veces mayor que el grafito) se atribuye a una transferencia neta del electrón de valencia del metal alcalino a las capas de grafito para producir, por ejemplo, K + C 8 −.
Todos los metales alcalinos reaccionan directamente con hidrógeno gaseoso a temperaturas elevadas para producir hidruros iónicos (M+ H −):
\[2M_{(s)} + H_{2(g)} \rightarrow 2MH_{(s)} \label{21.15a}\]
Todos también son capaces de reducir el agua para producir gas hidrógeno:
\[\mathrm{M(s)}+\mathrm{H_2O(l)}\rightarrow\frac{1}{2}\mathrm{H_2(g)}+\mathrm{MOH(aq)} \label{21.16}\]
Aunque el litio reacciona bastante lentamente con el agua, el sodio reacciona con bastante vigor (Figura\(\PageIndex{4}\)), y los metales alcalinos más pesados (K, Rb y Cs) reaccionan tan vigorosamente que invariablemente explotan. Esta tendencia, que no es consistente con las magnitudes relativas de los potenciales de reducción de los elementos, sirve como otro ejemplo de la compleja interacción de diferentes fuerzas y fenómenos, en este caso, cinética y termodinámica. Aunque la fuerza impulsora de la reacción es mayor para el litio, los metales más pesados tienen puntos de fusión más bajos. El calor liberado por la reacción hace que se fundan, y la mayor superficie del metal líquido en contacto con el agua acelera enormemente la velocidad de reacción.
Los cationes de metales alcalinos se encuentran en una amplia variedad de compuestos iónicos. En general, cualquier sal de metal alcalino se puede preparar haciendo reaccionar el hidróxido de metal alcalino con un ácido y luego evaporando el agua:
\[2MOH_{(aq)} + H_2SO_{4(aq)} \rightarrow M_2SO_{4(aq)} + 2H_2O_{(l)} \label{21.17}\]
\[MOH_{(aq)} + HNO_{3(aq)} \rightarrow MNO_{3(aq)} + H_2O_{(l)} \label{21.18}\]
Los hidróxidos de metales alcalinos también pueden reaccionar con compuestos orgánicos que contienen un hidrógeno ácido para producir una sal. Un ejemplo es la preparación de acetato de sodio (CH 3 CO 2 Na) haciendo reaccionar hidróxido de sodio y ácido acético:
\[CH_3CO_2H_{(aq)} + NaOH_{(s)} \rightarrow CH_3CO_2Na_{(aq)} + H_2O_{(l)} \label{21.19}\]
El jabón es una mezcla de las sales de sodio y potasio de ácidos carboxílicos naturales, como el ácido palmítico [CH 3 (CH 2) 14 CO 2 H] y ácido esteárico [CH 3 (CH 2) 16 CO 2 H]. Las sales de litio, como el estearato de litio [CH 3 (CH 2) 14 CO 2 Li], se utilizan como aditivos en aceites y grasas para motores.
Complejos de los Metales Alcalis
Debido a su baja carga positiva (+1) y radios iónicos relativamente grandes, los cationes de metales alcalinos solo tienen una débil tendencia a reaccionar con bases de Lewis simples para formar complejos metálicos. La formación de complejos es más significativa para el catión más pequeño (Li +) y disminuye al aumentar el radio. En solución acuosa, por ejemplo, Li + forma el complejo tetraédrico [Li (H 2 O) 4] +. En contraste, los cationes de metales alcalinos más grandes forman complejos octaédricos [M (H 2 O) 6] +. La formación de complejos se debe principalmente a la interacción electrostática del catión metálico con las moléculas polares de agua. Debido a su alta afinidad por el agua, las sales anhidras que contienen iones Li + y Na + (como Na 2 SO 4) a menudo se utilizan como agentes secantes. Estos compuestos absorben trazas de agua de soluciones no acuosas para formar sales hidratadas, que luego se eliminan fácilmente de la solución por filtración.
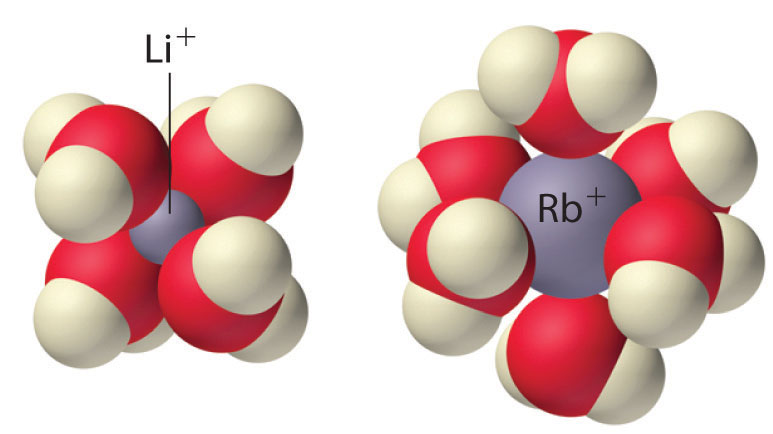
Debido a su baja carga positiva (+1) y radios iónicos relativamente grandes, los cationes de metales alcalinos solo tienen una tendencia débil a formar complejos con bases de Lewis simples.
Las interacciones electrostáticas también permiten que los iones de metales alcalinos formen complejos con ciertos poliéteres cíclicos y compuestos relacionados, como éteres corona y criptandos. Como se discute en el Capítulo 13, los éteres corona son poliéteres cíclicos que contienen cuatro o más átomos de oxígeno separados por dos o tres átomos de carbono. Todos los éteres corona tienen una cavidad central que puede acomodar un ion metálico coordinado al anillo de átomos de oxígeno, y los éteres corona con anillos de diferentes tamaños prefieren unir iones metálicos que encajan en la cavidad. Por ejemplo, 14-corona-4, con la cavidad más pequeña que puede acomodar un ion metálico, tiene la mayor afinidad por Li +, mientras que 18-corona-6 forma los complejos más fuertes con K +.
Los criptandos son análogos más casi esféricos de los éteres corona y son agentes complejantes aún más potentes y selectivos. Los criptandos consisten en tres cadenas que contienen oxígeno que están conectadas por dos átomos de nitrógeno (parte (b) en la Figura 13.7). Pueden rodear (encapsular) completamente un ion metálico del tamaño apropiado, coordinándose con el metal por un par solitario de electrones en cada átomo de O y los dos átomos de N. Al igual que los éteres corona, los criptandos con diferentes tamaños de cavidad son altamente selectivos para iones metálicos de tamaños particulares. Los éteres corona y criptandos se utilizan a menudo para disolver sales inorgánicas simples como KMnO 4 en solventes orgánicos no polares.
Soluciones de amoníaco líquido
Una característica notable de los metales alcalinos es su capacidad para disolverse reversiblemente en amoníaco líquido. Al igual que en sus reacciones con el agua, la reacción de metales alcalinos con amoníaco líquido eventualmente produce gas hidrógeno y la sal metálica de la base conjugada del disolvente, en este caso, el ion amida (NH 2 −) en lugar de hidróxido:
\[\mathrm{M(s)}+\mathrm{NH_3(l)}\rightarrow\frac{1}{2}\mathrm{H_2(g)}+\mathrm{M^+(am)}+\mathrm{NH_2^-(am)} \label{21.20}\]
donde la designación (am) se refiere a una solución de amoníaco, análoga a (ac) utilizada para indicar soluciones acuosas. Sin catalizador, la reacción en la Ecuación 21.20 tiende a ser bastante lenta. En muchos casos, la sal amida de metal alcalino (MNH 2) no es muy soluble en amoníaco líquido y precipita, pero cuando se disuelve, se producen soluciones muy concentradas del metal alcalino. Un mol de metal Cs, por ejemplo, se disolverá en tan solo 53 mL (40 g) de amoníaco líquido. El metal puro se recupera fácilmente cuando el amoníaco se evapora.
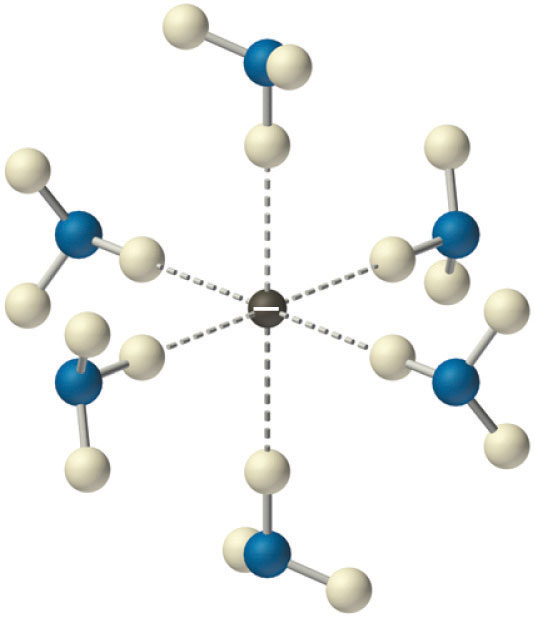
Las soluciones de metales alcalinos en amoníaco líquido son de color intenso y son buenos conductores de electricidad debido a la presencia de electrones solvatados (e −, NH 3), que no están unidos a átomos individuales. Un electrón solvatado se asocia flojamente con una cavidad en el disolvente de amoníaco que se estabiliza por enlaces de hidrógeno. Las soluciones de amoníaco líquido de metal alcalino de aproximadamente 3 M o menos son de color azul profundo (Figura\(\PageIndex{5}\)) y conducen la electricidad aproximadamente 10 veces mejor que una solución acuosa de NaCl debido a la alta movilidad de los electrones solvatados. A medida que la concentración del metal aumenta por encima de 3 M, el color cambia a bronce metálico u oro, y la conductividad aumenta a un valor comparable al de los metales líquidos puros.

Además de los electrones solvatados, las soluciones de metales alcalinos en amoníaco líquido contienen el catión metálico (M +), el átomo de metal neutro (M), dímeros metálicos (M 2) y el anión metálico (M −). El anión se forma mediante la adición de un electrón al orbital de valencia ns ocupado individualmente del átomo metálico. Incluso en ausencia de un catalizador, estas soluciones no son muy estables y eventualmente se descomponen a los productos termodinámicamente favorecidos: M + NH 2 − y gas hidrógeno (Ecuación 21.20). Sin embargo, el electrón solvatado es un potente reductor que a menudo se usa en química sintética.
Compuestos Organometálicos de los Elementos del Grupo 1
Los compuestos que contienen un metal unido covalentemente a un átomo de carbono de una especie orgánica se denominan compuestos organometálicos. Las propiedades y reactividades de los compuestos organometálicos difieren mucho de las de los componentes metálicos u orgánicos. Debido a su pequeño tamaño, el litio, por ejemplo, forma una extensa serie de compuestos de organolitio covalentes, como el metillitio (LiCH 3), que son, con mucho, los compuestos organometálicos del grupo 1 más estables y conocidos. Estos sólidos o líquidos volátiles de bajo punto de fusión pueden ser sublimados o destilados a temperaturas relativamente bajas y son solubles en disolventes no polares. Al igual que los compuestos orgánicos, los sólidos fundidos no conducen electricidad en ningún grado significativo. Los compuestos de organolitio tienen tendencia a formar oligómeros con la fórmula (RLi) n, donde R representa el componente orgánico. Por ejemplo, tanto en estado sólido como en solución, el metillitio existe como tetrámero con la estructura mostrada en la Figura\(\PageIndex{6}\), donde cada cara triangular del tetraedro Li 4 está puenteada por el átomo de carbono de un grupo metilo. Efectivamente, el átomo de carbono de cada grupo CH 3 está utilizando un solo par de electrones en un lóbulo híbrido sp 3 para unir tres átomos de litio, haciendo de este un ejemplo de enlace de dos electrones y cuatro centros. Claramente, tal estructura, en la que cada átomo de carbono aparentemente está unido a otros seis átomos, no puede explicarse usando ninguno de los esquemas de unión de pares de electrones. La teoría orbital molecular puede explicar la unión en el metillitio, pero la descripción está fuera del alcance de este texto.
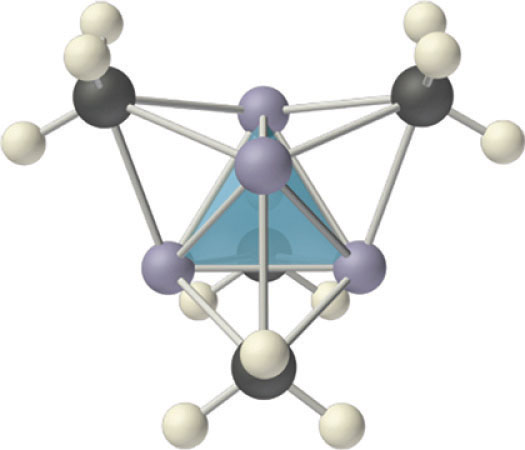
- Las propiedades y reactividades de los compuestos organometálicos difieren mucho de las de los componentes metálicos u orgánicos.
- Los compuestos organosódicos y organopotásicos son más iónicos que los compuestos de organolitio. Contienen iones M + y R − discretos y son insolubles o solo escasamente solubles en disolventes no polares.
Usos de los metales alcalinos
Debido a que el sodio permanece líquido en un amplio rango de temperatura (97.8-883°C), se utiliza como refrigerante en aplicaciones especializadas de alta temperatura, como reactores nucleares y válvulas de escape en motores de autos deportivos de alto rendimiento. El cesio, debido a su baja energía de ionización, se utiliza en fotosensores en puertas automáticas, inodoros, alarmas de robo y otros dispositivos electrónicos. En estos dispositivos, el cesio es ionizado por un haz de luz visible, produciendo así una pequeña corriente eléctrica; bloqueando la luz interrumpe la corriente eléctrica y desencadena una respuesta.
Los compuestos de sodio y potasio se producen a gran escala en la industria. Cada año, los 50 principales compuestos industriales incluyen NaOH, utilizado en una amplia variedad de procesos industriales; Na 2 CO 3, utilizado en la fabricación de vidrio; K 2 O, utilizado en esmaltes de porcelana; y Na 4 SiO 4, utilizado en detergentes.
Varios otros compuestos de metales alcalinos también son importantes. Por ejemplo, Li 2 CO 3 es uno de los tratamientos más efectivos disponibles para la depresión maníaca o el trastorno bipolar. Parece modular o amortiguar el efecto sobre el cerebro de los cambios en el nivel de los neurotransmisores, que son sustancias bioquímicas encargadas de transmitir los impulsos nerviosos entre neuronas. En consecuencia, los pacientes que toman “litio” no presentan los cambios de humor extremos que caracterizan a este trastorno.
Para cada aplicación, elija la sustancia más adecuada en función de las propiedades y reactividades de los metales alcalinos y sus compuestos. Explica tu elección en cada caso.
- Para una reacción que requiera una base fuerte en una solución de tetrahidrofurano (THF), ¿usarías LiOH o CsOH?
- Para extinguir un incendio causado por la quema de metal de litio, ¿usaría agua, CO 2, gas N 2 o arena (SiO 2)?
- Tanto el LiN 3 como el CsnO 3 son altamente solubles en acetona (2-propanona). ¿Cuál de estas sales de metales alcalinos usaría para precipitar I − de una solución de acetona?
Dado: aplicación y metales alcalinos seleccionados
Preguntado por: metal apropiado para cada aplicación
Estrategia:
Utilizar las propiedades y reactividades discutidas en esta sección para determinar qué metal alcalino es el más adecuado para la aplicación indicada.
Solución
- Tanto LiOH como CsOH son compuestos iónicos que contienen el anión hidróxido. Li +, sin embargo, es mucho más pequeño que Cs +, por lo que el catión Li + será solvatado de manera más efectiva por el oxígeno del THF con sus pares solitarios de electrones. Esta diferencia tendrá dos efectos: (1) LiOH es probable que sea mucho más soluble que CsOH en el disolvente no polar, lo que podría ser una ventaja significativa, y (2) los iones Li + solvatados tienen menos probabilidades de formar pares de iones estrechos con los iones OH - en la solución relativamente no polar. haciendo que el OH − sea más básico y, por lo tanto, más reactivo. Así LiOH es la mejor opción.
- El litio es un potente reductor que reacciona con el agua para formar LiOH y gas H 2, por lo que es probable que agregar una fuente de hidrógeno como el agua a un fuego de litio produzca una explosión. El litio también reacciona con oxígeno y nitrógeno en el aire para formar Li 2 O y Li 3 N, respectivamente, por lo que no esperaríamos que el nitrógeno apague un fuego de litio. Debido a que el CO 2 es una molécula gaseosa que contiene carbono en su estado de oxidación más alto accesible (+4), agregar CO 2 a un reductor fuerte como Li debería resultar en una reacción redox vigorosa. Por lo tanto, el agua, el N 2 y el CO 2 son opciones inadecuadas para extinguir un fuego de litio. Por el contrario, la arena es principalmente SiO 2, que es un sólido de red que no se reduce fácilmente. Asfixiar un fuego de litio con arena es, por lo tanto, la mejor opción.
- La sal con el catión más pequeño tiene la mayor energía reticular, y las altas energías reticulares tienden a disminuir la solubilidad de una sal. Sin embargo, la energía de solvatación del catión también es importante para determinar la solubilidad, y los cationes pequeños tienden a tener mayores energías de solvatación. Recordemos que las altas energías de solvatación tienden a aumentar la solubilidad de las sustancias iónicas. Así, CSi debe ser el menos soluble de los yoduros de metales alcalinos, y LiI el más soluble. En consecuencia, CSnO 3 es la mejor opción.
Indicar cuál de los metales alcalinos alternativos o sus compuestos dados es más apropiado para cada aplicación.
- agente de secado para un disolvente orgánico—Li 2 SO 4 o Rb 2 SO 4
- eliminar trazas de N2 de Ar Gas-Li, K o Cs altamente purificados
- hacer reaccionar con un haluro de alquilo (fórmula RX) para preparar un compuesto organometálico (fórmula MR) -Li o K
Responder
- Li 2 SO 4
- Li
- Li
Predecir los productos de cada reacción y luego equilibrar cada ecuación química.
- Na (s) + O 2 (g) →
- Li 2 O (s) + H 2 O (l) →
- K (s) + CH 3 OH (l) →
- Li (s) + CH 3 Cl (l) →
- Li 3 N (s) + KCl (s) →
Dado: reactivos
Preguntado por: productos y ecuación química equilibrada
Estrategia:
A Determinar si uno de los reactivos es un oxidante o un reductor o un ácido fuerte o una base fuerte. Si es así, es probable que ocurra una reacción redox o una reacción ácido-base. Identificar los productos de la reacción.
B Si se predice que ocurrirá una reacción, equilibre la ecuación química.
Solución
- Un Sodio es un reductor, y el oxígeno es un oxidante, por lo que es muy probable una reacción redox. Esperamos que un electrón sea transferido de Na (formando así Na +) a O 2. Ahora necesitamos determinar si el producto reducido es un superóxido (O 2 −), peróxido (O 2 2−) u óxido (O 2−). En condiciones normales de reacción, el producto de la reacción de un metal alcalino con oxígeno depende de la identidad del metal. Debido a las diferencias en la energía de la red, Li produce el óxido (Li 2 O), los metales más pesados (K, Rb, Cs) producen el superóxido (MO 2) y Na produce el peróxido (Na 2 O 2).
B La ecuación química equilibrada es 2Na (s) + O 2 (g) → Na 2 O 2 (s).
- Un Li 2 O es una sal iónica que contiene el ion óxido (O 2−), que es la forma completamente desprotonada del agua y por lo tanto se espera que sea una base fuerte. El otro reactivo, el agua, es tanto un ácido débil como una base débil, por lo que podemos predecir que ocurrirá una reacción ácido-base.
B La ecuación química equilibrada es Li 2 O (s) + H 2 O (l) → 2LiOH (aq).
- Un Potasio es un reductor, mientras que el metanol es tanto un ácido débil como una base débil (similar al agua). Un ácido débil produce H +, que puede actuar como oxidante aceptando que se forme un electrón\(\frac{1}{2}\mathrm{H_2}\). Esta reacción, por lo tanto, es una disociación ácida que es conducida a su finalización por una reducción de los protones a medida que se liberan.
B La ecuación química equilibrada es la siguiente:\(\mathrm{K(s)}+\mathrm{CH_3OH(l)}\rightarrow\frac{1}{2}\mathrm{H_2(g)}+\mathrm{CH_3OK(soln)}\).
- A Uno de los reactivos es un metal alcalino, un potente reductor y el otro es un haluro de alquilo. Cualquier compuesto que contenga un enlace carbono-halógeno puede, en principio, reducirse, liberando un ion haluro y formando un compuesto organometálico. Ese resultado parece probable en este caso porque los compuestos de organolitio se encuentran entre los compuestos organometálicos más estables conocidos.
B Se requieren dos moles de litio para equilibrar la ecuación: 2Li (s) + CH 3 Cl (l) → LiCl (s) + CH 3 Li (soln).
- A El nitruro de litio y el cloruro de potasio son en gran parte compuestos iónicos. El ion nitruro (N 3−) es una base muy fuerte porque es la forma completamente desprotonada del amoníaco, un ácido débil. Sin embargo, una reacción ácido-base requiere tanto un ácido como una base, y el KCl no es ácido. ¿Y una reacción redox? Ambas sustancias contienen iones que tienen configuraciones de electrones de valencia de caparazón cerrado. El ion nitruro podría actuar como reductor donando electrones a un oxidante y formando N 2. El KCl no es un oxidante, sin embargo, y una reacción redox requiere tanto un oxidante como un reductor.
B Concluimos que las dos sustancias no reaccionarán entre sí.
Predecir los productos de cada reacción y equilibrar cada ecuación química.
- K (s) + N 2 (g) →
- Li 3 N (s) + H 2 O (l) →
- Na (s) + (CH 3) 2 NH (soln) →
- C 6 H 5 Li (soln) + D 2 O (l) → C 6 H 5 D (l) + LiOD (soln)
- CH 3 CH 2 Cl (soln) + 2Li →
Responder
- sin reacción
- Li 3 N (s) + 3H 2 O (l) → NH 3 (aq) + 3LiOH (aq)
- \(\mathrm{Na(s)}+\mathrm{(CH_3)_2NH(soln)}\rightarrow\frac{1}{2}\mathrm{H_2(g)}+\mathrm{Na[(CH_3)_2N](soln)}\)
- C 6 H 5 Li (soln) + D 2 O (l) → C 6 H 5 D (l) + LiOD (soln)
- CH 3 CH 2 Cl (soln) + 2Li → CH 3 CH 2 Li (soln) + LiCl (soln)
Resumen
Los metales alcalinos son potentes reductores cuya química es en gran parte la de los compuestos iónicos que contienen el ion M +. Los metales alcalinos solo tienen una tendencia débil a formar complejos con bases de Lewis simples. Los primeros metales alcalinos que se aislaron (Na y K) se obtuvieron haciendo pasar una corriente eléctrica a través de carbonatos de potasio y sodio fundidos. Los metales alcalinos se encuentran entre los reductores más potentes conocidos; la mayoría pueden aislarse por electrólisis de sus sales fundidas o, en el caso de rubidio y cesio, haciendo reaccionar sus sales de hidróxido con un reductor. También se pueden recuperar de sus minerales de silicato mediante un proceso de múltiples etapas. El litio, el reductor más fuerte, y el sodio, el más débil, son ejemplos de los efectos físicos y químicos de las tendencias periódicas opuestas. Los metales alcalinos reaccionan con halógenos (grupo 17) para formar haluros iónicos; los calcógenos más pesados (grupo 16) para producir calcogenuros metálicos; y oxígeno para formar compuestos, cuya estequiometría depende del tamaño del átomo metálico. Los peróxidos y superóxidos son potentes oxidantes. El único metal alcalino que reacciona con el nitrógeno atmosférico es el litio. Los metales alcalinos más pesados reaccionan con el grafito para formar compuestos de intercalación de grafito, sustancias en las que se insertan átomos metálicos entre las láminas de átomos de carbono. Con los elementos más pesados del grupo 14, los metales alcalinos reaccionan para dar aniones poliatómicos con estructuras de jaula tridimensionales. Todos los metales alcalinos reaccionan con hidrógeno a altas temperaturas para producir los hidruros correspondientes, y todos reducen el agua para producir gas hidrógeno. Las sales de metales alcalinos se preparan haciendo reaccionar un hidróxido metálico con un ácido, seguido de evaporación del agua. Tanto las sales de Li como de Na se utilizan como agentes secantes, compuestos que se utilizan para absorber agua. Los agentes complejantes como los éteres corona y los criptandos pueden acomodar iones de metales alcalinos del tamaño apropiado. Los metales alcalinos también pueden reaccionar con amoníaco líquido para formar soluciones que se descomponen lentamente para dar gas hidrógeno y la sal metálica del ion amida (NH 2 −). Estas soluciones, que contienen electrones solvatados inestables poco asociados con una cavidad en el solvente, son intensamente coloreadas, buenos conductores de electricidad y excelentes reductores. Los metales alcalinos pueden reaccionar con compuestos orgánicos que contienen un protón ácido para producir sales. También pueden formar compuestos organometálicos, los cuales tienen propiedades que difieren de las de sus componentes metálicos y orgánicos.


