20.6: Los elementos del bloque S en biología
- Page ID
- 78318
- Conocer los roles de los elementos s-block en biología.
Los elementos del bloque s juegan un papel importante en los sistemas biológicos. Los hidruros covalentes, por ejemplo, son los bloques de construcción de compuestos orgánicos, y otros compuestos e iones que contienen elementos de bloque s se encuentran en tejidos y fluidos celulares. En esta sección, describimos algunas formas en las que la biología depende de las propiedades de los elementos del grupo 1 y del grupo 2.
Hidruros Covalentes
Hay tres clases principales de hidruros, covalentes, iónicos y metálicos, pero solo los hidruros covalentes ocurren en las células vivas y tienen algún significado bioquímico. Como aprendió en el Capítulo 3, el carbono y el hidrógeno tienen electronegatividades similares, y los enlaces C-H en las moléculas orgánicas son fuertes y esencialmente no polares. Poca química ácido-base está involucrada en la escisión o formación de estos enlaces. En contraste, debido a que el hidrógeno es menos electronegativo que el oxígeno y el nitrógeno (simbolizados por Z), el enlace H—Z en los hidruros de estos elementos está polarizado (H δ+ —Z δ−). En consecuencia, los átomos de hidrógeno en estos enlaces H-Z son relativamente ácidos. Además, los enlaces S-H son relativamente débiles debido a la mala superposición orbital, por lo que se escinden fácilmente para dar un protón. Los hidruros en los que H está unido a átomos de O, N o S son, por lo tanto, moléculas polares e hidrofílicas que forman enlaces de hidrógeno. También sufren reacciones ácido-base transfiriendo un protón.
Tenga en cuenta el patrón
Los hidruros covalentes en los que H está unido a átomos de O, N o S son polares e hidrófilos, forman enlaces de hidrógeno y transfieren un protón en sus reacciones ácido-base.
Los enlaces de hidrógeno son cruciales en la bioquímica, en parte porque ayudan a mantener las proteínas en sus estructuras plegadas biológicamente activas. Los enlaces de hidrógeno también conectan las dos hebras entrelazadas del ADN (ácido desoxirribonucleico), la sustancia que contiene el código genético para todos los organismos. (Para mayor información sobre el ADN, consulte la Sección 23.6.) Debido a que los enlaces de hidrógeno son más fáciles de romper que los enlaces covalentes que forman las cadenas individuales de ADN, las dos cadenas entrelazadas se pueden separar para dar cadenas individuales intactas, lo cual es esencial para la duplicación de la información genética.
Además de la importancia de los enlaces de hidrógeno en las moléculas bioquímicas, la extensa red de enlaces de hidrógeno en el agua es una de las claves de la existencia de la vida en nuestro planeta. En base a su masa molecular, el agua debe ser un gas a temperatura ambiente (20°C), pero las fuertes interacciones intermoleculares en el agua líquida aumentan enormemente su punto de ebullición. Los enlaces de hidrógeno también producen la disposición molecular relativamente abierta que se encuentra en el hielo, lo que hace que el hielo sea menos denso que el agua. Debido a que el hielo flota en la superficie del agua, crea una capa aislante que permite que los organismos acuáticos sobrevivan durante los fríos meses de invierno.
Estas mismas fuertes interacciones intermoleculares de enlaces de hidrógeno también son responsables de la alta capacidad calorífica del agua y su alto calor de fusión. Una gran cantidad de energía debe ser removida del agua para que se congele. En consecuencia, como se señala en el Capítulo 9, grandes masas de agua actúan como “amortiguadores térmicos” que tienen un efecto estabilizador sobre el clima de las áreas terrestres adyacentes. Quizás el ejemplo más llamativo de este efecto es el hecho de que los humanos pueden vivir cómodamente en latitudes muy altas. Por ejemplo, las palmeras crecen en el sur de Inglaterra a la misma latitud (°/N) que el extremo sur de la gélida Bahía de Hudson y el norte de Terranova en América del Norte, áreas conocidas más por sus poblaciones de alces que por su vegetación tropical. El agua caliente de la corriente de la Corriente del Golfo en el Océano Atlántico fluye en el sentido de las agujas del reloj desde el clima tropical en el ecuador pasando por la costa este de los Estados Unidos y luego gira hacia Inglaterra, donde se libera el calor almacenado en el agua. El clima templado de Europa es atribuible en gran medida a las propiedades térmicas del agua.
Tenga en cuenta el patrón
Las fuertes interacciones intermoleculares de enlaces de hidrógeno son responsables de la alta capacidad calorífica del agua y su alto calor de fusión.
Macrominerales
Los miembros del grupo 1 y grupo 2 que están presentes en las mayores cantidades en los organismos son sodio, potasio, magnesio y calcio, todos los cuales forman cationes monoatómicos con una carga de +1 (grupo 1, M +) o +2 (grupo 2, M 2+). Biológicamente, estos elementos pueden clasificarse como macrominerales.
Por ejemplo, el calcio se encuentra en forma de sales de calcio relativamente insolubles que se utilizan como materiales estructurales en muchos organismos. La hidroxiapatita [Ca 5 (PO 4) 3 OH] es el componente principal de los huesos, el carbonato de calcio (CaCo 3) es el componente principal de las conchas de los moluscos y los huevos de aves y reptiles, y el oxalato de calcio (CaO 2 CCO 2) se encuentra en muchas plantas. Debido a que el calcio y el estroncio tienen tamaños y relaciones de carga a radio similares, siempre se encuentran pequeñas cantidades de estroncio en el hueso y otros materiales estructurales que contienen calcio. Normalmente esto no es un problema porque los iones Sr 2+ ocupan sitios que de otro modo estarían ocupados por iones Ca 2+. Cuando se liberan trazas de 90 Sr radiactivos a la atmósfera a partir de pruebas de armas nucleares o de un accidente nuclear, sin embargo, el estroncio radiactivo finalmente llega al suelo, donde es absorbido por plantas que son consumidas por el ganado lechero. Luego, el isótopo se concentra en la leche de vaca, junto con el calcio. Debido a que el estroncio radiactivo coprecipita con calcio en la hidroxiapatita que rodea la médula ósea (donde se producen glóbulos blancos), los niños, que generalmente ingieren más leche de vaca que los adultos, tienen un riesgo sustancialmente mayor de leucemia, un tipo de cáncer caracterizado por la sobreproducción de glóbulos blancos.
Transporte de iones
Los iones Na +, K +, Mg 2+ y Ca 2+ son componentes importantes de los fluidos intracelulares y extracelulares. Tanto Na + como Ca 2+ se encuentran principalmente en fluidos extracelulares, como el plasma sanguíneo, mientras que K + y Mg 2+ se encuentran principalmente en fluidos intracelulares. Se requieren insumos sustanciales de energía para establecer y mantener estos gradientes de concentración y evitar que el sistema alcance el equilibrio. Por lo tanto, se necesita energía para transportar cada ion a través de la membrana celular hacia el lado con la mayor concentración. Las máquinas biológicas que se encargan del transporte selectivo de estos iones metálicos son conjuntos complejos de proteínas llamadas bombas de iones Un complejo ensamblaje de proteínas que transportan selectivamente iones a través de las membranas celulares por su alta afinidad por iones de cierta carga y radio. . Las bombas de iones reconocen y discriminan entre iones metálicos de la misma manera que lo hacen los éteres corona y los criptandos, con una alta afinidad por iones de cierta carga y radio.
Los defectos en las bombas de iones o sus mecanismos de control pueden dar lugar a problemas de salud importantes. Por ejemplo, la fibrosis quística, la enfermedad hereditaria más común en Estados Unidos, es causada por un defecto en el sistema de transporte (en este caso, iones cloruro). De manera similar, en muchos casos, se cree que la hipertensión, o presión arterial alta, se debe a la absorción y/o excreción defectuosa de Na +. Si se absorbe demasiado Na + de la dieta (o si se excreta muy poco), el agua se difunde desde los tejidos hacia la sangre para diluir la solución, disminuyendo así la presión osmótica en el sistema circulatorio. El aumento del volumen aumenta la presión arterial, y las arterias rotas llamadas aneurismas pueden resultar, a menudo en el cerebro. Debido a que la presión arterial alta también causa otros problemas médicos, es uno de los trastornos biomédicos más importantes en la sociedad moderna.
Para los pacientes que sufren de hipertensión, a menudo se prescriben dietas bajas en sodio que utilizan sustitutos de NaCl, como KCl. Aunque el KCl y el NaCl dan sabores similares a los alimentos, el K + no es fácilmente absorbido por el sistema altamente específico de absorción de Na +. Este enfoque para controlar la hipertensión es polémico, sin embargo, debido a que las correlaciones directas entre el contenido de Na + en la dieta y la presión arterial son difíciles de demostrar en la población general. Más importante aún, observaciones recientes indican que la presión arterial alta puede correlacionarse más estrechamente con una ingesta inadecuada de calcio en la dieta que con niveles excesivos de sodio. Este hallazgo es importante porque la dieta típica “baja en sodio” también es baja en buenas fuentes de calcio, como los productos lácteos.
Algunas de las funciones biológicas más importantes de los metales del grupo 1 y del grupo 2 se deben a pequeños cambios en las concentraciones celulares del ión metálico. La transmisión de impulsos nerviosos, por ejemplo, va acompañada de un aumento del flujo de iones Na + hacia una célula nerviosa. De manera similar, la unión de diversas hormonas a receptores específicos en la superficie de una célula conduce a una rápida afluencia de iones Ca 2+; el aumento repentino resultante de la concentración intracelular de Ca 2+ desencadena otros eventos, como la contracción muscular, la liberación de neurotransmisores, enzimas activación, o la secreción de otras hormonas.
Dentro de las células, K + y Mg 2+ a menudo activan enzimas particulares al unirse a sitios específicos cargados negativamente en la estructura de la enzima. La clorofila, el pigmento verde utilizado por todas las plantas para absorber la luz e impulsar el proceso de fotosíntesis, contiene magnesio. Durante la fotosíntesis, el CO 2 se reduce para formar azúcares como la glucosa. La estructura de la porción central de una molécula de clorofila se asemeja a un éter corona (parte (a) en la Figura 13.2.4) con cuatro anillos que contienen nitrógeno de cinco miembros unidos entre sí para formar un anillo grande que proporciona un “agujero” del tamaño adecuado para unir fuertemente Mg 2+.
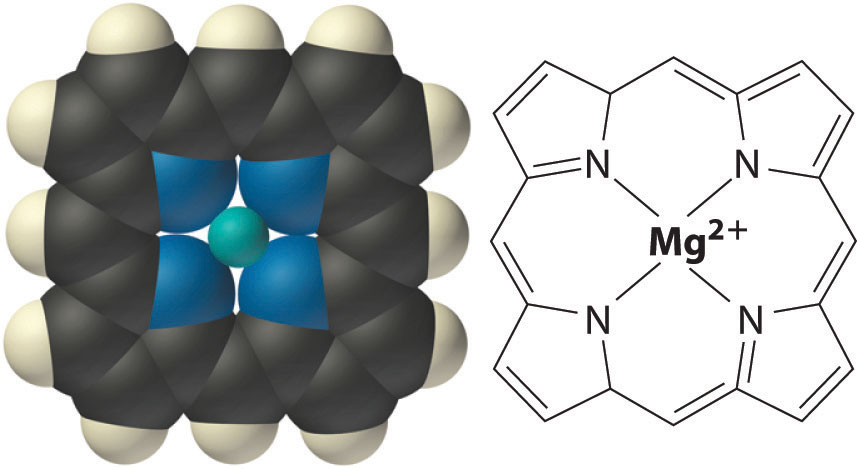
La estructura del núcleo central de clorofila, un complejo de magnesio presente en todos los tejidos fotosintéticos. Obsérvese el parecido con los complejos de éter corona discutidos en el Capítulo 13.
Ionóforos
Debido a que la salud de las células depende de mantener los niveles adecuados de cationes en los fluidos intracelulares, cualquier cambio que afecte el flujo normal de iones metálicos a través de las membranas celulares bien podría causar la muerte de un organismo. Las moléculas que facilitan el transporte de iones metálicos a través de las membranas generalmente se denominan ionóforos Una molécula que facilita el transporte de iones metálicos a través de las membranas. (ion más phore del griego phorein, que significa “llevar”). Muchos ionóforos son potentes antibióticos que pueden matar o inhibir el crecimiento de bacterias. Un ejemplo es la valinomicina, una molécula cíclica con una cavidad central revestida con átomos de oxígeno (parte (a) en la Figura 20.5.1) que es similar a la cavidad de un éter corona (parte (a) en la Figura 13.2.4). Al igual que un éter corona, la valinomicina es altamente selectiva: su afinidad por K + es aproximadamente 1000 veces mayor que la de Na +. Al aumentar el flujo de iones K + hacia las células, la valinomicina interrumpe el gradiente normal de K + a través de una membrana celular, destruyendo así la célula (parte (b) en la Figura 20.5.1).
Figura 20.5.1 La valinomicina es un antibiótico que funciona como un ionóforo (a) Este modelo de la estructura del complejo K + -valinomicina, determinado por difracción de rayos X, muestra cómo la molécula de valinomicina se envuelve alrededor del ion K +, protegiéndolo de el ambiente, de una manera que recuerda a un complejo de éter corona. (Para mayor información sobre los éteres corona, consulte la Sección 13.2.) (b) La valinomicina mata las bacterias al facilitar el transporte de iones K + a través de la membrana celular, alterando así la distribución normal de iones en la bacteria. En la superficie de la membrana, la valinomicina se une a un ion K +. Debido a que el exterior hidrófobo de la molécula de valinomicina forma una “rosquilla” que protege la carga positiva del ion metálico, el complejo K + -valinomicina es altamente soluble en el interior no polar de la membrana. Después de que el complejo K + -valinomicina se difunde a través de la membrana hacia el interior de la célula, se libera el ion K + y la valinomicina es libre para difundirse de nuevo al otro lado de la membrana para unirse a otro ion K +. La valinomicina destruye así el gradiente normal de K + a través de la membrana, matando a la célula.
Ejemplo 20.5.1
Una forma común de estudiar la función de un ión metálico en biología es reemplazar el metal natural por uno cuya reactividad se pueda rastrear por métodos espectroscópicos. El ion metálico sustituto debe unirse al mismo sitio que el ion natural, y debe tener una afinidad similar (o mayor) por ese sitio, como lo indica su densidad de carga. Organizar los siguientes iones en orden de aumentar la efectividad como reemplazo del Ca 2+, que tiene un radio iónico de 100pm (los números entre paréntesis son radios iónicos): Na + (102pm), Eu 2+ (117pm), Sr 2+ (118pm), F − (133pm), Pb 2+ (119pm), y La 3+ (103pm). Explica tu razonamiento.
Dado: iones y radios iónicos
Preguntado por: idoneidad como reemplazo para Ca 2+
Estrategia:
Use tendencias periódicas para organizar los iones de menos efectivos a más efectivos como reemplazo del Ca 2+.
Solución:
Las propiedades más importantes para determinar la afinidad de una molécula biológica por un ion metálico son el tamaño y la relación carga-radio del ión metálico. De los posibles reemplazos de Ca 2+ enumerados, el ion F − tiene la carga opuesta, por lo que no debe tener afinidad por un sitio de unión a Ca 2+. Na + es aproximadamente del tamaño correcto, pero con una carga +1 se unirá mucho más débilmente que Ca 2+. Aunque Eu 2+, Sr 2+ y Pb 2+ son todos un poco más grandes que Ca 2+, probablemente sean lo suficientemente similares en tamaño y carga para unirse. Basado en su radio iónico, Eu 2+ debería unirse más estrechamente de los tres. La 3+ es casi del mismo tamaño que Ca 2+ y más altamente cargada. Con una mayor relación carga/radio y un tamaño similar, La 3+ debe unirse firmemente a un sitio de Ca 2+ y ser el reemplazo más efectivo para Ca 2+. El orden es F − << Na + << Pb 2+ ~ Sr 2+ ~ Eu 2+ < La 3+.
Ejercicio
El radio iónico de K + es de 138pm. Organizar los siguientes iones en orden de afinidad creciente por un sitio de unión K + en una enzima (los números entre paréntesis son radios iónicos): Na + (102pm), Rb + (152pm), Ba 2+ (135pm), Cl − (181pm) y Tl + (150pm).
Respuesta Cl − << Na + < Tl + ~ Rb + < Ba 2+
Resumen
Los hidruros covalentes en los que el hidrógeno está unido al oxígeno, nitrógeno o azufre son moléculas polares e hidrofílicas que forman enlaces de hidrógeno y experimentan reacciones ácido-base. Las interacciones de enlaces de hidrógeno son cruciales para estabilizar la estructura de las proteínas y el ADN y permiten duplicar la información genética. Las interacciones de enlaces de hidrógeno en el agua y el hielo también permiten que la vida exista en nuestro planeta. Los metales del grupo 1 y del grupo 2 presentes en los organismos son macrominerales, los cuales son componentes importantes de los fluidos intracelulares y extracelulares. Pequeños cambios en la concentración celular de un ion metálico pueden tener un impacto significativo en las funciones biológicas. Los iones metálicos se transportan selectivamente a través de las membranas celulares mediante bombas de iones, que unen iones en función de su carga y radio. Los ionóforos, muchos de los cuales son potentes antibióticos, facilitan el transporte de iones metálicos a través de las membranas.
Llave para llevar
- Entre sus múltiples funciones en biología, los elementos del bloque s permiten duplicar la información genética y son componentes importantes de los fluidos intracelulares y extracelulares.
Problemas conceptuales
-
Explicar las propiedades termoquímicas del agua en términos de sus interacciones de unión intermolecular. ¿Cómo afecta esto a los patrones climáticos globales?
-
De las tres clases de hidruros, ¿cuál es (son) bioquímicamente significativos? ¿Cómo contabilizas esto?
-
Muchas proteínas se degradan y se vuelven infuncionales cuando se calientan por encima de cierta temperatura, a pesar de que las moléculas de proteína individuales no experimentan un cambio químico distinto. Proponer una explicación para esta observación.
-
Los Ángeles tiene un clima moderado durante todo el año, con temperaturas promedio entre 57°F y 70°F. En contraste, Palm Springs, que está a solo 100 millas tierra adentro, tiene temperaturas promedio entre 55°F y 95°F. Explique la diferencia en los rangos de temperatura promedio entre las dos ciudades.
-
Aunque todos los iones del grupo 1 tienen la misma carga (+1), los iones Na + y K + se transportan selectivamente a través de las membranas celulares. ¿Qué estrategia emplean los organismos para discriminar entre estos dos cationes?
Estructura y Reactividad
-
Una muestra de 0.156 g de una sal de cloruro de un metal alcalinotérreo se disuelve en agua suficiente para hacer 20.5 mL de solución. Si esta solución tiene una presión osmótica de 2.68 atm a 25°C, ¿cuál es la identidad del metal alcalinotérreo?
-
La capacidad de amortiguación térmica del agua es una de las razones por las que el cuerpo humano es capaz de soportar una amplia gama de temperaturas. ¿Cuánto calor (en kilojulios) se requiere para elevar la temperatura de un humano de 70.0 kg de 37.0°C a 38.0°C? Supongamos que el 70% de la masa del cuerpo es agua y que los fluidos corporales tienen el mismo calor específico que el agua.
-
Durante la enfermedad, la temperatura corporal puede aumentar en más de 2°C. Una pieza del folclore es que debes “alimentar con fiebre”. Utilizando los datos del Cuadro 8.7.2, ¿cuántos muslos de pollo fritos necesitaría comer una persona de 70.0 kg para generar un cambio de 2.0°C en la temperatura corporal? Supongamos lo siguiente: existe una conversión completa del contenido calórico del pollo a energía térmica, el 70% de la masa del cuerpo se debe únicamente al agua, y los fluidos corporales tienen el mismo calor específico que el agua.
-
Los enlaces de hidrógeno son en parte responsables de la alta entalpía de vaporización del agua (Δ H vap = 43.99 kJ/mol a 25°C), lo que contribuye a enfriar el cuerpo durante el ejercicio. Supongamos que un corredor de 50.0 kg produce 20.0 g de transpiración durante una carrera, y toda la transpiración se convierte en vapor de agua a 37.0°C. ¿Qué cantidad de calor (en julios) se elimina de la piel del corredor si la transpiración consiste solo en agua?
Contestar
-
Ba
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern



