20.5: Los Metales Alcalinotérreos (Grupo 2)
- Page ID
- 78334
- Describir cómo aislar los metales alcalinotérreos.
- Estar familiarizado con las reacciones, compuestos y complejos de los metales alcalinotérreos.
Al igual que los metales alcalinos, los metales alcalinotérreos son tan reactivos que nunca se encuentran en forma elemental en la naturaleza. Debido a que forman +2 iones que tienen potenciales de reducción muy negativos, se necesitan grandes cantidades de energía para aislarlos de sus minerales. Cuatro de los seis elementos del grupo 2 —magnesio (Mg), calcio (Ca), estroncio (Sr) y bario (Ba )— fueron aislados por primera vez a principios del siglo XIX por Sir Humphry Davy, utilizando una técnica similar a la que utilizó para obtener los primeros metales alcalinos. Sin embargo, en contraste con los metales alcalinos, los compuestos de los metales alcalinotérreos habían sido reconocidos como únicos durante muchos siglos. De hecho, el nombre álcali proviene del árabe al-qili, que significa “cenizas”, que se sabía que neutralizaban los ácidos. Los alquimistas medievales encontraron que una porción de las cenizas se derretiría al calentarse, y estas sustancias fueron posteriormente identificadas como los carbonatos de sodio y potasio (\(M_2CO_3\)). Las cenizas que no se fundieron (sino que se disolvieron en ácido), originalmente llamadas tierras alcalinas, fueron posteriormente identificadas como los óxidos alcalinotérreos (MO). En 1808, Davy pudo obtener muestras puras de Mg, Ca, Sr y Ba por electrólisis de sus cloruros u óxidos.
El berilio (Be), el metal alcalinotérreo más ligero, fue obtenido por primera vez en 1828 por Friedrich Wöhler en Alemania y simultáneamente por Antoine Bussy en Francia. El método utilizado por ambos hombres fue la reducción del cloruro por el potente reductor “nuevo”, el potasio:
El radio fue descubierto en 1898 por Pierre y Marie Curie, quienes procesaron toneladas de residuos de minas de uranio para obtener alrededor de 120 mg de casi puro\(RaCl_2\). Marie Curie fue galardonada con el Premio Nobel de Química en 1911 por su descubrimiento. Sin embargo, debido a su baja abundancia y alta radiactividad, el radio tiene pocos usos.
Preparación de los Metales Alcalinotérreos
Los metales alcalinotérreos se producen para uso industrial por reducción electrolítica de sus cloruros fundidos, como se indica en esta ecuación para el calcio:
\[CaCl_{2\;(l)} \rightarrow Ca_{(l)} + Cl_{2\;(g)} \label{Eq2}\]
Los cloruros metálicos del grupo 2 se obtienen de diversas fuentes. Por ejemplo,\(BeCl_2\) se produce al reaccionar\(HCl\) con berilia (\(BeO\)), que se obtiene de la piedra semipreciosa berilo\([Be_3Al_2(SiO_3)_6]\).

También se pueden utilizar reductores químicos para obtener los elementos del grupo 2. Por ejemplo, el magnesio se produce a gran escala calentando una forma de piedra caliza llamada dolomita (CaCo 3 ·MgCO 3) con una aleación barata de hierro/silicio a 1150°C. Inicialmente\(CO_2\) se libera, dejando atrás una mezcla de\(CaO\) y MgO; Mg 2 + es luego reducido:
\[2CaO·MgO_{(s)} + Fe/Si_{(s)} \rightarrow 2Mg(l) + Ca_2SiO_{4\;(s)} + Fe(s) \label{Eq3}\]
Una fuente temprana de magnesio fue un mineral llamado magnesita (\(MgCO_3\)) del distrito del norte de Grecia llamado Magnesia. El estroncio se obtuvo de la estrontianita (\(SrCO_3\)) encontrada en una mina de plomo en la ciudad de Strontian en Escocia. Los metales alcalinotérreos son algo más fáciles de aislar de sus minerales, en comparación con los metales alcalinos, debido a que su carbonato y algunas sales de sulfato e hidróxido son insolubles.

Propiedades Generales de los Metales Alcalinotérreos
Varias propiedades importantes de los metales alcalinotérreos se resumen en la Tabla\(\PageIndex{1}\). Aunque muchas de estas propiedades son similares a las de los metales alcalinos (Cuadro\(\PageIndex{1}\)), ciertas diferencias clave son atribuibles a las diferencias en las configuraciones de electrones de valencia de los dos grupos (ns 2 para los metales alcalinotérreos versus ns 1 para los metales alcalinos).
| Berilio | Magnesio | Calcio | Estroncio | Bario | Radio | |
|---|---|---|---|---|---|---|
| *Los valores citados son para iones de seis coordenadas excepto para Be 2 +, para lo cual se da el valor para el ion de cuatro coordenadas. | ||||||
| símbolo atómico | Be | Mg | Ca | Sr | Ba | Ra |
| número atómico | 4 | 12 | 20 | 38 | 56 | 88 |
| masa atómica | 9.01 | 24.31 | 40.08 | 87.62 | 137.33 | 226 |
| configuración de electrones de valencia | 2s 2 | 3s 2 | 4s 2 | 5s 2 | 6s 2 | 7s 2 |
| punto de fusión/punto de ebullición (°C) | 1287/2471 | 650/1090 | 842/1484 | 777/1382 | 727/1897 | 700/— |
| densidad (g/cm 3) a 25°C | 1.85 | 1.74 | 1.54 | 2.64 | 3.62 | ~5 |
| radio atómico (pm) | 112 | 145 | 194 | 219 | 253 | — |
| primera energía de ionización (kJ/mol) | 900 | 738 | 590 | 549 | 503 | — |
| estado de oxidación más común | +2 | +2 | +2 | +2 | +2 | +2 |
| radio iónico (pm) * | 45 | 72 | 100 | 118 | 135 | — |
| afinidad electrónica (kJ/mol) | ≥ 0 | ≥ 0 | −2 | −5 | −14 | — |
| electronegatividad | 1.6 | 1.3 | 1.0 | 1.0 | 0.9 | 0.9 |
| potencial de electrodo estándar (E°, V) | −1.85 | −2.37 | −2.87 | −2.90 | −2.91 | −2.8 |
| producto de reacción con O 2 | BeO | MgO | CaO | SRo | BaO 2 | — |
| tipo de óxido | anfóteros | débilmente básico | básico | básico | básico | — |
| producto de reacción con N 2 | ninguno | Mg 3 N 2 | Ca 3 N 2 | Sr 3 N 2 | Ba 3 N 2 | — |
| producto de reacción con X 2 | BeX 2 | MGx 2 | CAx 2 | SRx 2 | BAx 2 | — |
| producto de reacción con H 2 | ninguno | MgH 2 | CaH 2 | SRh 2 | BaH 2 | — |
Al igual que con los metales alcalinos, los radios atómicos e iónicos de los metales alcalinotérreos aumentan suavemente de Be a Ba, y las energías de ionización disminuyen. Como es de esperar, la primera energía de ionización de un metal alcalinotérreo, con una configuración de electrones de valencia ns 2, es siempre significativamente mayor que la del metal alcalino inmediatamente anterior a él. Los elementos del grupo 2 sí presentan algunas anomalías, sin embargo. Por ejemplo, la densidad de Ca es menor que la de Be y Mg, los dos miembros más ligeros del grupo, y Mg tiene los puntos de fusión y ebullición más bajos. A diferencia de los metales alcalinos, el metal alcalinotérreo más pesado (Ba) es el reductor más fuerte, y el más ligero (Be) es el más débil. Los potenciales de electrodo estándar de Ca y Sr no son muy diferentes de los de Ba, lo que indica que las tendencias opuestas en energías de ionización y energías de hidratación son de aproximadamente la misma importancia.
Una diferencia importante entre los elementos del grupo 1 y el grupo 2 son sus afinidades electrónicas. Con sus orbitales ns medio llenos, los metales alcalinos tienen una afinidad significativa por un electrón adicional. En contraste, los metales alcalinotérreos generalmente tienen poca o ninguna tendencia a aceptar un electrón adicional porque sus orbitales de valencia ns ya están llenos; un electrón agregado tendría que ocupar uno de los orbitales np vacantes, que son mucho más altos en energía.
Reacciones y Compuestos de los Metales Alcalinotérreos
Con sus bajas energías de ionización primera y segunda, los elementos del grupo 2 forman casi exclusivamente compuestos iónicos que contienen iones M 2 +. Sin embargo, como era de esperar, el elemento más ligero (Be), con su mayor energía de ionización y su pequeño tamaño, forma compuestos que son en gran parte covalentes. Algunos compuestos de Mg 2 + también tienen un carácter covalente significativo. De ahí que los compuestos organometálicos como los discutidos para Li en el grupo 1 también son importantes para Be y Mg en el grupo 2.
Los elementos del grupo 2 forman casi exclusivamente compuestos iónicos que contienen iones M 2 +.
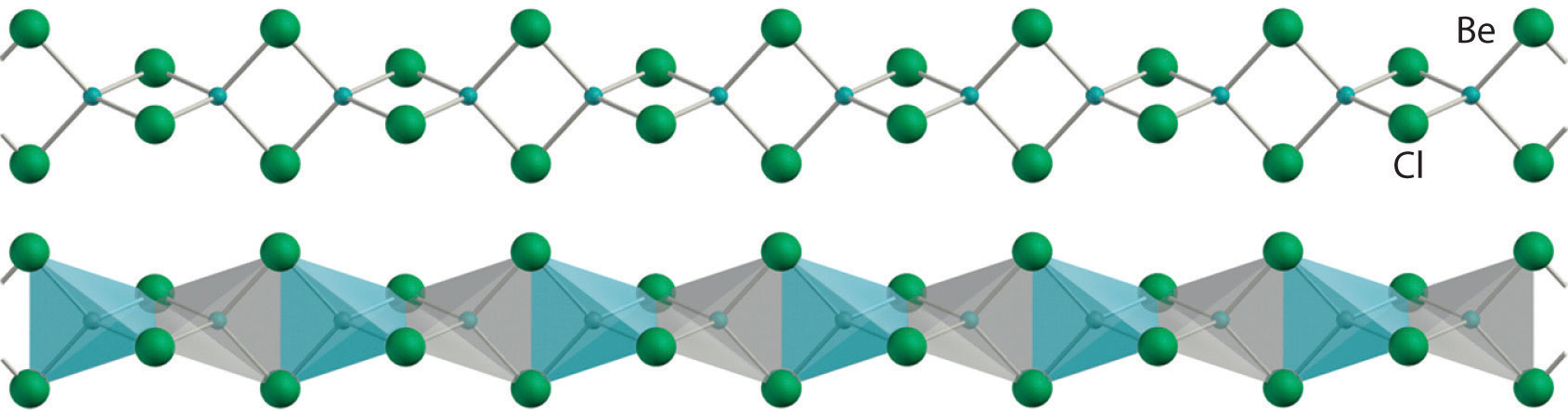
Todos los metales alcalinotérreos reaccionan vigorosamente con los halógenos (grupo 17) para formar los haluros correspondientes (MX 2). A excepción de los haluros de berilio, todos estos compuestos son principalmente de naturaleza iónica, conteniendo el catión M 2 + y dos aniones X −. Los haluros de berilio, con propiedades más típicas de los compuestos covalentes, tienen una estructura polimérica puenteada con haluros en estado sólido, como se muestra para BeCl 2. Estos compuestos son volátiles, produciendo vapores que contienen las moléculas lineales X—Be—X predichas por el modelo de repulsión de pares de electrones de capa de valencia (VSEPR). Como se esperaba para compuestos con solo cuatro electrones de valencia alrededor del átomo central, los haluros de berilio son potentes ácidos de Lewis. Reaccionan fácilmente con bases de Lewis, tales como éteres, para formar aductos tetraédricos en los que el berilio central está rodeado por un octeto de electrones:
\[ BeCl_{2(s)} + 2(CH_3CH_2)_2O_{(l)} \rightarrow BeCl_2[O(CH_2CH_3)_2]_{2(soln)} \label{Eq4}\]
Debido a su mayor energía de ionización y pequeño tamaño, tanto Be como Mg forman compuestos organometálicos.
Las reacciones de los metales alcalinotérreos con oxígeno son menos complejas que las de los metales alcalinos. Todos los elementos del grupo 2 excepto el bario reaccionan directamente con el oxígeno para formar el óxido simple MO. El bario forma peróxido de bario (BaO 2) porque el ion O 2 2− más grande es más capaz de separar los iones grandes de Ba 2 + en la red cristalina. En la práctica, solo BeO se prepara por reacción directa con oxígeno, y esta reacción requiere Be finamente dividido y altas temperaturas porque Be es relativamente inerte. Los otros óxidos alcalinotérreos se preparan generalmente mediante la descomposición térmica de sales de carbonato:
\[\mathrm{MCO_3(s)}\xrightarrow\Delta\mathrm{MO(s)}+\mathrm{CO_2(g)} \label{Eq5}\]
Las reacciones de los metales alcalinotérreos con los calcógenos más pesados (Y) son similares a las de los metales alcalinos. Cuando los reactivos están presentes en una relación 1:1, se forman los calcogenidos binarios (MY); a menores proporciones de M:Y, se forman sales que contienen iones policalcogenuro (Y n 2−).
Al revés de la Ecuación\(\ref{Eq5}\), los óxidos de Ca, Sr y Ba reaccionan con CO 2 para regenerar el carbonato. A excepción del BeO, que tiene un carácter covalente significativo y por lo tanto es anfótero, todos los óxidos alcalinotérreos son básicos. Así reaccionan con agua para formar los hidróxidos—M (OH) 2:
\[MO_{(s)} + H_2O_{(l)} \rightarrow M^{2+}_{(aq)} + 2OH^−_{(aq)} \label{Eq6}\]
y se disuelven en ácido acuoso. Los hidróxidos de los metales alcalinotérreos más ligeros son insolubles en agua, pero su solubilidad aumenta a medida que aumenta el número atómico del metal. Debido a que BeO y MgO son mucho más inertes que los otros óxidos del grupo 2, se utilizan como materiales refractarios en aplicaciones que involucran altas temperaturas y tensión mecánica. Por ejemplo, se utiliza MgO (punto de fusión = 2825°C) para recubrir los elementos calefactores en rangos eléctricos.
Los carbonatos de los metales alcalinotérreos también reaccionan con ácido acuoso para dar CO 2 y H 2 O:
\[MCO_{3(s)} + 2H^+_{(aq)} \rightarrow M^{2+}_{(aq)} + CO_{2(g)} + H_2O_{(l)} \label{Eq7}\]
La reacción en la Ecuación\(\ref{Eq7}\) es la base de los antiácidos que contienen MCO 3, que se utiliza para neutralizar el exceso de ácido estomacal.
La tendencia en las reactividades de los metales alcalinotérreos con nitrógeno es la opuesta a la observada para los metales alcalinos. Sólo el elemento más ligero (Be) no reacciona fácilmente con N 2 para formar el nitruro (M 3 N 2), aunque el Be finamente dividido reaccionará a altas temperaturas. La mayor energía reticular debido a los iones M 2 + y N 3− altamente cargados es aparentemente suficiente para superar la inercia química de la molécula de N 2, con su enlace N=N. De igual manera, todos los metales alcalinotérreos reaccionan con el grupo más pesado 15 elementos para formar compuestos binarios como fosfuros y arsenidos con la fórmula general M 3 Z 2.
Las energías de red más altas hacen que los metales alcalinotérreos sean más reactivos que los metales alcalinos hacia los elementos del grupo 15.
Cuando se calientan, todos los metales alcalinotérreos, excepto el berilio, reaccionan directamente con el carbono para formar carburos iónicos con la fórmula general MC 2. El carburo alcalinotérreo más importante es el carburo de calcio (CaC 2), que reacciona fácilmente con el agua para producir acetileno. Durante muchos años, esta reacción fue la principal fuente de acetileno para soldadura y lámparas en los cascos de los mineros. En contraste, el berilio reacciona con el carbono elemental para formar Be 2 C, que formalmente contiene el ion C 4− (aunque el compuesto es covalente). Consistente con esta formulación, la reacción de Be 2 C con agua o ácido acuoso produce metano:
\[Be_2C_{(s)} + 4H_2O_{(l)} \rightarrow 2Be(OH)_{2(s)} + CH_{4(g)} \label{Eq8}\]
El berilio no reacciona con hidrógeno excepto a altas temperaturas (1500°C), aunque BeH 2 se puede preparar a temperaturas más bajas por vía indirecta. Todos los metales alcalinotérreos más pesados (Mg a Ba) reaccionan directamente con hidrógeno para producir los hidruros binarios (MH 2). Los hidruros de los metales alcalinotérreos más pesados son iónicos, pero tanto BeH 2 como MgH 2 tienen estructuras poliméricas que reflejan un carácter covalente significativo. Todos los hidruros alcalinotérreos son buenos agentes reductores que reaccionan rápidamente con agua o ácido acuoso para producir hidrógeno gaseoso:
\[CaH_{2(s)} + 2H_2O_{(l)} \rightarrow Ca(OH)_{2(s)} + 2H_{2(g)} \label{Eq9} \]
Al igual que los metales alcalinos, los metales alcalinotérreos más pesados son suficientemente electropositivos para disolverse en amoníaco líquido. En este caso, sin embargo, se forman dos electrones solvatados por átomo de metal, y no se conocen equilibrios que involucren dímeros metálicos o aniones metálicos. Además, al igual que los metales alcalinos, los metales alcalinotérreos forman una amplia variedad de sales iónicas simples con oxoaniones, como carbonato, sulfato y nitrato. Las sales de nitrato tienden a ser solubles, pero los carbonatos y sulfatos de los metales alcalinotérreos más pesados son bastante insolubles debido a la mayor energía reticular debido al catión y anión doblemente cargados. La solubilidad de los carbonatos y sulfatos disminuye rápidamente en el grupo debido a que las energías de hidratación disminuyen con el aumento del tamaño del catión.
La solubilidad de los carbonatos y sulfatos alcalinotérreos disminuye en el grupo debido a que las energías de hidratación disminuyen.
Complejos de los Metales Alcalinotérreos
Debido a su mayor carga positiva (+2) y radios iónicos más pequeños, los metales alcalinotérreos tienen una tendencia mucho mayor a formar complejos con bases de Lewis que los metales alcalinos. Esta tendencia es más importante para el catión más ligero (Be 2 +) y disminuye rápidamente con el radio creciente del ion metálico.
Los metales alcalinotérreos tienen una tendencia sustancialmente mayor a formar complejos con bases de Lewis que los metales alcalinos.
La química de Be 2 + está dominada por su comportamiento como ácido de Lewis, formando complejos con bases de Lewis que producen un octeto de electrones alrededor del berilio. Por ejemplo, las sales Be 2 + se disuelven en agua para formar soluciones ácidas que contienen el ion tetraédrico [Be (H 2 O) 4] 2+. Debido a su alta relación carga-radio, el ion Be 2 + polariza las moléculas de agua coordinadas, aumentando así su acidez:
\[ [Be(H_2O)_4]^{2+}_{(aq)} \rightarrow [Be(H_2O)_3(OH)]^+_{(aq)} + H^+_{(aq)} \label{Eq10}\]
De igual manera, en presencia de una base fuerte, el berilio y sus sales forman el complejo hidroxo tetraédrico: [Be (OH) 4] 2−. De ahí que el óxido de berilio sea anfótero. El berilio también forma un complejo de fluoruro tetraédrico muy estable: [BeF 4] 2−. Recordemos que los haluros de berilio se comportan como ácidos de Lewis al formar aductos con bases de Lewis (Ecuación\(\ref{Eq4}\)).
Los metales alcalinotérreos más pesados también forman complejos, pero generalmente con un número de coordinación de 6 o superior. La formación de complejos es lo más importante para los cationes más pequeños (Mg 2 + y Ca 2 +). Así, las soluciones acuosas de Mg 2 + contienen el ion octaédrico [Mg (H 2 O) 6] 2+. Al igual que los metales alcalinos, los metales alcalinotérreos forman complejos con ligandos cíclicos neutros como los éteres corona y criptandos discutidos en la Sección 21.3.
Compuestos organometálicos que contienen elementos del grupo 2
Al igual que los metales alcalinos, los metales alcalinotérreos más ligeros (Be y Mg) forman los enlaces más covalentes con el carbono, y forman los compuestos organometálicos más estables. Los compuestos organometálicos de magnesio con la fórmula RMGx, donde R es un grupo alquilo o arilo y X es un halógeno, se denominan universalmente reactivos de Grignard, después de Victor Grignard (1871-1935), el químico francés que los descubrió. Los reactivos de Grignard se pueden usar para sintetizar diversos compuestos orgánicos, tales como alcoholes, aldehídos, cetonas, ácidos carboxílicos, ésteres, tioles y aminas.
Usos de los metales alcalinotérreos
El magnesio elemental es el único metal alcalinotérreo que se produce a gran escala (aproximadamente 5 × 10 5 tn al año). Su baja densidad (1.74 g/cm 3 frente a 7.87 g/cm 3 para hierro y 2.70 g/cm 3 para aluminio) lo convierte en un componente importante de las aleaciones metálicas ligeras utilizadas en bastidores de aviones y partes de motores de aviones y automóviles (Figura\(\PageIndex{1}\)). La mayoría del aluminio comercial en realidad contiene aproximadamente 5% de magnesio para mejorar su resistencia a la corrosión y sus propiedades mecánicas. El magnesio elemental también sirve como un reductor económico y potente para la producción de una serie de metales, incluyendo titanio, circonio, uranio e incluso berilio, como se muestra en la siguiente ecuación:
\[TiCl_{4\;(l)} + 2Mg(s) \rightarrow Ti_{(s)} + 2MgCl_{2\;(s)} \label{11}\]
El único otro alcalinotérreo que es ampliamente utilizado como metal es el berilio, el cual es extremadamente tóxico. La ingestión de berilio o la exposición al polvo que contiene berilio provoca un síndrome llamado beriliosis, caracterizado por una inflamación severa de las vías respiratorias u otros tejidos. Un pequeño porcentaje de berilio aumenta drásticamente la resistencia de las aleaciones de cobre o níquel, que se utilizan en herramientas no magnéticas que no producen chispas (como llaves y destornilladores), resortes de cámara y contactos eléctricos. El bajo número atómico de berilio le da una tendencia muy baja a absorber rayos X y lo hace especialmente adecuado para aplicaciones que involucran radiactividad. Tanto el Be elemental como el BeO, que es una cerámica de alta temperatura, se utilizan en reactores nucleares, y las ventanas de todos los tubos y fuentes de rayos X están hechas de lámina de berilio.

Millones de toneladas de compuestos de calcio se utilizan cada año. Como se discutió en capítulos anteriores, el CaCl 2 se utiliza como “sal vial” para bajar el punto de congelación del agua en las carreteras en temperaturas frías. Además, CaCo 3 es un componente importante del cemento y un ingrediente en muchos antiácidos comerciales. La “cal viva” (CaO), producida calentando CaCo 3 (Ecuación\(\ref{Eq5}\)), se utiliza en la industria siderúrgica para eliminar impurezas de óxido, fabricar muchos tipos de vidrio y neutralizar suelos ácidos. Otras aplicaciones de los compuestos del grupo 2 descritas en capítulos anteriores incluyen el uso médico de BaSO 4 en “batidos de bario” para identificar problemas digestivos mediante rayos X y el uso de diversos compuestos alcalinotérreos para producir los colores brillantes que se ven en los fuegos artificiales.
Para cada aplicación, elija la sustancia más adecuada en función de las propiedades y reactividades de los metales alcalinotérreos y sus compuestos. Explica tu elección en cada caso. Utilice cualquier tabla que necesite para tomar su decisión, como valores K sp (Tabla 17.1), energías de celosía (Tabla 8.1) y energías de banda prohibida.
- Para neutralizar el exceso de ácido estomacal que causa indigestión, ¿usarías BeCo 3, CaCo 3 o BaCo 3?
- Para eliminar el CO 2 de la atmósfera en una cápsula espacial, ¿usarías MgO, CaO o BaO?
- Como componente de la aleación en un electrodo de bujía automotriz, ¿usaría Be, Ca o Ba?
Dado: aplicación y metales alcalinotérreos seleccionados
Preguntado por: sustancia más apropiada para cada aplicación
Estrategia:
Con base en la discusión en esta sección y cualquier información relevante en otra parte de este libro, determinar qué sustancia es la más adecuada para el uso indicado.
Solución
- Todos los carbonatos alcalinotérreos neutralizarán una solución ácida por Ecuación\(\ref{Eq7}\). Debido a que el berilio y sus sales son tóxicas, sin embargo, el BeCo 3 no puede usarse como antiácido. De las opciones restantes, CaCo 3 es algo más soluble que BaCo 3 (según los valores de K sp en la Tabla 17.1), lo que sugiere que actuará con mayor rapidez. Además, la masa de fórmula de CaCo 3 es 100.1 amu, mientras que la de BaCo 3 es casi el doble de grande. Por lo tanto, neutralizar una cantidad dada de ácido requeriría el doble de masa de BaCo 3 en comparación con CaCo 3. Además, la reacción de BaCo 3 con ácido produce una solución que contiene iones Ba 2 +, los cuales son tóxicos. (Ba 2 + es un estimulante que puede causar fibrilación ventricular del corazón). Finalmente, CaCo 3 se produce a gran escala, por lo que CaCo 3 es probable que sea significativamente menos costoso que cualquier compuesto de bario. En consecuencia, CaCo 3 es la mejor opción para un antiácido.
- Esta aplicación implica hacer reaccionar CO 2 con un óxido alcalinotérreo para formar el carbonato, que es el reverso de la reacción de descomposición térmica en la que MCO 3 se descompone en CO 2 y el óxido metálico MO (Ecuación\(\ref{Eq5}\)). Debido a sus mayores energías reticulares, los metales alcalinotérreos más pequeños deben formar los óxidos más estables. De ahí que sus carbonatos deben descomponerse a las temperaturas más bajas, como se observa (BeCo 3 se descompone a 100°C; BaCo 3 a 1360°C). Si el carbonato con el metal alcalinotérreo más pequeño se descompone más fácilmente, esperaríamos que la reacción inversa (formación de un carbonato) ocurra más fácilmente con el catión metálico más grande (Ba 2 +). De ahí que BaO sea la mejor opción.
- La aleación en un electrodo de bujía debe liberar electrones y promover su flujo a través del espacio entre los electrodos a altas temperaturas. De los tres metales enumerados, Ba tiene la energía de ionización más baja y, por lo tanto, libera electrones más fácilmente. Calentar una aleación que contiene bario a altas temperaturas provocará cierta ionización, proporcionando el paso inicial en la formación de una chispa.
¿Cuál de los metales alcalinotérreos indicados o sus compuestos es el más adecuado para cada aplicación?
- agente de secado para eliminar el agua de la atmósfera—CaCl 2, MgSO 4 o BaF 2
- eliminación de depósitos de incrustaciones (principalmente CaCO 3) en tuberías de agua: HCl (ac) o H 2 SO 4 (aq)
- eliminación de trazas de N 2 del gas argón purificado: Be, Ca o Ba
Contestar
- MgSO 4
- HCl
- Ba
Predecir los productos de cada reacción y luego equilibrar cada ecuación química.
- CaO (s) + HCl (g) →
- MgO (s) + exceso de OH − (aq) →
- \(\mathrm{CaH_2(s)}+\mathrm{TiO_2(s)}\xrightarrow\Delta\)
Dado: reactivos
Preguntado por: productos y ecuación química equilibrada
Estrategia:
Siga el procedimiento dado en el Ejemplo 3 para predecir los productos de cada reacción y luego equilibrar cada ecuación química.
Solución
- Un HCl gaseoso es un ácido, y el CaO es un óxido básico que contiene el ion O 2−. Por lo tanto, esta es una reacción ácido-base que produce CaCl 2 y H 2 O.
B La ecuación química equilibrada es\[CaO_{(s)} + 2HCl_{(g)} → CaCl_{2(aq)} + H_2O_{(l)}\]
- Un óxido de magnesio es un óxido básico, por lo que puede reaccionar con agua para dar una solución básica o disolverse en una solución ácida. El ion hidróxido también es una base. Debido a que tenemos dos bases pero no ácido, una reacción ácido-base es imposible. No es probable una reacción redox porque el MgO no es ni un buen oxidante ni un buen reductor.
B Concluimos que no se produce ninguna reacción.
- A Debido a que CaH 2 contiene el ion hidruro (H −), es un buen reductor. También es una base fuerte porque los iones H − pueden reaccionar con iones H + para formar H 2. El óxido de titanio (TiO 2) es un óxido metálico que contiene el metal en su estado de oxidación más alto (+4 para un metal del grupo 4); puede actuar como oxidante aceptando electrones. Por lo tanto, predecimos que ocurrirá una reacción redox, en la que H − se oxida y Ti 4 + se reduce. El producto de reducción más probable es el titanio metálico, pero ¿cuál es el producto de oxidación? El oxígeno debe aparecer en los productos, y tanto el CaO como el H 2 O son compuestos estables. El estado de oxidación +1 del hidrógeno en H 2 O es un signo de que se ha producido una oxidación (2H − → 2H + + 4e −).
B La ecuación química equilibrada es
\(\mathrm{CaH_2(s)}+\mathrm{TiO_2(s)}\xrightarrow\Delta\mathrm{Ti(s)}+\mathrm{CaO(s)}+\mathrm{H_2O(l)}\)
También podríamos escribir los productos como Ti (s) + Ca (OH) 2 (s).
Predecir los productos de cada reacción y luego equilibrar cada ecuación química.
- \(\mathrm{BeCl_2(s)}+\mathrm{Mg(s)}\xrightarrow\Delta\)
- BaCl 2 (aq) + Na 2 SO 4 (aq) →
- BeO (s) + OH − (aq) + H 2 O (l) →
Contestar
- \(\mathrm{BeCl_2(s)}+\mathrm{Mg(s)}\xrightarrow\Delta\mathrm{Be(s)}+ \mathrm{MgCl_2(s)}\)
- BaCl 2 (aq) + Na 2 SO 4 (aq) → BaSO 4 (s) + 2NaCl (aq)
- BeO (s) + 2OH − (aq) + H 2 O (l) → [Ser (OH) 4] 2− (aq)
Resumen
Los elementos del grupo 2 forman casi exclusivamente compuestos iónicos que contienen el ion M 2 +, son más reactivos hacia los elementos del grupo 15 y tienen una mayor tendencia a formar complejos con bases de Lewis que los metales alcalinos. Las muestras puras de la mayoría de los metales alcalinotérreos se pueden obtener por electrólisis de los cloruros u óxidos. El berilio se obtuvo primero por la reducción de su cloruro; el cloruro de radio, que es radiactivo, se obtuvo a través de una serie de reacciones y separaciones. A diferencia de los metales alcalinos, los metales alcalinotérreos generalmente tienen poca o ninguna afinidad por un electrón agregado. Todos los metales alcalinotérreos reaccionan con los halógenos para producir los haluros correspondientes, con oxígeno para formar el óxido (excepto el bario, que forma el peróxido), y con los calcógenos más pesados para formar calcogenuros o iones policalcógenuros. Todos los óxidos excepto BeO reaccionan con CO 2 para formar carbonatos, que a su vez reaccionan con ácido para producir CO 2 y H 2 O. Excepto Be, todos los metales alcalinotérreos reaccionan con N 2 para formar nitruros, y todos reaccionan con carbono e hidrógeno para formar carburos e hidruros. Los metales alcalinotérreos se disuelven en amoníaco líquido para dar soluciones que contienen dos electrones solvatados por átomo de metal. Los metales alcalinotérreos tienen una mayor tendencia que los metales alcalinos a formar complejos con éteres corona, criptandos y otras bases de Lewis. Los compuestos organometálicos alcalinotérreos más importantes son los reactivos de Grignard (RMGx), los cuales se utilizan para sintetizar compuestos orgánicos.


