22.3: Metalurgia
- Page ID
- 78243
- Entender cómo se extraen los metales de sus minerales.
Muy pocos de los metales de transición se encuentran en la naturaleza como metales libres (por ejemplo, oro y plata). En consecuencia, casi todos los elementos metálicos deben aislarse de minerales de óxido metálico o sulfuro metálico. La metalurgia es el conjunto de procesos mediante los cuales los metales se extraen de sus minerales y se convierten en formas más útiles. La metalurgia consta de tres pasos generales:
- minando el mineral,
- separar y concentrar el metal o el compuesto que contiene metal, y
- reduciendo el mineral al metal.
A veces se requieren procesos adicionales para mejorar las propiedades mecánicas del metal o aumentar su pureza. Muchos minerales contienen concentraciones relativamente bajas del metal deseado; por ejemplo, los minerales de cobre que contienen incluso 1% de Cu en masa se consideran comercialmente útiles.
Después de que un mineral ha sido extraído, el primer paso en el procesamiento suele ser triturarlo porque la tasa de reacciones químicas aumenta dramáticamente con el aumento de la superficie. A continuación, se utiliza una de las tres estrategias generales para separar y concentrar el (los) compuesto (s) de interés: sedimentación y flotación, que se basan en diferencias de densidad entre el compuesto deseado e impurezas; pirometalurgia, que utiliza reducción química a altas temperaturas; e hidrometalurgia, que emplea reducción química o electroquímica de una solución acuosa del metal. También se pueden usar otros métodos que aprovechen las propiedades físicas o químicas inusuales de un compuesto en particular. Por ejemplo, los cristales de magnetita (Fe 3 O 4) son imanes diminutos pero bastante potentes; de hecho, la magnetita (también conocida como piedra magnética) se utilizó para hacer las primeras brújulas en China durante el siglo I a.C. Si un mineral triturado que contiene magnetita pasa a través de un poderoso imán, las partículas de Fe 3 O 4 son atraídas hacia los polos del imán, permitiendo que se separen fácilmente de otros minerales.
La metalurgia depende de la separación de un compuesto metálico de su mineral y la reducción al metal a alta temperatura (pirometalurgia) o en solución acuosa (hidrometalurgia).
La sedimentación y la flotación se han utilizado desde hace miles de años para separar partículas de metales densos como el oro, utilizando la técnica conocida como panning, en la que una muestra de grava o arena se arremolina en el agua en una sartén metálica poco profunda. Debido a que la densidad del oro (19.3 g/cm 3) es mucho mayor que la de la mayoría de los minerales de silicato (aproximadamente 2.5 g/cm 3), las partículas de silicato se asientan más lentamente y se pueden verter con el agua, dejando partículas densas de oro en el fondo de la sartén. Por el contrario, en la flotación, el compuesto de interés se hace flotar sobre una solución. El soplado de aire a través de una suspensión del mineral crudo en una mezcla de agua y un líquido orgánico, como el alquitrán de pino, produce una “espuma” que contiene partículas diminutas de sólidos hidrófobos, como sulfuros metálicos, mientras que más minerales de óxido hidrófilos permanecen suspendidos en la fase acuosa (Figura 23.3.1). Para hacer la separación más eficiente, se añaden pequeñas cantidades de un compuesto aniónico que contiene azufre, como Na + C 2 H 5 OCS 2 −; el aditivo se une a la superficie rica en azufre de las partículas de sulfuro metálico y hace que las partículas de sulfuro metálico aún más hidrofóbica. La espuma resultante está altamente enriquecida en el (los) sulfuro (s) metálico (s) deseado (s), que se puede eliminar simplemente mediante desnatado. Este método funciona incluso para compuestos tan densos como PbS (7.5 g/cm 3).

Figura 23.3.1: Flotación por Espuma. (a) Cuando se sopla aire a través de una mezcla de un mineral de sulfuro metálico finamente molido y agua, los sulfuros metálicos más hidrofóbicos forman una espuma que se puede eliminar fácilmente, permitiendo que se separen de óxidos metálicos y silicatos más hidrófilos. b) Una espuma que contiene sulfuros de metales preciosos se forma como subproducto durante la producción de níquel metálico. c) Se puede utilizar un aditivo aniónico de azufre con “colas” hidrofóbicas para mejorar el carácter hidrófobo de las partículas de sulfuro metálico, lo que hace que sean atraídas hacia la interfaz aire/agua en la espuma.
Pirometalurgia
En pirometalurgia, se calienta un mineral con un reductor para obtener el metal. Teóricamente, debería ser posible obtener prácticamente cualquier metal de su mineral utilizando coque, una forma económica de carbono crudo, como reductor. Un ejemplo de tal reacción es el siguiente:
\[\mathrm{CaO(s) + C(s)\xrightarrow{\Delta}Ca(l) + CO(g)} \tag{23.3.1}\]
Desafortunadamente, muchos de los primeros metales de transición, como el Ti, reaccionan con el carbono para formar carburos binarios estables. En consecuencia, se deben usar reductores más caros, como hidrógeno, aluminio, magnesio o calcio, para obtener estos metales. Muchos metales que ocurren naturalmente como sulfuros se pueden obtener calentando el sulfuro en aire, como se muestra para el plomo en la siguiente ecuación:
\[\mathrm{PbS(s) + O_2(g)\xrightarrow{\Delta}Pb(l) + SO_2(g)}\tag{23.3.2}\]
La reacción es conducida a su finalización por la formación de SO 2, un gas estable.
La pirometalurgia también se utiliza en las industrias del hierro y el acero. La reacción general para la producción de hierro en un alto horno es la siguiente:
\[\mathrm{Fe_2O_3(s) +3C(s)\xrightarrow{\Delta}2Fe(l) +3CO(g)} \tag{23.3.3}\]
El reductor real es CO, el cual reduce Fe 2 O 3 para dar Fe (l) y CO 2 (g); el CO 2 se vuelve a reducir a CO por reacción con exceso de carbono. A medida que el mineral, la cal y el coque caen en el horno (Figura 23.3.2), cualquier mineral de silicato en el mineral reacciona con la cal para producir una mezcla de silicatos de calcio de bajo punto de fusión llamada escoria, que flota sobre el hierro fundido. Luego se deja que el hierro fundido salga corriendo por el fondo del horno, dejando atrás la escoria. Originalmente, el hierro se recolectaba en albercas llamadas cerdos, que es el origen del nombre arrabio.

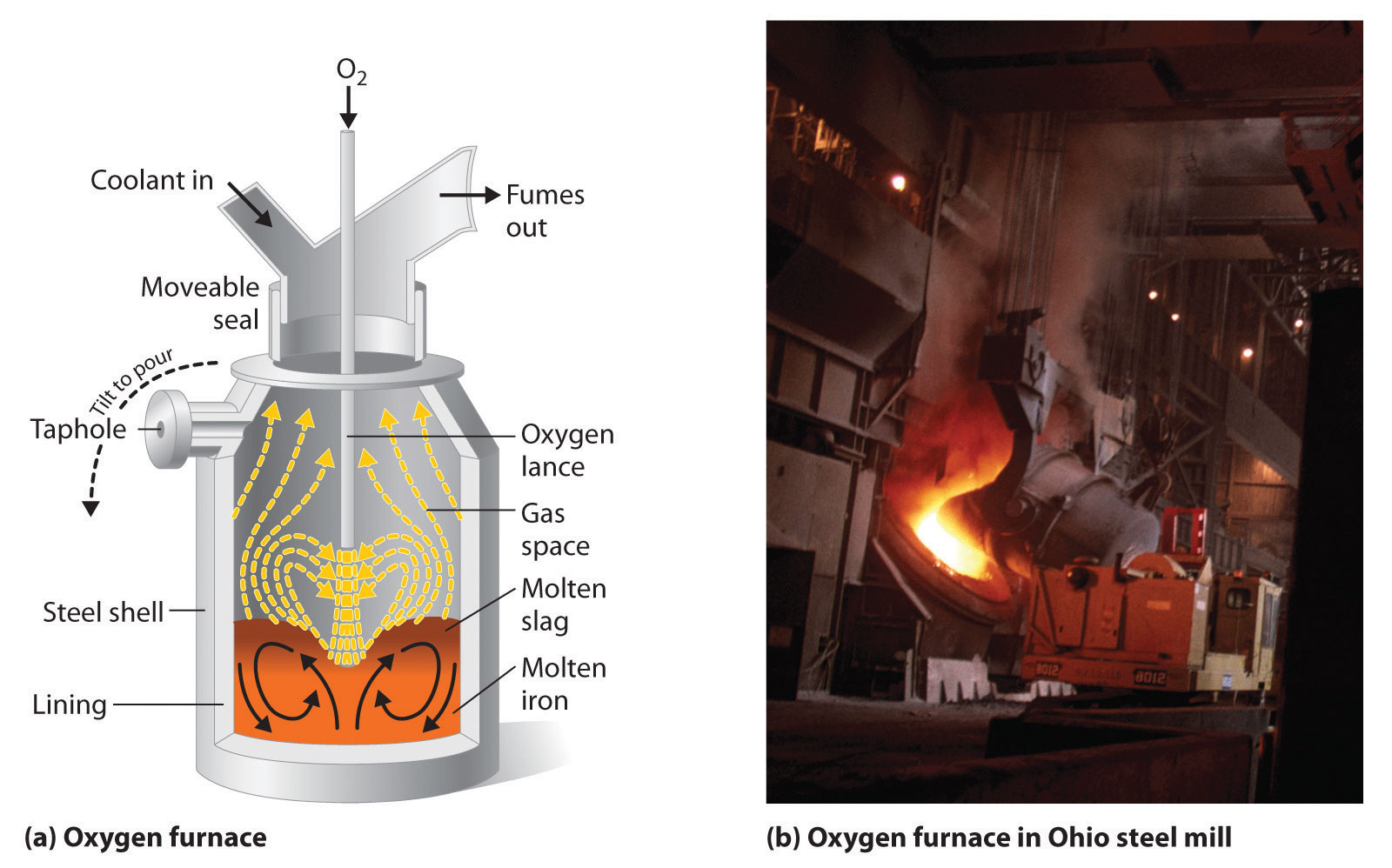
El hierro que se obtiene directamente de un alto horno tiene un punto de fusión indeseablemente bajo (aproximadamente 1100°C en lugar de 1539°C) porque contiene una gran cantidad de carbono disuelto. Contiene otras impurezas (como Si, S, P y Mn de contaminantes en el mineral de hierro que también se redujeron durante el procesamiento) que deben eliminarse porque hacen que el hierro sea quebradizo e inadecuado para la mayoría de las aplicaciones estructurales. En el proceso de Bessemer, el oxígeno es soplado a través del arrabio fundido para eliminar las impurezas por oxidación selectiva debido a que estas impurezas se oxidan más fácilmente que el hierro (Figura 23.3.3). En la etapa final de este proceso, se agregan pequeñas cantidades de otros metales a temperaturas específicas para producir acero con la combinación de propiedades deseada.
Hidrometalurgia
Los métodos más selectivos para separar metales de sus minerales se basan en la formación de complejos metálicos. Por ejemplo, el oro a menudo se encuentra como pequeñas escamas del metal, generalmente en asociación con depósitos de cuarzo o pirita. En esas circunstancias, el oro se extrae típicamente mediante lixiviación de cianuro, que forma un complejo estable de oro-cianuro— [Au (CN) 2] −:
\[ 4Au_{(s)} + 8NaCN_{(aq)} + O_{2(g)} + 2H_2O_{(l)} \rightarrow 4Na[Au(CN)_2]_{(aq)} + 4NaOH_{(aq)} \tag{23.3.4}\]
Se puede obtener oro prácticamente puro añadiendo zinc en polvo a la solución:
\[Zn_{(s)} + 2[Au(CN)_2]^−_{(aq)} \rightarrow [Zn(CN)_4]^{2−}_{(aq)} + 2Au_{(s)} \tag{23.3.5}\]
Un método relacionado, que se utiliza para separar Co 3 +, Ni 2 + y Cu + de Fe, Mn y Ti, se basa en la formación de complejos de amoníaco estables y solubles de iones de los metales de transición tardíos.
Supongamos que está trabajando en el laboratorio de química de una empresa minera que ha descubierto una nueva fuente de mineral de tungsteno que contiene aproximadamente 5% WS 2 en una matriz de granito (el granito es un mineral complejo de aluminosilicato). Se le ha pedido que describa un procedimiento económico para aislar WS 2 del mineral y luego convertirlo en tungsteno elemental en los pocos pasos posibles. ¿Qué recomendarías?
Dado: composición del mineral
Preguntado por: procedimiento para aislar sulfuro metálico
Estrategia:
Determinar qué método sería más efectivo para separar el sulfuro metálico del mineral. Luego determine el mejor método para reducir el metal al elemento puro.
Solución
Es necesario separar y concentrar el WS 2, convertirlo a una forma adecuada para que se pueda reducir al metal (si es necesario), y luego llevar a cabo la reducción. Debido a que el nuevo mineral es un sulfuro metálico binario, podría aprovechar la naturaleza hidrofílica de la mayoría de los sulfuros metálicos para separar WS 2 mediante flotación por espuma. Entonces, debido a que la mayoría de los sulfuros metálicos no se pueden reducir directamente al metal usando carbono, probablemente necesitará convertir WS 2 en un óxido para su posterior reducción. Un punto a considerar es si el óxido se puede reducir usando carbono porque muchos metales de transición reaccionan con el carbono para formar carburos estables. Aquí hay un posible procedimiento para producir tungsteno a partir de este nuevo mineral:
- Moler el mineral y separar WS 2 de la matriz de silicato por flotación.
- Convierta el WS 2 crudo en un óxido tostándolo al aire (debido a que W está en el grupo 6, anticipa que el tostado producirá WO 3, el óxido en el estado de oxidación más alto posible). La reacción también producirá SO 2, que tendrá que ser eliminado lavando los gases de escape para minimizar la contaminación ambiental.
- Reducir el óxido con gas hidrógeno a alta temperatura para evitar la formación de carburo:
Proponer un procedimiento económico para convertir un depósito mineral de silicato que contiene BaCo 3 en el metal puro de Ba.
Respuesta:
- Disolver la muestra que contiene carbonato de bario en HCl (ac) para dar Ba 2 + (ac), lo que permitirá eliminar los minerales de silicato insolubles por filtración.
- Precipitar el bario de la solución como BaCo 3 añadiendo Na 2 CO 3 sólido.
- Disolver el BaCo 3 sólido en HCl concentrado y eliminar el agua por evaporación para obtener BaCl 2 anhidro.
- Reducir el BaCl 2 fundido al metal por electrólisis.
Resumen
- Un metal se separa de su mineral y luego se aísla mediante pirometalurgia o hidrometalurgia o aprovechando las propiedades químicas o físicas inusuales de un compuesto en particular.
La conversión de metales de sus minerales a formas más útiles se llama metalurgia, la cual consta de tres etapas generales: minería, separación y concentración, y reducción. La sedimentación y la flotación son métodos de separación basados en diferencias de densidad, mientras que la pirometalurgia se basa en una reducción química a temperaturas elevadas, y la hidrometalurgia utiliza la reducción química o electroquímica de una solución acuosa. En pirometalurgia se debe utilizar un reductor que no forme compuestos estables con el metal de interés. En la hidrometalurgia, los metales se separan mediante la formación de complejos metálicos.
Problemas conceptuales
- El coque es un reductor abundante y económico que se utiliza para aislar metales de sus minerales. De Cr, Co, W, Cu, Ni, Os, Fe, Mn, La, y Hf, ¿que no pueden aislarse usando este reductor? ¿Por qué?
- La hidrometalurgia es el método preferido para separar los metales de transición tardía de sus minerales. ¿Qué tipos de ligandos son más efectivos en este proceso?
Contestar
- El coque no se puede usar como reductor para metales que forman carburos estables, como los metales de transición temprana (La, Hf y W).
Estructura y Reactividad
- El tantalio y el niobio se encuentran frecuentemente juntos en los minerales. Estos elementos pueden separarse de otros metales presentes por tratamiento con una solución de HF. Explique por qué se trata de una técnica de separación efectiva.
- Un mineral de cromo comercialmente importante es la cromita (FeCr 2 O 4), que es un análogo de la magnetita (Fe 3 O 4). Con base en lo que sabes sobre los estados de oxidación del hierro en la magnetita, predice los estados de oxidación de los iones metálicos en la cromita.
- El vanadio puro se obtiene reduciendo VCl 4 con H 2 o Mg o reduciendo V 2 O 5 con Ca. Escribe una ecuación química equilibrada para cada reacción. ¿Por qué no se utiliza carbono para la reducción?
- El manganeso es un aditivo importante en el acero por su reactividad con el oxígeno y el azufre, los cuales contribuyen a la fragilidad. Predecir los productos de reacción de Mn con estas especies.
- El diagrama de un alto horno en la Figura 23.3.2 ilustra varias características importantes de la reducción de Fe 2 O 3 a hierro. Escribe una ecuación química balanceada para cada paso del proceso descrito en la figura y da la ecuación general para la conversión. El oxígeno se sopla a través del producto final para eliminar las impurezas. ¿Por qué este paso no simplemente revierte el proceso y produce óxidos de hierro?
- El Zr Metálico es producido por el método Kroll, que utiliza Na como reductor. Escribir una ecuación química equilibrada para cada reacción involucrada en este proceso. El producto está frecuentemente contaminado con Hf. Proponer un método factible para separar los dos elementos.
- El compuesto Cr 2 O 3 es importante comercialmente; entre otras cosas, se utiliza como pigmento en pintura y como catalizador para la fabricación de butadieno. Escribe una ecuación química equilibrada para mostrar cómo producirías este compuesto a partir de
- metal de cromo.
- dicromato de amonio.
- CrCl 3 en una solución básica.
Contestar
\ xrightarrow {\ Delta}\ mathrm {V (s) +4HCl (g)}\\
&\ mathrm {vcl_4 (l) +2Mg (s)}
\ xrightarrow {\ Delta}\ mathrm {V (s) +2mgCL_2 (g)}\\
&\ mathrm {V_2O_5 (s) +5Ca (s)}
\ xrightarrow {\ Delta}\ mathrm {2 V (s) +5CaO (s)}\ end {align}\)
El carbono no se puede usar como reductor porque el vanadio forma carburos estables, como VC y VC 2.


