22.4: Compuestos de Coordinación
- Page ID
- 78244
- Conocer las estructuras más comunes observadas para los complejos metálicos.
- Predecir las estabilidades relativas de complejos metálicos con diferentes ligandos.
Una de las propiedades más importantes de los elementos metálicos es su capacidad para actuar como ácidos de Lewis que forman complejos con una variedad de bases de Lewis. Un complejo metálico consiste en un átomo o ion metálico central que está unido a uno o más ligandos (del latín ligare, que significa “unir”), que son iones o moléculas que contienen uno o más pares de electrones que pueden ser compartidos con el metal. Los complejos metálicos pueden ser neutros, como Co (NH 3) 3 Cl 3; cargados positivamente, como [Nd (H 2 O) 9] 3+; o cargados negativamente, como [UF 8] 4−. Los complejos metálicos cargados eléctricamente a veces se llaman iones complejos. Un compuesto de coordinación contiene uno o más complejos metálicos.
Los compuestos de coordinación son importantes por al menos tres razones. Primero, la mayoría de los elementos de la tabla periódica son metales, y casi todos los metales forman complejos, por lo que los complejos metálicos son una característica de la química de más de la mitad de los elementos. En segundo lugar, muchos catalizadores industriales son complejos metálicos, y dichos catalizadores son cada vez más importantes como una forma de controlar la reactividad. Por ejemplo, una mezcla de un complejo de titanio y un compuesto organometálico de aluminio es el catalizador utilizado para producir la mayoría de los artículos “plásticos” de polietileno y polipropileno que usamos todos los días. Finalmente, los complejos de metales de transición son esenciales en la bioquímica. Los ejemplos incluyen hemoglobina, un complejo de hierro que transporta oxígeno en nuestra sangre; citocromos, complejos de hierro que transfieren electrones en nuestras células; y complejos de Fe, Zn, Cu y Mo que son componentes cruciales de ciertas enzimas, los catalizadores de todas las reacciones biológicas. Los complejos metálicos son tan importantes en biología que consideramos el tema por separado en la Sección 23.6.
Historia de los Compuestos de Coordinación
Los compuestos de coordinación se conocen y utilizan desde la antigüedad; probablemente el más antiguo es el pigmento azul profundo llamado azul prusiano: KFe 2 (CN) 6. Sin embargo, la naturaleza química de estas sustancias no estaba clara por varias razones. Por ejemplo, se conocían muchos compuestos llamados “sales dobles”, como AlF 3·3KF, Fe (CN) 2·4KCN, y ZnCl 2 ·2CSCl, que eran combinaciones de sales simples en proporciones fijas y aparentemente arbitrarias. ¿Por qué debería existir AlF 3 ·3KF pero no AlF 3 ·4KF o AlF 3 ·2KF? Y ¿por qué una mezcla 3:1 KF:Alf 3 debería tener diferentes propiedades químicas y físicas que cualquiera de sus componentes? De igual manera, también se conocían aductos de sales metálicas con moléculas neutras como el amoníaco, por ejemplo, CoCl 3 ·6NH 3, que se preparó por primera vez antes de 1798. Al igual que las sales dobles, las composiciones de estos aductos exhibieron proporciones fijas y aparentemente arbitrarias de los componentes. Por ejemplo, CoCl 3·6NH 3, CoCl 3·5NH 3, CoCl 3·4NH 3 y CoCl 3·3NH 3 eran todos conocidos y tenían propiedades muy diferentes, pero a pesar de todos los intentos, los químicos no pudieron preparar CoCl 3·2NH 3 o CoCl 3 ·NH 3.

La Gran Ola Fuera de Kanagawa. La artista japonesa Katsushika Hokusai utilizó el azul prusiano para crear esta famosa xilografía.
Aunque la composición química de dichos compuestos se estableció fácilmente por los métodos analíticos existentes, su naturaleza química fue desconcertante y altamente controvertida. El principal problema era que se pensaba que lo que ahora llamamos valencia (es decir, el estado de oxidación) y el número de coordinación eran idénticos. Como resultado, se propusieron estructuras altamente inverosímiles (al menos a los ojos modernos) para tales compuestos, incluyendo el modelo “Chattanooga choo-choo” para CoCl 3·4NH 3 que se muestra aquí.

La teoría moderna de la química de coordinación se basa en gran medida en la obra de Alfred Werner (1866-1919; Premio Nobel de Química en 1913). En una serie de cuidadosos experimentos llevados a cabo a fines de la década de 1880 y principios de la década de 1890, examinó las propiedades de varias series de complejos de halogenuros metálicos con amoníaco. Por ejemplo, en ese momento se conocían cinco “aductos” diferentes de amoníaco con PtCl 4: PtCl 4 · n NH 3 (n = 2—6). Algunos de los datos originales de Werner sobre estos compuestos se muestran en la Tabla\(\PageIndex{1}\). La conductividad eléctrica de las soluciones acuosas de estos compuestos fue aproximadamente proporcional al número de iones formados por mol, mientras que el número de iones cloruro que pudieron precipitarse como AgCl después de agregar Ag + (ac) fue una medida del número de iones cloruro “libres” presentes. Por ejemplo, los datos de Werner sobre PTCl 4·6NH 3 en la Tabla\(\PageIndex{1}\) mostraron que todos los iones cloruro estaban presentes como cloruro libre. En contraste, PtcL 4·2NH 3 era una molécula neutra que no contenía iones cloruro libres.
Alfred Werner (1866—1919)
Werner, hijo de un obrero de fábrica, nació en Alsacia. Desarrolló un interés por la química a una edad temprana, e hizo sus primeros experimentos de investigación independientes a los 18 años. Mientras hacía su servicio militar en el sur de Alemania, asistió a una serie de conferencias de química, y posteriormente recibió su doctorado en la Universidad de Zúrich en Suiza, donde fue nombrado profesor de química a los 29 años. Ganó el Premio Nobel de Química en 1913 por su trabajo en compuestos de coordinación, que realizó como estudiante de posgrado y presentó por primera vez a los 26 años. Al parecer, Werner estaba tan obsesionado con resolver el enigma de la estructura de los compuestos de coordinación que su cerebro siguió trabajando en el problema incluso mientras estaba dormido. En 1891, cuando apenas tenía 25 años, se despertó a mitad de la noche y, en apenas unas horas, había sentado las bases para la química de coordinación moderna.
Tabla Datos de\(\PageIndex{1}\) Werner sobre Complejos de Amoníaco con PtCl 4
| Complejo | Conductividad (ohmios −1) | Número de iones por unidad de fórmula | Número de Cl − Iones Precipitados por Ag + |
|---|---|---|---|
| PtcL 4 ·6NH 3 | 523 | 5 | 4 |
| PtcL 4 ·5NH 3 | 404 | 4 | 3 |
| PtcL 4 ·4NH 3 | 299 | 3 | 2 |
| PtCl 4 ·3NH 3 | 97 | 2 | 1 |
| PtcL 4 ·2NH 3 | 0 | 0 | 0 |
Estos datos llevaron a Werner a postular que los iones metálicos tienen dos tipos diferentes de valencia: (1) una valencia primaria (estado de oxidación) que corresponde a la carga positiva sobre el ión metálico y (2) una valencia secundaria (número de coordinación) que es el número total de ligandos unidos al ión metálico. Si Pt tuviera una valencia primaria de 4 y una valencia secundaria de 6, Werner podría explicar las propiedades de los aductos PtCl 4·NH 3 mediante las siguientes reacciones, donde el complejo metálico está encerrado entre corchetes:
\ begin {alineado}
\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {6}\ derecha]\ mathrm {Cl} _ {4} &\ fila derecha\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {6}\ derecha] ^ {4+} (\ mathrm {aq}) +4\ mathrm {Cl} ^ {-} (\ mathrm {aq})\\
\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {5}\ mathrm {Cl}\ derecha] \ mathrm {Cl} _ {3} &\ fila derecha\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {5}\ mathrm {Cl}\ derecha] ^ {3+} (\ mathrm {aq}) +3\ mathrm {Cl} ^ {-} (\ mathrm {aq})\
\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {4}\ mathrm {Cl} _ {2}\ derecha]\ mathrm {Cl} _ {2} &\ fila derecha\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {4}\ mathrm {Cl} _ {2}\ derecha] ^ {2+} (\ mathrm {aq}) +2\ mathrm {Cl} ^ {-} (\ mathrm {aq})\
\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {3}\ mathrm {Cl} _ {3}\ derecha]\ mathrm {Cl} &\ fila derecha\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {3}\ mathrm {Cl} _ {3}\ derecha] ^ {+} (\ mathrm {aq}) +\ mathrm {Cl} ^ {-} (\ mathrm {aq})\
\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {2}\ mathrm {Cl} _ {4}\ derecha] &\ fila derecha\ izquierda [\ mathrm {Pt}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {2}\ mathrm {Cl} _ {4}\ derecha] ^ {0} (\ mathrm {aq})
\ end {alineado}
Otros trabajos mostraron que los dos miembros faltantes de la serie, [Pt (NH 3) Cl 5] − y [PtCl 6] 2−, podrían prepararse como sus sales mono y dipotásicas, respectivamente. Estudios similares establecieron números de coordinación de 6 para Co 3+ y Cr 3+ y 4 para Pt 2+ y Pd 2+.
Los estudios de Werner sobre los complejos análogos de Co 3+ también le permitieron proponer un modelo estructural para complejos metálicos con un número de coordinación de 6. Así encontró que [Co (NH 3) 6] Cl 3 (amarillo) y [Co (NH 3) 5 Cl] Cl 2 (púrpura) fueron electrolitos 1:3 y 1:2. Inesperadamente, sin embargo, se conocieron dos compuestos diferentes de [Co (NH 3) 4 Cl 2] Cl: uno era rojo y el otro verde (parte (a) en la Figura\(\PageIndex{1}\). Debido a que ambos compuestos tenían la misma composición química y el mismo número de grupos del mismo tipo unidos al mismo metal, tenía que haber algo diferente en la disposición de los ligandos alrededor del ión metálico. La visión clave de Werner fue que los seis ligandos en [Co (NH 3) 4 Cl 2] Cl tuvieron que estar dispuestos en los vértices de un octaedro porque esa era la única estructura consistente con la existencia de dos, y solo dos, arreglos de ligandos (parte (b) en la Figura\(\PageIndex{1}\). Su conclusión fue corroborada por la existencia de sólo dos formas diferentes del siguiente compuesto en la serie: Co (NH 3) 3 Cl 3.
\(\PageIndex{1}\)Los complejos de figuras con diferentes disposiciones de los mismos ligandos tienen diferentes propiedades
 El ion [Co (NH 3) 4 Cl 2] + puede tener dos disposiciones diferentes de los ligandos, lo que da como resultado diferentes colores: si los dos ligandos Cl − están uno al lado del otro, el complejo es rojo (a), pero si son opuestos entre sí, el complejo es verde (b).
El ion [Co (NH 3) 4 Cl 2] + puede tener dos disposiciones diferentes de los ligandos, lo que da como resultado diferentes colores: si los dos ligandos Cl − están uno al lado del otro, el complejo es rojo (a), pero si son opuestos entre sí, el complejo es verde (b).
En la época de Werner se conocían muchos complejos de fórmula general MA 4 B 2, pero no se habían preparado más de dos compuestos diferentes con la misma composición para ningún metal. Para confirmar el razonamiento de Werner, calcule el número máximo de diferentes estructuras que son posibles para los complejos MA 4 B 2 de seis coordenadas con cada uno de los tres
Dado: tres estructuras posibles y el número de formas diferentes conocidas para los complejos MA 4 B 2
Preguntado por: número de diferentes arreglos de ligandos para el complejo MA 4 B 2 para cada estructura
Solución
Aquí se muestran las tres estructuras regulares de seis coordenadas, con cada posición de coordinación numerada para que podamos realizar un seguimiento de los diferentes arreglos de ligandos. Para cada estructura, todos los vértices son equivalentes. Comenzamos con un complejo MA 6 simétrico y simplemente reemplazamos dos de los ligandos A en cada estructura para dar un complejo MA 4 B 2:

Para el hexágono, colocamos el primer ligando B en la posición 1. Ahora hay tres posibles lugares para el segundo ligando B: en la posición 2 (o 6), posición 3 (o 5), o posición 4. Estos son los únicos arreglos posibles. Las disposiciones (1, 2) y (1, 6) son químicamente idénticas porque los dos ligandos B son adyacentes entre sí. Las disposiciones (1, 3) y (1, 5) también son idénticas porque en ambos casos los dos ligandos B están separados por un ligando A.
Volviendo al prisma trigonal, colocamos el primer ligando B en la posición 1. Nuevamente, hay tres opciones posibles para el segundo ligando B: en la posición 2 o 3 en la misma cara triangular, posición 4 (en la otra cara triangular pero adyacente a 1), o posición 5 o 6 (en la otra cara triangular pero no adyacente a 1). Los arreglos (1, 2) y (1, 3) son químicamente idénticos, al igual que los arreglos (1, 5) y (1, 6).
En el octaedro, sin embargo, si colocamos el primer ligando B en la posición 1, entonces solo tenemos dos opciones para el segundo ligando B: en la posición 2 (o 3 o 4 o 5) o en la posición 6. En este último, los dos ligandos B se encuentran en vértices opuestos del octaedro, estando el metal directamente entre ellos. Aunque existen cuatro arreglos posibles para los primeros, son químicamente idénticos porque en todos los casos los dos ligandos B son adyacentes entre sí.
El número de posibles arreglos MA 4 B 2 para las tres geometrías es así: hexágono, 3; prisma trigonal, 3; y octaedro, 2. El hecho de que solo se conocieran dos formas diferentes para todos los complejos MA 4 B 2 que se habían preparado sugiere que la estructura correcta era el octaedro pero no lo probó. Por alguna razón uno de los tres arreglos posibles para las otras dos estructuras podría haber sido menos estable o más difícil de preparar y simplemente aún no se había sintetizado. Sin embargo, cuando se combinaron con resultados análogos para otros tipos de complejos (p. ej., MA 3 B 3), los datos se explicaron mejor por una estructura octaédrica para complejos metálicos de seis coordenadas.
Determinar el número máximo de estructuras que son posibles para un complejo MA 2 B 2 de cuatro coordenadas con una estructura plana cuadrada o una estructura simétrica tetraédrica.
- Contestar
-
plano cuadrado, 2; tetraédrico, 1
Estructuras de Complejos Metálicos
Los números de coordinación de iones metálicos en complejos metálicos pueden variar de 2 a al menos 9. En general, las diferencias de energía entre diferentes arreglos de ligandos son mayores para complejos con números de coordinación bajos y disminuyen a medida que aumenta el número de coordinación. Por lo general, solo una o dos estructuras son posibles para complejos con números de coordinación bajos, mientras que varias estructuras energéticamente equivalentes diferentes son posibles para complejos con números de coordinación altos (n > 6). A continuación se presentan las estructuras más comúnmente encontradas para los números de coordinación 2—9. Muchas de estas estructuras deberían resultarle familiares a partir de nuestra discusión sobre el modelo de repulsión de pares de electrones de capa de valencia (VSEPR) en el Capítulo 9 porque corresponden a las disposiciones de menor energía de n pares de electrones alrededor de un átomo central.
Tenga en cuenta el patrón
Los compuestos con bajos números de coordinación presentan las mayores diferencias de energía entre diferentes arreglos de ligandos.
Coordinación Número 2

Aunque es raro para la mayoría de los metales, este número de coordinación es sorprendentemente común para los iones metálicos d 10, especialmente Cu +, Ag +, Au + y Hg 2+. Un ejemplo es el ion [Au (CN) 2] −, que se utiliza para extraer oro de sus minerales, como se describe en la Sección 23.3. Como se esperaba en base a consideraciones de VSEPR, estos complejos tienen la estructura lineal L-M-L que se muestra aquí.
Coordinación Número 3

Aunque también es raro, este número de coordinación se encuentra con d 10 iones metálicos como Cu + y Hg 2+. Entre los pocos ejemplos conocidos se encuentra el ion hGi 3 −. Los complejos de tres coordenadas casi siempre tienen la estructura plana trigonal esperada del modelo VSEPR.
Coordinación Número 4

Se observan dos estructuras comunes para los complejos metálicos de cuatro coordenadas: tetraédrica y plana cuadrada. La estructura tetraédrica se observa para todos los complejos de cuatro coordenadas de metales que no son de transición, tales como [BeF 4] 2−, y d 10 iones, como [ZnCl 4] 2−. También se encuentra para complejos de cuatro coordenadas de los metales de transición de la primera fila, especialmente aquellos con ligandos haluro (por ejemplo, [FeCl 4] − y [FeCl 4] 2−). Por el contrario, las estructuras planas cuadradas se observan rutinariamente para complejos de cuatro coordenadas de metales de transición de segunda y tercera fila con configuraciones de electrones d 8, como Rh + y Pd 2+, y también se encuentran en algunos complejos de Ni 2 + y Cu 2+.
Coordinación Número 5

Este número de coordinación es menos común que 4 y 6, pero todavía se encuentra frecuentemente en dos estructuras diferentes: bipiramidal trigonal y piramidal cuadrado. Debido a que las energías de estas estructuras suelen ser bastante similares para la mayoría de los ligandos, muchos complejos de cinco coordenadas tienen estructuras distorsionadas que se encuentran en algún lugar entre los dos extremos.
Coordinación Número 6

Este número de coordinación es con mucho el más común. Los seis ligandos están casi siempre en los vértices de un octaedro o un octaedro distorsionado. La única otra estructura de seis coordenadas es el prisma trigonal, que es muy poco común en complejos metálicos simples.
Coordinación Número 7

Este número de coordinación relativamente poco común generalmente se encuentra solo para metales grandes (como los metales de transición de la segunda y tercera fila, lantánidos y actínidos). Se conocen al menos tres estructuras diferentes, dos de las cuales se derivan de un octaedro o un prisma trigonal añadiendo un ligando a una cara del poliedro para dar un octaedro o prisma trigonal “tapado”. Con mucho, la más común, sin embargo, es la bipirámide pentagonal.
Coordinación Número 8
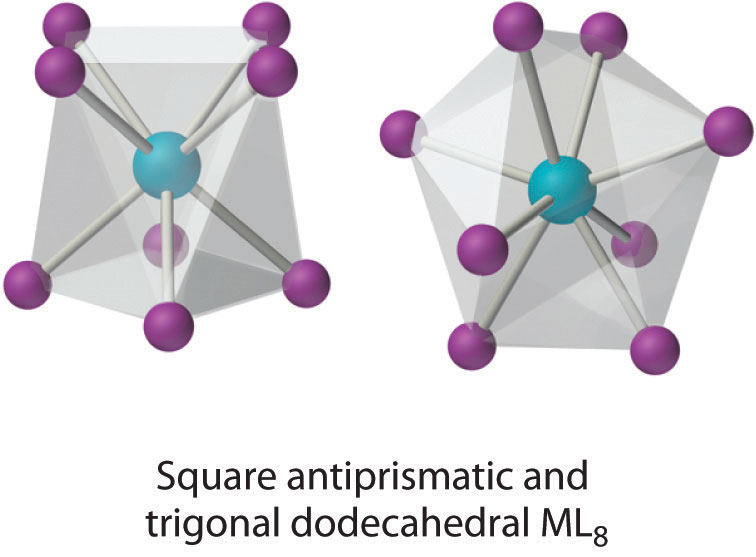
Este número de coordinación es relativamente común para iones metálicos más grandes. La estructura más simple es el cubo, lo cual es raro porque no minimiza las interacciones repulsivas interligandos. Las estructuras comunes son el antiprisma cuadrado y el dodecaedro, ambos de los cuales se pueden generar a partir del cubo.
Coordinación Número 9

Este número de coordinación se encuentra en iones metálicos más grandes, y la estructura más común es el prisma trigonal tricapado, como en [Nd (H 2 O) 9] 3+.
Estabilidad de Complejos Metálicos
La estabilidad termodinámica de un complejo metálico depende en gran medida de las propiedades del ligando y del ion metálico y del tipo de unión. Recordemos que la interacción metal-ligando es un ejemplo de una interacción ácido-base de Lewis. Las bases de Lewis se pueden dividir en dos categorías: bases duras, que contienen átomos donadores pequeños y relativamente no polarizables (como N, O y F), y bases blandas, que contienen átomos donantes más grandes y relativamente polarizables (como P, S y Cl). Los iones metálicos con las mayores afinidades por las bases duras son los ácidos duros, mientras que los iones metálicos con mayor afinidad por las bases blandas son los ácidos blandos. Algunos ejemplos de ácidos y bases duros y blandos se dan en la Tabla\(\PageIndex{2}\). Observe que los ácidos duros suelen ser cationes de metales electropositivos; en consecuencia, son relativamente no polarizables y tienen mayores relaciones carga-radio. Por el contrario, los ácidos blandos tienden a ser cationes de metales menos electropositivos; en consecuencia, tienen relaciones de carga a radio más bajas y son más polarizables. Los químicos pueden predecir las estabilidades relativas de los complejos formados por los metales del bloque d con un notable grado de precisión usando una regla simple: los ácidos duros prefieren unirse a bases duras y los ácidos blandos prefieren unirse a bases blandas.
Tabla\(\PageIndex{2}\) Ejemplos de ácidos duros y blandos y bases
| Ácidos | Bases | |
|---|---|---|
| duro | H + | NH 3, RNH 2, N 2 H 4 |
| Li +, Na +, K + | H 2 O, ROH, R 2 O | |
| Ser 2+, Mg 2+, Ca 2+, VO 2+ | OH −, F −, Cl −, CH 3 CO 2 − | |
| Al 3+, Sc 3+, Cr 3+ | CO 3 2− | |
| Ti 4+ | PO 4 3− | |
| suave | BF 3, Al 2 Cl 6, CO 2, SO 3 | |
| Cu +, Ag +, Au +, Tl +, Hg 2 2+ | H − | |
| Pd 2+, Pt 2+, Hg 2+ | CN −, SCN −, I −, RS − | |
| GaCL 3, GaBr 3, GaI 3 | CO, R 2 S |
Debido a que la interacción entre los ácidos duros y las bases duras es principalmente de naturaleza electrostática, la estabilidad de los complejos que involucran ácidos duros y bases duras aumenta a medida que aumenta la carga positiva sobre el ión metálico y a medida que disminuye su radio. Por ejemplo, el complejo de Al 3+ (r = 53.5 pm) con cuatro ligandos fluoruro (AlF 4 −) es aproximadamente 10 8 veces más estable que InF 4 −, el complejo fluoruro correspondiente de In 3+ (r = 80 pm). En general, la estabilidad de los complejos de metales de transición divalentes de primera fila con un ligando dado varía inversamente con el radio del ión metálico, como se muestra en la siguiente serie:La inversión en el orden en el cobre se debe a la estructura anómala de los complejos de cobre (II), lo que se discutirá en breve.
\ begin {alineado}
&\ text {estabilidad compleja}\ mathrm {Mn} ^ {2+} <\ mathrm {Fe} ^ {2+} <\ mathrm {Co} ^ {2+} <\ mathrm {Ni} ^ {2+} <\ mathrm {Cu} ^ {2+} >\ mathrm {Zn} ^ {2+}\\
&78\ quad 74.5\\
&69\
&73\ quad 74\\
&\ texto {iónico radio} (\ mathrm {pm})\ quad 83\ quad 7\\
&6\\
&\ texto {-}
\ end {alineado}
Debido a que un metal duro interactúa con una base de la misma manera que un protón, al unirse a un par solitario de electrones en la base, la estabilidad de los complejos de ácidos duros con bases duras aumenta a medida que el ligando se vuelve más básico. Por ejemplo, debido a que el amoníaco es una base más fuerte que el agua, los iones metálicos se unen preferentemente al amoníaco. En consecuencia, agregar amoníaco a soluciones acuosas de muchos de los cationes de metales de transición de la primera fila da como resultado la formación de los complejos de amoníaco correspondientes.
En contraste, la interacción entre los metales blandos (como los metales de transición de la segunda y tercera fila y Cu +) y las bases blandas es en gran medida de naturaleza covalente. La mayoría de los iones de metal blando tienen una subcubierta d llena o casi llena, lo que sugiere que la unión π de metal a ligando es importante. Por lo tanto, los complejos de metales blandos con bases blandas son mucho más estables de lo que se prediría con base en argumentos electrostáticos.
Tenga en cuenta el patrón
Los ácidos duros prefieren unirse a bases duras, y los ácidos blandos prefieren unirse a bases blandas.
El concepto de ácido duro, base duro/ácido blando, base blanda, también nos permite comprender por qué los metales se encuentran en la naturaleza en diferentes tipos de minerales. Recordemos de la Sección 23.2 que la mayoría de los metales de transición de la primera fila están aislados de minerales de óxido, pero que el cobre y el zinc tienden a ocurrir naturalmente en los minerales de sulfuro. Esto es consistente con el incremento en el carácter blando de los metales a lo largo de la primera fila de los metales de transición de izquierda a derecha. Recordemos también que la mayoría de los metales de transición de la segunda y tercera fila ocurren en la naturaleza como minerales de sulfuro, lo que concuerda con su mayor carácter blando.
Se dice que ligandos como el cloruro, el agua y el amoníaco son monodentados (de un diente, del griego mono, que significa “uno”, y el latín dent -, que significa “diente”): están unidos al metal a través de un solo átomo. Los ligandos pueden, sin embargo, ser bidentado (de dos dientes, del griego di, que significa “dos”), tridentados (de tres dientes, del griego tri, que significa “tres”), o, en general, polidentados (muchos dientes, del griego poli, que significa “muchos”), indicando que están adheridas al metal en dos, tres o varios sitios, respectivamente. La etilendiamina (H 2 NCH 2 CH 2 NH 2, a menudo abreviada como en) y la dietilenotriamina (H 2 NCH 2 CH 2 NHCH 2 CH 2 NH 2, a menudo abreviada como dien) son ejemplos de un bidentado y un ligando tridentado, respectivamente, porque cada átomo de nitrógeno tiene un par solitario que puede ser compartido con un ion metálico. Cuando un ligando bidentado como la etilendiamina se une a un metal como Ni 2+, se forma un anillo de cinco miembros. Un anillo que contiene metal como el que se muestra se llama anillo de quelato (del griego chele, que significa “garra”). Correspondientemente, un ligando polidentado es un agente quelante, y los complejos que contienen ligandos polidentados se denominan complejos quelatos.

Experimentalmente, se observa que los complejos metálicos de ligandos polidentados son significativamente más estables que los correspondientes complejos de ligandos monodentados químicamente similares; este aumento en la estabilidad se denomina efecto quelato. Por ejemplo, el complejo de Ni 2+ con tres ligandos etilendiamina, [Ni (en) 3] 2+, debe ser químicamente similar al complejo Ni 2+ con seis ligandos de amoníaco, [Ni (NH 3) 6] 2+. De hecho, la constante de equilibrio para la formación de [Ni (en) 3] 2+ es casi 10 órdenes de magnitud mayor que la constante de equilibrio para la formación de [Ni (NH 3) 6] 2+:
\ begin {alineada}
& {\ izquierda [\ mathrm {Ni}\ izquierda (\ mathrm {H} _ {2}\ mathrm {O}\ derecha) _ {6}\ derecha] ^ {2+} +6\ mathrm {NH} _ {3}\ derechaurpoons\ izquierda [\ mathrm {Ni}\ izquierda (\ mathrm {NH} _ {3}\ derecha) _ {6}\ derecha] ^ {2+} +6\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {l})\ quad K_ {\ mathrm {f}} =4\ veces 10^ {8}}\\
& {\ izquierda [\ mathrm {Ni}\ izquierda (\ mathrm {H} _ {2}\ mathrm {O}\ derecha) _ {6}\ derecha] ^ {2+} +3\ mathrm {en}\ quad\ rightleftharpoons\ left [\ mathrm {Ni}\ left (\ mathrm {NH} _ {3}\ right) _ {6}\ right] ^ {2+} +6\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {l})\ quad K_ {\ mathrm {f}} =2\ veces 10^ {18}}
\ end {alineado}
Tenga en cuenta el patrón
Los complejos quelatos son más estables que los complejos análogos con ligandos monodentados.
La estabilidad de un complejo de quelato depende del tamaño de los anillos de quelato. Para los ligandos con una cadena principal orgánica flexible como la etilendiamina, los complejos que contienen anillos quelatos de cinco miembros, que casi no tienen cepa, son significativamente más estables que los complejos con anillos de quelato de seis miembros, que a su vez son mucho más estables que los complejos con anillos de cuatro o siete miembros. Por ejemplo, el complejo de cobre (II) con dos ligandos de etilendiamina es aproximadamente 1000 veces más estable que el complejo correspondiente con trietilendiamina (H 2 NCH 2 CH 2 CH 2 NH 2, abreviado como trieno):
\(\begin{array}{ll}{\left[\mathrm{Cu}\left(\mathrm{H}_{2} \mathrm{O}\right)_{6}\right]^{2+}+2 \mathrm{en}} & \rightleftharpoons\left[\mathrm{Cu}(\mathrm{en})_{2}\right]^{2+}+6 \mathrm{H}_{2} \mathrm{O}(\mathrm{l}) & K_{\mathrm{f}}=10^{20} \\ {\left[\mathrm{Cu}\left(\mathrm{H}_{2} \mathrm{O}\right)_{6}\right]^{2+}+3 \text { trien }} & \rightleftharpoons\left[\mathrm{Cu}(\text { trien })_{2}\right]^{2+}+6 \mathrm{H}_{2} \mathrm{O}(\mathrm{l}) & K_{\mathrm{f}}=10^{17}\end{array}\)
Organizar [Cr (en) 3] 3+, [CrCl 6] 3−, [CrF 6] 3− y [Cr (NH 3) 6] 3+ en orden de aumentar la estabilidad.
Dado: cuatro complejos de Cr (III)
Preguntado por: estabilidades relativas
Solución
A Determinar la basicidad relativa de los ligandos para identificar los complejos más estables.
B Decidir si algún complejo se estabiliza adicionalmente por un efecto quelato y organizar los complejos en orden de aumentar la estabilidad.
Solución:
A El ion metálico es el mismo en cada caso: Cr 3+. En consecuencia, debemos enfocarnos en las propiedades de los ligandos para determinar las estabilidades de los complejos. Debido a que la estabilidad de un complejo metálico aumenta a medida que aumenta la basicidad de los ligandos, necesitamos determinar la basicidad relativa de los cuatro ligandos. Nuestra discusión anterior sobre las propiedades ácido-base sugiere que el amoníaco y la etilendiamina, con átomos donantes de nitrógeno, son los ligandos más básicos. El ion fluoruro es una base más fuerte (tiene una relación carga-radio mayor) que el cloruro, por lo que el orden de estabilidad esperado debido a la basicidad del ligando es [CrCl 6] 3− < [CrF 6] 3− < [Cr (NH 3) 6] 3+ ≈ [Cr (en) 3 ] 3+.
B Debido al efecto quelato, esperamos que la etilendiamina forme un complejo más fuerte con Cr 3+ que el amoníaco. En consecuencia, el orden probable de aumentar la estabilidad es [CrCl 6] 3− < [CrF 6] 3− < [Cr (NH 3) 6] 3+ < [Cr (en) 3] 3+.
Organizar [Co (NH 3) 6] 3+, [CoF 6] 3− y [Co (en) 3] 3+ en orden decreciente de estabilidad.
- Contestar
-
[Co (es) 3] 3+ > [Co (NH 3) 6] 3+ > [CoF 6] 3−
Isómeros de complejos metálicos
Como discutimos anteriormente en esta sección, la existencia de compuestos de coordinación con la misma fórmula pero diferentes arreglos de los ligandos fue crucial en el desarrollo de la química de coordinación. Dos o más compuestos con la misma fórmula pero diferentes disposiciones de los átomos se denominan isómeros. Debido a que los isómeros suelen tener diferentes propiedades físicas y químicas, es importante saber con qué isómero estamos tratando si es posible más de un isómero. Recordemos del Capítulo 2 que en muchos casos es posible más de una estructura para compuestos orgánicos con la misma fórmula molecular; los ejemplos discutidos anteriormente incluyen n-butano versus isobutano y cis -2-buteno versus trans -2-buteno. Como veremos, los compuestos de coordinación exhiben los mismos tipos de isómeros que los compuestos orgánicos, así como varios tipos de isómeros que son únicos. (Para mayor información sobre los isómeros en compuestos orgánicos, véase el Capítulo 24, Sección 24.2.)
Isómeros estructurales
Los isómeros que contienen el mismo número de átomos de cada tipo pero difieren en qué átomos están unidos entre sí se denominan isómeros estructurales. El isobutano y el n-butano son ejemplos de isómeros estructurales. Un tipo de isomería consiste en dos compuestos que tienen la misma fórmula empírica pero difieren en el número de unidades de fórmula presentes en la fórmula molecular. Un ejemplo en compuestos de coordinación son dos compuestos con la fórmula empírica Pt (NH 3) 2 Cl 2. Uno es un complejo de platino plano cuadrado simple (II), Pt (NH 3) 2 Cl 2, y el otro es un compuesto iónico que contiene el catión [Pt (NH 3) 4] 2+ y el anión [PtCl 4] 2-, [Pt (NH 3) 4 ] [PtcL 4]. Como cabría esperar, estos compuestos tienen propiedades físicas y químicas muy diferentes. Una disposición de los ligandos Cl − y NH 3 alrededor del ion platino en el primero da el fármaco anticancerígeno cisplatino, mientras que el otro arreglo no tiene aplicaciones biomédicas conocidas.
Isómeros Geométricos
Los complejos metálicos que difieren solo en los que los ligandos son adyacentes entre sí (cis) o directamente uno frente al otro (trans) en la esfera de coordinación del metal se denominan isómeros geométricos. Son más importantes para los complejos cuadrados planos y octaédricos.
Debido a que todos los vértices de un cuadrado son equivalentes, no importa qué vértice esté ocupado por el ligando B en un complejo MA 3 B plano cuadrado; de ahí que en este caso solo sea posible un único isómero geométrico (y en el caso análogo MAB 3). Las cuatro estructuras que se muestran aquí son químicamente idénticas porque pueden superponerse simplemente girando el complejo en el espacio:

Para un complejo MA 2 B2, existen dos isómeros posibles: o bien los ligandos A pueden estar adyacentes entre sí (cis), en cuyo caso los ligandos B también deben ser cis, o los ligandos A pueden estar cruzados entre sí (trans), en cuyo caso los ligandos B también debe ser trans. Aunque es posible dibujar el isómero cis de cuatro maneras diferentes y el isómero trans de dos maneras diferentes, todos los miembros de cada conjunto son químicamente equivalentes:

Debido a que no hay manera de convertir la estructura cis a la trans girando o volteando la molécula en el espacio, son fundamentalmente diferentes disposiciones de átomos en el espacio. Probablemente los ejemplos más conocidos de isómeros cis y trans de un complejo plano cuadrado MA 2 B 2 son cis-Pt (NH 3) 2 Cl 2, también conocido como cisplatino, y trans-Pt (NH 3) 2 Cl 2, que en realidad es tóxico más que terapéutico.

El fármaco anticancerígeno cisplatino y su isómero trans inactivo. El cisplatino es especialmente efectivo contra los tumores de los órganos reproductivos (los testículos en los machos y los ovarios en las hembras), que afectan principalmente a individuos en sus 20 años y fueron notoriamente difíciles de curar. Por ejemplo, después de ser diagnosticado con cáncer testicular metastatizado en 1991 y dado sólo un 50% de posibilidades de supervivencia, Lance Armstrong se curó por tratamiento con cisplatino y pasó a ganar siete carreras ciclistas sin precedentes del Tour de Francia.
Los complejos planos cuadrados que contienen ligandos bidentados simétricos, como [Pt (en) 2] 2+, tienen solo una estructura posible, en la que las líneas curvas que unen los dos átomos de N indican los ligandos de etilendiamina:

Los complejos octaédricos también exhiben isómeros cis y trans. Al igual que los complejos planos cuadrados, solo una estructura es posible para los complejos octaédricos en los que solo un ligando es diferente de los otros cinco (MA 5 B). Aunque usualmente dibujamos un octaedro de una manera que sugiere que los cuatro ligandos “en el plano” son diferentes de los dos ligandos “axiales”, de hecho los seis vértices de un octaedro son equivalentes. En consecuencia, no importa cómo dibujemos una estructura MA 5 B, puede superponerse a cualquier otra representación simplemente rotando la molécula en el espacio. Dos de las muchas orientaciones posibles de una estructura MA 5 B son las siguientes:

Si dos ligandos en un complejo octaédrico son diferentes de los otros cuatro, dando un complejo MA 4 B 2, son posibles dos isómeros. Los dos ligandos B pueden ser cis o trans. Cis - y trans - [Co (NH 3) 4 Cl 2] Cl son ejemplos de este tipo de sistemas:

Reemplazar otro ligando A por B da un complejo MA 3 B 3 para el cual también hay dos isómeros posibles. En uno, los tres ligandos de cada tipo ocupan caras triangulares opuestas del octaedro; esto se llama isómero fac (para facial). En el otro, los tres ligandos de cada tipo se encuentran en lo que sería el meridiano si el complejo fuera visto como una esfera; esto se llama el isómero mer (para meridional):

Dibujar todos los isómeros geométricos posibles para el complejo [Co (H 2 O) 2 (ox) BrCl] −, donde buey es − O 2 CCO 2 −, que significa oxalato.
Dado: fórmula de complejo
Preguntado por: estructuras de isómeros geométricos
Solución:
Este complejo contiene un ligando bidentado (oxalato), que puede ocupar solo posiciones adyacentes (cis), y cuatro ligandos monodentados, dos de los cuales son idénticos (H 2 O). La forma más fácil de atacar el problema es pasar por las diversas combinaciones de ligandos sistemáticamente para determinar qué ligandos pueden ser trans. Así, o bien los ligandos de agua pueden ser trans entre sí o los dos ligandos haluro pueden ser trans entre sí, dando los dos isómeros geométricos mostrados aquí:

Además, son posibles dos estructuras en las que uno de los haluros es trans a un ligando de agua. En el primero, el ligando cloruro está en el mismo plano que el ligando oxalato y trans a uno de los oxígenos de oxalato. El intercambio de los ligandos cloruro y bromuro da el otro, en el que el ligando bromuro está en el mismo plano que el ligando de oxalato y trans a uno de los oxígenos de oxalato:

Por lo tanto, este complejo puede existir como cuatro isómeros geométricos diferentes.
Dibujar todos los isómeros geométricos posibles para el complejo [Cr (en) 2 (CN) 2] +.
- Contestar
-

Dos isómeros geométricos son posibles: trans y cis.
Resumen
Los metales de transición forman complejos metálicos, especies poliatómicas en las que un ión metálico se une a uno o más ligandos, que son grupos unidos a un ión metálico. Los iones complejos son complejos metálicos cargados eléctricamente, y un compuesto de coordinación contiene uno o más complejos metálicos. Los complejos metálicos con números de coordinación bajos generalmente tienen solo una o dos estructuras posibles, mientras que aquellos con números de coordinación mayores a seis pueden tener varias estructuras diferentes. Los números de coordinación de dos y tres son comunes para los iones metálicos d 10. Los complejos tetraédricos y planos cuadrados tienen un número de coordinación de cuatro; los complejos bipiramidales trigonales y piramidales cuadrados tienen un número de coordinación de cinco; y los complejos octaédricos tienen un número de coordinación de seis. Se conocen al menos tres estructuras para un número de coordinación de siete, que generalmente se encuentra solo para iones metálicos grandes. También se encuentran números de coordinación de ocho y nueve para iones metálicos más grandes. La estabilidad de los complejos metálicos con metales de transición de primera fila en un estado de oxidación +2 varía inversamente con su radio iónico. Las bases de Lewis pueden ser bases duras, que tienen átomos donadores pequeños, relativamente no polarizables, o bases blandas, con átomos donantes más grandes y relativamente polarizables. Los ácidos duros tienen la mayor afinidad por las bases duras, y los ácidos blandos tienen la mayor afinidad por las bases blandas. Los metales blandos y las bases blandas forman complejos que son más estables de lo que se predeciría con base en argumentos electrostáticos, lo que sugiere que el enlace π de metal a ligando es importante. Los ligandos que son bases fuertes forman los complejos más estables con iones metálicos que son ácidos duros. Los complejos excepcionalmente estables están formados por quelatos, que son ligandos poliatómicos con dos o más átomos donantes; esta estabilidad mejorada se conoce como el efecto quelato. Muchos complejos metálicos forman isómeros, que son dos o más compuestos con la misma fórmula pero diferentes disposiciones de átomos. Los isómeros estructurales difieren en qué átomos están unidos entre sí, mientras que los isómeros geométricos difieren solo en la disposición de los ligandos alrededor del ion metálico. Los ligandos adyacentes entre sí son cis, mientras que los ligandos entre sí son trans.
COMIDA PARA LLEVAR CLAVE
- Los compuestos de coordinación son una característica importante de la química de más de la mitad de los elementos.
- Los compuestos de coordinación tienen un papel importante como catalizadores industriales en el control de la reactividad y son esenciales en los procesos bioquímicos.
PROBLEMAS CONCEPTUALES
- Dé dos razones por las que un metal puede unirse solo a un número finito de ligandos. Con base en este razonamiento, ¿cuál predice es el número máximo de coordinación de Ti? de Ac?
- ¿Puede un complejo tetraédrico MA 2 B 2 formar isómeros cis y trans? Explica tu respuesta.
- Los elementos del grupo 12 nunca se encuentran en su forma nativa (libre) sino siempre en combinación con otro elemento. ¿Qué elemento es este? ¿Por qué? ¿Cuál de los 12 elementos del grupo tiene la mayor afinidad por el elemento que seleccionó?
Contestar
- Los metales del grupo 12 son bastante blandos y prefieren unirse a un anión blando como el sulfuro en lugar de a un anión duro como el óxido; de ahí que generalmente se encuentran en la naturaleza como minerales de sulfuro. Debido a que es el más blando de estos metales, el mercurio tiene la mayor afinidad por el sulfuro.
ESTRUCTURA Y REACTIVIDAD
- Los complejos de metales en el estado de oxidación +6 suelen contener enlaces a los que dos bases Lewis? ¿Por qué estos enlaces se describen mejor como covalentes en lugar de iónicos? ¿Ca, Sr y Ba también forman enlaces covalentes con estas dos bases de Lewis, o su unión se describe mejor como iónica?
- Cr, Mn, Fe, Co y Ni forman complejos de CO estables. En contraste, los metales de transición anteriores no forman complejos estables similares. ¿Por qué?
- Los metales de transición Cr a Ni forman complejos de cianuro muy estables. ¿Por qué estos complejos son mucho más estables que compuestos similares formados a partir de los primeros metales de transición?
- De Co (en) 3 3+, CoF 6 3−, Co (NH 3) 6 3+, y Co (dien) 2 3+, ¿qué especies esperas que sean las más estables? ¿Por qué?
- De Ca 2+, Ti 2+, V 2+, Mn 2+, Fe 2+, Co 2+, Ni 2+ y Zn 2+, ¿qué iones metálicos divalentes forman los complejos más estables con ligandos como NH 3? ¿Por qué?
- Empareja cada base de Lewis con los iones metálicos con los que es más probable que forme un complejo estable:
Bases de Lewis: NH 3, F −, RS −, OH − y Cl −
Metales: Sc 3+, Cu +, W 6+, Mg 2+, V 3+, Fe 3+, Zr 4+, Co 2+, Ti 4+, Au +, Al 3+ y Mn 7+
- De ReF 2, RecL 5, MnF 6, Mn 2 O 7, y ReO, ¿cuáles no son probables que existan?
- De WF 2, CrF 6, MoBr 6, WI 6, CrO 3, MoS 2, W 2 S 3, y MoH, ¿cuáles no son probables de existir?
RESPUESTAS
- Los metales en el estado de oxidación +6 son estabilizados por óxido (O 2−) y fluoruro (F −). Los enlaces M-F y M-O son covalentes polares debido a la polarización extrema de los aniones por el metal altamente cargado. Ca, Sr y Ba se pueden oxidar solo a los dicados (M 2+), que forman óxidos iónicos y fluoruros.
- El cianuro es una base relativamente blanda, y los cationes de metales de transición tempranos son ácidos más duros que los metales de transición posteriores.
- La formación de complejos entre NH 3 y un catión divalente se debe en gran parte a interacciones electrostáticas entre el extremo negativo del momento dipolar de amoníaco y el catión cargado positivamente. Así, los cationes divalentes más pequeños (Ni 2 +, Zn 2+ y Cu 2+) formarán los complejos más estables con amoníaco.
- Re 2+ es un catión muy blando, y F − y O 2− son bases muy duras, por lo que es poco probable que existan ReO y ReF 2. También es poco probable que exista MnF 6: aunque el fluoruro debe estabilizar estados de oxidación altos, en este caso Mn 6+ es probablemente demasiado pequeño para acomodar seis iones F −.


