9.1: Sistemas compuestos por una reacción
- Page ID
- 76687
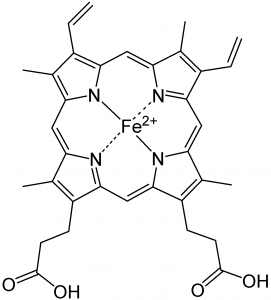
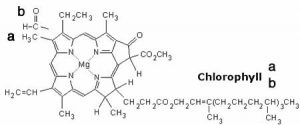
Comenzamos con algunas reacciones importantes que pueden moverse hacia atrás o hacia adelante dependiendo de las condiciones. [1] El oxígeno molecular (\(\mathrm{O}_{2}\)) es un componente vital en una serie de reacciones en nuestros cuerpos, como la respiración aeróbica, el proceso evolutivamente antiguo por el cual capturamos energía de los alimentos. [2]\(\mathrm{O}_{2}\) debe ser transportada a cada célula para que pueda participar en reacciones celulares. \(\mathrm{O}_{2}\)se difunde en el torrente sanguíneo en los pulmones, pero no es muy soluble en agua (el principal componente de la sangre). Si confiáramos en la solubilidad del oxígeno en el agua para transportarlo alrededor del cuerpo, estaríamos en problemas. En cambio\(\mathrm{O}_{2}\) reacciona con (solemos decir “se une a”, pero esta es definitivamente una reacción química) una proteína llamada hemoglobina. La estructura de la hemoglobina es compleja: está compuesta por cuatro subunidades polipeptídicas y cada polipéptido está asociado con un grupo hemo. [3] El grupo hemo contiene un ion hierro (\(\mathrm{Fe}^{2+}\)) complejado con cuatro bases nitrogenadas unidas en un anillo (llamado porfirina) para formar una disposición más o menos plana, como se muestra en la figura. El hemo es también la porción activa central de uno de los componentes principales de nuestro sistema inmune, la mieloperoxidasa. [4] Cuando te suenas la nariz, ese color verde familiar en realidad es causado por las propiedades absorbentes de luz del grupo hemo en esta enzima, más que por la infección bacteriana. Debido a que el grupo hemo se encuentra en un ambiente molecular diferente, su color aparece verde en lugar de rojo. La clorofila, una molécula similar, difiere más dramáticamente del hemo en que el ion hierro es reemplazado por un ion magnesio (como se muestra en la figura). Su función no es unir\(\mathrm{O}_{2}\) (o\(\mathrm{CO}_{2}\)), sino absorber la luz visible y liberar un electrón energético como parte del proceso fotosintético.
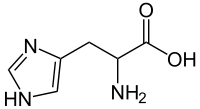
El hierro es un metal de transición. Recordemos que estos elementos tienen d orbitales, algunos de los cuales están vacíos y disponibles para la unión. El Hierro II (\(\mathrm{Fe}^{2+}\)) tiene muchos orbitales disponibles energéticamente y, por lo tanto, puede formar complejos ácido-base de Lewis con compuestos que tienen electrones disponibles (como bases nitrogenadas). Dentro del anillo de porfirina, cuatro nitrógenos interactúan con el\(\mathrm{Fe}^{2+}\) ion. Típicamente, los metales de transición forman complejos que son geométricamente octaédricos. En el caso del grupo hemo, cuatro de estas interacciones involucran nitrógenos de los cuatro anillos; una quinta involucra un residuo de nitrógeno de histidina de uno de los polipéptidos de la proteína que se aproxima desde debajo del plano del anillo. Esto deja un sitio abierto para la unión de una\(\mathrm{O}_{2}\) molécula, que tiene disponibles pares de electrones solitarios. [5] Cuando una\(\mathrm{O}_{2}\) se une a uno de estos grupos hemo,\[\text {Hemoglobin } + \mathrm{O}_{2} \rightleftarrows \text { Hemoglobin } - \mathrm{O}_{2} .\]
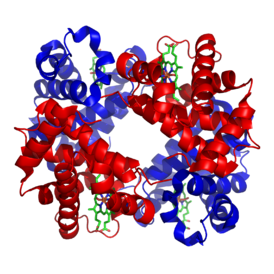
Tenga en cuenta que esta forma de representar la reacción es una simplificación excesiva. Como dijimos inicialmente, cada molécula de hemoglobina contiene cuatro polipéptidos, cada uno de los cuales está asociado con un grupo hemo (verde en la figura), por lo que hay cuatro grupos hemo en una sola molécula de hemoglobina. Cada grupo hemo puede unirse a una\(\mathrm{O}_{2}\) molécula. Cuando una\(\mathrm{O}_{2}\) molécula se une al hierro hemo, hay cambios estructurales y electrónicos que tienen lugar dentro de la proteína como un todo. Esto lleva a un proceso conocido como cooperatividad, en el que los cuatro grupos hemo no actúan de manera independiente. La unión\(\mathrm{O}_{2}\) a uno de los cuatro grupos hemo en la hemoglobina provoca cambios estructurales\(\mathrm{O}_{2}\) en la proteína, lo que aumenta la afinidad por cada uno de los tres grupos hemo restantes. Cuando un segundo\(\mathrm{O}_{2}\) se une, la afinidad por\(\mathrm{O}_{2}\) se incrementa una vez más en los dos grupos hemo restantes.
Como podrías sospechar, este proceso es reversible. Imagínese una proteína de hemoglobina con cuatro moléculas de oxígeno unidas. Cuando\(\mathrm{O}_{2}\) se libera a partir de la molécula de hemoglobina, se reduce la afinidad entre los grupos restantes\(\mathrm{O}_{2}\) y hemo, lo que hace que sea más probable que se liberen más de los\(\mathrm{O}_{2}\) ligados. Esta es una reacción de equilibrio, y podemos aplicarle el principio de Le Chatelier. Donde\(\mathrm{O}_{2}\) hay abundancia (en los pulmones), la reacción se desplaza hacia la derecha (unión y afinidad creciente por\(\mathrm{O}_{2}\)). Donde\(\mathrm{O}_{2}\) está presente en niveles bajos, la reacción se desplaza hacia la izquierda (liberando y reduciendo la afinidad por\(\mathrm{O}_{2}\)). La molécula de hemoglobina resultante tiene una alta capacidad de unión\(\mathrm{O}_{2}\) donde\(\mathrm{O}_{2}\) está presente a altas concentraciones y se libera fácilmente\(\mathrm{O}_{2}\) donde\(\mathrm{O}_{2}\) está presente a bajas concentraciones. En la sangre, [hemoglobina] oscila entre\(135–170 \mathrm{~g/L}\), aproximadamente\(2\) milimoles por litro (\(\mathrm{mM}\)), y debido a que hay cuatro sitios de\(\mathrm{O}_{2}\) unión por hemoglobina, esto da como resultado aproximadamente\(\sim 250 \mathrm{~mg/L}\) o\(s8-\mathrm{mM}\) concentración de\(\mathrm{O}_{2}\).
En comparación,\(\mathrm{O}_{2}\) la solubilidad en agua es\(\sim 8 \mathrm{~mg/L}\) de\(37 { }^{\circ}\mathrm{C}\), o\(250\) micromoles por litro (\(\mu \mathrm{M}\)). La reacción se puede escribir así:
\(\mathrm{O}_{2}\)en el aire\(\rightleftarrows \(\mathrm{~O}_{2}\) en el\(\text{ blood (liquid) + hemoglobin } \rightleftarrows \text { hemoglobin-}\mathrm{O}_{2} + \mathrm{O}_{2} \text{ in the blood } \rightleftarrows \text { hemoglobin-}2\mathrm{O}_{2} + \mathrm{~O}_{2} \text{ in the blood } \rightleftarrows \text { hemoglobin-}3\mathrm{O}_{2} + \mathrm{O}_{2} \text{ in the blood } \(\rightleftarrows\)\ texto {hemoglobina-} 4\ mathrm {O} _ {2}
Cuando la hemoglobina llega a zonas del cuerpo donde\(\left[\mathrm{O}_{2}\right]\) es baja, el oxígeno se disocia de la hemoglobina hacia la sangre. El\ mathrm {O} _ {2} disuelto se extrae entonces de la sangre por respiración aeróbica (que utiliza oxígeno):\[\mathrm{C}_{6}\mathrm{H}_{12}\mathrm{O}_{6} + 6\mathrm{O}_{2} \rightleftarrows 6\mathrm{CO}_{2} + 6\mathrm{H}_{2}\mathrm{O} .\]
La combinación del principio de Le Chatelier y la cooperatividad de la reacción de la\(\mathrm{O}_{2} +\) hemoglobina conduce ahora a la disociación completa del complejo\ text {hemoglobin—} 4\ mathrm {O} _ {2}\), liberando\(\mathrm{O}_{2}\). Los productos de la respiración aeróbica (esencialmente una reacción de combustión) son el dióxido de carbono y el agua. Claramente el agua se puede llevar en el fluido celular, pero el dióxido de carbono debe eliminarse de diversas maneras: una pequeña parte se elimina reaccionando con la hemoglobina (pero no en el centro Fe), parte se disuelve en la sangre, y otra participa en el sistema de amortiguación presente en la sangre, y la mayoría es liberado en los pulmones, en el aire que exhalas.
Preguntas
Preguntas para responder
- ¿Qué complica los sistemas de reacción en el mundo real (fuera del laboratorio)?
- ¿Por qué\(\mathrm{O}_{2}\) no es muy soluble en agua?
- ¿Por qué factor la unión con la hemoglobina aumenta la solubilidad de\(\mathrm{O}_{2}\) en el agua?
- Dibuja estructuras de Lewis para\(\mathrm{O}_{2}\) y\(\mathrm{CO}\). ¿Por qué crees que se unen de manera similar a la hemoglobina?
- ¿Por qué\(\mathrm{CO}_{2}\) reacciona diferente con la hemoglobina de la forma en que\(\mathrm{O}_{2}\) interactúa con la hemoglobina?
Preguntas para reflexionar
- ¿Por qué tiene sentido fisiológico que\(\mathrm{O}_{2}\) se una a la hemoglobina libre de oxígeno (desoxihemoglobina) de manera relativamente débil y cooperativa?


