4.E: Estequiometría de Reacciones Químicas (Ejercicios)
- Page ID
- 75860
4.1: Escribir y equilibrar ecuaciones químicas
Q4.1.1
¿Qué significa decir que una ecuación está equilibrada? ¿Por qué es importante que una ecuación esté equilibrada?
S4.1.1
Una ecuación se equilibra cuando se representa el mismo número de cada elemento en los lados del reactivo y del producto. Las ecuaciones deben ser equilibradas para reflejar con precisión la ley de conservación de la materia.
Q4.1.2
Considera las ecuaciones moleculares, iónicas completas y netas.
- ¿Cuál es la diferencia entre este tipo de ecuaciones?
- ¿En qué circunstancia serían idénticas las ecuaciones iónicas completas y netas para una reacción?
Q4.1.3
Equilibrar las siguientes ecuaciones:
- \(\ce{PCl5}(s)+\ce{H2O}(l)\rightarrow \ce{POCl3}(l)+\ce{HCl}(aq)\)
- \(\ce{Cu}(s)+\ce{HNO3}(aq)\rightarrow \ce{Cu(NO3)2}(aq)+\ce{H2O}(l)+\ce{NO}(g)\)
- \(\ce{H2}(g)+\ce{I2}(s)\rightarrow \ce{HI}(s)\)
- \(\ce{Fe}(s)+\ce{O2}(g)\rightarrow \ce{Fe2O3}(s)\)
- \(\ce{Na}(s)+\ce{H2O}(l)\rightarrow \ce{NaOH}(aq)+\ce{H2}(g)\)
- \(\ce{(NH4)2Cr2O7}(s)\rightarrow \ce{Cr2O3}(s)+\ce{N2}(g)+\ce{H2O}(g)\)
- \(\ce{P4}(s)+\ce{Cl2}(g)\rightarrow \ce{PCl3}(l)\)
- \(\ce{PtCl4}(s)\rightarrow \ce{Pt}(s)+\ce{Cl2}(g)\)
S4.1.3
- \(\ce{PCl5}(s)+\ce{H2O}(l)\rightarrow \ce{POCl3}(l)+\ce{2HCl}(aq)\);
- \(\ce{3Cu}(s)+\ce{8HNO3}(aq)\rightarrow \ce{3Cu(NO3)2}(aq)+\ce{4H2O}(l)+\ce{2NO}(g)\);
- \(\ce{H2}(g)+\ce{I2}(s)\rightarrow \ce{2HI}(s)\);
- \(\ce{4Fe}(s)+\ce{3O2}(g)\rightarrow \ce{2Fe2O3}(s)\);
- \(\ce{2Na}(s)+\ce{2H2O}(l)\rightarrow \ce{2NaOH}(aq)+\ce{H2}(g)\);
- \(\ce{(NH4)2Cr52O7}(s)\rightarrow \ce{Cr2O3}(s)+\ce{N2}(g)+\ce{4H2O}(g)\);
- \(\ce{P4}(s)+\ce{6Cl2}(g)\rightarrow \ce{4PCl3}(l)\);
- \(\ce{PtCl4}(s)\rightarrow \ce{Pt}(s)+\ce{2Cl2}(g)\)
Q4.1.4
Equilibrar las siguientes ecuaciones:
- \(\ce{Ag}(s)+\ce{H2S}(g)+\ce{O2}(g)\rightarrow \ce{Ag2S}(s)+\ce{H2O}(l)\)
- \(\ce{P4}(s)+\ce{O2}(g)\rightarrow \ce{P4O10}(s)\)
- \(\ce{Pb}(s)+\ce{H2O}(l)+\ce{O2}(g)\rightarrow \ce{Pb(OH)2}(s)\)
- \(\ce{Fe}(s)+\ce{H2O}(l)\rightarrow \ce{Fe3O4}(s)+\ce{H2}(g)\)
- \(\ce{Sc2O3}(s)+\ce{SO3}(l)\rightarrow \ce{Sc2(SO4)3}(s)\)
- \(\ce{Ca3(PO4)2}(aq)+\ce{H3PO4}(aq)\rightarrow \ce{Ca(H2PO4)2}(aq)\)
- \(\ce{Al}(s)+\ce{H2SO4}(aq)\rightarrow \ce{Al2(SO4)3}(s)+\ce{H2}(g)\)
- \(\ce{TiCl4}(s)+\ce{H2O}(g)\rightarrow \ce{TiO2}(s)+\ce{HCl}(g)\)
S4.1.4
- \(\ce{4Ag}(s)+\ce{2H2S}(g)+\ce{O2}(g)\rightarrow \ce{2Ag2S}(s)+\ce{2H2O}(l)\)
- \(\ce{P4}(s)+\ce{5O2}(g)\rightarrow \ce{P4O10}(s)\)
- \(\ce{2Pb}(s)+\ce{2H2O}(l)+\ce{O2}(g)\rightarrow \ce{2Pb(OH)2}(s)\)
- \(\ce{3Fe}(s)+\ce{4H2O}(l)\rightarrow \ce{Fe3O4}(s)+\ce{4H2}(g)\)
- \(\ce{Sc2O3}(s)+\ce{3SO3}(l)\rightarrow \ce{Sc2(SO4)3}(s)\)
- \(\ce{Ca3(PO4)2}(aq)+\ce{4H3PO4}(aq)\rightarrow \ce{3Ca(H2PO4)2}(aq)\)
- \(\ce{2Al}(s)+\ce{3H2SO4}(aq)\rightarrow \ce{Al2(SO4)3}(s)+\ce{3H2}(g)\)
- \(\ce{TiCl4}(s)+\ce{2H2O}(g)\rightarrow \ce{TiO2}(s)+\ce{4HCl}(g)\)
Q4.1.5
Escriba una ecuación molecular equilibrada describiendo cada una de las siguientes reacciones químicas.
- El carbonato de calcio sólido se calienta y se descompone en óxido de calcio sólido y gas dióxido de carbono.
- El butano gaseoso, C 4 H 10, reacciona con gas oxígeno diatómico para producir dióxido de carbono gaseoso y vapor de agua.
- Las soluciones acuosas de cloruro de magnesio e hidróxido de sodio reaccionan para producir hidróxido de magnesio sólido y cloruro de sodio acuoso.
- El vapor de agua reacciona con el metal de sodio para producir hidróxido de sodio sólido e hidrógeno gaseoso.
S4.1.5
- \(\ce{CaCO3}(s)\rightarrow \ce{CaO}(s)+\ce{CO2}(g)\);
- \(\ce{2C4H10}(g)+\ce{13O2}(g)\rightarrow \ce{8CO2}(g)+\ce{10H2O}(g)\);
- \(\ce{MgCl2}(aq)+\ce{2NaOH}(aq)\rightarrow \ce{Mg(OH)2}(s)+\ce{2NaCl}(aq)\);
- \(\ce{2H2O}(g)+\ce{2Na}(s)\rightarrow \ce{2NaOH}(s)+\ce{H2}(g)\)
Q4.1.6
Escriba una ecuación equilibrada que describa cada una de las siguientes reacciones químicas.
- El clorato de potasio sólido, KClO 3, se descompone para formar cloruro de potasio sólido y oxígeno gaseoso diatómico.
- El metal de aluminio sólido reacciona con yodo diatómico sólido para formar Al 2 I 6 sólido.
- Cuando se agrega cloruro de sodio sólido al ácido sulfúrico acuoso, se producen cloruro de hidrógeno gaseoso y sulfato de sodio acuoso.
- Las soluciones acuosas de ácido fosfórico e hidróxido de potasio reaccionan para producir dihidrogenofosfato de potasio acuoso y agua líquida.
Q4.1.7
Los fuegos artificiales coloridos a menudo implican la descomposición del nitrato de bario y el clorato de potasio y la reacción de los metales magnesio, aluminio y hierro con el oxígeno.
- Escribir las fórmulas de nitrato de bario y clorato de potasio.
- La descomposición del clorato de potasio sólido conduce a la formación de cloruro de potasio sólido y oxígeno gaseoso diatómico. Escribe una ecuación para la reacción.
- La descomposición del nitrato de bario sólido conduce a la formación de óxido de bario sólido, gas nitrógeno diatómico y gas oxígeno diatómico. Escribe una ecuación para la reacción.
- Escribir ecuaciones separadas para las reacciones de los metales sólidos magnesio, aluminio y hierro con gas oxígeno diatómico para producir los óxidos metálicos correspondientes. (Supongamos que el óxido de hierro contiene iones Fe 3+.)
Q4.1.7
- Ba (NO 3) 2, KClO 3;
- \(\ce{2KClO3}(s)\rightarrow \ce{2KCl}(s)+\ce{3O2}(g)\);
- \(\ce{2Ba(NO3)2}(s)\rightarrow \ce{2BaO}(s)+\ce{2N2}(g)+\ce{5O2}(g)\);
- \(\ce{2Mg}(s)+\ce{O2}(g)\rightarrow \ce{2MgO}(s)\);\(\ce{4Al}(s)+\ce{3O2}(g)\rightarrow \ce{2Al2O3}(g)\);\(\ce{4Fe}(s)+\ce{3O2}(g)\rightarrow \ce{2Fe2O3}(s)\)
Q4.1.8
Rellene el blanco con una sola fórmula química para un compuesto covalente que equilibrará la ecuación:
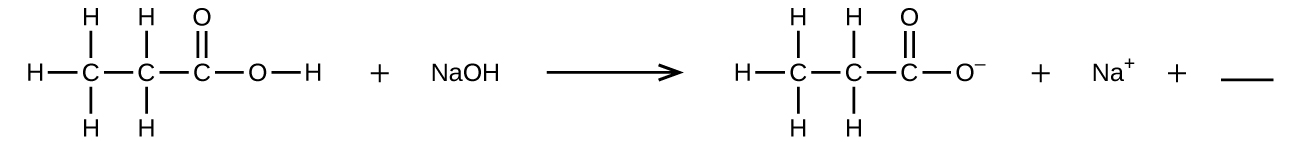
Q4.1.9
El fluoruro de hidrógeno acuoso (ácido fluorhídrico) se utiliza para grabar vidrio y analizar minerales para determinar su contenido de silicio. El fluoruro de hidrógeno también reaccionará con la arena (dióxido de silicio).
- Escribir una ecuación para la reacción de dióxido de silicio sólido con ácido fluorhídrico para producir tetrafluoruro de silicio gaseoso y agua líquida.
- La fluorita mineral (fluoruro de calcio) se presenta extensamente en Illinois. El fluoruro de calcio sólido también se puede preparar mediante la reacción de soluciones acuosas de cloruro de calcio y fluoruro de sodio, produciendo cloruro de sodio acuoso como el otro producto. Escribir ecuaciones iónicas completas y netas para esta reacción.
S4.1.9
- \(\ce{4HF}(aq)+\ce{SiO2}(s)\rightarrow \ce{SiF4}(g)+\ce{2H2O}(l)\);
- ecuación iónica completa:\(\ce{2Na+}(aq)+\ce{2F-}(aq)+\ce{Ca^2+}(aq)+\ce{2Cl-}(aq)\rightarrow \ce{CaF2}(s)+\ce{2Na+}(aq)+\ce{2Cl-}(aq)\), ecuación iónica neta:\(\ce{2F-}(aq)+\ce{Ca^2+}(aq)\rightarrow \ce{CaF2}(s)\)
Q4.1.10
Un nuevo proceso para obtener magnesio a partir del agua de mar implica varias reacciones. Escribe una ecuación química balanceada para cada paso del proceso.
- El primer paso es la descomposición del carbonato de calcio sólido de conchas marinas para formar óxido de calcio sólido y dióxido de carbono gaseoso.
- La segunda etapa es la formación de hidróxido de calcio sólido como único producto de la reacción del óxido de calcio sólido con agua líquida.
- Luego se agrega hidróxido de calcio sólido al agua de mar, reaccionando con cloruro de magnesio disuelto para producir hidróxido de magnesio sólido y cloruro de calcio acuoso.
- El hidróxido de magnesio sólido se agrega a una solución de ácido clorhídrico, produciendo cloruro de magnesio disuelto y agua líquida.
- Finalmente, el cloruro de magnesio se funde y electroliza para producir magnesio metálico líquido y cloro gas diatómico.
Q4.1.11
A partir de las ecuaciones moleculares balanceadas, escriba las ecuaciones iónicas completas y netas iónicas para lo siguiente:
- \(\ce{K2C2O4}(aq)+\ce{Ba(OH)2}(aq)\rightarrow \ce{2KOH}(aq)+\ce{BaC2O2}(s)\)
- \(\ce{Pb(NO3)2}(aq)+\ce{H2SO4}(aq)\rightarrow \ce{PbSO4}(s)+\ce{2HNO3}(aq)\)
- \(\ce{CaCO3}(s)+\ce{H2SO4}(aq)\rightarrow \ce{CaSO4}(s)+\ce{CO2}(g)+\ce{H2O}(l)\)
S4.1.11
- \[\ce{2K+}(aq)+\ce{C2O4^2-}(aq)+\ce{Ba^2+}(aq)+\ce{2OH-}(aq)\rightarrow \ce{2K+}(aq)+\ce{2OH-}(aq)+\ce{BaC2O4}(s)\hspace{20px}\ce{(complete)}\]\[\ce{Ba^2+}(aq)+\ce{C2O4^2-}(aq)\rightarrow \ce{BaC2O4}(s)\hspace{20px}\ce{(net)}\]
- \[\ce{Pb^2+}(aq)+\ce{2NO3-}(aq)+\ce{2H+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{PbSO4}(s)+\ce{2H+}(aq)+\ce{2NO3-}(aq)\hspace{20px}\ce{(complete)}\]\[\ce{Pb^2+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{PbSO4}(s)\hspace{20px}\ce{(net)}\]
- \[\ce{CaCO3}(s)+\ce{2H+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{CaSO4}(s)+\ce{CO2}(g)+\ce{H2O}(l)\hspace{20px}\ce{(complete)}\]\[\ce{CaCO3}(s)+\ce{2H+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{CaSO4}(s)+\ce{CO2}(g)+\ce{H2O}(l)\hspace{20px}\ce{(net)}\]
4.2: Clasificación de reacciones químicas
Q4.2.1
Utilice las siguientes ecuaciones para responder a las siguientes cinco preguntas:
- \(\ce{H2O}(s)\rightarrow \ce{H2O}(l)\)
- \(\ce{Na+}(aq)+\ce{Cl-}(aq)\ce{Ag+}(aq)+\ce{NO3-}(aq) \rightarrow \ce{AgCl}(s)+\ce{Na+}(aq)+\ce{NO3-}(aq)\)
- \(\ce{CH3OH}(g)+\ce{O2}(g)\rightarrow \ce{CO2}(g)+\ce{H2O}(g)\)
- \(\ce{2H2O}(l)\rightarrow \ce{2H2}(g)+\ce{O2}(g)\)
- \(\ce{H+}(aq)+\ce{OH-}(aq)\rightarrow \ce{H2O}(l)\)
- ¿Qué ecuación describe un cambio físico?
- ¿Qué ecuación identifica los reactivos y productos de una reacción de combustión?
- ¿Qué ecuación no está equilibrada?
- ¿Cuál es una ecuación iónica neta?
S4.2.1
a.) i.\(H_2O (solid) → H_2O(liquid)\)
b.) iii.
c.) iii. \(\ce{2CH3OH}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{4H2O}(g)\)
d.) v.
Q4.2.2
Indicar qué tipo, o tipos, de reacción representa cada uno de los siguientes:
- \(\ce{Ca}(s)+\ce{Br2}(l)\rightarrow \ce{CaBr2}(s)\)
- \(\ce{Ca(OH)2}(aq)+\ce{2HBr}(aq)\rightarrow \ce{CaBr2}(aq)+\ce{2H2O}(l)\)
- \(\ce{C6H12}(l)+\ce{9O2}(g)\rightarrow \ce{6CO2}(g)+\ce{6H2O}(g)\)
S4.2.2
oxidación-reducción (adición); ácido-base (neutralización); oxidación-reducción (combustión)
<
Q4.2.3
Indicar qué tipo, o tipos, de reacción representa cada uno de los siguientes:
- \(\ce{H2O}(g)+\ce{C}(s)\rightarrow \ce{CO}(g)+\ce{H2}(g)\)
- \(\ce{2KClO3}(s)\rightarrow \ce{2KCl}(s)+\ce{3O2}(g)\)
- \(\ce{Al(OH)3}(aq)+\ce{3HCl}(aq)\rightarrow \ce{AlBr3}(aq)+\ce{3H2O}(l)\)
- \(\ce{Pb(NO3)2}(aq)+\ce{H2SO4}(aq)\rightarrow \ce{PbSO4}(s)+\ce{2HNO3}(aq)\)
Q4.2.4
La plata se puede separar del oro porque la plata se disuelve en ácido nítrico mientras que el oro no. ¿La disolución de la plata en ácido nítrico es una reacción ácido-base o una reacción de oxidación-reducción? Explica tu respuesta.
S4.2.4
Es una reacción de oxidación-reducción debido a que el estado de oxidación de la plata cambia durante la reacción.
Q4.2.5
Determinar los estados de oxidación de los elementos en los siguientes compuestos:
- NaI
- GdCl 3
- LiN 3
- H 2 Se
- Mg 2 Si
- RbO 2, superóxido de rubidio
- HF
Q4.2.6
Determinar los estados de oxidación de los elementos en los compuestos enumerados. Ninguno de los compuestos que contienen oxígeno son peróxidos o superóxidos.
- H 3 PO 4
- Al (OH) 3
- SeO 2
- KNO 2
- En 2 S 3
- P 4 O 6
S4.2.6
H +1, P +5, O −2; Al +3, H +1, O −2; Se +4, O −2; K +1, N +3, O −2; In +3, S −2; P +3, O −2
Q4.2.7
Determinar los estados de oxidación de los elementos en los compuestos enumerados. Ninguno de los compuestos que contienen oxígeno son peróxidos o superóxidos.
- H 2 SO 4
- Ca (OH) 2
- BroH
- ClnO 2
- TiCL 4
- NaH
S4.2.7
- H 1+, O 2 -, S 6+
- H 1+, O 2 -, Ca +2
- H 1+, O 2 -, Br 1+
- O 2 -, Cl 1-, N 5+
- Cl 1-, Ti 4+
- H 1+, Na 1-
Q4.2.8
Clasifique lo siguiente como reacciones ácido-base o reacciones de oxidación-reducción:
- \(\ce{Na2S}(aq)+\ce{2HCl}(aq)\rightarrow \ce{2NaCl}(aq)+\ce{H2S}(g)\)
- \(\ce{2Na}(s)+\ce{2HCl}(aq)\rightarrow \ce{2NaCl}(aq)+\ce{H2}(g)\)
- \(\ce{Mg}(s)+\ce{Cl2}(g)\rightarrow \ce{MgCl2}(s)\)
- \(\ce{MgO}(s)+\ce{2HCl}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{H2O}(l)\)
- \(\ce{K3P}(s)+\ce{2O2}(g)\rightarrow \ce{K3PO4}(s)\)
- \(\ce{3KOH}(aq)+\ce{H3PO4}(aq)\rightarrow \ce{K3PO4}(aq)+\ce{3H2O}(l)\)
S4.2.9
ácido-base; oxidación-reducción: Na se oxida, H + se reduce; oxidación-reducción: Mg se oxida, Cl 2 se reduce; ácido-base; oxidación-reducción: P3− se oxida, O 2 se reduce; ácido-base
Q4.2.10
Identificar los átomos que se oxidan y reducen, el cambio en el estado de oxidación para cada uno, y los agentes oxidantes y reductores en cada una de las siguientes ecuaciones:
- \(\ce{Mg}(s)+\ce{NiCl2}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{Ni}(s)\)
- \(\ce{PCl3}(l)+\ce{Cl2}(g)\rightarrow \ce{PCl5}(s)\)
- \(\ce{C2H4}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{2H2O}(g)\)
- \(\ce{Zn}(s)+\ce{H2SO4}(aq)\rightarrow \ce{ZnSO4}(aq)+\ce{H2}(g)\)
- \(\ce{2K2S2O3}(s)+\ce{I2}(s)\rightarrow \ce{K2S4O6}(s)+\ce{2KI}(s)\)
- \(\ce{3Cu}(s)+\ce{8HNO3}(aq)\rightarrow\ce{3Cu(NO3)2}(aq)+\ce{2NO}(g)+\ce{4H2O}(l)\)
Q4.2.11
Completa y equilibra las siguientes ecuaciones ácido-base:
- El gas HCl reacciona con Ca (OH) 2 (s) sólido.
- Se agrega una solución de Sr (OH) 2 a una solución de HNO 3.
S4.2.11
- \(\ce{2HCl}(g)+\ce{Ca(OH)2}(s)\rightarrow \ce{CaCl2}(s)+\ce{2H2O}(l)\);
- \(\ce{Sr(OH)2}(aq)+\ce{2HNO3}(aq)\rightarrow \ce{Sr(NO3)2}(aq)+\ce{2H2O}(l)\)
Q4.2.12
Completa y equilibra las siguientes ecuaciones ácido-base:
- Se agrega una solución de HClO 4 a una solución de LiOH.
- El H 2 SO 4 acuoso reacciona con NaOH.
- Ba (OH) 2 reacciona con gas HF.
Q4.2.13
Completar y equilibrar las siguientes reacciones de oxidación-reducción, las cuales dan el mayor estado de oxidación posible para los átomos oxidados.
- \(\ce{Al}(s)+\ce{F2}(g)\rightarrow\)
- \(\ce{Al}(s)+\ce{CuBr2}(aq)\rightarrow\)(desplazamiento único)
- \(\ce{P4}(s)+\ce{O2}(g)\rightarrow \)
- \(\ce{Ca}(s)+\ce{H2O}(l)\rightarrow \)(los productos son una base fuerte y un gas diatómico)
S4.2.13
- \(\ce{2Al}(s)+\ce{3F2}(g)\rightarrow \ce{2AlF3}(s)\);
- \(\ce{2Al}(s)+\ce{3CuBr2}(aq)\rightarrow \ce{3Cu}(s)+\ce{2AlBr3}(aq)\);
- \(\ce{P4}(s)+\ce{5O2}(g)\rightarrow \ce{P4O10}(s)\);\(\ce{Ca}(s)+\ce{2H2O}(l)\rightarrow \ce{Ca(OH)2}(aq)+\ce{H2}(g)\)
Q4.2.14
Completar y equilibrar las siguientes reacciones de oxidación-reducción, las cuales dan el mayor estado de oxidación posible para los átomos oxidados.
- \(\ce{K}(s)+\ce{H2O}(l)\rightarrow \)
- \(\ce{Ba}(s)+\ce{HBr}(aq)\rightarrow \)
- \(\ce{Sn}(s)+\ce{I2}(s)\rightarrow \)
Q4.2.15
Completar y equilibrar las ecuaciones para las siguientes reacciones de neutralización ácido-base. Si se usa agua como disolvente, escriba los reactivos y productos como iones acuosos. En algunos casos, puede haber más de una respuesta correcta, dependiendo de las cantidades de reactivos utilizados.
- \(\ce{Mg(OH)2}(s)+\ce{HClO4}(aq)\rightarrow \)
- \(\ce{SO3}(g)+\ce{H2O}(l)\rightarrow \)(asumir un exceso de agua y que el producto se disuelve)
- \(\ce{SrO}(s)+\ce{H2SO4}(l)\rightarrow \)
S4.2.15
- \(\ce{Mg(OH)2}(s)+\ce{2HClO4}(aq)\rightarrow \ce{Mg^2+}(aq)+\ce{2ClO4-}(aq)+\ce{2H2O}(l)\);
- \(\ce{SO3}(g)+\ce{2H2O}(l)\rightarrow \ce{H3O+}(aq)+\ce{HSO4-}(aq)\), (una solución de H 2 SO 4);
- \(\ce{SrO}(s)+\ce{H2SO4}(l)\rightarrow \ce{SrSO4}(s)+\ce{H2O}\)
Q4.2.16
Cuando se calientan a 700—800 °C, los diamantes, que son carbono puro, son oxidados por el oxígeno atmosférico. (¡Se queman!) Escribe la ecuación equilibrada para esta reacción.
Q4.2.17
Los militares han experimentado con láseres que producen una luz muy intensa cuando el flúor se combina explosivamente con el hidrógeno. ¿Cuál es la ecuación equilibrada para esta reacción?
S4.2.17
\(\ce{H2}(g)+\ce{F2}(g)\rightarrow \ce{2HF}(g)\)
Q4.2.18
Escriba las ecuaciones molecular, iónica total y neta iónica para las siguientes reacciones:
- \(\ce{Ca(OH)2}(aq)+\ce{HC2H3O2}(aq)\rightarrow \)
- \(\ce{H3PO4}(aq)+\ce{CaCl2}(aq)\rightarrow \)
Q4.2.19
Great Lakes Chemical Company produce bromo, Br 2, a partir de sales de bromuro como NaBr, en salmuera de Arkansas mediante el tratamiento de la salmuera con gas cloro. Escribir una ecuación equilibrada para la reacción de NaBr con Cl 2.
S4.2.19
\(\ce{2NaBr}(aq)+\ce{Cl2}(g)\rightarrow \ce{2NaCl}(aq)+\ce{Br2}(l)\)
Q4.2.20
En un experimento común en el laboratorio de química general, el magnesio metálico se calienta al aire para producir MgO. El MgO es un sólido blanco, pero en estos experimentos suele verse gris, debido a pequeñas cantidades de Mg 3 N 2, un compuesto formado a medida que parte del magnesio reacciona con el nitrógeno. Escribe una ecuación equilibrada para cada reacción.
Q4.2.21
El hidróxido de litio se puede utilizar para absorber dióxido de carbono en ambientes cerrados, como naves espaciales tripuladas y submarinos. Escribir una ecuación para la reacción que involucre 2 mol de LiOH por 1 mol de CO 2. (Pista: El agua es uno de los productos.)
S4.2.21
\(\ce{2LiOH}(aq)+\ce{CO2}(g)\rightarrow \ce{Li2CO3}(aq)+\ce{H2O}(l)\)
Q4.2.22
A veces se agrega propionato de calcio al pan para retardar el deterioro. Este compuesto se puede preparar mediante la reacción de carbonato de calcio, CaCO 3, con ácido propiónico, C 2 H 5 CO 2 H, el cual tiene propiedades similares a las del ácido acético. Escribir la ecuación equilibrada para la formación de propionato de calcio.
Q4.2.23
Completar y equilibrar las ecuaciones de las siguientes reacciones, cada una de las cuales podría usarse para eliminar sulfuro de hidrógeno del gas natural:
- \(\ce{Ca(OH)2}(s)+\ce{H2S}(g) \rightarrow\)
- \(\ce{Na2CO3}(aq)+\ce{H2S}(g)\rightarrow \)
S4.2.23
- \(\ce{Ca(OH)2}(s)+\ce{H2S}(g)\rightarrow \ce{CaS}(s)+\ce{2H2O}(l)\);
- \(\ce{Na2CO3}(aq)+\ce{H2S}(g)\rightarrow \ce{Na2S}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\)
Q4.2.24
El sulfuro de cobre (II) es oxidado por oxígeno molecular para producir trióxido de azufre gaseoso y óxido de cobre sólido (II). El producto gaseoso reacciona entonces con agua líquida para producir hidrógeno sulfato líquido como único producto. Escribe las dos ecuaciones que representan estas reacciones.
Q4.2.25
Escribir ecuaciones químicas balanceadas para las reacciones utilizadas para preparar cada uno de los siguientes compuestos a partir del (los) material (s) de partida dado (s). En algunos casos, pueden requerirse reactivos adicionales.
- nitrato de amonio sólido a partir de nitrógeno molecular gaseoso a través de un proceso de dos etapas (primero reducir el nitrógeno a amoníaco, luego neutralizar el amoníaco con un ácido apropiado)
- bromuro de hidrógeno gaseoso a partir de bromo molecular líquido a través de una reacción redox de una etapa
- H 2 S gaseoso de Zn sólido y S a través de un proceso de dos etapas (primero una reacción redox entre los materiales de partida, luego reacción del producto con un ácido fuerte)
S4.2.25
- paso 1:\(\ce{N2}(g)+\ce{3H2}(g)\rightarrow \ce{2NH3}(g)\), paso 2:\(\ce{NH3}(g)+\ce{HNO3}(aq)\rightarrow \ce{NH4NO3}(aq)\rightarrow \ce{NH4NO3}(s)\ce{(after\: drying)}\);
- \(\ce{H2}(g)+\ce{Br2}(l)\rightarrow \ce{2HBr}(g)\);
- \(\ce{Zn}(s)+\ce{S}(s)\rightarrow \ce{ZnS}(s)\)y\(\ce{ZnS}(s)+\ce{2HCl}(aq)\rightarrow \ce{ZnCl2}(aq)+\ce{H2S}(g)\)
Q4.2.26
Ciclamato de calcio Ca (C 6 H 11 NHSO 3) 2 es un edulcorante artificial utilizado en muchos países del mundo pero está prohibido en Estados Unidos. Se puede purificar industrialmente convirtiéndola en la sal de bario a través de la reacción del ácido C 6 H 11 NHSO 3 H con carbonato de bario, tratamiento con ácido sulfúrico (el sulfato de bario es muy insoluble), y luego neutralización con hidróxido de calcio. Escribe las ecuaciones balanceadas para estas reacciones.
Q4.2.27
Completar y equilibrar cada una de las siguientes semi-reacciones (etapas 2—5 en el método de semirreacción):
- \(\ce{Sn^4+}(aq)\rightarrow \ce{Sn^2+}(aq)\)
- \(\ce{[Ag(NH3)2]+}(aq)\rightarrow \ce{Ag}(s)+\ce{NH3}(aq)\)
- \(\ce{Hg2Cl2}(s)\rightarrow \ce{Hg}(l)+\ce{Cl-}(aq)\)
- \(\ce{H2O}(l)\rightarrow \ce{O2}(g)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{IO3-}(aq)\rightarrow \ce{I2}(s)\)
- \(\ce{SO3^2-}(aq)\rightarrow \ce{SO4^2-}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{MnO4-}(aq)\rightarrow \ce{Mn^2+}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{Cl-}(aq)\rightarrow \ce{ClO3-}(aq)\ce{\:(in\: basic\: solution)}\)
S4.2.27
- \(\ce{Sn^4+}(aq)+\ce{2e-}\rightarrow \ce{Sn^2+}(aq)\),
- \(\ce{[Ag(NH3)2]+}(aq)+ \ce{e-} \rightarrow \ce{Ag}(s)+\ce{2NH3}(aq)\);
- \(\ce{Hg2Cl2}(s)+ \ce{2e-} \rightarrow \ce{2Hg}(l)+\ce{2Cl-}(aq)\);
- \(\ce{2H2O}(l)\rightarrow \ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-}\);
- \(\ce{6H2O}(l)+\ce{2IO3-}(aq)+\ce{10e-}\rightarrow \ce{I2}(s)+\ce{12OH-}(aq)\);
- \(\ce{H2O}(l)+\ce{SO3^2-}(aq)\rightarrow \ce{SO4^2-}(aq)+\ce{2H+}(aq)+\ce{2e-}\);
- g)\(\ce{8H+}(aq)+\ce{MnO4-}(aq)+\ce{5e-}\rightarrow \ce{Mn^2+}(aq)+\ce{4H2O}(l)\);
- h)\(\ce{Cl-}(aq)+\ce{6OH-}(aq)\rightarrow \ce{ClO3-}(aq)+\ce{3H2O}(l)+\ce{6e-}\)
Q4.2.28
Completar y equilibrar cada una de las siguientes semi-reacciones (etapas 2—5 en el método de semirreacción):
- \(\ce{Cr^2+}(aq)\rightarrow \ce{Cr^3+}(aq)\)
- \(\ce{Hg}(l)+\ce{Br-}(aq)\rightarrow \ce{HgBr4^2-}(aq)\)
- \(\ce{ZnS}(s)\rightarrow \ce{Zn}(s)+\ce{S^2-}(aq)\)
- \(\ce{H2}(g)\rightarrow \ce{H2O}(l)\ce{\:(in\: basic\: solution)}\)
- \(\ce{H2}(g)\rightarrow \ce{H3O+}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{NO3-}(aq)\rightarrow \ce{HNO2}(aq)\ce{\:(in\: acidic\: solution)}\)
- \(\ce{MnO2}(s)\rightarrow \ce{MnO4-}(aq)\ce{\:(in\: basic\: solution)}\)
- \(\ce{Cl-}(aq)\rightarrow \ce{ClO3-}(aq)\ce{\:(in\: acidic\: solution)}\)
Q4.2.29
Equilibrar cada una de las siguientes ecuaciones según el método de media reacción:
- \(\ce{Sn^2+}(aq)+\ce{Cu^2+}(aq)\rightarrow \ce{Sn^4+}(aq)+\ce{Cu+}(aq)\)
- \(\ce{H2S}(g)+\ce{Hg2^2+}(aq)\rightarrow \ce{Hg}(l)+\ce{S}(s)\ce{\:(in\: acid)}\)
- \(\ce{CN-}(aq)+\ce{ClO2}(aq)\rightarrow \ce{CNO-}(aq)+\ce{Cl-}(aq)\ce{\:(in\: acid)}\)
- \(\ce{Fe^2+}(aq)+\ce{Ce^4+}(aq)\rightarrow \ce{Fe^3+}(aq)+\ce{Ce^3+}(aq)\)
- \(\ce{HBrO}(aq)\rightarrow \ce{Br-}(aq)+\ce{O2}(g)\ce{\:(in\: acid)}\)
S4.2.29
- \(\ce{Sn^2+}(aq)+\ce{2Cu^2+}(aq)\rightarrow \ce{Sn^4+}(aq)+\ce{2Cu+}(aq)\);
- \(\ce{H2S}(g)+\ce{Hg2^2+}(aq)+\ce{2H2O}(l)\rightarrow \ce{2Hg}(l)+\ce{S}(s)+\ce{2H3O+}(aq)\);
- \(\ce{5CN-}(aq)+\ce{2ClO2}(aq)+\ce{3H2O}(l)\rightarrow \ce{5CNO-}(aq)+\ce{2Cl-}(aq)+\ce{2H3O+}(aq)\);
- \(\ce{Fe^2+}(aq)+\ce{Ce^4+}(aq)\rightarrow \ce{Fe^3+}(aq)+\ce{Ce^3+}(aq)\);
- \(\ce{2HBrO}(aq)+\ce{2H2O}(l)\rightarrow \ce{2H3O+}(aq)+\ce{2Br-}(aq)+\ce{O2}(g)\)
Q4.2.30
Equilibrar cada una de las siguientes ecuaciones según el método de media reacción:
- \(\ce{Zn}(s)+\ce{NO3-}(aq)\rightarrow \ce{Zn^2+}(aq)+\ce{N2}(g)\ce{\:(in\: acid)}\)
- \(\ce{Zn}(s)+\ce{NO3-}(aq)\rightarrow \ce{Zn^2+}(aq)+\ce{NH3}(aq)\ce{\:(in\: base)}\)
- \(\ce{CuS}(s)+\ce{NO3-}(aq)\rightarrow \ce{Cu^2+}(aq)+\ce{S}(s)+\ce{NO}(g)\ce{\:(in\: acid)}\)
- \(\ce{NH3}(aq)+\ce{O2}(g)\rightarrow \ce{NO2}(g)\ce{\:(gas\: phase)}\)
- \(\ce{Cl2}(g)+\ce{OH-}(aq)\rightarrow \ce{Cl-}(aq)+\ce{ClO3-}(aq)\ce{\:(in\: base)}\)
- \(\ce{H2O2}(aq)+\ce{MnO4-}(aq)\rightarrow \ce{Mn^2+}(aq)+\ce{O2}(g)\ce{\:(in\: acid)}\)
- \(\ce{NO2}(g)\rightarrow \ce{NO3-}(aq)+\ce{NO2-}(aq)\ce{\:(in\: base)}\)
- \(\ce{Fe^3+}(aq)+\ce{I-}(aq)\rightarrow \ce{Fe^2+}(aq)+\ce{I2}(aq)\)
Q4.2.31
Equilibrar cada una de las siguientes ecuaciones según el método de media reacción:
- \(\ce{MnO4-}(aq)+\ce{NO2-}(aq)\rightarrow \ce{MnO2}(s)+\ce{NO3-}(aq)\ce{\:(in\: base)}\)
- \(\ce{MnO4^2-}(aq)\rightarrow \ce{MnO4-}(aq)+\ce{MnO2}(s)\ce{\:(in\: base)}\)
- \(\ce{Br2}(l)+\ce{SO2}(g)\rightarrow \ce{Br-}(aq)+\ce{SO4^2-}(aq)\ce{\:(in\: acid)}\)
S4.2.31
- \(\ce{2MnO4-}(aq)+\ce{3NO2-}(aq)+\ce{H2O}(l)\rightarrow \ce{2MnO2}(s)+\ce{3NO3-}(aq)+\ce{2OH-}(aq)\);
- \(\ce{3MnO4^2-}(aq)+\ce{2H2O}(l)\rightarrow \ce{2MnO4-}(aq)+\ce{4OH-}(aq)+\ce{MnO2}(s)\ce{\:(in\: base)}\);
- \(\ce{Br2}(l)+\ce{SO2}(g)+\ce{2H2O}(l)\rightarrow \ce{4H+}(aq)+\ce{2Br-}(aq)+\ce{SO4^2-}(aq)\)
4.3: Estequiometría de Reacción
Q4.3.1
Escriba la ecuación balanceada, luego delinear los pasos necesarios para determinar la información solicitada en cada uno de los siguientes:
- El número de moles y la masa de cloro, Cl 2, requirieron para reaccionar con 10.0 g de sodio metálico, Na, para producir cloruro de sodio, NaCl.
- El número de moles y la masa de oxígeno formada por la descomposición de 1.252 g de óxido de mercurio (II).
- El número de moles y la masa de nitrato de sodio, NaNO 3, requirieron para producir 128 g de oxígeno. (Nano 2 es el otro producto.)
- El número de moles y la masa de dióxido de carbono formada por la combustión de 20.0 kg de carbono en exceso de oxígeno.
- El número de moles y la masa de carbonato de cobre (II) necesarios para producir 1.500 kg de óxido de cobre (II). (CO 2 es el otro producto.)

Q4.3.2
Determinar el número de moles y la masa solicitada para cada reacción en Ejercicio.
S4.3.2
0.435 mol Na, 0.217 mol Cl 2, 15.4 g Cl 2; 0.005780 mol de HGO, 2.890 × 10 −3 mol O 2, 9.248 × 10 −2 g O 2; 8.00 mol de NaNO 3, 6.8 × 10 2 g de NaNO 3; 1665 mol CO 2, 73.3 kg CO 2 ; 18.86 mol CuO, 2.330 kg CuCo 3; 0.4580 mol C 2 H 4 Br 2, 86.05 g C 2 H 4 Br 2
Q4.3.3
Escriba la ecuación balanceada, luego delinear los pasos necesarios para determinar la información solicitada en cada uno de los siguientes:
- El número de moles y la masa de Mg requeridos para reaccionar con 5.00 g de HCl y producir MgCl 2 y H 2.
- El número de moles y la masa de oxígeno formada por la descomposición de 1.252 g de óxido de plata (I).
- El número de moles y la masa de carbonato de magnesio, MgCO 3, requirieron para producir 283 g de dióxido de carbono. (MgO es el otro producto.)
- El número de moles y la masa de agua formada por la combustión de 20.0 kg de acetileno, C 2 H 2, en exceso de oxígeno.
- El número de moles y la masa de peróxido de bario, BaO 2, necesarios para producir 2.500 kg de óxido de bario, BaO (O 2 es el otro producto.)

Q4.3.4
Determinar el número de moles y la masa solicitada para cada reacción en Ejercicio.
S4.3.4
0.0686 mol Mg, 1.67 g Mg; 2.701 × 10 −3 mol O 2, 0.08644 g O 2; 6.43 mol MgCO 3, 542 g MgCO 3 713 mol H 2 O, 12.8 kg H 2 O; 16.31 mol BaO 2, 2762 g BaO 2; 0.207 mol C 2 H 4 , 5.81 g C 2 H 4
Q4.3.5
H 2 se produce por la reacción de 118.5 mL de una solución 0.8775-M de H 3 PO 4 de acuerdo con la siguiente ecuación:\(\ce{2Cr + 2H3PO4 \rightarrow 3H2 + 2CrPO4}\).
- Outline the steps necessary to determine the number of moles and mass of H2.
- Perform the calculations outlined.
S4.3.5
a.)
- Convert mL to L
- Multiply L by the molarity to determine moles of H3PO4
- Convert moles of H3PO4 to moles of H2
- Multiply moles of H2 by the molar mass of H2 to get the answer in grams
b.)
1. \(118.5\: mL\times \dfrac{1\: L}{1000\: mL} = 0.1185\: L\)
2. \(0.1185\: L \times \dfrac{0.8775\: moles\: \ce{H3PO4}}{1\: L} = 0.1040\: moles\: \ce{H3PO4}\)
3. \(0.1040\: moles\: \ce{H3PO4} \times \dfrac{3\: moles\:\ce{H_2}}{2\: moles\: \ce{H3PO4}} = 0.1560\: moles\: \ce{H2}\)
4. \(0.1560\: moles\: \ce{H2} \times \dfrac{2.02 g}{1\: mole} = 0.3151g\: \ce{H2}\)
Q4.3.6
Gallium chloride is formed by the reaction of 2.6 L of a 1.44 M solution of HCl according to the following equation: \(\ce{2Ga + 6HCl \rightarrow 2GaCl3 + 3H2}\).
- Outline the steps necessary to determine the number of moles and mass of gallium chloride.
- Perform the calculations outlined.
S4.3.6
\(\mathrm{volume\: HCl\: solution \rightarrow mol\: HCl \rightarrow mol\: GaCl_3}\); 1.25 mol GaCl3, 2.2 × 102 g GaCl3
Q4.3.7
I2 is produced by the reaction of 0.4235 mol of CuCl2 according to the following equation: \(\ce{2CuCl2 + 4KI \rightarrow 2CuI + 4KCl + I2}\).
- How many molecules of I2 are produced?
- What mass of I2 is produced?
Q4.3.8
Silver is often extracted from ores as K[Ag(CN)2] and then recovered by the reaction
\(\ce{2K[Ag(CN)2]}(aq)+\ce{Zn}(s)\rightarrow \ce{2Ag}(s)+\ce{Zn(CN)2}(aq)+\ce{2KCN}(aq)\)
- How many molecules of Zn(CN)2 are produced by the reaction of 35.27 g of K[Ag(CN)2]?
- What mass of Zn(CN)2 is produced?
S4.3.8
5.337 × 1022 molecules; 10.41 g Zn(CN)2
Q4.3.9
What mass of silver oxide, Ag2O, is required to produce 25.0 g of silver sulfadiazine, AgC10H9N4SO2, from the reaction of silver oxide and sulfadiazine?
\(\ce{2C10H10N4SO2 + Ag2O \rightarrow 2AgC10H9N4SO2 + H2O}\)
Q4.3.10
Carborundum is silicon carbide, SiC, a very hard material used as an abrasive on sandpaper and in other applications. It is prepared by the reaction of pure sand, SiO2, with carbon at high temperature. Carbon monoxide, CO, is the other product of this reaction. Write the balanced equation for the reaction, and calculate how much SiO2 is required to produce 3.00 kg of SiC.
S4.3.10
\(\ce{SiO2 + 3C \rightarrow SiC + 2CO}\), 4.50 kg SiO2
Q4.3.11
Automotive air bags inflate when a sample of sodium azide, NaN3, is very rapidly decomposed.
\(\ce{2NaN3}(s) \rightarrow \ce{2Na}(s) + \ce{3N2}(g)\)
What mass of sodium azide is required to produce 2.6 ft3 (73.6 L) of nitrogen gas with a density of 1.25 g/L?
S4.3.11
142g NaN3
Q4.3.12
Urea, CO(NH2)2, is manufactured on a large scale for use in producing urea-formaldehyde plastics and as a fertilizer. What is the maximum mass of urea that can be manufactured from the CO2 produced by combustion of 1.00×103 kg of carbon followed by the reaction?
\[\ce{CO2}(g)+\ce{2NH3}(g)\rightarrow \ce{CO(NH2)2}(s)+\ce{H2O}(l)\]
S4.3.12
5.00 × 103 kg
Q4.3.13
In an accident, a solution containing 2.5 kg of nitric acid was spilled. Two kilograms of Na2CO3 was quickly spread on the area and CO2 was released by the reaction. Was sufficient Na2CO3 used to neutralize all of the acid?
Q4.3.14
A compact car gets 37.5 miles per gallon on the highway. If gasoline contains 84.2% carbon by mass and has a density of 0.8205 g/mL, determine the mass of carbon dioxide produced during a 500-mile trip (3.785 liters per gallon).
S4.3.14
1.28 × 105 g CO2
Q4.3.15
What volume of a 0.750 M solution of hydrochloric acid, a solution of HCl, can be prepared from the HCl produced by the reaction of 25.0 g of NaCl with an excess of sulfuric acid?
\[\ce{NaCl}(s)+\ce{H2SO4}(l)\rightarrow \ce{HCl}(g)+\ce{NaHSO4}(s)\]
Q4.3.16
What volume of a 0.2089 M KI solution contains enough KI to react exactly with the Cu(NO3)2 in 43.88 mL of a 0.3842 M solution of Cu(NO3)2?
\[\ce{2Cu(NO3)2 + 4KI \rightarrow 2CuI + I2 + 4KNO3}\]
S4.3.16
161.40 mL KI solution
Q4.3.17
A mordant is a substance that combines with a dye to produce a stable fixed color in a dyed fabric. Calcium acetate is used as a mordant. It is prepared by the reaction of acetic acid with calcium hydroxide.
\[\ce{2CH3CO2H + Ca(OH)2 \rightarrow Ca(CH3CO2)2 + 2H2O}\]
What mass of Ca(OH)2 is required to react with the acetic acid in 25.0 mL of a solution having a density of 1.065 g/mL and containing 58.0% acetic acid by mass?
Q4.3.18
The toxic pigment called white lead, Pb3(OH)2(CO3)2, has been replaced in white paints by rutile, TiO2. How much rutile (g) can be prepared from 379 g of an ore that contains 88.3% ilmenite (FeTiO3) by mass?
\[\ce{2FeTiO3 + 4HCl + Cl2 \rightarrow 2FeCl3 + 2TiO2 + 2H2O}\]
S4.3.18
176 g TiO2
4.4: Reaction Yields
Q4.4.1
The following quantities are placed in a container: 1.5 × 1024 atoms of hydrogen, 1.0 mol of sulfur, and 88.0 g of diatomic oxygen.
- What is the total mass in grams for the collection of all three elements?
- What is the total number of moles of atoms for the three elements?
- If the mixture of the three elements formed a compound with molecules that contain two hydrogen atoms, one sulfur atom, and four oxygen atoms, which substance is consumed first?
- How many atoms of each remaining element would remain unreacted in the change described in ?
Q4.4.2
What is the limiting reactant in a reaction that produces sodium chloride from 8 g of sodium and 8 g of diatomic chlorine?
S4.4.2
The limiting reactant is Cl2.
Q4.4.3
Which of the postulates of Dalton's atomic theory explains why we can calculate a theoretical yield for a chemical reaction?
Q4.4.4
A student isolated 25 g of a compound following a procedure that would theoretically yield 81 g. What was his percent yield?
S4.4.4
\(\mathrm{Percent\: yield = 31\%}\)
Q4.4.5
A sample of 0.53 g of carbon dioxide was obtained by heating 1.31 g of calcium carbonate. What is the percent yield for this reaction?
\[\ce{CaCO3}(s)\rightarrow \ce{CaO}(s)+\ce{CO2}(s)\]
Q4.4.6
Freon-12, CCl2F2, is prepared from CCl4 by reaction with HF. The other product of this reaction is HCl. Outline the steps needed to determine the percent yield of a reaction that produces 12.5 g of CCl2F2 from 32.9 g of CCl4. Freon-12 has been banned and is no longer used as a refrigerant because it catalyzes the decomposition of ozone and has a very long lifetime in the atmosphere. Determine the percent yield.
S4.4.6
\(\ce{g\: CCl4\rightarrow mol\: CCl4\rightarrow mol\: CCl2F2 \rightarrow g\: CCl2F2}, \mathrm{\:percent\: yield=48.3\%}\)
Q4.4.7
Citric acid, C6H8O7, a component of jams, jellies, and fruity soft drinks, is prepared industrially via fermentation of sucrose by the mold Aspergillus niger. The equation representing this reaction is
\[\ce{C12H22O11 + H2O + 3O2 \rightarrow 2C6H8O7 + 4H2O}\]
What mass of citric acid is produced from exactly 1 metric ton (1.000 × 103 kg) of sucrose if the yield is 92.30%?
Q4.4.8
Toluene, C6H5CH3, is oxidized by air under carefully controlled conditions to benzoic acid, C6H5CO2H, which is used to prepare the food preservative sodium benzoate, C6H5CO2Na. What is the percent yield of a reaction that converts 1.000 kg of toluene to 1.21 kg of benzoic acid?
\[\ce{2C6H5CH3 + 3O2 \rightarrow 2C6H5CO2H + 2H2O}\]
S4.4.8
\(\mathrm{percent\: yield=91.3\%}\)
Q4.4.9
In a laboratory experiment, the reaction of 3.0 mol of H2 with 2.0 mol of I2 produced 1.0 mol of HI. Determine the theoretical yield in grams and the percent yield for this reaction.
Q4.4.10
Outline the steps needed to solve the following problem, then do the calculations. Ether, (C2H5)2O, which was originally used as an anesthetic but has been replaced by safer and more effective medications, is prepared by the reaction of ethanol with sulfuric acid.
2C2H5OH + H2SO4 ⟶ (C2H5)2 + H2SO4·H2O
Q4.4.11
What is the percent yield of ether if 1.17 L (d = 0.7134 g/mL) is isolated from the reaction of 1.500 L of C2H5OH (d = 0.7894 g/mL)?
S4.4.11
Convert mass of ethanol to moles of ethanol; relate the moles of ethanol to the moles of ether produced using the stoichiometry of the balanced equation. Convert moles of ether to grams; divide the actual grams of ether (determined through the density) by the theoretical mass to determine the percent yield; 87.6%
Q4.4.12
Outline the steps needed to determine the limiting reactant when 30.0 g of propane, C3H8, is burned with 75.0 g of oxygen.
\[\mathrm{percent\: yield=\dfrac{0.8347\:\cancel{g}}{0.9525\:\cancel{g}}\times 100\%=87.6\%}\]
Determine the limiting reactant.
Q4.4.13
Outline the steps needed to determine the limiting reactant when 0.50 g of Cr and 0.75 g of H3PO4 react according to the following chemical equation?
\[\ce{2Cr + 2H3PO4 \rightarrow 2CrPO4 + 3H2}\]
Determine the limiting reactant.
S4.4.13
The conversion needed is \(\ce{mol\: Cr \rightarrow mol\: H2PO4}\). Then compare the amount of Cr to the amount of acid present. Cr is the limiting reactant.
Q4.4.14
What is the limiting reactant when 1.50 g of lithium and 1.50 g of nitrogen combine to form lithium nitride, a component of advanced batteries, according to the following unbalanced equation?
\[\ce{Li + N2 \rightarrow Li3N}\]
S4.4.14
\[\ce{6Li} + \ce{N2} \rightarrow \: \ce{2Li3N}\]
\[1.50g\: \ce{Li} \times \dfrac{1\: mole\: \ce{Li}}{6.94g\: \ce{Li}} \times\dfrac{2\: mole\: \ce{Li3N}}{6\:mole\: \ce{Li}} = 0.0720\: moles\: \ce{Li3N}\]
\[1.50g\: \ce{N2} \times \dfrac{1\: mole\: \ce{N2}}{28.02g\: \ce{N2}} \times\dfrac{2\: mole\: \ce{Li3N}}{1\:mole\: \ce{N2}} = 0.107\: moles\: \ce{Li3N}\]
\(\ce{Li}\) is the limiting reactant
Q4.4.15
Uranium can be isolated from its ores by dissolving it as UO2(NO3)2, then separating it as solid UO2(C2O4)·3H2O. Addition of 0.4031 g of sodium oxalate, Na2C2O4, to a solution containing 1.481 g of uranyl nitrate, UO2(NO2)2, yields 1.073 g of solid UO2(C2O4)·3H2O.
\[\ce{Na2C2O4 + UO2(NO3)2 + 3H2O ⟶ UO2(C2O4)·3H2O + 2NaNO3}\]
Determine the limiting reactant and the percent yield of this reaction.
S4.4.15
Na2C2O4 is the limiting reactant. percent yield = 86.6%
Q4.4.16
How many molecules of C2H4Cl2 can be prepared from 15 C2H4 molecules and 8 Cl2 molecules?
Q4.4.17
How many molecules of the sweetener saccharin can be prepared from 30 C atoms, 25 H atoms, 12 O atoms, 8 S atoms, and 14 N atoms?
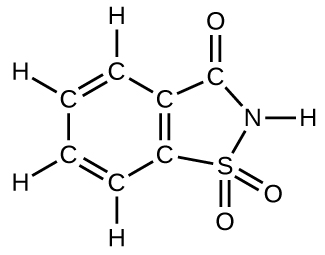
S4.4.17
Only four molecules can be made.
Q4.4.18
The phosphorus pentoxide used to produce phosphoric acid for cola soft drinks is prepared by burning phosphorus in oxygen.
- What is the limiting reactant when 0.200 mol of P4 and 0.200 mol of O2 react according to \[\ce{P4 + 5O2 \rightarrow P4O10}\]
- Calculate the percent yield if 10.0 g of P4O10 is isolated from the reaction.
Q4.4.19
Would you agree to buy 1 trillion (1,000,000,000,000) gold atoms for $5? Explain why or why not. Find the current price of gold at http://money.cnn.com/data/commodities/ \(\mathrm{(1\: troy\: ounce=31.1\: g)}\)
S4.4.19
This amount cannot be weighted by ordinary balances and is worthless.
4.5: Quantitative Chemical Analysis
Q4.5.1
What volume of 0.0105-M HBr solution is be required to titrate 125 mL of a 0.0100-M Ca(OH)2 solution?
\[\ce{Ca(OH)2}(aq)+\ce{2HBr}(aq) \rightarrow \ce{CaBr2}(aq)+\ce{2H2O}(l)\]
Q4.5.2
Titration of a 20.0-mL sample of acid rain required 1.7 mL of 0.0811 M NaOH to reach the end point. If we assume that the acidity of the rain is due to the presence of sulfuric acid, what was the concentration of sulfuric acid in this sample of rain?
S4.5.2
3.4 × 10−3 M H2SO4
Q4.5.3
What is the concentration of NaCl in a solution if titration of 15.00 mL of the solution with 0.2503 M AgNO3 requires 20.22 mL of the AgNO3 solution to reach the end point?
\[\ce{AgNO3}(aq)+\ce{NaCl}(aq)\rightarrow \ce{AgCl}(s)+\ce{NaNO3}(aq)\]
Q4.5.4
In a common medical laboratory determination of the concentration of free chloride ion in blood serum, a serum sample is titrated with a Hg(NO3)2 solution.
\[\ce{2Cl-}(aq)+\ce{Hg(NO3)2}(aq)\rightarrow \ce{2NO3-}(aq)+\ce{HgCl2}(s)\]
What is the Cl− concentration in a 0.25-mL sample of normal serum that requires 1.46 mL of 5.25 × 10−4 M Hg(NO3)2(aq) to reach the end point?
S4.5.4
9.6 × 10−3 M Cl−
Q4.5.5
Potatoes can be peeled commercially by soaking them in a 3-M to 6-M solution of sodium hydroxide, then removing the loosened skins by spraying them with water. Does a sodium hydroxide solution have a suitable concentration if titration of 12.00 mL of the solution requires 30.6 mL of 1.65 M HCI to reach the end point?
Q4.5.6
A sample of gallium bromide, GaBr2, weighing 0.165 g was dissolved in water and treated with silver nitrate, AgNO3, resulting in the precipitation of 0.299 g AgBr. Use these data to compute the %Ga (by mass) GaBr2.
S4.5.6
22.4%
Q4.5.7
The principal component of mothballs is naphthalene, a compound with a molecular mass of about 130 amu, containing only carbon and hydrogen. A 3.000-mg sample of naphthalene burns to give 10.3 mg of CO2. Determine its empirical and molecular formulas.
Q4.5.8
A 0.025-g sample of a compound composed of boron and hydrogen, with a molecular mass of ~28 amu, burns spontaneously when exposed to air, producing 0.063 g of B2O3. What are the empirical and molecular formulas of the compound.
S4.5.8
The empirical formula is BH3. The molecular formula is B2H6.
Q4.5.9
Sodium bicarbonate (baking soda), NaHCO3, can be purified by dissolving it in hot water (60 °C), filtering to remove insoluble impurities, cooling to 0 °C to precipitate solid NaHCO3, and then filtering to remove the solid, leaving soluble impurities in solution. Any NaHCO3 that remains in solution is not recovered. The solubility of NaHCO3 in hot water of 60 °C is 164 g L. Its solubility in cold water of 0 °C is 69 g/L. What is the percent yield of NaHCO3 when it is purified by this method?
Q4.5.10
What volume of 0.600 M HCl is required to react completely with 2.50 g of sodium hydrogen carbonate?
\[\ce{NaHCO3}(aq)+\ce{HCl}(aq)\rightarrow \ce{NaCl}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\]
S4.5.10
49.6 mL
Q4.5.11
What volume of 0.08892 M HNO3 is required to react completely with 0.2352 g of potassium hydrogen phosphate?
\[\ce{2HNO3}(aq)+\ce{K2HPO4}(aq)\rightarrow \ce{H2PO4}(aq)+\ce{2KNO3}(aq)\]
Q4.5.12
What volume of a 0.3300-M solution of sodium hydroxide would be required to titrate 15.00 mL of 0.1500 M oxalic acid?
\[\ce{C2O4H2}(aq)+\ce{2NaOH}(aq)\rightarrow \ce{Na2C2O4}(aq)+\ce{2H2O}(l)\]
S4.5.12
13.64 mL
Q4.5.13
What volume of a 0.00945-M solution of potassium hydroxide would be required to titrate 50.00 mL of a sample of acid rain with a H2SO4 concentration of 1.23 × 10−4 M.
\[\ce{H2SO4}(aq)+\ce{2KOH}(aq)\rightarrow \ce{K2SO4}(aq)+\ce{2H2O}(l)\]
S4.5.13
1.30 mL
Q4.5.14
A sample of solid calcium hydroxide, Ca(OH)2, is allowed to stand in water until a saturated solution is formed. A titration of 75.00 mL of this solution with 5.00 × 10−2 M HCl requires 36.6 mL of the acid to reach the end point.
\[\ce{Ca(OH)2}(aq)+\ce{2HCl}(aq)\rightarrow \ce{CaCl2}(aq)+\ce{2H2O}(l)\]
What is the molarity?
S4.5.14
1.22 M
Q4.5.15
What mass of Ca(OH)2 will react with 25.0 g of propionic acid to form the preservative calcium propionate according to the equation?
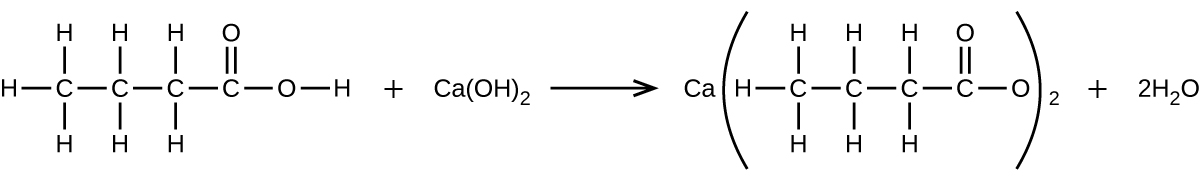
Q4.5.16
How many milliliters of a 0.1500-M solution of KOH will be required to titrate 40.00 mL of a 0.0656-M solution of H3PO4?
\[\ce{H3PO4}(aq)+\ce{2KOH}(aq)\rightarrow \ce{K2HPO4}(aq)+\ce{2H2O}(l)\]
S4.5.16
34.99 mL KOH
Q4.5.17
Potassium acid phthalate, KHC6H4O4, or KHP, is used in many laboratories, including general chemistry laboratories, to standardize solutions of base. KHP is one of only a few stable solid acids that can be dried by warming and weighed. A 0.3420-g sample of KHC6H4O4 reacts with 35.73 mL of a NaOH solution in a titration. What is the molar concentration of the NaOH?
\[\ce{KHC6H4O4}(aq)+\ce{NaOH}(aq)\rightarrow \ce{KNaC6H4O4}(aq)+\ce{H2O}(aq)\]
Q4.5.18
The reaction of WCl6 with Al at ~400 °C gives black crystals of a compound containing only tungsten and chlorine. A sample of this compound, when reduced with hydrogen, gives 0.2232 g of tungsten metal and hydrogen chloride, which is absorbed in water. Titration of the hydrochloric acid thus produced requires 46.2 mL of 0.1051 M NaOH to reach the end point. What is the empirical formula of the black tungsten chloride?
S4.5.19
The empirical formula is WCl4.


