7.E: Vinculación Química y Geometría Molecular (Ejercicios)
- Page ID
- 75620
7.1: Unión Iónica
Q7.1.1
¿Un catión gana protones para formar una carga positiva o pierde electrones?
S7.1.1
Los protones en el núcleo no cambian durante las reacciones químicas normales. Sólo se mueven los electrones externos. Las cargas positivas se forman cuando se pierden electrones.
Q7.1.2
Sulfato de hierro (III) [Fe 2 (SO 4) 3] está compuesto por Fe 3+ e\(\ce{SO4^2-}\) iones. Explique por qué una muestra de sulfato de hierro (III) está descargada.
Q7.1.3
¿Cuál de los siguientes átomos se esperaría que formara iones negativos en compuestos iónicos binarios y cuáles se esperaría que formaran iones positivos: P, I, Mg, Cl, In, Cs, O, Pb, Co?
S7.1.3
P, I, Cl y O formarían aniones porque son no metales. Mg, In, Cs, Pb y Co formarían cationes porque son metales.
Q7.1.4
¿Cuál de los siguientes átomos se esperaría que formara iones negativos en compuestos iónicos binarios y cuáles se esperaría que formaran iones positivos: Br, Ca, Na, N, F, Al, Sn, S, Cd?
Q7.1.5
Predecir la carga en los iones monoatómicos formados a partir de los siguientes átomos en compuestos iónicos binarios:
- P
- Mg
- Al
- O
- Cl
- Cs
S7.1.5
P 3—; Mg 2+; Al 3+; O 2—; Cl —; Cs +
Q7.1.6
Predecir la carga en los iones monoatómicos formados a partir de los siguientes átomos en compuestos iónicos binarios:
- I
- Sr
- K
- N
- S
- En
S7.1.6
- I -
- Sr 2+
- K +
- N 3-
- S 2-
- En 3+
Q7.1.7
Escriba la configuración electrónica para cada uno de los siguientes iones:
- Como 3—
- I —
- Ser 2+
- Cd 2+
- O 2—
- Ga 3+
- Li +
- h) N 3—
- (i) Sn 2+
- j) Co 2+
- k) Fe 2+
- l) Como 3+
S7.1.7
[Ar] 4 s 2 3 d 10 4 p 6; [Kr] 4 d 10 5 s 2 5 p 6 1 s 2 [Kr] 4 d 10; [Él] 2 s 2 2 p 6; [Ar] 3 d 10; 1 s 2 (h) [Él] 2 s 2 2 p 6 (i) [Kr] 4 d 10 5 s 2 (j) [Ar] 3 d 7 (k) [Ar] 3 d 6, (l) [Ar] 3 d 10 4 s 2
Q7.1.8
Escribe la configuración electrónica para los iones monatómicos formados a partir de los siguientes elementos (que forman la mayor concentración de iones monatómicos en el agua de mar):
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- h) F
Q7.1.9
Escriba la configuración electrónica completa para cada uno de los siguientes átomos y para el ion monoatómico que se encuentra en los compuestos iónicos binarios que contienen el elemento:
- Al
- Br
- Sr
- Li
- Como
- S
S7.1.9
1 s 2 2 s 2 p 6 3 s 2 3 p 1; Al 3+: 1 s 2 2 s 2 2 p 6; 1 s 2 2 p 6; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 5; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 5 s 2;
Sr 2+: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6; 1 s 2 2 s 1;
Li +: 1 s 2; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 3; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 4; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Q7.1.10
A partir de las etiquetas de varios productos comerciales, preparar una lista de seis compuestos iónicos en los productos. Para cada compuesto, escriba la fórmula. (Es posible que deba buscar algunas fórmulas en una referencia adecuada).
7.3: Enlace covalente
¿Por qué es incorrecto hablar de una molécula de NaCl sólido?
El NaCl consiste en iones discretos dispuestos en una red cristalina, no moléculas unidas covalentemente.
¿Qué información puedes usar para predecir si un enlace entre dos átomos es covalente o iónico?
Predecir cuáles de los siguientes compuestos son iónicos y cuáles son covalentes, con base en la ubicación de sus átomos constituyentes en la tabla periódica:
- Cl 2 CO
- MnO
- NCl 3
- CobR 2
- K 2 S
- CO
- CaF 2
- h) HI
- (i) CaO
- j) iBr
- k) CO 2
iónicos: (b), (d), (e), (g) e (i); covalentes: (a), (c), (f), (h), (j) y (k)
Explicar la diferencia entre un enlace covalente no polar, un enlace covalente polar y un enlace iónico.
A partir de su posición en la tabla periódica, determine qué átomo de cada par es más electronegativo:
- Br o Cl
- N u O
- S u O
- P o S
- Si o N
- Ba o P
- N o K
Cl; O; O; S; N; P; N
A partir de su posición en la tabla periódica, determine qué átomo de cada par es más electronegativo:
- N o P
- N o Ge
- S o F
- Cl o S
- H o C
- Se o P
- C o Si
De sus posiciones en la tabla periódica, organice los átomos en cada una de las siguientes series en orden de creciente electronegatividad:
- C, F, H, N, O
- Br, Cl, F, H, I
- F, H, O, P, S
- Al, H, Na, O, P
- Ba, H, N, O, As
H, C, N, O, F; H, I, Br, Cl, F; H, P, S, O, F; Na, Al, H, P, O; Ba, H, As, N, O
De sus posiciones en la tabla periódica, organice los átomos en cada una de las siguientes series en orden de creciente electronegatividad:
- As, H, N, P, Sb
- Cl, H, P, S, Si
- Br, Cl, Ge, H, Sr
- Ca, H, K, N, Si
- Cl, Cs, Ge, H, Sr
¿Qué átomos pueden unirse al azufre para producir una carga parcial positiva en el átomo de azufre?
N, O, F y Cl
¿Cuál es el enlace más polar?
- C—C
- C—H
- N—H
- O—H
- Se—H
Identificar el enlace más polar en cada uno de los siguientes pares de enlaces:
- HF o HCl
- NO o CO
- SH u OH
- PCl o SCl
- CH o NH
- SO o PO
- CN o NN
HF; CO; OH; PCl; NH; PO; CN
¿Cuáles de las siguientes moléculas o iones contienen enlaces polares?
- O 3
- S 8
- \(\ce{O2^2-}\)
- \(\ce{NO3-}\)
- CO 2
- H 2 S
- \(\ce{BH4-}\)
7.4: Símbolos y estructuras de Lewis
Q7.4.1
Escribe los símbolos de Lewis para cada uno de los siguientes iones:
- Como 3—
- I —
- Ser 2+
- O 2—
- Ga 3+
- Li +
- N 3—
S7.4.1
ocho electrones:
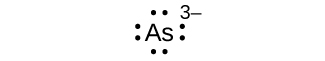
ocho electrones:

sin electrones
Ser 2+;
ocho electrones:
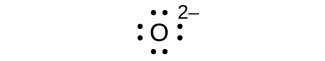
sin electrones
Ga 3+;
sin electrones
Li +;
ocho electrones:
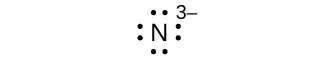
Q7.4.2
Muchos iones monatómicos se encuentran en el agua de mar, incluyendo los iones formados a partir de la siguiente lista de elementos. Escribe los símbolos de Lewis para los iones monatómicos formados a partir de los siguientes elementos:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
Q7.4.3
Escribe los símbolos de Lewis de los iones en cada uno de los siguientes compuestos iónicos y los símbolos de Lewis del átomo a partir del cual se forman:
- MG
- Al 2 O 3
- GACL 3
- K 2 O
- Li 3 N
- KF
(a)
 ;
;
b)
 ;
;
c)
 ;
;
d)
 ;
;
(e)
 ;
;
f)

En las estructuras de Lewis aquí enumeradas, M y X representan diversos elementos en el tercer periodo de la tabla periódica. Escribe la fórmula de cada compuesto usando los símbolos químicos de cada elemento:
(a)

b)

c)

d)

Escribir la estructura de Lewis para la molécula diatómica P 2, una forma inestable de fósforo que se encuentra en el vapor de fósforo a alta temperatura.

Escribe estructuras de Lewis para lo siguiente:
- H 2
- HBr
- PCl 3
- SF 2
- H 2 CCH 2
- HNNH
- H 2 CNH
- h) NO —
- (i) N 2
- j) CO
- k) CN —
Escribe estructuras de Lewis para lo siguiente:
- O 2
- H 2 CO
- ASf 3
- ClnO
- SiCl 4
- H 3 O +
- \(\ce{NH4+}\)
- (h) \(\ce{BF4-}\)
- (i) HCCH
- (j) ClCN
- (k) \(\ce{C2^2+}\)
(a)

In this case, the Lewis structure is inadequate to depict the fact that experimental studies have shown two unpaired electrons in each oxygen molecule.
(b)
 ;
;
(c)
 ;
;
d)
 ;
;
(e)
 ;
;
f)
 ;
;
g)
 ;
;
h)
 ;
;
(i)
 ;
;
(j)
 ;
;
(k)

Escribe estructuras de Lewis para lo siguiente:
- CLF 3
- PCl 5
- BF 3
- \(\ce{PF6-}\)
Write Lewis structures for the following:
- SeF6
- XeF4
- \(\ce{SeCl3+}\)
- Cl2BBCl2 (contains a B–B bond)
SeF6:
 ;
;
XeF4:
 ;
;
\(\ce{SeCl3+}\):
 ;
;
Cl 2 BBCl 2:

Escribe estructuras de Lewis para:
- \(\ce{PO4^3-}\)
- \(\ce{ICl4-}\)
- \(\ce{SO3^2-}\)
- HONO
Correct the following statement: “The bonds in solid PbCl2 are ionic; the bond in a HCl molecule is covalent. Thus, all of the valence electrons in PbCl2 are located on the Cl– ions, and all of the valence electrons in a HCl molecule are shared between the H and Cl atoms.”
Two valence electrons per Pb atom are transferred to Cl atoms; the resulting Pb2+ ion has a 6s2 valence shell configuration. Two of the valence electrons in the HCl molecule are shared, and the other six are located on the Cl atom as lone pairs of electrons.
Write Lewis structures for the following molecules or ions:
- SbH3
- XeF2
- Se8 (a cyclic molecule with a ring of eight Se atoms)
Methanol, H3COH, is used as the fuel in some race cars. Ethanol, C2H5OH, is used extensively as motor fuel in Brazil. Both methanol and ethanol produce CO2 and H2O when they burn. Write the chemical equations for these combustion reactions using Lewis structures instead of chemical formulas.

Many planets in our solar system contain organic chemicals including methane (CH4) and traces of ethylene (C2H4), ethane (C2H6), propyne (H3CCCH), and diacetylene (HCCCCH). Write the Lewis structures for each of these molecules.
Carbon tetrachloride was formerly used in fire extinguishers for electrical fires. It is no longer used for this purpose because of the formation of the toxic gas phosgene, Cl2CO. Write the Lewis structures for carbon tetrachloride and phosgene.

Identificar los átomos que corresponden a cada una de las siguientes configuraciones de electrones. Luego, escribe el símbolo de Lewis para el ion común formado a partir de cada átomo:
- 1 s 2 2 s 2 2 p 5
- 1 s 2 2 s 2 p 6 3 s 2
- 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10
- 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 4
- 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 1
Aquí se da la disposición de los átomos en varias moléculas biológicamente importantes. Completar las estructuras de Lewis de estas moléculas añadiendo múltiples enlaces y pares solitarios. No agregue más átomos.
el aminoácido serina:

urea:

ácido pirúvico:

uracilo:

ácido carbónico:

(a)
 ;
;
b)
 ;
;
c)
 ;
;
d)
 ;
;
e)

Un compuesto con una masa molar de aproximadamente 28 g/mol contiene 85.7% de carbono y 14.3% de hidrógeno en masa. Escribe la estructura de Lewis para una molécula del compuesto.
Un compuesto con una masa molar de aproximadamente 42 g/mol contiene 85.7% de carbono y 14.3% de hidrógeno en masa. Escribe la estructura de Lewis para una molécula del compuesto.

Dos disposiciones de átomos son posibles para un compuesto con una masa molar de aproximadamente 45 g/mol que contiene 52.2% C, 13.1% H y 34.7% O en masa. Escribe las estructuras de Lewis para las dos moléculas.
¿Cómo son similares los bonos simples, dobles y triples? ¿En qué se diferencian?
Cada enlace incluye un reparto de electrones entre átomos. Dos electrones se comparten en un enlace sencillo; cuatro electrones se comparten en un doble enlace; y seis electrones se comparten en un triple enlace.
7.5: Cargos Formales y Resonancia
Escribir formas de resonancia que describan la distribución de electrones en cada una de estas moléculas o iones.
- dióxido de selenio, OSEO
- ión nitrato,\(\ce{NO3-}\)
- nitric acid, HNO3 (N is bonded to an OH group and two O atoms)
- benzene, C6H6:

el ion formiato:

Escribir formas de resonancia que describan la distribución de electrones en cada una de estas moléculas o iones.
- dióxido de azufre, SO 2
- ión carbonato,\(\ce{CO3^2-}\)
- hydrogen carbonate ion, \(\ce{HCO3-}\) (C is bonded to an OH group and two O atoms)
- pyridine:

el ion alilo:

(a)
 ;
;
b)
 ;
;
c)
 ;
;
d)
 ;
;
e)

Escribe las formas de resonancia del ozono, O 3, el componente de la atmósfera superior que protege a la Tierra de la radiación ultravioleta.
El nitrito de sodio, que se ha utilizado para conservar el tocino y otras carnes, es un compuesto iónico. Escribir las formas de resonancia del ion nitrito,\(\ce{NO2-}\).

En cuanto a los enlaces presentes, explique por qué el ácido acético, CH 3 CO 2 H, contiene dos tipos distintos de enlaces carbono-oxígeno, mientras que el ion acetato, formado por la pérdida de un ión hidrógeno del ácido acético, solo contiene un tipo de enlace carbono-oxígeno. Se muestran las estructuras esqueléticas de estas especies:

Escriba las estructuras de Lewis para lo siguiente, e incluya estructuras de resonancia cuando corresponda. Indicar cuál tiene el enlace carbono-oxígeno más fuerte.
- CO 2
- CO
(a)

b)

El CO tiene el enlace carbono-oxígeno más fuerte porque hay un triple enlace que une C y O. CO 2 tiene dobles enlaces.
Las pastas dentales que contienen hidrogenocarbonato de sodio (bicarbonato de sodio) y peróxido de hidrógeno son ampliamente utilizadas. Escribir estructuras de Lewis para el ion carbonato de hidrógeno y la molécula de peróxido de hidrógeno, con formas de resonancia donde corresponda.
Determinar la carga formal de cada elemento en lo siguiente:
- HCl
- CF 4
- PCl 3
- PF 5
H: 0, Cl: 0; C: 0, F: 0; P: 0, Cl 0; P: 0, F: 0
Determinar la carga formal de cada elemento en lo siguiente:
- H 3 O +
- \(\ce{SO4^2-}\)
- NH3
- \(\ce{O2^2-}\)
- H2O2
Calculate the formal charge of chlorine in the molecules Cl2, BeCl2, and ClF5.
Cl in Cl2: 0; Cl in BeCl2: 0; Cl in ClF5: 0
Calculate the formal charge of each element in the following compounds and ions:
- F2CO
- NO–
- \(\ce{BF4-}\)
- \(\ce{SnCl3-}\)
- H2CCH2
- ClF3
- SeF6
- (h) \(\ce{PO4^3-}\)
Draw all possible resonance structures for each of these compounds. Determine the formal charge on each atom in each of the resonance structures:
- O3
- SO2
- \(\ce{NO2-}\)
- \(\ce{NO3-}\)
 ;
;
(b)
 ;
;
(c)
![[Two Lewis structures are shown, with brackets surrounding each with a superscripted negative sign and a double ended arrow in between. The left structure shows a nitrogen atom with one lone pair of electrons single bonded to an oxygen atom with three lone pairs of electrons and double bonded to an oxygen atom with two lone pairs of electrons. The symbols and numbers below this structure read “open parenthesis, 0, close parenthesis, open parenthesis, 0, close parenthesis, open parenthesis, negative 1, close parenthesis. The right structure appears as a mirror image of the left and the symbols and numbers below this structure read “open parenthesis, negative 1, close parenthesis, open parenthesis, 0, close parenthesis, open parenthesis, 0, close parenthesis.]](http://cnx.org/resources/1fdade826754e56f88dd8009bac80fa91af0bebc/CNX_Chem_07_04_Exercis12c_img.jpg) ;
;
d)
![[Se muestran tres estructuras de Lewis, con corchetes rodeando cada una con un signo negativo superíndice y una flecha de doble punta en el medio. La estructura izquierda muestra un átomo de nitrógeno unido a dos átomos de oxígeno, cada uno con tres pares solitarios de electrones y doble enlace a un átomo de oxígeno con dos pares solitarios de electrones. Los átomos de oxígeno unidos simples están etiquetados, desde la parte superior de la estructura y yendo en sentido horario, “paréntesis abierto, negativo 1, paréntesis cerrado, paréntesis abierto, positivo 1, paréntesis cerrado”. Los símbolos y números debajo de esta estructura dicen “paréntesis abierto, 0, paréntesis cerrado, paréntesis abierto, negativo 1, paréntesis cerrado. La estructura media muestra un átomo de nitrógeno unido a dos átomos de oxígeno, cada uno con tres pares solitarios de electrones, uno de los cuales está etiquetado como “paréntesis abierto, 1 positivo, paréntesis cerrado” y doble enlazado a un átomo de oxígeno con dos pares solitarios de electrones etiquetados como “paréntesis abierto, 0, paréntesis cerrada”. Los símbolos y números debajo de esta estructura dicen “paréntesis abierto, negativo 1, paréntesis cerrado, paréntesis abierto, negativo 1, paréntesis cerrado. La estructura derecha muestra un átomo de nitrógeno unido a dos átomos de oxígeno, cada uno con tres pares solitarios de electrones y doble enlace a un átomo de oxígeno con dos pares solitarios de electrones. Uno de los átomos de oxígeno unidos simples está etiquetado, “paréntesis abierto, negativo 1, paréntesis cerrado mientras que el oxígeno de doble enlace está etiquetado, “paréntesis abierto, positivo 1, paréntesis cerrado”. Los símbolos y números debajo de esta estructura dicen “paréntesis abierto, negativo 1, paréntesis cerrado” y “paréntesis abierto, 0, paréntesis cerrado”.]](http://cnx.org/resources/263fd2cd3c8d574474c489b5bb2f41b94cd81ae5/CNX_Chem_07_04_Exercis12d_img.jpg)
Con base en consideraciones formales de carga, ¿cuál de las siguientes sería probablemente la disposición correcta de los átomos en el cloruro de nitrosil: ClnO o ClON?
Con base en consideraciones formales de carga, ¿cuál de las siguientes sería probablemente la disposición correcta de los átomos en el ácido hipocloroso: HOCl u OClH?
HOCl
Con base en consideraciones formales de carga, ¿cuál de las siguientes sería probablemente la disposición correcta de los átomos en el dióxido de azufre: OSO o SOO?
Dibuje la estructura de hidroxilamina, H 3 NO, y asigne cargos formales; busque la estructura. ¿La estructura real es consistente con los cargos formales?
La estructura que da cero cargos formales es consistente con la estructura real:

El yodo forma una serie de fluoruros (enumerados aquí). Escriba las estructuras de Lewis para cada uno de los cuatro compuestos y determine la carga formal del átomo de yodo en cada molécula:
- SI
- SI 3
- SI 5
- SI 7
Escribir la estructura de Lewis y la fórmula química del compuesto con una masa molar de aproximadamente 70 g/mol que contiene 19.7% de nitrógeno y 80.3% flúor en masa, y determinar la carga formal de los átomos en este compuesto.
NF 3;

¿Cuál de las siguientes estructuras esperaríamos para el ácido nitroso? Determinar los cargos formales:

El ácido sulfúrico es el químico industrial producido en mayor cantidad a nivel mundial. Tan solo en Estados Unidos se producen alrededor de 90 mil millones de libras cada año. Escribe la estructura de Lewis para el ácido sulfúrico, H 2 SO 4, que tiene dos átomos de oxígeno y dos grupos OH unidos al azufre.

7.6: Fortalezas de los enlaces iónicos y covalentes
¿Qué vínculo en cada uno de los siguientes pares de bonos es el más fuerte?
- C—C o\(\mathrm{C=C}\)
- C–N or \(\mathrm{C≡N}\)
- \(\mathrm{C≡O}\) or \(\mathrm{C=O}\)
- H–F or H–Cl
- C–H or O–H
- C–N or C–O
Using the bond energies in Table, determine the approximate enthalpy change for each of the following reactions:
- \(\ce{H2}(g)+\ce{Br2}(g)⟶\ce{2HBr}(g)\)
- \(\ce{CH4}(g)+\ce{I2}(g)⟶\ce{CH3I}(g)+\ce{HI}(g)\)
- (c) \(\ce{C2H4}(g)+\ce{3O2}(g)⟶\ce{2CO2}(g)+\ce{2H2O}(g)\)
- −114 kJ;
- 30 kJ;
- (c) −1055 kJ
Using the bond energies in Table, determine the approximate enthalpy change for each of the following reactions:
- \(\ce{Cl2}(g)+\ce{3F2}(g)⟶\ce{2ClF3}(g)\)
- \(\mathrm{H_2C=CH_2}(g)+\ce{H2}(g)⟶\ce{H3CCH3}(g)\)
- (c) \(\ce{2C2H6}(g)+\ce{7O2}(g)⟶\ce{4CO2}(g)+\ce{6H2O}(g)\)
When a molecule can form two different structures, the structure with the stronger bonds is usually the more stable form. Use bond energies to predict the correct structure of the hydroxylamine molecule:

The greater bond energy is in the figure on the left. It is the more stable form.
How does the bond energy of HCldiffer from the standard enthalpy of formation of HCl(g)?
Using the standard enthalpy of formation data in Appendix G, show how the standard enthalpy of formation of HCl(g) can be used to determine the bond energy.
\(\ce{HCl}(g)⟶\dfrac{1}{2}\ce{H2}(g)+\dfrac{1}{2}\ce{Cl2}(g)\hspace{20px}ΔH^\circ_1=−ΔH^\circ_{\ce f[\ce{HCl}(g)]}\\
\dfrac{1}{2}\ce{H2}(g)⟶\ce{H}(g)\hspace{105px}ΔH^\circ_2=ΔH^\circ_{\ce f[\ce H(g)]}\\
\underline{\dfrac{1}{2}\ce{Cl2}(g)⟶\ce{Cl}(g)\hspace{99px}ΔH^\circ_3=ΔH^\circ_{\ce f[\ce{Cl}(g)]}}\\
\ce{HCl}(g)⟶\ce{H}(g)+\ce{Cl}(g)\hspace{58px}ΔH^\circ_{298}=ΔH^\circ_1+ΔH^\circ_2+ΔH^\circ_3\)
\(\begin{align}
D_\ce{HCl}=ΔH^\circ_{298}&=ΔH^\circ_{\ce f[\ce{HCl}(g)]}+ΔH^\circ_{\ce f[\ce H(g)]}+ΔH^\circ_{\ce f[\ce{Cl}(g)]}\\
&=\mathrm{−(−92.307\:kJ)+217.97\:kJ+121.3\:kJ}\\
&=\mathrm{431.6\:kJ}
\end{align}\)
Using the standard enthalpy of formation data in Appendix G, calculate the bond energy of the carbon-sulfur double bond in CS2.
Using the standard enthalpy of formation data in Appendix G, determine which bond is stronger: the S–F bond in SF4(g) or in SF6(g)?
The S–F bond in SF4 is stronger.
Using the standard enthalpy of formation data in Appendix G, determine which bond is stronger: the P–Cl bond in PCl3(g) or in PCl5(g)?
Complete the following Lewis structure by adding bonds (not atoms), and then indicate the longest bond:


The C–C single bonds are longest.
Use the bond energy to calculate an approximate value of ΔH for the following reaction. Which is the more stable form of FNO2?

Use principles of atomic structure to answer each of the following:1
- The radius of the Ca atom is 197 pm; the radius of the Ca2+ ion is 99 pm. Account for the difference.
- The lattice energy of CaO(s) is –3460 kJ/mol; the lattice energy of K2O is –2240 kJ/mol. Account for the difference.
- (c) Given these ionization values, explain the difference between Ca and K with regard to their first and second ionization energies.
| Element | First Ionization Energy (kJ/mol) | Second Ionization Energy (kJ/mol) |
|---|---|---|
| K | 419 | 3050 |
| Ca | 590 | 1140 |
The first ionization energy of Mg is 738 kJ/mol and that of Al is 578 kJ/mol. Account for this difference.
When two electrons are removed from the valence shell, the Ca radius loses the outermost energy level and reverts to the lower n = 3 level, which is much smaller in radius. The +2 charge on calcium pulls the oxygen much closer compared with K, thereby increasing the lattice energy relative to a less charged ion. (c) Removal of the 4s electron in Ca requires more energy than removal of the 4s electron in K because of the stronger attraction of the nucleus and the extra energy required to break the pairing of the electrons. The second ionization energy for K requires that an electron be removed from a lower energy level, where the attraction is much stronger from the nucleus for the electron. In addition, energy is required to unpair two electrons in a full orbital. For Ca, the second ionization potential requires removing only a lone electron in the exposed outer energy level. In Al, the removed electron is relatively unprotected and unpaired in a p orbital. The higher energy for Mg mainly reflects the unpairing of the 2s electron.
The lattice energy of LiF is 1023 kJ/mol, and the Li–F distance is 200.8 pm. NaF crystallizes in the same structure as LiF but with a Na–F distance of 231 pm. Which of the following values most closely approximates the lattice energy of NaF: 510, 890, 1023, 1175, or 4090 kJ/mol? Explain your choice.
For which of the following substances is the least energy required to convert one mole of the solid into separate ions?
- MgO
- SrO
- (c) KF
- CsF
- MgF2
(d)
The reaction of a metal, M, with a halogen, X2, proceeds by an exothermic reaction as indicated by this equation: \(\ce{M}(s)+\ce{X2}(g)⟶\ce{MX2}(s)\). For each of the following, indicate which option will make the reaction more exothermic. Explain your answers.
- a large radius vs. a small radius for M+2
- a high ionization energy vs. a low ionization energy for M
- (c) an increasing bond energy for the halogen
- a decreasing electron affinity for the halogen
- an increasing size of the anion formed by the halogen
The lattice energy of LiF is 1023 kJ/mol, and the Li–F distance is 201 pm. MgO crystallizes in the same structure as LiF but with a Mg–O distance of 205 pm. Which of the following values most closely approximates the lattice energy of MgO: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, or 4008 kJ/mol? Explain your choice.
4008 kJ/mol; both ions in MgO have twice the charge of the ions in LiF; the bond length is very similar and both have the same structure; a quadrupling of the energy is expected based on the equation for lattice energy
Which compound in each of the following pairs has the larger lattice energy? Note: Mg2+ and Li+ have similar radii; O2– and F– have similar radii. Explain your choices.
- MgO or MgSe
- LiF or MgO
- (c) Li2O or LiCl
- Li2Se or MgO
Which compound in each of the following pairs has the larger lattice energy? Note: Ba2+ and
K+ have similar radii; S2– and Cl– have similar radii. Explain your choices.
- K2O or Na2O
- K2S or BaS
- (c) KCl or BaS
- BaS or BaCl2
Na2O; Na+ has a smaller radius than K+; BaS; Ba has a larger charge than K; (c) BaS; Ba and S have larger charges; BaS; S has a larger charge
Which of the following compounds requires the most energy to convert one mole of the solid into separate ions?
- MgO
- SrO
- (c) KF
- CsF
- MgF2
Which of the following compounds requires the most energy to convert one mole of the solid into separate ions?
- K2S
- K2O
- (c) CaS
- Cs2S
- CaO
(e)
The lattice energy of KF is 794 kJ/mol, and the interionic distance is 269 pm. The Na–F
distance in NaF, which has the same structure as KF, is 231 pm. Which of the following values is the closest approximation of the lattice energy of NaF: 682 kJ/mol, 794 kJ/mol, 924 kJ/mol, 1588 kJ/mol, or 3175 kJ/mol? Explain your answer.
7.7: Molecular Structure and Polarity
Explain why the HOH molecule is bent, whereas the HBeH molecule is linear.
The placement of the two sets of unpaired electrons in water forces the bonds to assume a tetrahedral arrangement, and the resulting HOH molecule is bent. The HBeH molecule (in which Be has only two electrons to bond with the two electrons from the hydrogens) must have the electron pairs as far from one another as possible and is therefore linear.
What feature of a Lewis structure can be used to tell if a molecule’s (or ion’s) electron-pair geometry and molecular structure will be identical?
Explain the difference between electron-pair geometry and molecular structure.
Space must be provided for each pair of electrons whether they are in a bond or are present as lone pairs. Electron-pair geometry considers the placement of all electrons. Molecular structure considers only the bonding-pair geometry.
Why is the H–N–H angle in NH3 smaller than the H–C–H bond angle in CH4? Why is the H–N–H angle in \(\ce{NH4+}\) identical to the H–C–H bond angle in CH4?
Explain how a molecule that contains polar bonds can be nonpolar.
As long as the polar bonds are compensated (for example. two identical atoms are found directly across the central atom from one another), the molecule can be nonpolar.
As a general rule, MXn molecules (where M represents a central atom and X represents terminal atoms; n = 2 – 5) are polar if there is one or more lone pairs of electrons on M. NH3 (M = N, X = H, n = 3) is an example. There are two molecular structures with lone pairs that are exceptions to this rule. What are they?
Predict the electron pair geometry and the molecular structure of each of the following molecules or ions:
- SF6
- PCl5
- (c) BeH2
- \(\ce{CH3+}\)
- Both the electron geometry and the molecular structure are octahedral.
- Both the electron geometry and the molecular structure are trigonal bipyramid.
- (c) Both the electron geometry and the molecular structure are linear.
- Both the electron geometry and the molecular structure are trigonal planar.
Identify the electron pair geometry and the molecular structure of each of the following molecules or ions:
- \(\ce{IF6+}\)
- CF4
- (c) BF3
- \(\ce{SiF5-}\)
- BeCl2
What are the electron-pair geometry and the molecular structure of each of the following molecules or ions?
- ClF5
- \(\ce{ClO2-}\)
- (c) \(\ce{TeCl4^2-}\)
- PCl3
- SeF4
- \(\ce{PH2-}\)
electron-pair geometry: octahedral, molecular structure: square pyramidal; electron-pair geometry: tetrahedral, molecular structure: bent; (c) electron-pair geometry: octahedral, molecular structure: square planar; electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal; electron-pair geometry: trigonal bypyramidal, molecular structure: seesaw; electron-pair geometry: tetrahedral, molecular structure: bent (109°)
Predict the electron pair geometry and the molecular structure of each of the following ions:
- H3O+
- \(\ce{PCl4-}\)
- (c) \(\ce{SnCl3-}\)
- \(\ce{BrCl4-}\)
- ICl3
- XeF4
- (g) SF2
Identify the electron pair geometry and the molecular structure of each of the following molecules:
- ClNO (N is the central atom)
- CS2
- (c) Cl2CO (C is the central atom)
- Cl2SO (S is the central atom)
- SO2F2 (S is the central atom)
- XeO2F2 (Xe is the central atom)
- (g) \(\ce{ClOF2+}\) (Cl is the central atom)
electron-pair geometry: trigonal planar, molecular structure: bent (120°); electron-pair geometry: linear, molecular structure: linear; (c) electron-pair geometry: trigonal planar, molecular structure: trigonal planar; electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal; electron-pair geometry: tetrahedral, molecular structure: tetrahedral; electron-pair geometry: trigonal bipyramidal, molecular structure: seesaw; (g) electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal
Predict the electron pair geometry and the molecular structure of each of the following:
- IOF5 (I is the central atom)
- POCl3 (P is the central atom)
- (c) Cl2SeO (Se is the central atom)
- ClSO+ (S is the central atom)
- F2SO (S is the central atom)
- \(\ce{NO2-}\)
- (g) \(\ce{SiO4^4-}\)
Which of the following molecules and ions contain polar bonds? Which of these molecules and ions have dipole moments?
- ClF5
- \(\ce{ClO2-}\)
- (c) \(\ce{TeCl4^2-}\)
- PCl3
- SeF4
- \(\ce{PH2-}\)
- (g) XeF2
All of these molecules and ions contain polar bonds. Only ClF5, \(\ce{ClO2-}\), PCl3, SeF4, and \(\ce{PH2-}\) have dipole moments.
Which of the molecules and ions in Exercise contain polar bonds? Which of these molecules and ions have dipole moments?
- H3O+
- \(\ce{PCl4-}\)
- (c) \(\ce{SnCl3-}\)
- \(\ce{BrCl4-}\)
- ICl3
- XeF4
- (g) SF2
Which of the following molecules have dipole moments?
- CS2
- SeS2
- (c) CCl2F2
- PCl3 (P is the central atom)
- ClNO (N is the central atom)
SeS2, CCl2F2, PCl3, and ClNO all have dipole moments.
Identify the molecules with a dipole moment:
- SF4
- CF4
- (c) Cl2CCBr2
- CH3Cl
- H2CO
The molecule XF3 has a dipole moment. Is X boron or phosphorus?
P
The molecule XCl2 has a dipole moment. Is X beryllium or sulfur?
Is the Cl2BBCl2 molecule polar or nonpolar?
nonpolar
There are three possible structures for PCl2F3 with phosphorus as the central atom. Draw them and discuss how measurements of dipole moments could help distinguish among them.
Describe the molecular structure around the indicated atom or atoms:
- the sulfur atom in sulfuric acid, H2SO4 [(HO)2SO2]
- the chlorine atom in chloric acid, HClO3 [HOClO2]
- (c) the oxygen atom in hydrogen peroxide, HOOH
- the nitrogen atom in nitric acid, HNO3 [HONO2]
- the oxygen atom in the OH group in nitric acid, HNO3 [HONO2]
- the central oxygen atom in the ozone molecule, O3
- (g) each of the carbon atoms in propyne, CH3CCH
- (h) the carbon atom in Freon, CCl2F2
- (i) each of the carbon atoms in allene, H2CCCH2
tetrahedral; trigonal pyramidal; (c) bent (109°); trigonal planar; bent (109°); bent (109°); (g) CH3CCH tetrahedral, CH3CCH linear; (h) tetrahedral; (i) H2CCCH2 linear; H2CCCH2 trigonal planar
Draw the Lewis structures and predict the shape of each compound or ion:
- CO2
- \(\ce{NO2-}\)
- (c) SO3
- \(\ce{SO3^2-}\)
A molecule with the formula AB2, in which A and B represent different atoms, could have one of three different shapes. Sketch and name the three different shapes that this molecule might have. Give an example of a molecule or ion for each shape.

Una molécula con la fórmula AB 3, en la que A y B representan diferentes átomos, podría tener una de tres formas diferentes. Dibuja y nombra las tres formas diferentes que esta molécula podría tener. Dar un ejemplo de una molécula o ion que tiene cada forma.
Dibuje las estructuras de puntos de electrones de Lewis para estas moléculas, incluyendo las estructuras de resonancia cuando sea apropiado:
- \(\ce{CS3^2-}\)
- CS 2
- (c) CS
predice las formas moleculares para\(\ce{CS3^2-}\) y CS 2 y explica cómo llegaste a tus predicciones
(a)
 ;
;
b)
 ;
;
c)
 ;
;
\(\ce{CS3^2-}\) includes three regions of electron density (all are bonds with no lone pairs); the shape is trigonal planar; CS2 has only two regions of electron density (all bonds with no lone pairs); the shape is linear
What is the molecular structure of the stable form of FNO2? (N is the central atom.)
A compound with a molar mass of about 42 g/mol contains 85.7% carbon and 14.3% hydrogen. What is its molecular structure?
The Lewis structure is made from three units, but the atoms must be rearranged:

Utilice la simulación para realizar los siguientes ejercicios para una molécula de dos átomos:
- Ajusta el valor de electronegatividad para que el dipolo de enlace apunte hacia B. Luego determine cuáles deben ser los valores de electronegatividad para cambiar el dipolo de manera que apunte hacia A.
- Con una carga positiva parcial en A, encienda el campo eléctrico y describa lo que sucede.
- (c) Con una pequeña carga negativa parcial en A, encienda el campo eléctrico y describa lo que sucede.
- Restablecer todo, y luego con una gran carga negativa parcial en A, encienda el campo eléctrico y describa lo que sucede.
Utilice la simulación para realizar los siguientes ejercicios para una molécula real. Es posible que necesite rotar las moléculas en tres dimensiones para ver ciertos dipolos.
- Dibuje los dipolos de enlace y el dipolo molecular (si los hubiera) para O 3. Explique sus observaciones.
- Mira los dipolos de enlace para NH 3. Utilice estos dipolos para predecir si N o H son más electronegativos.
- (c) Predecir si debe haber un dipolo molecular para NH 3 y, de ser así, en qué dirección apuntará. Marque la caja del dipolo molecular para probar su hipótesis.
El dipolo molecular apunta lejos de los átomos de hidrógeno.
Usa el simulador Molecule Shape para construir una molécula. Comenzando con el átomo central, haga clic en el doble enlace para agregar un doble enlace. Luego agrega un enlace sencillo y un par solitario. Gire la molécula para observar la geometría completa. Nombra la geometría del grupo de electrones y la estructura molecular y predice el ángulo de enlace. Luego haz clic en las casillas de verificación en la parte inferior y derecha del simulador para verificar tus respuestas.
Usa el simulador Molecule Shape para explorar moléculas reales. En la pestaña Moléculas reales, seleccione H 2 O. Cambie entre los modos “real” y “modelo”. Explicar la diferencia observada.
Las estructuras son muy similares. En el modo modelo, cada grupo de electrones ocupa la misma cantidad de espacio, por lo que el ángulo de enlace se muestra como 109.5°. En el modo “real”, los pares solitarios son más grandes, haciendo que los hidrógenos se compriman. Esto lleva al ángulo más pequeño de 104.5°.
Usa el simulador Molecule Shape para explorar moléculas reales. En la pestaña Moléculas reales, seleccione el modo “modelo” y S 2 O. ¿Cuál es el ángulo de unión del modelo? Explique si el ángulo de unión “real” debe ser mayor o menor que el ángulo del modelo ideal.


