7.6: Estructura Molecular y Polaridad
- Page ID
- 75582
- Predecir las estructuras de moléculas pequeñas usando la teoría de repulsión de pares de electrones de capa de valencia (VSEPR)
- Explicar los conceptos de enlaces covalentes polares y polaridad molecular
- Evaluar la polaridad de una molécula en función de su unión y estructura
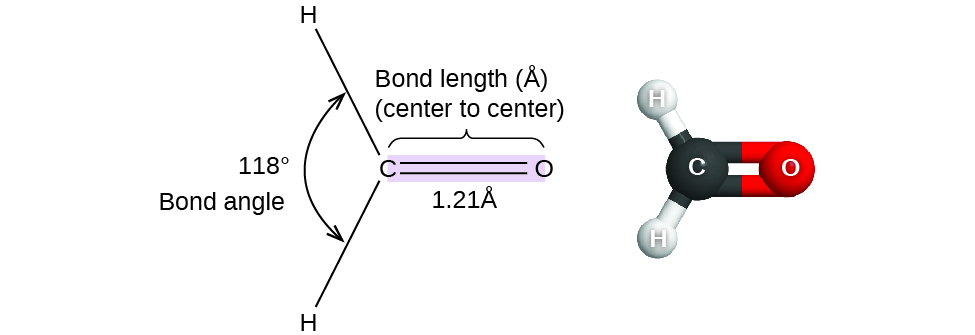
Hasta el momento, hemos utilizado estructuras bidimensionales de Lewis para representar moléculas. Sin embargo, la estructura molecular es en realidad tridimensional, y es importante poder describir los enlaces moleculares en términos de sus distancias, ángulos y disposiciones relativas en el espacio (Figura\(\PageIndex{1}\)). Un ángulo de enlace es el ángulo entre dos enlaces cualesquiera que incluyan un átomo común, generalmente medido en grados. Una distancia de enlace (o longitud de enlace) es la distancia entre los núcleos de dos átomos unidos a lo largo de la línea recta que une los núcleos. Las distancias de unión se miden en Ångstroms (1 Å = 10 —10 m) o picometros (1 pm = 10 —12 m, 100pm = 1 Å).
Teoría VSEPR
La teoría de repulsión de pares de electrones de la capa de valencia (teoría VSEPR) nos permite predecir la estructura molecular, incluidos los ángulos de enlace aproximados alrededor de un átomo central, de una molécula a partir de un examen del número de enlaces y pares de electrones solitarios en su estructura de Lewis. El modelo VSEPR asume que los pares de electrones en la capa de valencia de un átomo central adoptarán una disposición que minimiza las repulsiones entre estos pares de electrones maximizando la distancia entre ellos. Los electrones en la capa de valencia de un átomo central forman pares de electrones enlazados, ubicados principalmente entre átomos unidos, o pares solitarios. La repulsión electrostática de estos electrones se reduce cuando las diversas regiones de alta densidad electrónica asumen posiciones lo más alejadas posible entre sí.
La teoría de VSEPR predice la disposición de los pares de electrones alrededor de cada átomo central y, generalmente, la disposición correcta de los átomos en una molécula. Debemos entender, sin embargo, que la teoría sólo considera las repulsiones de pares de electrones. Otras interacciones, como las repulsiones nucleares nucleares y las atracciones de electrones nucleares, también están involucradas en la disposición final que los átomos adoptan en una estructura molecular particular.
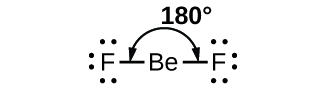
Como ejemplo sencillo de la teoría de VSEPR, predecimos la estructura de una molécula gaseosa de BeF 2. La estructura de Lewis de BeF 2 (Figura\(\PageIndex{2}\)) muestra solo dos pares de electrones alrededor del átomo central de berilio. Con dos enlaces y sin pares solitarios de electrones en el átomo central, los enlaces están lo más separados posible, y la repulsión electrostática entre estas regiones de alta densidad de electrones se reduce al mínimo cuando están en lados opuestos del átomo central. El ángulo de unión es de 180° (Figura\(\PageIndex{2}\)).
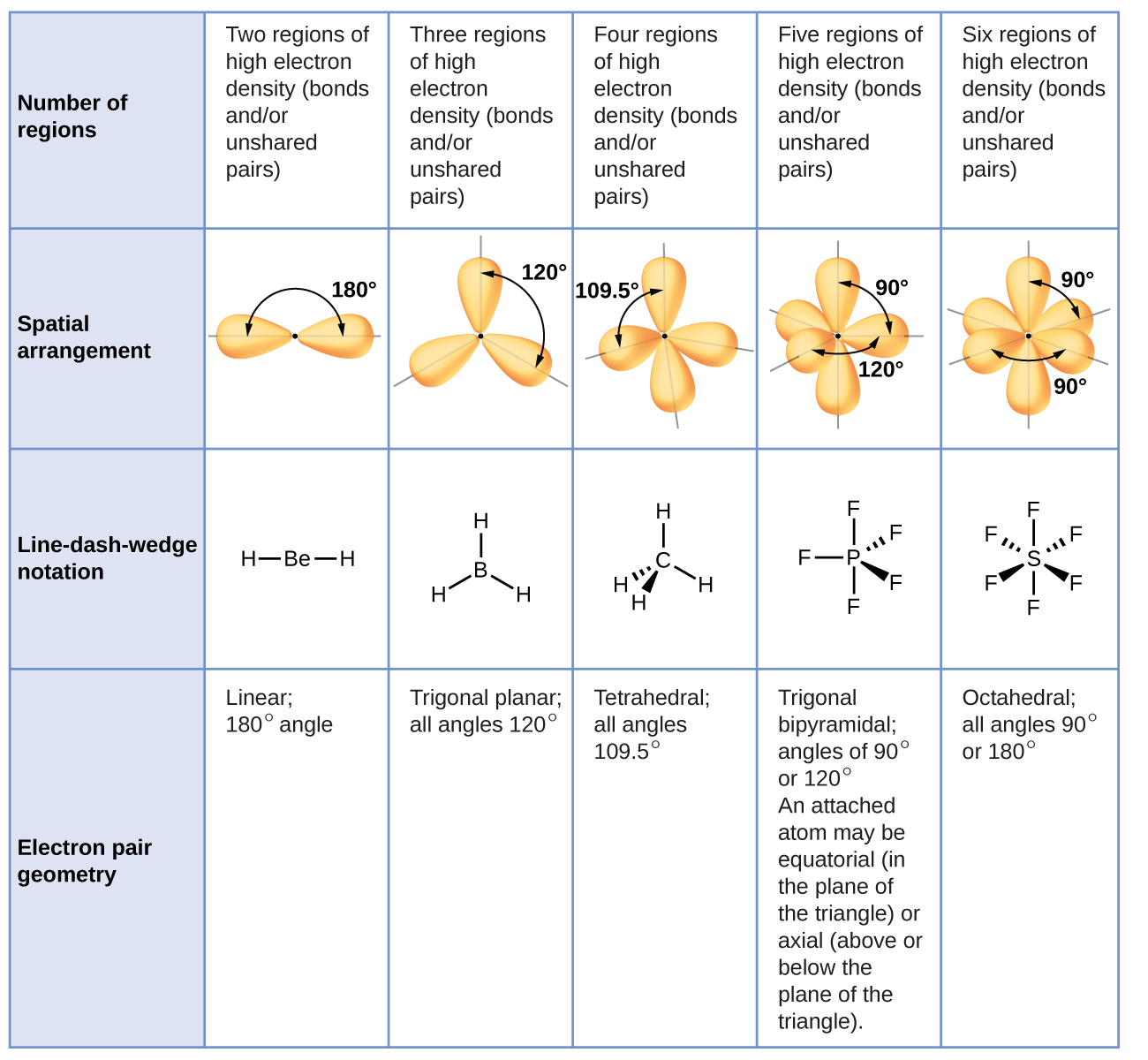
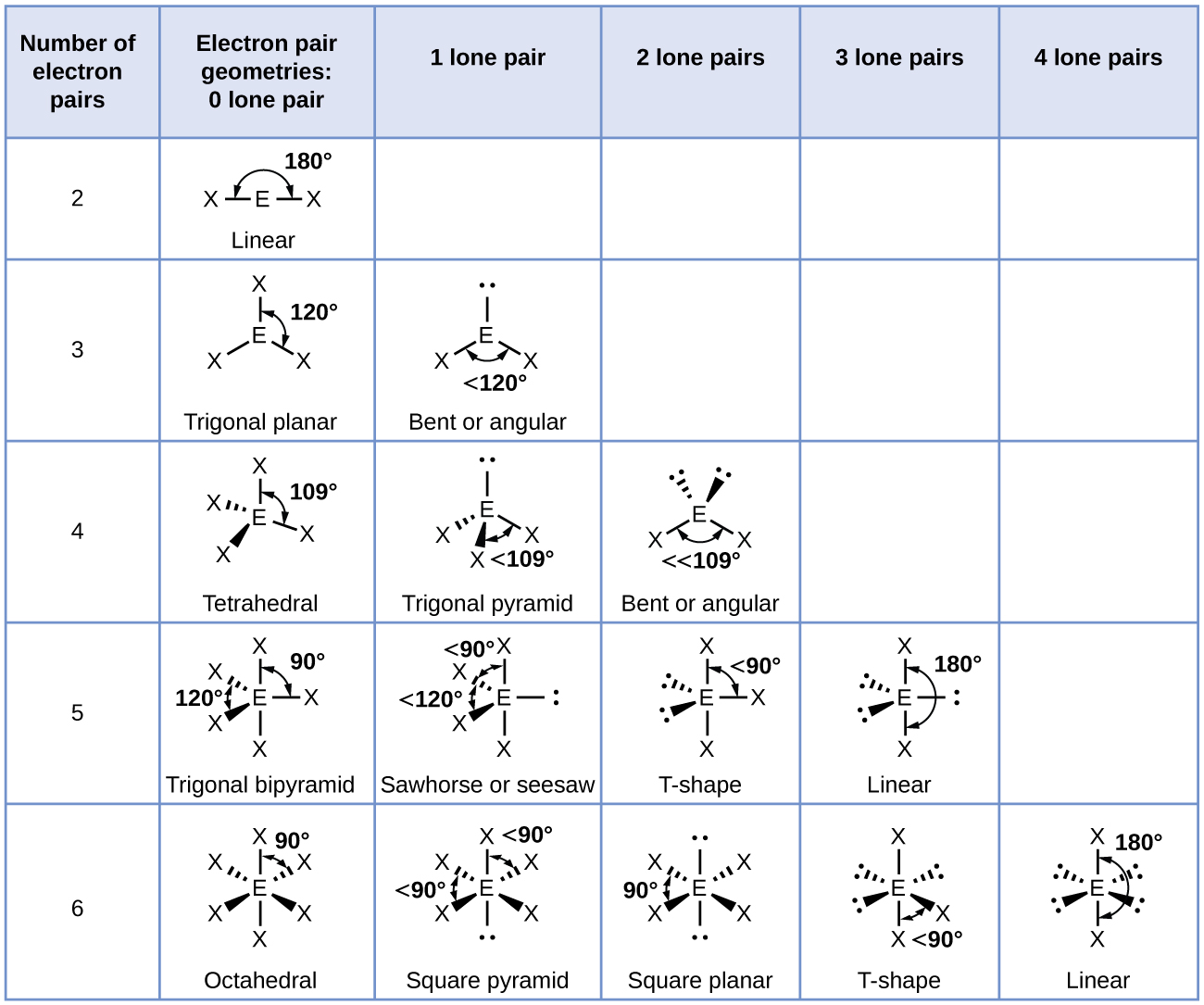
La figura\(\PageIndex{3}\) ilustra esta y otras geometrías de pares de electrones que minimizan las repulsiones entre regiones de alta densidad de electrones (enlaces y/o pares solitarios). Dos regiones de densidad electrónica alrededor de un átomo central en una molécula forman una geometría lineal; tres regiones forman una geometría plana trigonal; cuatro regiones forman una geometría tetraédrica; cinco regiones forman una geometría bipiramidal trigonal; y seis regiones forman una Geometría octaédrica.
Geometría de pares de electrones versus estructura molecular
Es importante señalar que la geometría de pares de electrones alrededor de un átomo central no es lo mismo que su estructura molecular. Las geometrías de pares de electrones que se muestran en la Figura\(\PageIndex{3}\) describen todas las regiones donde se encuentran los electrones, los enlaces y los pares solitarios. La estructura molecular describe la ubicación de los átomos, no los electrones.
Diferenciamos entre estas dos situaciones nombrando la geometría que incluye a todos los pares de electrones la geometría de pares de electrones. La estructura que incluye solo la colocación de los átomos en la molécula se llama estructura molecular. Las geometrías de pares de electrones serán las mismas que las estructuras moleculares cuando no haya pares de electrones solitarios alrededor del átomo central, pero serán diferentes cuando haya pares solitarios presentes en el átomo central.
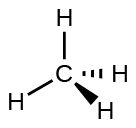
Por ejemplo, la molécula de metano, CH 4, que es el componente principal del gas natural, tiene cuatro pares de electrones de unión alrededor del átomo de carbono central; la geometría del par de electrones es tetraédrica, al igual que la estructura molecular (Figura\(\PageIndex{4}\)). Por otro lado, la molécula de amoníaco, NH 3, también tiene cuatro pares de electrones asociados con el átomo de nitrógeno, y por lo tanto tiene una geometría tetraédrica de pares de electrones. Una de estas regiones, sin embargo, es un par solitario, que no está incluido en la estructura molecular, y este par solitario influye en la forma de la molécula (Figura\(\PageIndex{5}\)).
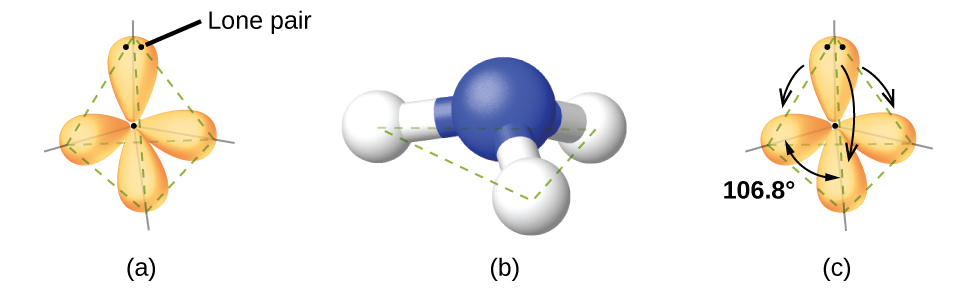
Pequeñas distorsiones desde los ángulos ideales en la Figura\(\PageIndex{5}\) pueden ser el resultado de diferencias en la repulsión entre varias regiones de densidad electrónica. La teoría VSEPR predice estas distorsiones estableciendo un orden de repulsiones y un orden de la cantidad de espacio ocupado por diferentes tipos de pares de electrones. El orden de las repulsiones de pares de electrones de mayor a menor repulsión es:
par solitario-par solitario > par de unión de pares solitarios > par de unión par de unión
Este orden de repulsiones determina la cantidad de espacio ocupado por diferentes regiones de electrones. Un par solitario de electrones ocupa una región más grande del espacio que los electrones en un triple enlace; a su vez, los electrones en un triple enlace ocupan más espacio que los de un doble enlace, y así sucesivamente. El orden de tamaños de mayor a menor es:
par solitario > triple enlace > doble enlace > enlace sencillo
Considera el formaldehído, H 2 CO, que se utiliza como conservante para especímenes biológicos y anatómicos. Esta molécula tiene regiones de alta densidad de electrones que consisten en dos enlaces simples y un doble enlace. La geometría básica es plana trigonal con ángulos de unión de 120°, pero vemos que el doble enlace causa ángulos ligeramente mayores (121°), y el ángulo entre los enlaces simples es ligeramente menor (118°).
En la molécula de amoníaco, los tres átomos de hidrógeno unidos al nitrógeno central no están dispuestos en una estructura molecular plana, trigonal, sino en una pirámide trigonal tridimensional (Figura\(\PageIndex{6}\)) con el átomo de nitrógeno en el ápice y los tres átomos de hidrógeno formando la base. Los ángulos de enlace ideales en una pirámide trigonal se basan en la geometría de pares de electrones tetraédricos. Nuevamente, hay ligeras desviaciones del ideal porque los pares solitarios ocupan regiones más grandes del espacio que los electrones de unión. Los ángulos de unión H-N-H en NH 3 son ligeramente más pequeños que el ángulo de 109.5° en un tetraedro regular (Figura\(\PageIndex{6}\)) porque la repulsión de par de unión de pares solitarios es mayor que la repulsión de par de unión de pares de unión. Las estructuras moleculares ideales se predicen en base a las geometrías de pares de electrones para varias combinaciones de pares solitarios y pares de unión.
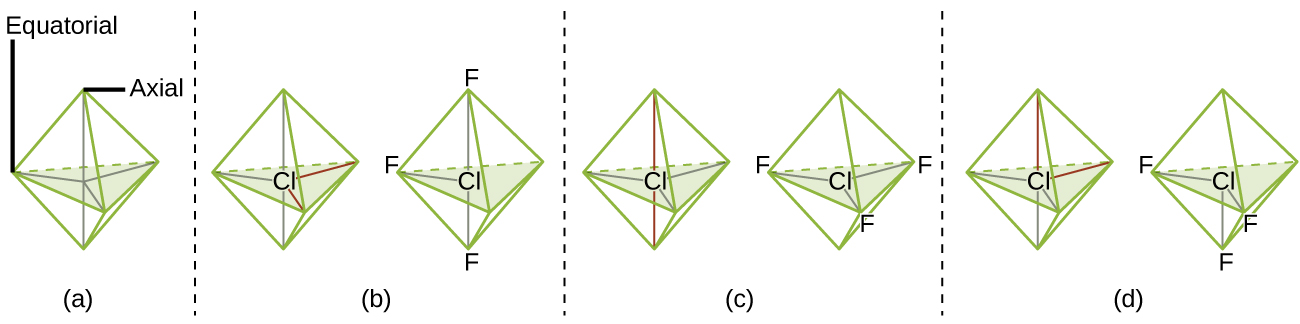
De acuerdo con la teoría de VSEPR, las ubicaciones de los átomos terminales (Xs en la Figura\(\PageIndex{7}\)) son equivalentes dentro de las geometrías lineales, planas trigonales y tetraédricas de pares de electrones (las tres primeras filas de la tabla). No importa qué X se sustituya por un par solitario porque las moléculas se pueden rotar para convertir posiciones. Para geometrías de pares de electrones bipiramidales trigonales, sin embargo, hay dos posiciones X distintas (Figura\(\PageIndex{7}\) a): una posición axial (si mantenemos un modelo de una bipirámide trigonal por las dos posiciones axiales, tenemos un eje alrededor del cual podemos rotar el modelo) y una posición ecuatorial (tres posiciones forman un ecuador alrededor de la mitad de la molécula). La posición axial está rodeada por ángulos de unión de 90°, mientras que la posición ecuatorial tiene más espacio disponible debido a los ángulos de unión de 120°. En una geometría de pares de electrones bipiramidales trigonales, los pares solitarios siempre ocupan posiciones ecuatoriales porque estas posiciones más espaciosas pueden acomodar más fácilmente a los pares solitarios más grandes.
Teóricamente, podemos llegar a tres arreglos posibles para los tres enlaces y dos pares solitarios para la molécula ClF 3 (Figura\(\PageIndex{7}\)). La estructura estable es la que coloca a los pares solitarios en localizaciones ecuatoriales, dando una estructura molecular en forma de T.
Cuando un átomo central tiene dos pares de electrones solitarios y cuatro regiones de enlace, tenemos una geometría octaédrica de pares de electrones. Los dos pares solitarios están en lados opuestos del octaedro (separados 180°), dando una estructura molecular plana cuadrada que minimiza las repulsiones de pares solitarios y pares solitarios.
El siguiente procedimiento utiliza la teoría VSEPR para determinar las geometrías de pares de electrones y las estructuras moleculares:
- Escribe la estructura de Lewis de la molécula o ion poliatómico.
- Contar el número de regiones de densidad electrónica (pares solitarios y enlaces) alrededor del átomo central. Un enlace simple, doble o triple cuenta como una región de densidad electrónica.
- Identificar la geometría del par de electrones con base en el número de regiones de densidad electrónica: lineal, plano trigonal, tetraédrico, trigonal bipiramidal u octaédrico (Figura\(\PageIndex{7}\), primera columna).
- Utilice el número de pares solitarios para determinar la estructura molecular (Figura\(\PageIndex{7}\)). Si es posible más de un arreglo de pares solitarios y enlaces químicos, elija el que minimice las repulsiones, recordando que los pares solitarios ocupan más espacio que los enlaces múltiples, que ocupan más espacio que los enlaces simples. En los arreglos bipiramidales trigonales, la repulsión se minimiza cuando cada par solitario está en posición ecuatorial. En una disposición octaédrica con dos pares solitarios, la repulsión se minimiza cuando los pares solitarios están en lados opuestos del átomo central.
Los siguientes ejemplos ilustran el uso de la teoría VSEPR para predecir la estructura molecular de moléculas o iones que no tienen pares solitarios de electrones. En este caso, la estructura molecular es idéntica a la geometría del par de electrones.
Predecir la geometría del par de electrones y la estructura molecular para cada uno de los siguientes:
- dióxido de carbono, CO 2, una molécula producida por la combustión de combustibles fósiles
- tricloruro de boro, BCl3, un importante químico industrial
Solución
(a) Escribimos la estructura Lewis del CO 2 como:

Esto nos muestra dos regiones de alta densidad de electrones alrededor del átomo de carbono: cada doble enlace cuenta como una región, y no hay pares solitarios en el átomo de carbono. Usando la teoría VSEPR, predecimos que las dos regiones de densidad electrónica se disponen en lados opuestos del átomo central con un ángulo de enlace de 180°. La geometría del par de electrones y la estructura molecular son idénticas, y las moléculas de CO 2 son lineales.
(b) Escribimos la estructura de Lewis de BCl 3 como:
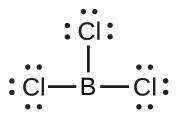
Así vemos que Bcl3 contiene tres enlaces, y no hay pares solitarios de electrones sobre el boro. La disposición de tres regiones de alta densidad de electrones da una geometría plana trigonal de pares de electrones. Los enlaces B—Cl se encuentran en un plano con ángulos de 120° entre ellos. BCl3 también tiene una estructura molecular plana trigonal.
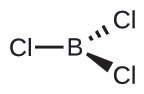
La geometría de pares de electrones y la estructura molecular de Bcl3 son planas trigonales. Tenga en cuenta que la geometría VSEPR indica los ángulos de unión correctos (120°), a diferencia de la estructura de Lewis mostrada anteriormente.
El carbonato\(\ce{CO3^2-}\), es un ion poliatómico común que se encuentra en diversos materiales, desde cáscaras de huevo hasta antiácidos. ¿Cuáles son la geometría de pares de electrones y la estructura molecular de este ion poliatómico?
- Responder
-
La geometría del par de electrones es plano trigonal y la estructura molecular es plana trigonal. Debido a la resonancia, los tres enlaces C-O son idénticos. Ya sean simples, dobles o un promedio de los dos, cada enlace cuenta como una región de densidad electrónica.
Dos de los 50 principales productos químicos producidos en Estados Unidos, el nitrato de amonio y el sulfato de amonio, ambos utilizados como fertilizantes, contienen el ion amonio. Predecir la geometría del par de electrones y la estructura molecular del\(\ce{NH4+}\) catión.
Solución
Escribimos la estructura de Lewis de\(\ce{NH4+}\) como:
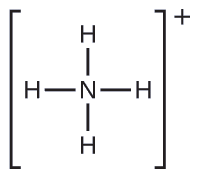
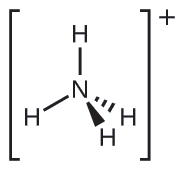
Identificar una molécula con estructura molecular bipiramidal trigonal.
- Responder
-
Cualquier molécula con cinco pares de electrones alrededor de los átomos centrales, incluyendo no pares solitarios, será trigonal bipiramidal. \(\ce{PF5}\)es un ejemplo común
Los siguientes ejemplos ilustran el efecto de pares solitarios de electrones sobre la estructura molecular.
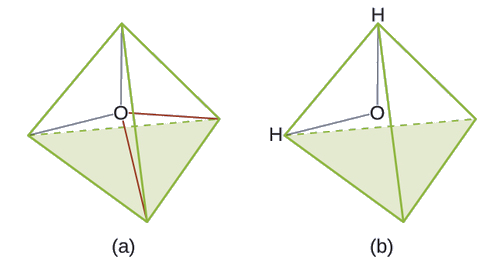
Predecir la geometría de pares de electrones y la estructura molecular de una molécula de agua.
Solución
La estructura de Lewis de H 2 O indica que hay cuatro regiones de alta densidad electrónica alrededor del átomo de oxígeno: dos pares solitarios y dos enlaces químicos:
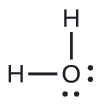
El ion hidronio, H 3 O +, se forma cuando los ácidos se disuelven en agua. Predecir la geometría de pares de electrones y la estructura molecular de este catión.
- Responder
-
Geometría de pares de electrones: tetraédrica; estructura molecular: piramidal trigonal
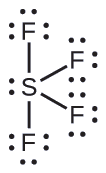
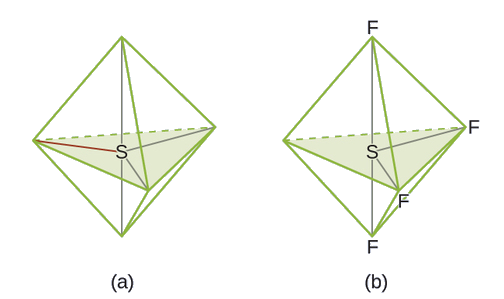
Predicción de Geometría de Par de Electrones y Estructura Molecular: SF 4, es extremadamente valioso para la preparación de compuestos que contienen flúor utilizados como herbicidas (es decir, SF 4 se usa como agente fluorante). Predecir la geometría de pares de electrones y la estructura molecular de una molécula SF 4.
Solución
La estructura de Lewis de SF 4 indica cinco regiones de densidad electrónica alrededor del átomo de azufre: un par solitario y cuatro pares de enlace:
Predecir la geometría del par de electrones y la estructura molecular para moléculas de xEF 2.
- Responder
-
La geometría del par de electrones es bipiramidal trigonal. La estructura molecular es lineal.
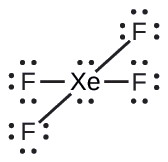
De todos los gases nobles, el xenón es el más reactivo, reaccionando frecuentemente con elementos como el oxígeno y el flúor. Predecir la geometría del par de electrones y la estructura molecular de la molécula xEF 4.
Solución
La estructura de Lewis de XeF 4 indica seis regiones de alta densidad de electrones alrededor del átomo de xenón: dos pares solitarios y cuatro enlaces:
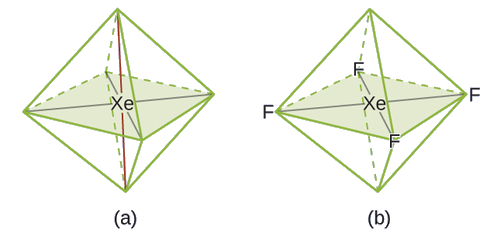
En una determinada molécula, el átomo central tiene tres pares solitarios y dos enlaces. ¿Cuál será la geometría del par de electrones y la estructura molecular?
- Responder
-
Geometría de pares de electrones: bipiramidal trigonal; estructura molecular: lineal
Estructura Molecular para Moléculas Multicéntricas
Cuando una molécula o ion poliatómico tiene solo un átomo central, la estructura molecular describe completamente la forma de la molécula. Las moléculas más grandes no tienen un solo átomo central, sino que están conectadas por una cadena de átomos interiores que poseen cada uno una geometría “local”. La forma en que estas estructuras locales se orientan entre sí también influye en la forma molecular, pero tales consideraciones están en gran parte fuera del alcance de esta discusión introductoria. Para nuestros propósitos, solo nos enfocaremos en determinar las estructuras locales.
Aquí se muestra la estructura de Lewis para el aminoácido más simple, glicina, H 2 NCH 2 CO 2 H. Predecir la geometría local para el átomo de nitrógeno, los dos átomos de carbono y el átomo de oxígeno con un átomo de hidrógeno unido:
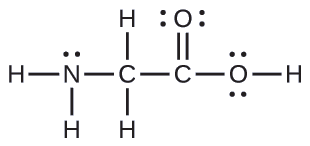
Solución
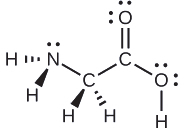
Considera cada átomo central de forma independiente. Las geometrías de pares de electrones:
- nitrógeno — cuatro regiones de densidad electrónica; tetraédrica
- carbono (C H 2) ——cuatro regiones de densidad electrónica; tetraédrica
- carbono (C O 2): tres regiones de densidad electrónica; plano trigonal
- oxígeno (O H) —cuatro regiones de densidad electrónica; tetraédrica
Las estructuras locales:
- nitrógeno — tres enlaces, un par solitario; piramidal trigonal
- carbono (C H 2) —cuatro enlaces, sin pares solitarios; tetraédrico
- carbono (C O 2): tres enlaces (el doble enlace cuenta como un enlace), sin pares solitarios; plano trigonal
- oxígeno (O H): dos enlaces, dos pares solitarios; doblado (109°)
Otro aminoácido es la alanina, que tiene la estructura de Lewis que se muestra aquí. Predecir la geometría del par de electrones y la estructura local del átomo de nitrógeno, los tres átomos de carbono y el átomo de oxígeno con hidrógeno unido:
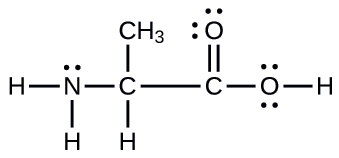
- Responder
-
geometrías de pares de electrones: nitrógeno — tetraédrico; carbono (CH) —tetraédrico; carbono (C H 3) —tetraédrico; carbono (C O 2) —plano trigonal; oxígeno (O H) —tetraédrico; estructuras locales: nitrógeno-piramidal trigonal; carbono (C H) — tetraédrico; carbono (C H 3) —tetraédrico; carbono (C O 2) —plano trigonal; oxígeno (O H) —doblado (109°)
El uso de este simulador de formas moleculares nos permite controlar si se muestran los ángulos de unión y/o pares solitarios marcando o desmarcando las casillas debajo de “Opciones” a la derecha. También podemos usar las casillas de verificación “Nombre” en la parte inferior izquierda para mostrar u ocultar la geometría del par de electrones (llamada “geometría de electrones” en el simulador) y/o la estructura molecular (llamada “forma molecular” en el simulador).
Construye la molécula HCN en el simulador basado en la siguiente estructura de Lewis:
Haga clic en cada tipo de enlace o par solitario a la derecha para agregar ese grupo al átomo central. Una vez que tenga la molécula completa, gírela para examinar la estructura molecular predicha. ¿Qué estructura molecular es esta?
Solución
La estructura molecular es lineal.
Construye una molécula más compleja en el simulador. Identificar la geometría del grupo de electrones, la estructura molecular y los ángulos de enlace. Entonces trata de encontrar una fórmula química que coincida con la estructura que has dibujado.
- Responder
-
Las respuestas variarán. Por ejemplo, un átomo con cuatro enlaces simples, un doble enlace y un par solitario tiene una geometría octaédrica de grupos de electrones y una estructura molecular piramidal cuadrada. XeoF 4 es una molécula que adopta esta estructura.
Polaridad Molecular y Momento Dipolar
Como se discutió anteriormente, los enlaces covalentes polares conectan dos átomos con electronegatividades diferentes, dejando un átomo con una carga positiva parcial (δ+) y el otro átomo con una carga negativa parcial (δ—), a medida que los electrones son arrastrados hacia el átomo más electronegativo. Esta separación de carga da lugar a un momento dipolar de enlace. La magnitud de un momento dipolo de enlace está representada por la letra griega mu (µ) y viene dada por
\[μ=Qr \label{7.6.X} \]
donde
- \(Q\)es la magnitud de las cargas parciales (determinada por la diferencia de electronegatividad) y
- \(r\)es la distancia entre las cargas:
Este momento de enlace se puede representar como un vector, una cantidad que tiene tanto dirección como magnitud (Figura\(\PageIndex{12}\)). Los vectores dipolares se muestran como flechas apuntando a lo largo del enlace desde el átomo menos electronegativo hacia el átomo más electronegativo. Se dibuja un pequeño signo más en el extremo menos electronegativo para indicar el extremo parcialmente positivo del enlace. La longitud de la flecha es proporcional a la magnitud de la diferencia de electronegatividad entre los dos átomos.
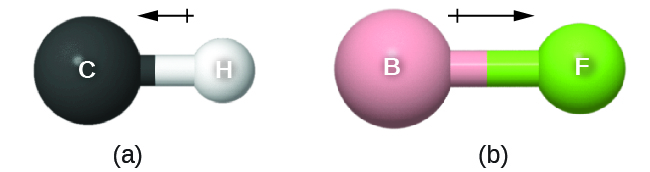
Una molécula entera también puede tener una separación de carga, dependiendo de su estructura molecular y la polaridad de cada uno de sus enlaces. Si existe tal separación de carga, se dice que la molécula es una molécula polar (o dipolo); de lo contrario, se dice que la molécula es no polar. El momento dipolar mide el grado de separación de carga neta en la molécula como un todo. Determinamos el momento dipolar agregando los momentos de enlace en el espacio tridimensional, teniendo en cuenta la estructura molecular.
Para las moléculas diatómicas, solo hay un enlace, por lo que su momento dipolar de enlace determina la polaridad molecular. Las moléculas diatómicas homonucleares como Br 2 y N 2 no tienen diferencia en la electronegatividad, por lo que su momento dipolar es cero. Para las moléculas heteronucleares como el CO, hay un pequeño momento dipolar. Para HF, hay un momento dipolo más grande porque hay una mayor diferencia en la electronegatividad.
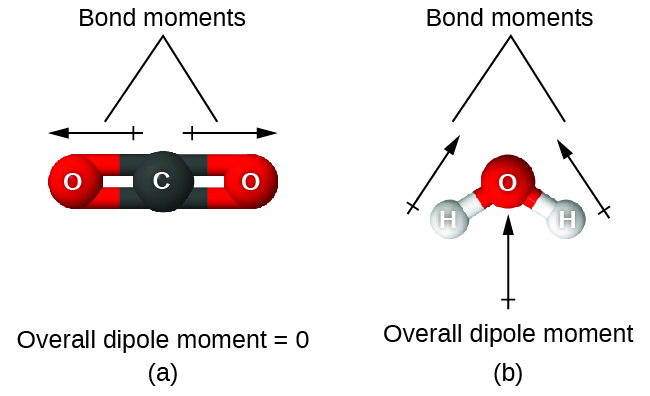
Cuando una molécula contiene más de un enlace, se debe tomar en cuenta la geometría. Si los enlaces en una molécula están dispuestos de tal manera que sus momentos de enlace se cancelan (la suma del vector es igual a cero), entonces la molécula es no polar. Esta es la situación en el CO 2 (Figura\(\PageIndex{13A}\)). Cada uno de los enlaces es polar, pero la molécula en su conjunto es no polar. A partir de la estructura de Lewis, y usando la teoría de VSEPR, determinamos que la molécula de CO 2 es lineal con enlaces polares C=O en lados opuestos del átomo de carbono. Los momentos de vínculo se cancelan porque están apuntados en direcciones opuestas. En el caso de la molécula de agua (Figura\(\PageIndex{13B}\)), la estructura de Lewis nuevamente muestra que hay dos enlaces a un átomo central, y la diferencia de electronegatividad nuevamente muestra que cada uno de estos enlaces tiene un momento de enlace distinto de cero. En este caso, sin embargo, la estructura molecular se dobla debido a los pares solitarios en O, y los dos momentos de enlace no se cancelan. Por lo tanto, el agua tiene un momento dipolar neto y es una molécula polar (dipolo).
La molécula OCS tiene una estructura similar al CO 2, pero un átomo de azufre ha reemplazado a uno de los átomos de oxígeno. Para determinar si esta molécula es polar, dibujamos la estructura molecular. La teoría de VSEPR predice una molécula lineal:
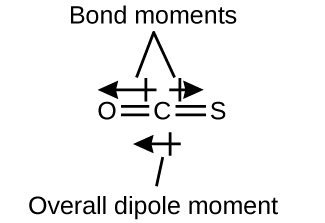
El enlace C—O es considerablemente polar. Aunque C y S tienen valores de electronegatividad muy similares, S es ligeramente más electronegativo que C, por lo que el enlace C-S es apenas ligeramente polar. Debido a que el oxígeno es más electronegativo que el azufre, el extremo de oxígeno de la molécula es el extremo negativo.
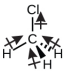
El clorometano, CH 3 Cl, es otro ejemplo de una molécula polar. Aunque los enlaces polares C—Cl y C—H están dispuestos en una geometría tetraédrica, los enlaces C—Cl tienen un momento de unión mayor que el enlace C—H, y los momentos de unión no se cancelan completamente entre sí. Todos los dipolos tienen un componente ascendente en la orientación mostrada, ya que el carbono es más electronegativo que el hidrógeno y menos electronegativo que el cloro:
Cuando examinamos las moléculas altamente simétricas BF 3 (plano trigonal), CH 4 (tetraédrico), PF 5 (trigonal bipiramidal) y SF 6 (octaédrico), en las que todos los enlaces polares son idénticos, las moléculas son no polares. Los enlaces en estas moléculas están dispuestos de tal manera que sus dipolos se cancelan. Sin embargo, el hecho de que una molécula contenga enlaces idénticos no significa que los dipolos siempre se cancelen. Muchas moléculas que tienen enlaces idénticos y pares solitarios en los átomos centrales tienen dipolos de enlace que no cancelan. Los ejemplos incluyen H 2 S y NH 3. Un átomo de hidrógeno está en el extremo positivo y un átomo de nitrógeno o azufre está en el extremo negativo de los enlaces polares en estas moléculas:
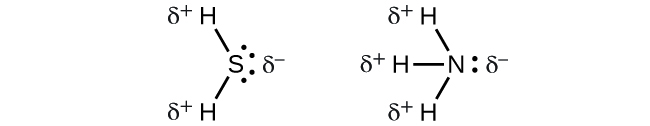
Para resumir, para ser polar, una molécula debe:
- Contienen al menos un enlace covalente polar.
- Tener una estructura molecular tal que la suma de los vectores de cada momento dipolo enlace no cancele.
Propiedades de Moléculas Polares
Las moléculas polares tienden a alinearse cuando se colocan en un campo eléctrico con el extremo positivo de la molécula orientado hacia la placa negativa y el extremo negativo hacia la placa positiva (Figura\(\PageIndex{14}\)). Podemos usar un objeto cargado eléctricamente para atraer moléculas polares, pero las moléculas no polares no son atraídas. Además, los solventes polares son mejores para disolver sustancias polares, y los solventes no polares son mejores para disolver sustancias no polares.
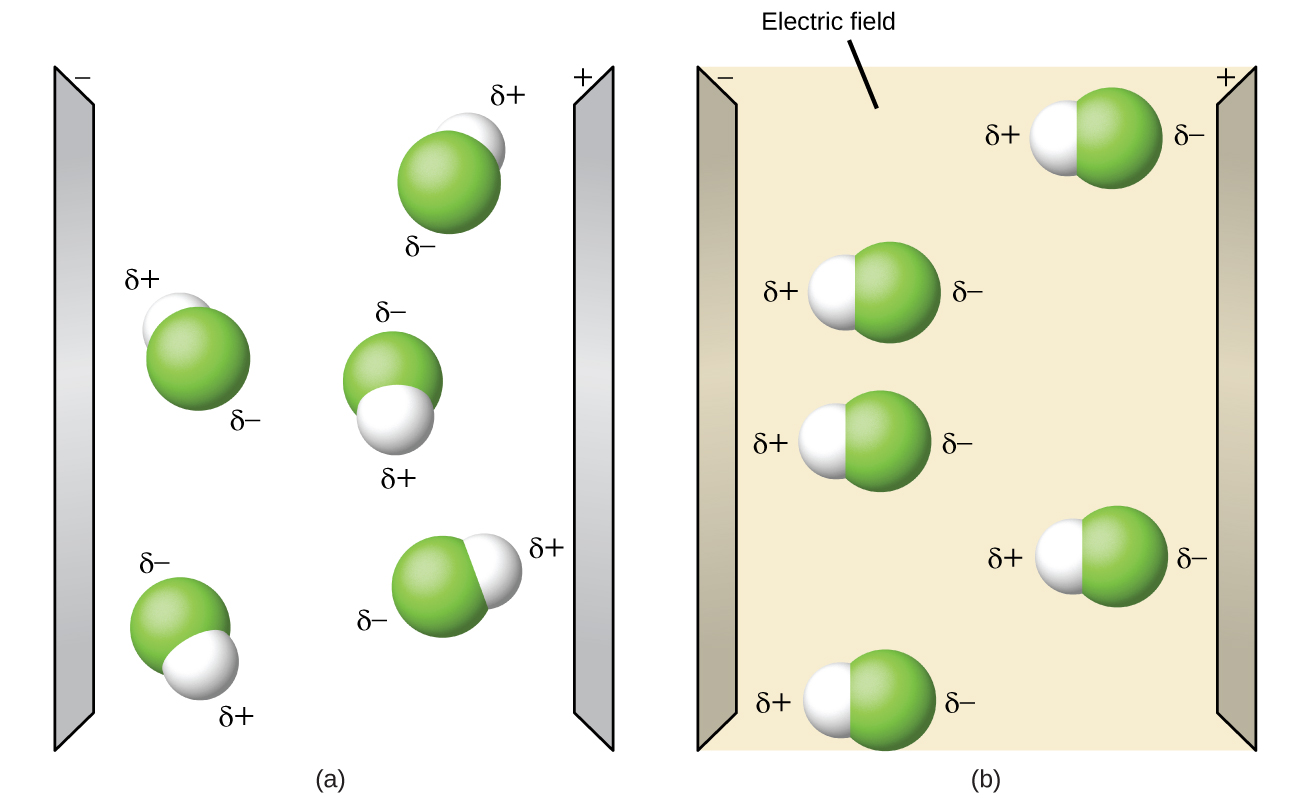
Abra la simulación de polaridad de la molécula y seleccione la pestaña “Tres átomos” en la parte superior. Esto debería mostrar una molécula ABC con tres ajustadores de electronegatividad. Puede mostrar u ocultar los momentos de enlace, los dipolos moleculares y las cargas parciales a la derecha. Al encender el Campo Eléctrico se mostrará si la molécula se mueve cuando se expone a un campo, similar a la Figura\(\PageIndex{14}\).
Use los controles de electronegatividad para determinar cómo buscará el dipolo molecular para la molécula doblada inicial si:
- A y C son muy electronegativos y B está en el medio del rango.
- A es muy electronegativo, y B y C no lo son.
Solución
- El momento dipolo molecular apunta inmediatamente entre A y C.
- El momento dipolo molecular apunta a lo largo del enlace A—B, hacia A.
Determinar las cargas parciales que darán los dipolos de enlace más grandes posibles.
- Responder
-
Los momentos de bonos más grandes se producirán con los mayores cargos parciales. Las dos soluciones anteriores representan cuán desigualmente se comparten los electrones en el enlace. Los momentos de vínculo se maximizarán cuando la diferencia de electronegatividad sea mayor. Los controles para A y C deben establecerse en un extremo, y B debe establecerse en el extremo opuesto. Si bien la magnitud del momento de unión no cambiará en función de si B es el más electronegativo o el menor, la dirección del momento de enlace lo hará.
Resumen
La teoría VSEPR predice la disposición tridimensional de los átomos en una molécula. Afirma que los electrones de valencia asumirán una geometría de par de electrones que minimiza las repulsiones entre áreas de alta densidad de electrones (enlaces y/o pares solitarios). La estructura molecular, que se refiere únicamente a la colocación de átomos en una molécula y no a los electrones, es equivalente a la geometría de pares de electrones solo cuando no hay pares de electrones solitarios alrededor del átomo central. Un momento dipolar mide una separación de carga. Para un enlace, el momento dipolar del enlace está determinado por la diferencia en la electronegatividad entre los dos átomos. Para una molécula, el momento dipolar general está determinado tanto por los momentos de enlace individuales como por la forma en que estos dipolos están dispuestos en la estructura molecular. Las moléculas polares (aquellas con un momento dipolar apreciable) interactúan con campos eléctricos, mientras que las moléculas no polares no lo hacen.
Glosario
- posición axial
- ubicación en una geometría bipiramidal trigonal en la que hay otro átomo en un ángulo de 180° y las posiciones ecuatoriales están en un ángulo de 90°
- ángulo de unión
- ángulo entre dos enlaces covalentes cualesquiera que comparten un átomo común
- distancia de enlace
- (también, longitud de enlace) distancia entre los núcleos de dos átomos unidos
- momento dipolo bond
- separación de carga en un enlace que depende de la diferencia en la electronegatividad y la distancia de enlace representada por cargas parciales o un vector
- momento dipolo
- propiedad de una molécula que describe la separación de carga determinada por la suma de los momentos de enlace individuales en función de la estructura molecular
- Geometría de par de electrones
- disposición alrededor de un átomo central de todas las regiones de densidad electrónica (enlaces, pares solitarios o electrones desapareados)
- posición ecuatorial
- una de las tres posiciones en una geometría bipiramidal trigonal con ángulos de 120° entre ellas; las posiciones axiales se ubican en un ángulo de 90°
- lineal
- forma en la que dos grupos externos se colocan en lados opuestos de un átomo central
- estructura molecular
- estructura que incluye solo la colocación de los átomos en la molécula
- octaédrico
- forma en la que se colocan seis grupos externos alrededor de un átomo central de tal manera que se genera una forma tridimensional con cuatro grupos formando un cuadrado y los otros dos formando el vértice de dos pirámides, una por encima y otra por debajo del plano cuadrado
- molécula polar
- (también, dipolo) molécula con un momento dipolo general
- tetraédrico
- forma en la que se colocan cuatro grupos externos alrededor de un átomo central de tal manera que se genera una forma tridimensional con cuatro esquinas y ángulos de 109.5° entre cada par y el átomo central
- bipiramidal trigonal
- forma en la que cinco grupos exteriores se colocan alrededor de un átomo central de tal manera que tres forman un triángulo plano con ángulos de 120° entre cada par y el átomo central, y los otros dos forman el vértice de dos pirámides, una arriba y otra debajo del plano triangular
- plano trigonal
- forma en la que tres grupos externos se colocan en un triángulo plano alrededor de un átomo central con ángulos de 120° entre cada par y el átomo central
- valencia shell electrón-par teoría de repulsión (VSEPR)
- teoría utilizada para predecir los ángulos de enlace en una molécula basada en el posicionamiento de regiones de alta densidad de electrones lo más alejadas posible para minimizar la repulsión electrostática
- vector
- cantidad que tiene magnitud y dirección


