8.E: Teorías Avanzadas del Enlace Covalente (Ejercicios)
- Page ID
- 75197
8.1: Teoría de los Vínculos de Valencia
Ejercicios de Capítulo
- Explique cómo los enlaces σ y π son similares y en qué se diferencian.
- Dibuja una curva que describa la energía de un sistema con átomos de H y Cl a distancias variables. Entonces, encuentra la energía mínima de esta curva de dos maneras.
- Utilizar la energía de enlace que se encuentra en la Tabla 8.2.1 para calcular la energía para un enlace único de HCl (Pista: ¿Cuántos enlaces hay en un mol?)
- Utilice la entalpía de reacción y las energías de enlace para\(H_2\) y\(Cl_2\) para resolver la energía de un mol de enlaces HCl. \[H_{2(g)}+Cl_{2(g)} \rightleftharpoons 2HCl_{(g)} \;\;\; ΔH^∘_{rxn}=−184.7\; kJ/mol\]
- Explique por qué los enlaces ocurren a distancias de enlace promedio específicas en lugar de que los átomos se acerquen infinitamente cerca.
- Utilice la teoría del enlace de valencia para explicar la unión en F 2, HF y CLBr. Esbozar el solapamiento de los orbitales atómicos involucrados en los enlaces.
- Utilizar la teoría del vínculo de valencia para explicar el vínculo en O 2. Esbozar el solapamiento de los orbitales atómicos involucrados en los enlaces en O 2.
- ¿Cuántos enlaces σ y π están presentes en la molécula HCN?
- Un amigo te dice que N 2 tiene tres enlaces π debido a la superposición de los tres p -orbitales en cada átomo de N. ¿Estás de acuerdo?
- Dibujar las estructuras de Lewis para CO 2 y CO, y predecir el número de enlaces σ y π para cada molécula.
- CO 2
- CO
Soluciones
1. Similitudes: Ambos tipos de enlaces resultan de la superposición de orbitales atómicos en átomos adyacentes y contienen un máximo de dos electrones. Diferencias: los enlaces σ son más fuertes y resultan de la superposición de extremo a extremo y todos los enlaces simples son enlaces σ; los enlaces π entre los mismos dos átomos son más débiles porque resultan de una superposición lado a lado, y los enlaces múltiples contienen uno o más enlaces π (además de un enlace σ).
2
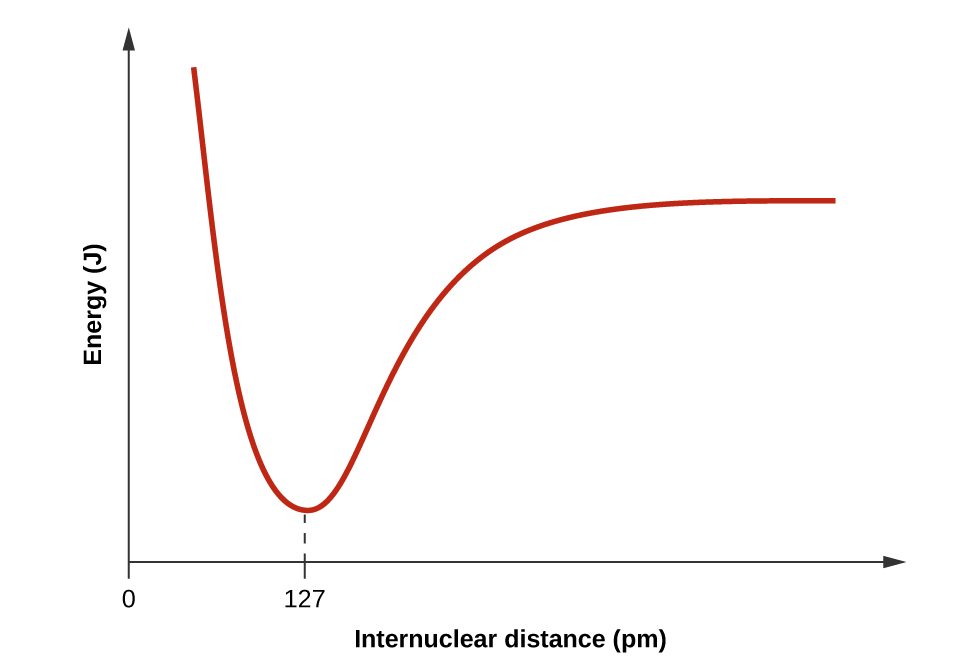
Cuando H y Cl están separados (el eje x) la energía está en un valor particular. A medida que se acercan, disminuye a un mínimo a las 127pm (la distancia de unión), y luego aumenta bruscamente a medida que te acercas.
- (a) H—Cl431 kJ/mol 427 kJmol × Mol6,022 × 1023 enlaces × 1000 JkJ=7,09 × 10-19
- (b) Conocemos la ley de Hess relacionada con las energías de enlace: ΔH°=ΔHBDE (roto) −ΔHBDE (formado) Se nos da la entalpía de la reacción
\[−184.7 kJ/mol=(ΔH∘BDE(H–H)+ΔH∘BDE(Cl–Cl))−(2ΔH∘BDE(H–Cl))\]
\[H–H is 436 kJ/mol and Cl–Cl is 243\]
\[–184.7 kJ/mol = (436 + 243) – 2x = 679 – 2x\]
\[2x = 863.7 kJ/mol\]
\[x = 432\; kJ/mol\]
Esto es muy cercano al valor de la parte (a).
3. La distancia de unión promedio específica es la distancia con la energía más baja. A distancias menores que la distancia de unión, las cargas positivas en los dos núcleos se repelen entre sí y la energía general aumenta.
4. El enlace sencillo presente en cada molécula resulta del solapamiento de los orbitales relevantes: orbitales F 2 p en F 2, los orbitales H 1 s y F 2 p en HF, y los orbitales Cl 3 p y Br 4 p orbitales en CLBr.
5. Vinculación: Un enlace σ y un enlace π. Los orbitales s se llenan y no se superponen. Los orbitales p se superponen a lo largo del eje para formar un enlace σ y uno al lado del otro para formar el enlace π.
6. \(\ce{H–C≡N}\)tiene dos σ (H—C y C—N) y dos π (haciendo el triple enlace CN).
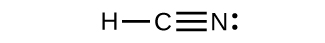
7. No, dos de los orbitales p (uno en cada N) estarán orientados de extremo a extremo y formarán un enlace σ.
 " height="174" width="442" src="https://chem.libretexts.org/@api/dek...ewStru_img.jpg">
" height="174" width="442" src="https://chem.libretexts.org/@api/dek...ewStru_img.jpg">
8. a) 2 σ 2 π;
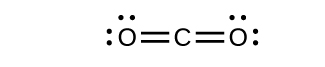
b) 1 σ 2 π;
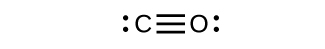
8.2: Orbitales Atómicos Híbridos
Ejercicios de Fin de Capítulo de Química
¿Por qué se requiere el concepto de hibridación en la teoría de los enlaces de valencia?
La hibridación se introduce para explicar la geometría de los orbitales de unión en la teoría de enlaces de cenefa.
Dar la forma que describe cada conjunto orbital híbrido:
(a) sp 2
b) sp 3 d
(c) sp
(d) sp 3 d 2
Explicar por qué un átomo de carbono no puede formar cinco enlaces usando orbitales híbridos sp 3 d.
No hay d orbitales en la capa de valencia del carbono.
¿Cuál es la hibridación del átomo central en cada uno de los siguientes?
a) BeH 2
b) SF 6
c)\(\ce{PO4^3-}\)
d) PCl 5
Una molécula con la fórmula AB 3 podría tener una de cuatro formas diferentes. Dar la forma y la hibridación del átomo A central para cada uno.
plano trigonal, sp 2; piramidal trigonal (un par solitario en A) sp 3; en forma de T (dos pares solitarios en A sp 3 d, o (tres pares solitarios en A) sp 3 d 2
La metionina, CH 3 SCH 2 CH 2 CH (NH 2) CO 2 H, es un aminoácido que se encuentra en las proteínas. Dibuja una estructura de Lewis de este compuesto. ¿Cuál es el tipo de hibridación de cada carbono, oxígeno, nitrógeno y azufre?

El ácido sulfúrico se fabrica mediante una serie de reacciones representadas por las siguientes ecuaciones:
\(\ce{S8}(s)+\ce{8O2}(g)⟶\ce{8SO2}(g)\)
\(\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g)\)
\(\ce{SO3}(g)+\ce{H2O}(l)⟶\ce{H2SO4}(l)\)
Draw a Lewis structure, predict the molecular geometry by VSEPR, and determine the hybridization of sulfur for the following:
(a) circular S8 molecule
(b) SO2 molecule
(c) SO3 molecule
(d) H2SO4 molecule (the hydrogen atoms are bonded to oxygen atoms)
(a) Each S has a bent (109°) geometry, sp3

(b) Doblada (120°), sp 2

(c) Plano trigonal, sp 2

d) Tetraédrico, sp 3

Dos importantes productos químicos industriales, eteno, C 2 H 4, y propeno, C 3 H 6, son producidos por el proceso de craqueo al vapor (o térmico):
\(\ce{2C3H8}(g)⟶\ce{C2H4}(g)+\ce{C3H6}(g)+\ce{CH4}(g)+\ce{H2}(g)\)For each of the four carbon compounds, do the following:
(a) Draw a Lewis structure.
(b) Predict the geometry about the carbon atom.
(c) Determine the hybridization of each type of carbon atom.
For many years after they were discovered, it was believed that the noble gases could not form compounds. Now we know that belief to be incorrect. A mixture of xenon and fluorine gases, confined in a quartz bulb and placed on a windowsill, is found to slowly produce a white solid. Analysis of the compound indicates that it contains 77.55% Xe and 22.45% F by mass.
(a) What is the formula of the compound?
(b) Write a Lewis structure for the compound.
(c) Predict the shape of the molecules of the compound.
(d) What hybridization is consistent with the shape you predicted?
(a) XeF2
(b)

(c) lineal (d) sp 3 d
Considera el ácido nitroso, HNO 2 (HONO).
(a) Escribir una estructura de Lewis.
b) ¿Cuáles son los pares de electrones y las geometrías moleculares de los átomos internos de oxígeno y nitrógeno en la molécula HNO 2?
(c) ¿Cuál es la hibridación en los átomos internos de oxígeno y nitrógeno en el HNO 2?
Los fósforos Strike-anywhere contienen una capa de KClO 3 y una capa de P 4 S 3. El calor producido por la fricción de golpear el fósforo hace que estos dos compuestos reaccionen vigorosamente, lo que prende fuego al tallo de madera del cerillo. KClO 3 contiene el\(\ce{ClO3-}\) ion. P 4 S 3 es una molécula inusual con la estructura esquelética.

(a) Escribir estructuras de Lewis para P 4 S 3 y\(\ce{ClO3-}\) ion.
(b) Describe the geometry about the P atoms, the S atom, and the Cl atom in these species.
(c) Assign a hybridization to the P atoms, the S atom, and the Cl atom in these species.
(d) Determine the oxidation states and formal charge of the atoms in P4S3 and the \(\ce{ClO3-}\) ion.
(a)

(b) átomos de P, piramidales trigonales; átomos de S, doblados, con dos pares solitarios; átomos de Cl, piramidales trigonales; (c) Hibridación sobre P, S y Cl es, en todos los casos, sp 3; (d) Estados de oxidación P +1\(−1\dfrac{1}{3}\), S, Cl +5, O —2. Cargos formales: P 0; S 0; Cl +2: O —1
Identificar la hibridación de cada átomo de carbono en la siguiente molécula. (Se da la disposición de los átomos; es necesario determinar cuántos enlaces conectan cada par de átomos).

Escribe estructuras Lewis para NF 3 y PF 5. A partir de orbitales híbridos, explique el hecho de que NF 3, PF 3 y PF 5 son moléculas estables, pero NF 5 no existe.

El fósforo y el nitrógeno pueden formar híbridos sp 3 para formar tres enlaces y mantener un par solitario en PF 3 y NF 3, respectivamente. Sin embargo, el nitrógeno no tiene valencia d orbitales, por lo que no puede formar un conjunto de orbitales híbridos sp 3 d para unir cinco átomos de flúor en NF 5. El fósforo tiene d orbitales y puede unir cinco átomos de flúor con orbitales híbridos sp 3 d en PF 5.
Además de NF 3, se conocen otros dos derivados fluorados del nitrógeno: N 2 F 4 y N 2 F 2. ¿Qué formas predices para estas dos moléculas? ¿Cuál es la hibridación para el nitrógeno en cada molécula?
8.3: Bonos Múltiples
Ejercicios de Fin de Capítulo de Química
La energía de enlace de un enlace sencillo C—C promedia 347 kJ mol −1; la de un triple enlace C=C promedia 839 kJ mol −1. Explique por qué el triple enlace no es tres veces más fuerte que un enlace sencillo.
Un triple enlace consiste en un enlace σ y dos enlaces π. Un enlace σ es más fuerte que un enlace π debido a una mayor superposición.
Para el ion carbonato,\(\ce{CO3^2-}\), draw all of the resonance structures. Identify which orbitals overlap to create each bond.
A useful solvent that will dissolve salts as well as organic compounds is the compound acetonitrile, H3CCN. It is present in paint strippers.
(a) Write the Lewis structure for acetonitrile, and indicate the direction of the dipole moment in the molecule.
(b) Identify the hybrid orbitals used by the carbon atoms in the molecule to form σ bonds.
(c) Describe the atomic orbitals that form the π bonds in the molecule. Note that it is not necessary to hybridize the nitrogen atom.
(a)

(b) El átomo de carbono terminal utiliza orbitales híbridos sp 3, mientras que el átomo de carbono central se hibrida sp. (c) Cada uno de los dos enlaces π está formado por solapamiento de una órbita de 2 p sobre carbono y una orbital de nitrógeno 2 p.
Para la molécula aleno,\(\mathrm{H_2C=C=CH_2}\), dar la hibridación de cada átomo de carbono. ¿Los átomos de hidrógeno estarán en el mismo plano o planos perpendiculares?
Identificar la hibridación del átomo central en cada una de las siguientes moléculas e iones que contienen múltiples enlaces:
(a) ClnO (N es el átomo central)
b) CS 2
(c) Cl 2 CO (C es el átomo central)
(d) Cl 2 SO (S es el átomo central)
(e) SO 2 F 2 (S es el átomo central)
(f) XEo 2 F 2 (Xe es el átomo central)
(g)\(\ce{ClOF2+}\) (Cl es el átomo central)
(a) sp 2; (b) sp; (c) sp 2; (d) sp 3; (e) sp 3; (f) sp 3 d; (g) sp 3
Describir la geometría molecular y la hibridación de los átomos de N, P o S en cada uno de los siguientes compuestos.
a) H 3 PO 4, ácido fosfórico, utilizado en refrescos de cola
b) NH 4 NO 3, nitrato amónico, un fertilizante y explosivo
(c) S 2 Cl 2, dicloruro de disulfur, utilizado en la vulcanización de caucho
d) K 4 [O 3 POPO 3], pirofosfato de potasio, ingrediente en algunas pastas dentales
Para cada una de las siguientes moléculas, indicar la hibridación solicitada y si los electrones serán deslocalizados o no:
(a) Hibridación con ozono (O 3) central O
b) Hibridación con dióxido de carbono (CO 2) C central
(c) Hibridación de N central con dióxido de nitrógeno (NO 2)
(d) Hibridación de iones fosfato (\(\ce{PO4^3-}\)) P central
(a) sp 2, deslocalizada; (b) sp, localizada; (c) sp 2, deslocalizada; (d) sp 3, deslocalizada
Para cada una de las siguientes estructuras, determine la hibridación solicitada y si los electrones serán deslocalizados:
(a) Hibridación de cada carbono

b) Hibridación de azufre

c) Todos los átomos

Dibuje el diagrama orbital para carbono en CO 2 mostrando cuántos electrones de átomos de carbono hay en cada orbital.

Cada uno de los cuatro electrones está en un orbital separado y se solapa con un electrón en un átomo de oxígeno.
8.4: Teoría Orbital Molecular
Ejercicios de Fin de Capítulo de Química
Esbozar la distribución de la densidad electrónica en los orbitales moleculares ligantes y antiadherentes formados a partir de orbitales de dos s y de dos orbitales p.
¿En qué se parecen los siguientes y en qué se diferencian?
(a) orbitales moleculares σ y orbitales moleculares π
(b) ψ para un orbital atómico y ψ para un orbital molecular
(c) orbitales de unión y orbitales antiadhesión
(a) Similitudes: Ambos son orbitales de unión que pueden contener un máximo de dos electrones. Diferencias: los orbitales σ son combinaciones de orbitales atómicos de extremo a extremo, mientras que los orbitales π se forman por superposición de orbitales lado a lado. (b) Similitudes: Ambos son constructos cuántico-mecánicos que representan la probabilidad de encontrar el electrón alrededor del átomo o la molécula. Diferencias: ψ para un orbital atómico describe el comportamiento de un solo electrón a la vez basado en el átomo. Para una molécula, ψ representa una combinación matemática de orbitales atómicos. (c) Similitudes: Ambos son orbitales que pueden contener dos electrones. Diferencias: Los orbitales de unión resultan en mantener juntos dos o más átomos. Los orbitales antiadhesión tienen el efecto de desestabilizar cualquier unión que se haya producido.
Si se crean orbitales moleculares combinando cinco orbitales atómicos del átomo A y cinco orbitales atómicos del átomo B se combinan, ¿cuántos orbitales moleculares resultarán?
¿Puede alguna vez una molécula con un número impar de electrones ser diamagnética? Explique por qué o por qué no.
Nunca se puede emparejar un número impar de electrones, independientemente de la disposición de los orbitales moleculares. Siempre será paramagnético.
¿Puede alguna vez una molécula con un número par de electrones ser paramagnética? Explique por qué o por qué no.
¿Por qué los orbitales moleculares de unión son más bajos en energía que los orbitales atómicos progenitores?
Los orbitales de unión tienen densidad electrónica muy cerca de más de un núcleo. La interacción entre los núcleos cargados positivamente y los electrones cargados negativamente estabiliza el sistema.
Calcule el orden de enlace para un ion con esta configuración:
Explain why an electron in the bonding molecular orbital in the H2 molecule has a lower energy than an electron in the 1s atomic orbital of either of the separated hydrogen atoms.
The pairing of the two bonding electrons lowers the energy of the system relative to the energy of the nonbonded electrons.
Predict the valence electron molecular orbital configurations for the following, and state whether they will be stable or unstable ions.
(a) \(\ce{Na2^2+}\)
(b) \(\ce{Mg2^2+}\)
(c) \(\ce{Al2^2+}\)
(d) \(\ce{Si2^2+}\)
(e) \(\ce{P2^2+}\)
(f) \(\ce{S2^2+}\)
(g) \(\ce{F2^2+}\)
(h) \(\ce{Ar2^2+}\)
Determine the bond order of each member of the following groups, and determine which member of each group is predicted by the molecular orbital model to have the strongest bond.
(a) H2, \(\ce{H2+}\), \(\ce{H2-}\)
(b) O2, \(\ce{O2^2+}\), \(\ce{O2^2-}\)
(c) Li2, \(\ce{Be2+}\), Be2
(d) F2, \(\ce{F2+}\), \(\ce{F2-}\)
(e) N2, \(\ce{N2+}\), \(\ce{N2-}\)
(a) H2 bond order = 1, \(\ce{H2+}\) bond order = 0.5, \(\ce{H2-}\) bond order = 0.5, strongest bond is H2; (b) O2 bond order = 2, \(\ce{O2^2+}\) bond order = 3; \(\ce{O2^2-}\) bond order = 1, strongest bond is \(\ce{O2^2+}\); (c) Li2 bond order = 1, \(\ce{Be2+}\) bond order = 0.5, Be2 bond order = 0, strongest bond is \(\ce{Li2}\);(d) F2 bond order = 1, \(\ce{F2+}\) bond order = 1.5, \(\ce{F2-}\) bond order = 0.5, strongest bond is \(\ce{F2+}\); (e) N2 bond order = 3, \(\ce{N2+}\) bond order = 2.5, \(\ce{N2-}\) bond order = 2.5, strongest bond is N2
For the first ionization energy for an N2 molecule, what molecular orbital is the electron removed from?
Compare the atomic and molecular orbital diagrams to identify the member of each of the following pairs that has the highest first ionization energy (the most tightly bound electron) in the gas phase:
(a) H and H2
(b) N and N2
(c) O and O2
(d) C and C2
(e) B and B2
(a) H2; (b) N2; (c) O; (d) C2; (e) B2
Which of the period 2 homonuclear diatomic molecules are predicted to be paramagnetic?
A friend tells you that the 2s orbital for fluorine starts off at a much lower energy than the 2s orbital for lithium, so the resulting σ2s molecular orbital in F2 is more stable than in Li2. Do you agree?
Yes, fluorine is a smaller atom than Li, so atoms in the 2s orbital are closer to the nucleus and more stable.
True or false: Boron contains 2s22p1 valence electrons, so only one p orbital is needed to form molecular orbitals.
What charge would be needed on F2 to generate an ion with a bond order of 2?
2+
Predict whether the MO diagram for S2 would show s-p mixing or not.
Explain why \(\ce{N2^2+}\) is diamagnetic, while \(\ce{O2^4+}\), which has the same number of valence electrons, is paramagnetic.
N2 has s-p mixing, so the π orbitals are the last filled in \(\ce{N2^2+}\). O2 does not have s-p mixing, so the σp orbital fills before the π orbitals.
Using the MO diagrams, predict the bond order for the stronger bond in each pair:
(a) B2 or \(\ce{B2+}\)
(b) F2 or \(\ce{F2+}\)
(c) O2 or \(\ce{O2^2+}\)
(d) \(\ce{C2+}\) or \(\ce{C2-}\)


