11.3: Solubilidad
- Page ID
- 75342
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir los efectos de la temperatura y la presión sobre la solubilidad
- Estado de la ley de Henry y utilizarla en cálculos que involucren la solubilidad de un gas en un líquido
- Explicar los grados de solubilidad posibles para soluciones líquido-líquido
Imagina agregar una pequeña cantidad de sal a un vaso de agua, remover hasta que toda la sal se haya disuelto, y luego agregar un poco más. Se puede repetir este proceso hasta que la concentración de sal de la solución alcance su límite natural, límite determinado principalmente por las fuerzas de atracción soluto-soluto, soluto-disolvente y disolvente-disolvente discutidas en los dos módulos anteriores de este capítulo. Puedes estar seguro de que has alcanzado este límite porque, por mucho tiempo que revuelvas la solución, queda sal sin disolver. La concentración de sal en la solución en este punto se conoce como su solubilidad.
La solubilidad de un soluto en un disolvente particular es la concentración máxima que se puede lograr en condiciones dadas cuando el proceso de disolución está en equilibrio. Refiriéndose al ejemplo de la sal en el agua:
\[\ce{NaCl}(s)⇌\ce{Na+}(aq)+\ce{Cl-}(aq) \label{11.4.1} \]
Cuando la concentración de un soluto es igual a su solubilidad, se dice que la solución está saturada con ese soluto. Si la concentración del soluto es menor que su solubilidad, se dice que la solución es insaturada. Una solución que contiene una concentración relativamente baja de soluto se llama diluida, y una con una concentración relativamente alta se llama concentrada.
Si añadimos más sal a una solución saturada de sal, la vemos caer al fondo y ya no parece disolverse más. De hecho, la sal añadida sí se disuelve, como se representa por la dirección hacia delante de la ecuación de disolución. Acompañando a este proceso, precipitará la sal disuelta, como se representa en la dirección inversa de la ecuación. Se dice que el sistema está en equilibrio cuando estos dos procesos recíprocos ocurren a tasas iguales, por lo que la cantidad de sal no disuelta y disuelta permanece constante. Se brinda soporte para la ocurrencia simultánea de los procesos de disolución y precipitación señalando que el número y tamaño de los cristales de sal no disueltos cambiarán con el tiempo, aunque su masa combinada seguirá siendo la misma.
Se pueden preparar soluciones en las que una concentración de soluto exceda su solubilidad. Se dice que tales soluciones están sobresaturadas, y son ejemplos interesantes de estados de no equilibrio. Por ejemplo, la bebida carbonatada en un recipiente abierto que aún no se ha “plano” está sobresaturada con gas dióxido de carbono; dado el tiempo, la concentración de CO 2 disminuirá hasta alcanzar su valor de equilibrio.
Soluciones de Gases en Líquidos
En un módulo anterior de este capítulo, se discutió el efecto de las fuerzas de atracción intermoleculares en la formación de soluciones. Las estructuras químicas del soluto y disolvente dictan los tipos de fuerzas posibles y, en consecuencia, son factores importantes para determinar la solubilidad. Por ejemplo, en condiciones similares, la solubilidad en agua del oxígeno es aproximadamente tres veces mayor que la del helio, pero 100 veces menor que la solubilidad del clorometano, CHCl 3. Considerando el papel de la estructura química del solvente, tenga en cuenta que la solubilidad del oxígeno en el hidrocarburo líquido hexano, C 6 H 14, es aproximadamente 20 veces mayor que en el agua.
Otros factores también afectan la solubilidad de una sustancia dada en un disolvente dado. La temperatura es uno de esos factores, con la solubilidad del gas típicamente disminuyendo a medida que aumenta la temperatura (Figura\(\PageIndex{1}\)). Este es uno de los mayores impactos derivados de la contaminación térmica de los cuerpos de agua naturales.
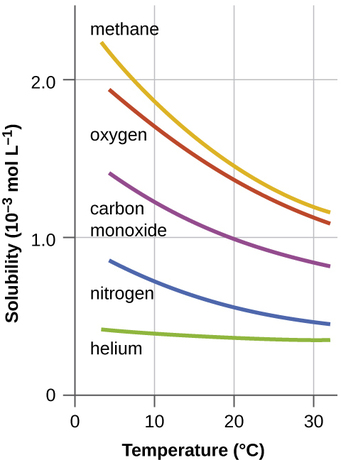
Cuando la temperatura de un río, lago o arroyo se eleva anormalmente alta, generalmente debido a la descarga de agua caliente de algún proceso industrial, la solubilidad del oxígeno en el agua disminuye. La disminución de los niveles de oxígeno disuelto puede tener graves consecuencias para la salud de los ecosistemas del agua y, en casos severos, puede provocar muertes de peces a gran escala (Figura\(\PageIndex{2}\)).

La solubilidad de un soluto gaseoso también se ve afectada por la presión parcial del soluto en el gas al que se expone la solución. La solubilidad del gas aumenta a medida que aumenta la presión del gas. Las bebidas carbonatadas proporcionan una buena ilustración de esta relación. El proceso de carbonatación implica exponer la bebida a una presión relativamente alta de gas dióxido de carbono y luego sellar el recipiente de bebida, saturando así la bebida con CO 2 a esta presión. Cuando se abre el recipiente de bebida, se escucha un silbido familiar a medida que se libera la presión del gas de dióxido de carbono, y parte del dióxido de carbono disuelto se ve típicamente dejando solución en forma de pequeñas burbujas (Figura\(\PageIndex{3}\)). En este punto, la bebida está sobresaturada con dióxido de carbono y, con el tiempo, la concentración de dióxido de carbono disuelto disminuirá a su valor de equilibrio y la bebida se volverá “plana”.

Para muchos solutos gaseosos, la relación entre solubilidad\(C_g\), y presión parcial\(P_g\),, es proporcional:
\[C_\ce{g}=kP_\ce{g} \nonumber \]
donde\(k\) es una constante de proporcionalidad que depende de las identidades del soluto gaseoso y disolvente, y de la temperatura de la solución. Esta es una declaración matemática de la ley de Henry: La cantidad de un gas ideal que se disuelve en un volumen definido de líquido es directamente proporcional a la presión del gas.
A 20 °C, la concentración de oxígeno disuelto en agua expuesta a oxígeno gaseoso a una presión parcial de 101.3 kPa (760 torr) es de 1.38 × 10 −3 mol L −1. Utilice la ley de Henry para determinar la solubilidad del oxígeno cuando su presión parcial es de 20.7 kPa (155 torr), la presión aproximada del oxígeno en la atmósfera terrestre.
Solución
Según la ley de Henry, para una solución ideal la solubilidad, C g, de un gas (1.38 × 10 −3 mol L −1, en este caso) es directamente proporcional a la presión, P g, del gas no disuelto por encima de la solución (101.3 kPa, o 760 torr, en este caso). Debido a que conocemos tanto C g como P g, podemos reorganizar esta expresión para resolver para k.
\ [\ begin {alinear*}
C_\ ce {g} &=kp_\ ce {g}\\ [4pt]
k&=\ dfrac {C_\ ce {g}} {P_\ ce {g}}\\ [4pt]
&=\ mathrm {\ dfrac {1.38×10^ {−3}\ :mol\ :L^ {−1}} 101.3\ :kPa}}\\ [4pt]
&=\ mathrm {1.36×10^ {−5}\ :mol\ :L^ {−1}\ :KPa^ {−1}}\\ [4pt]
&\ hspace {15px}\ mathrm {(1.82×10^ {−6}\ :mol\ :L^ {−1}\ :torr^ {−1})}
\ end {align*}\ nonumber\]
Ahora podemos usar k para encontrar la solubilidad a la presión más baja.
\[C_\ce{g}=kP_\ce{g} \nonumber \]
\ [\ mathrm {1.36×10^ {−5}\ :mol\ :L^ {−1}\ :kPa^ {−1} ×20.7\ :kPa\\ [4pt]
(o\ :1.82×10^ {−6}\ :mol\ :L^ {−1}\ :torr^ {−1} ×155\ :torr)\\ [4pt]
=2.82×10^ {−4}\ :mol\ :L^ {−1}}\ nonumber\]
Tenga en cuenta que se pueden usar varias unidades para expresar las cantidades involucradas en este tipo de cálculos. Cualquier combinación de unidades que cedan a las restricciones del análisis dimensional son aceptables.
La exposición de una muestra de 100.0 mL de agua a 0 °C a una atmósfera que contenía un soluto gaseoso a 20.26 kPa (152 torr) resultó en la disolución de 1.45 × 10 −3 g del soluto. Utilice la ley de Henry para determinar la solubilidad de este soluto gaseoso cuando su presión es de 101.3 kPa (760 torr).
- Contestar
-
7.25 × 10 −3 g en 100.0 mL o 0.0725 g/L
La enfermedad por descompresión (DCS), o “las curvas”, es un efecto del aumento de la presión del aire inhalado por los buceadores cuando nadan bajo el agua a profundidades considerables. Además de la presión ejercida por la atmósfera, los buzos son sometidos a presión adicional debido al agua por encima de ellos, experimentando un incremento de aproximadamente 1 atm por cada 10 m de profundidad. Por lo tanto, el aire inhalado por un buceador mientras está sumergido contiene gases a la presión ambiental más alta correspondiente, y las concentraciones de los gases disueltos en la sangre del buceador son proporcionalmente mayores según la ley de Henry.
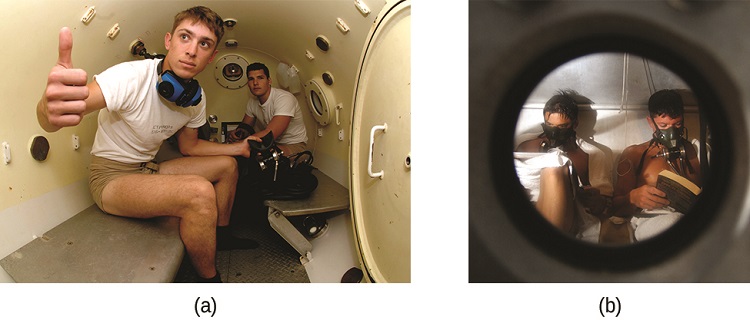
A medida que el buceador asciende a la superficie del agua, la presión ambiental disminuye y los gases disueltos se vuelven menos solubles. Si el ascenso es demasiado rápido, los gases que escapan de la sangre del buceador pueden formar burbujas que pueden causar una variedad de síntomas que van desde erupciones y dolor articular hasta parálisis y muerte. Para evitar DCS, los buzos deben ascender desde profundidades a velocidades relativamente lentas (10 o 20 m/min) o de otra manera realizar varias paradas de descompresión, haciendo una pausa de varios minutos a profundidades dadas durante el ascenso. Cuando estas medidas preventivas no tienen éxito, a los buceadores con DCS se les suele proporcionar oxigenoterapia hiperbárica en vasos presurizados llamados cámaras de descompresión (o recompresión) (Figura\(\PageIndex{4}\)).
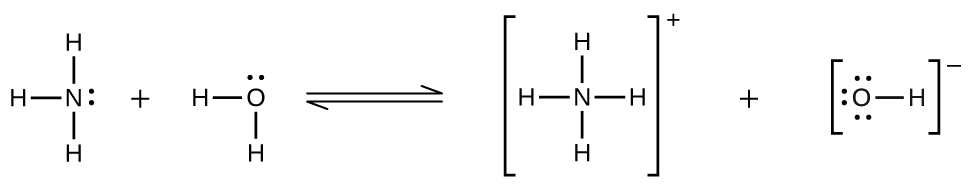
Se observan desviaciones de la ley de Henry cuando se produce una reacción química entre el soluto gaseoso y el disolvente. Así, por ejemplo, la solubilidad del amoníaco en agua no aumenta tan rápidamente con el aumento de la presión como predice la ley debido a que el amoníaco, al ser una base, reacciona en cierta medida con el agua para formar iones amonio e iones hidróxido.
Los gases pueden formar soluciones sobresaturadas. Si se prepara una solución de un gas en un líquido ya sea a baja temperatura o bajo presión (o ambas), entonces a medida que la solución se calienta o a medida que se reduce la presión del gas, la solución puede sobresaturarse. En 1986, más de 1700 personas en Camerún murieron cuando una nube de gas, casi con certeza dióxido de carbono, burbujeó del lago Nyos (Figura\(\PageIndex{5}\)), un lago profundo en un cráter volcánico. El agua en el fondo del lago Nyos está saturada de dióxido de carbono por la actividad volcánica debajo del lago. Se cree que el lago sufrió una rotación debido al calentamiento gradual desde debajo del lago, y el agua más cálida y menos densa saturada de dióxido de carbono llegó a la superficie. En consecuencia, se liberaron enormes cantidades de CO 2 disuelto, y el gas incoloro, que es más denso que el aire, fluyó por el valle debajo del lago y sofocó a humanos y animales que vivían en el valle.

Soluciones de Líquidos en Líquidos
Sabemos que algunos líquidos se mezclan entre sí en todas las proporciones; es decir, tienen infinita solubilidad mutua y se dice que son miscibles. Etanol, ácido sulfúrico y etilenglicol (popular para su uso como anticongelante, representado en la Figura\(\PageIndex{6}\)) son ejemplos de líquidos que son completamente miscibles con agua. El aceite de motor de dos tiempos es miscible con la gasolina.

Los líquidos que se mezclan con el agua en todas las proporciones suelen ser sustancias polares o sustancias que forman enlaces de hidrógeno. Para tales líquidos, las atracciones dipolo-dipolo (o enlaces de hidrógeno) de las moléculas de soluto con las moléculas de disolvente son al menos tan fuertes como las que se encuentran entre las moléculas en el soluto puro o en el disolvente puro. De ahí que los dos tipos de moléculas se mezclen fácilmente. Asimismo, los líquidos no polares son miscibles entre sí porque no hay diferencia apreciable en las resistencias de las atracciones intermoleculares soluto-soluto, disolvente-disolvente y soluto-disolvente. La solubilidad de moléculas polares en disolventes polares y de moléculas no polares en disolventes no polares es, nuevamente, una ilustración del axioma químico “como se disuelve como”.
Dos líquidos que no se mezclan en una medida apreciable se denominan inmiscibles. Las capas se forman cuando vertimos líquidos inmiscibles en el mismo recipiente. La gasolina, el aceite (Figura\(\PageIndex{7}\)), el benceno, el tetracloruro de carbono, algunas pinturas y muchos otros líquidos no polares son inmiscibles con el agua. La atracción entre las moléculas de tales líquidos no polares y las moléculas polares de agua es ineficazmente débil. Los únicos atractivos fuertes en tal mezcla son entre las moléculas de agua, por lo que efectivamente exprimen las moléculas del líquido no polar. La distinción entre inmiscibilidad y miscibilidad es realmente de grados, por lo que los líquidos miscibles son de solubilidad mutua infinita, mientras que los líquidos que se dice que son inmiscibles son de solubilidad mutua muy baja (aunque no nula).

Se dice que dos líquidos, como el bromo y el agua, que son de solubilidad mutua moderada son parcialmente miscibles. Dos líquidos parcialmente miscibles suelen formar dos capas cuando se mezclan. En el caso de la mezcla de bromo y agua, la capa superior es agua, saturada con bromo, y la capa inferior es bromo saturado con agua. Dado que el bromo es no polar, y, por lo tanto, no es muy soluble en agua, la capa de agua solo se decolora ligeramente por el bromo naranja brillante disuelto en ella. Dado que la solubilidad del agua en bromo es muy baja, no hay un efecto notable sobre el color oscuro de la capa de bromo (Figura\(\PageIndex{8}\)).

Soluciones de Sólidos en Líquidos
La dependencia de la solubilidad de la temperatura para un número de sólidos inorgánicos en agua se muestra por las curvas de solubilidad en la Figura\(\PageIndex{9}\). La revisión de estos datos indica una tendencia general de aumento de la solubilidad con la temperatura, aunque hay excepciones, como lo ilustra el compuesto iónico sulfato de cerio.
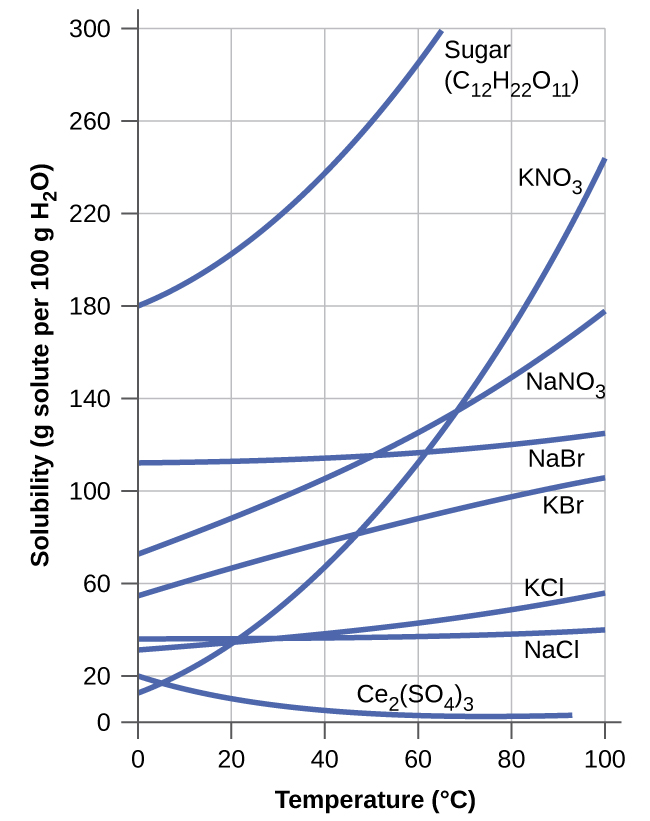
La dependencia de la temperatura de la solubilidad puede explotarse para preparar soluciones sobresaturadas de ciertos compuestos. Una solución puede saturarse con el compuesto a una temperatura elevada (donde el soluto es más soluble) y posteriormente enfriarse a una temperatura más baja sin precipitar el soluto. La solución resultante contiene soluto a una concentración mayor que su solubilidad en equilibrio a la temperatura más baja (es decir, está sobresaturado) y es relativamente estable. La precipitación del exceso de soluto se puede iniciar mediante la adición de un cristal semilla (ver el video en el Link to Learning anteriormente en este módulo) o agitando mecánicamente la solución. Algunos calentadores de manos, como el que se muestra en la Figura\(\PageIndex{10}\), aprovechan este comportamiento.

Video\(\PageIndex{2}\): Este video muestra el proceso de cristalización que ocurre en un calentador de manos.
Resumen
La medida en que una sustancia se disolverá en otra está determinada por varios factores, incluyendo los tipos y fuerzas relativas de las fuerzas de atracción intermoleculares que pueden existir entre los átomos, iones o moléculas de las sustancias. Esta tendencia a disolverse se cuantifica como la solubilidad de la sustancia, su concentración máxima en una solución en equilibrio bajo condiciones específicas. Una solución saturada contiene soluto a una concentración igual a su solubilidad. Una solución supersaturada es aquella en la que la concentración de un soluto excede su solubilidad, una condición de no equilibrio (inestable) que dará como resultado la precipitación de soluto cuando la solución se perturbe apropiadamente. Los líquidos miscibles son solubles en todas las proporciones, y los líquidos inmiscibles exhiben una solubilidad mutua muy baja. Las solubilidades para los solutos gaseosos disminuyen con el aumento de la temperatura, mientras que las de la mayoría, pero no todos, los solutos sólidos aumentan con la temperatura. La concentración de un soluto gaseoso en una solución es proporcional a la presión parcial del gas al que se expone la solución, relación conocida como ley de Henry.
Ecuaciones Clave
- \(C_\ce{g}=kP_\ce{g}\)
Glosario
- Ley de Henry
- ley que establece la relación proporcional entre la concentración de gas disuelto en una solución y la presión parcial del gas en contacto con la solución
- inmiscibles
- de solubilidad mutua insignificante; típicamente se refiere a sustancias líquidas
- miscible
- mutuamente solubles en todas las proporciones; típicamente se refiere a sustancias líquidas
- parcialmente miscible
- de solubilidad mutua moderada; típicamente se refiere a sustancias líquidas
- saturado
- de concentración igual a solubilidad; conteniendo la concentración máxima de soluto posible para una temperatura y presión dadas
- solubilidad
- grado en que un soluto puede disolverse en agua, o cualquier disolvente
- sobresaturado
- de concentración que excede la solubilidad; un estado de no equilibrio
- insaturado
- de concentración menor que solubilidad


