11.E: Soluciones y Coloides (Ejercicios)
- Page ID
- 75353
11.2: El Proceso de Disolución
Q11.2.1
¿En qué difieren las soluciones de los compuestos? ¿De otras mezclas?
S11.2.1
Una solución puede variar en composición, mientras que un compuesto no puede variar en composición. Las soluciones son homogéneas a nivel molecular, mientras que otras mezclas son heterogéneas.
Q11.2.2
¿Cuál de las principales características de las soluciones podemos ver en las soluciones que\(\ce{K2Cr2O7}\) se muestran en

Figura: Cuando el dicromato de potasio (\(\ce{K2Cr2O7}\)) se mezcla con agua, forma una solución naranja homogénea. (crédito: modificación de obra por Mark Ott)
S11.2.2
Las soluciones son las mismas en todas partes (el color es constante en todas partes), y la composición de una solución de K 2 Cr 2 O 7 en agua puede variar.
Q11.2.3
Cuando KNO 3 se disuelve en agua, la solución resultante es significativamente más fría de lo que era originalmente el agua.
- ¿La disolución de KNO 3 es un proceso endotérmico o exotérmico?
- ¿Qué conclusiones puedes sacar sobre los atractivos intermoleculares involucrados en el proceso?
- ¿La solución resultante es una solución ideal?
S11.2.3
(a) El proceso es endotérmico ya que la solución está consumiendo calor. (b) La atracción entre el K + y\(\ce{NO3-}\) los iones es más fuerte que entre los iones y las moléculas de agua (las interacciones ión-ion tienen una energía menor y más negativa). Por lo tanto, el proceso de disolución aumenta la energía de las interacciones moleculares, y consume la energía térmica de la solución para suplir la diferencia. (c) No, se forma una solución ideal sin liberación o consumo apreciables de calor.
Q11.2.4
Dé un ejemplo de cada uno de los siguientes tipos de soluciones:
- un gas en un líquido
- un gas en un gas
- un sólido en un sólido
S11.2.4
a) CO 2 en agua; b) O 2 en N 2 (aire); c) bronce (solución de estaño u otros metales en cobre)
Q11.2.5
Indicar los tipos más importantes de atracciones intermoleculares en cada una de las siguientes soluciones:
- La solución en la Figura.
- NO (l) en CO (l)
- Cl 2 (g) en Br 2 (l)
- HCl (ac) en benceno C 6 H 6 (l)
- Metanol CH 3 OH (l) en H 2 O (l)
S11.2.5
(a) fuerzas ión-dipolo; (b) fuerzas dipolo-dipolo; (c) fuerzas de dispersión; (d) fuerzas de dispersión; (e) enlaces de hidrógeno
Q11.2.5
Predecir si cada una de las siguientes sustancias sería más soluble en agua (disolvente polar) o en un hidrocarburo como heptano (C 7 H 16, disolvente no polar):
- aceite vegetal (no polar)
- alcohol isopropílico (polar)
- bromuro de potasio (iónico)
S11.2.5
a) heptano; b) agua; c) agua
Q11.2.6
El calor se libera cuando se forman algunas soluciones; el calor se absorbe cuando se forman otras soluciones. Proporcionar una explicación molecular de la diferencia entre estos dos tipos de procesos espontáneos.
S11.2.6
El calor se libera cuando las fuerzas intermoleculares totales (IMF) entre las moléculas de soluto y disolvente son más fuertes que las IMF totales en el soluto puro y en el disolvente puro: Romper IMF más débiles y formar IMF más fuertes libera calor. El calor se absorbe cuando los IMF totales en la solución son más débiles que el total de aquellos en el soluto puro y en el disolvente puro: Rompiendo IMF más fuertes y formando IMF más débiles absorbe el calor.
Q11.2.7
Se pueden formar soluciones de hidrógeno en paladio exponiendo el metal Pd a gas H 2. La concentración de hidrógeno en el paladio depende de la presión del gas H 2 aplicado, pero de una manera más compleja que la que puede describir la ley de Henry. Bajo ciertas condiciones, se disuelven 0.94 g de hidrógeno gaseoso en 215 g de paladio metálico.
- Determinar la molaridad de esta solución (densidad de solución = 1.8 g/cm 3).
- Determinar la molalidad de esta solución (densidad de solución = 1.8 g/cm 3).
- Determinar el porcentaje en masa de átomos de hidrógeno en esta solución (densidad de la solución = 1.8 g/cm 3).
S11.2.7
http://cnx.org/contents/ MH6AqEGx @2 /El-Proceso de Disolución
11.3: Electrolitos
Q11.3.1
Explique por qué los iones Na + y Cl − están fuertemente solvatados en agua pero no en hexano, un disolvente compuesto por moléculas no polares.
S11.3.2
Los cristales de NaCl se disuelven en agua, un líquido polar con un momento dipolar muy grande, y los iones individuales se solvatan fuertemente. El hexano es un líquido no polar con un momento dipolar de cero y, por lo tanto, no interactúa significativamente con los iones de los cristales de NaCl.
Q11.3.2
Explique por qué las soluciones de HBr en benceno (un disolvente no polar) no son conductoras, mientras que las soluciones en agua (un disolvente polar) son conductoras.
S11.3.2
HBr es un ácido y por lo tanto sus moléculas reaccionan con moléculas de agua para formar iones H 3 O + y Br − que proporcionan conductividad a la solución. Aunque HBr es soluble en benceno, no reacciona químicamente sino que permanece disuelto como moléculas neutras de HBr. Sin iones presentes en la solución de benceno, es eléctricamente no conductor.
Q11.3.3
Considere las soluciones presentadas:
(a) ¿Cuál de los siguientes bocetos representa mejor los iones en una solución de Fe (NO 3) 3 (aq)?
3_img.jpg") " style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
" style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
(b) Escribir una ecuación química equilibrada que muestre los productos de la disolución de Fe (NO 3) 3.
S11.3.3
(a) El Fe (NO 3) 3 es un electrolito fuerte, por lo que debe disociarse completamente en Fe 3+ e\(\ce{(NO3- )}\) iones. Por lo tanto, (z) mejor representa la solución. b)\(\ce{Fe(NO3)3}(s)⟶\ce{Fe^3+}(aq)+\ce{3NO3- }(aq)\)
Q11.3.4
Compare los procesos que ocurren cuando metanol (CH 3 OH), cloruro de hidrógeno (HCl) e hidróxido de sodio (NaOH) se disuelven en agua. Escribir ecuaciones y preparar bocetos que muestren la forma en que cada uno de estos compuestos está presente en su respectiva solución.
S11.3.3
El metanol,\(CH_3OH\), se disuelve en agua en todas las proporciones, interactuando a través de enlaces de hidrógeno.
Metanol:
\[CH_3OH_{(l)}+H_2O_{(l)}⟶CH_3OH_{(aq)}\]
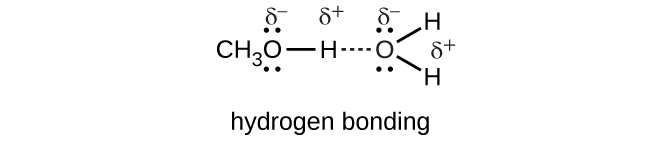
El cloruro de hidrógeno, HCl, se disuelve y reacciona con agua para producir cationes hidronio y aniones cloruro que se solvatan por fuertes interacciones ión-dipolo.
Cloruro de hidrógeno:
\[HCl{(g)}+H_2O_{(l)} \rightarrow H_3O^+_{(aq)}+Cl^−_{(aq)}\]
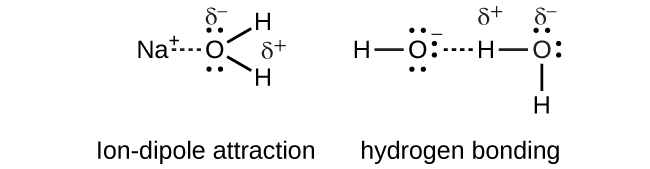
Sodium hydroxide, NaOH, dissolves in water and dissociates to yield sodium cations and hydroxide anions that are strongly solvated by ion-dipole interactions and hydrogen bonding, respectively.
Sodium hydroxide:
\[NaOH_{(s)} \rightarrow Na^+_{(aq)} + OH^−_{(aq)}\]
Q11.3.5
¿Cuál es la conductividad eléctrica esperada de las siguientes soluciones?
- NaOH (aq)
- HCl (aq)
- C 6 H 12 O 6 (aq) (glucosa)
- NH 3 (l)
S11.3.5
(a) alta conductividad (el soluto es un compuesto iónico que se disociará cuando se disuelve); (b) alta conductividad (el soluto es un ácido fuerte y se ionizará completamente cuando se disuelve); (c) no conductor (el soluto es un compuesto covalente, ni ácido ni base, no reactivo hacia el agua); (d) baja conductividad (el soluto es un base débil y se ionizará parcialmente cuando se disuelva)
Q11.3.6
¿Por qué la mayoría de los compuestos iónicos sólidos son eléctricamente no conductores, mientras que las soluciones acuosas de compuestos iónicos son buenos conductores? ¿Esperaría que un compuesto iónico líquido (fundido) sea eléctricamente conductor o no conductor? Explique.
S11.3.6
Un medio debe contener entidades cargadas libremente móviles para ser eléctricamente conductoras. Los iones presentes en un sólido iónico típico se inmovilizan en una red cristalina y así el sólido no es capaz de soportar una corriente eléctrica. Cuando los iones se movilizan, ya sea fundiendo el sólido o disolviéndolo en agua para disociar los iones, la corriente puede fluir y estas formas del compuesto iónico son conductoras.
Q11.3.7
Indicar el tipo más importante de atracción intermolecular responsable de la solvatación en cada una de las siguientes soluciones:
- las soluciones en la Figura
- metanol, CH 3 OH, disuelto en etanol, C 2 H 5 OH
- metano, CH 4, disuelto en benceno, C 6 H 6
- el halocarbono polar CF 2 Cl 2 disuelto en el halocarbono polar CF 2 ClCFCl 2
- O 2 (l) en N 2 (l)
S11.3.7
a) dipolo iónico; b) enlaces de hidrógeno; c) fuerzas de dispersión; d) atracciones dipolo-dipolo; e) fuerzas de dispersión
11.4: Solubilidad
Q11.4.1
Supongamos que se le presenta una solución transparente de tiosulfato de sodio, Na 2 S 2 O 3. ¿Cómo podría determinar si la solución es insaturada, saturada o sobresaturada?
S11.4.1
Agrega un pequeño cristal de\(Na_2S_2O_3\). Se disolverá en una solución insaturada, permanecerá aparentemente sin cambios en una solución saturada, o iniciará la precipitación en una solución sobresaturada.
Q11.4.2
Las soluciones supersaturadas de la mayoría de los sólidos en agua se preparan enfriando soluciones saturadas. Las soluciones supersaturadas de la mayoría de los gases en el agua se preparan calentando soluciones saturadas. Explique las razones de la diferencia en los dos procedimientos.
S11.4.2
La solubilidad de los sólidos generalmente disminuye al enfriar una solución, mientras que la solubilidad de los gases generalmente disminuye al calentarse.
Q11.4.3
Sugerir una explicación para las observaciones de que el etanol, C 2 H 5 OH, es completamente miscible con agua y que el etanotiol, C 2 H 5 SH, es soluble solo en la medida de 1.5 g por 100 mL de agua.
S11.4.3
Los enlaces de hidrógeno entre el agua y C 2 H 5 OH son mucho más fuertes que las atracciones intermoleculares entre el agua y C 2 H 5 SH.
Q11.4.4
Calcular el porcentaje por masa de KBr en una solución saturada de KBr en agua a 10 °C utilizando la siguiente figura para datos útiles, y reportar el porcentaje calculado a un dígito significativo.

Esta gráfica muestra cómo la solubilidad de varios sólidos cambia con la temperatura.
S11.4.4
A 10 °C, la solubilidad de KBr en agua es de aproximadamente 60 g por 100 g de agua.
\[\%\; KBr =\dfrac{60\; g\; KBr}{(60+100)\;g\; solution} = 40\%\]
Q11.4.5
¿Cuál de los siguientes gases se espera que sea más soluble en agua? Explica tu razonamiento.
- CH 4
- CCl 4
- CHCl 3
S11.4.5
c) Se espera que el CHCl 3 sea más soluble en agua. De los tres gases, sólo éste es polar y por lo tanto capaz de experimentar una atracción dipolo-dipolo relativamente fuerte hacia las moléculas de agua.
Q11.4.6
A 0 °C y 1.00 atm, tanto como 0.70 g de O 2 pueden disolverse en 1 L de agua. A 0 °C y 4.00 atm, ¿cuántos gramos de O 2 se disuelven en 1 L de agua?
S11.4.6
Este problema requiere la aplicación de la ley de Henry. La ecuación gobernante es\(C_g = kP_g\).
\[k=\dfrac{C_g}{P_g}=\dfrac{0.70\;g}{1.00\; atm} =0.70\;g\; atm^{−1}\]
Bajo las nuevas condiciones,\(C_g=0.70\;g\;atm^{−1} \times 4.00\; atm = 2.80\; g\).
Q11.4.7
Refiérase a la siguiente figura para las siguientes tres preguntas:

- ¿Cómo cambió la concentración de CO 2 disuelto en la bebida cuando se abrió la botella?
- ¿Qué causó este cambio?
- ¿La bebida es insaturada, saturada o sobresaturada con CO 2?
S11.4.7
a) Disminuyó a medida que parte del gas CO 2 salió de la solución (evidenciado por efervescencia). (b) Al abrir la botella se liberó el gas CO 2 de alta presión sobre la bebida. La presión reducida del gas CO 2, según la ley de Henry, disminuye la solubilidad del CO 2. (c) La concentración de CO 2 disuelto continuará disminuyendo lentamente hasta que se restaure el equilibrio entre la bebida y la muy baja presión de gas de CO 2 en la botella abierta. Inmediatamente después de la apertura, la bebida, por lo tanto, contiene CO 2 disuelto a una concentración mayor que su solubilidad, una condición de no equilibrio, y se dice que está sobresaturada.
Q11.4.8
La constante de la ley de Henry para el CO 2 es\(3.4 \times 10^{−2}\; M/atm\) a 25 °C. ¿Qué presión de dióxido de carbono se necesita para mantener una concentración de CO 2 de 0.10 M en una lata de soda de limón-lima?
S11.4.8
\[P_g=\dfrac{C_g}{k}=\dfrac{0.10\; M}{3.4 \times 10^{−2}\;M/atm} =2.9\; atm\]
Q11.4.9
La constante de la ley de Henry para O 2 está\(1.3\times 10^{−3}\; M/atm\) a 25 °C ¿Qué masa de oxígeno se disolvería en un acuario de 40 litros a 25 °C, asumiendo una presión atmosférica de 1.00 atm, y que la presión parcial de O 2 es 0.21 atm?
S11.4.9
Comience con la ley de Henry
\[C_g=kP_g\]
y aplicarlo a\(O_2\)
\[C(O_2)=(1.3 \times 10^{−3}\; M/atm) (0.21\;atm)=2.7 \times 10^{−4}\;mol/L\]
La cantidad total es\ ((2.7\ times 10^ {−4}\; mol/L) (40\; L=1.08\ times 10^ {−2}\; mol\]
La masa de oxígeno es\((1.08 \times 10^{−2}\; mol)(32.0\; g/mol)=0.346\;g\)
o, utilizando dos cifras significativas,\(0.35\; g\).
Q11.4.10
¿Cuántos litros de gas HCl, medidos a 30.0 °C y 745 torr, se requieren para preparar 1.25 L de una solución 3.20- M de ácido clorhídrico?
S11.4.10
Primero, calcule los moles de HCl necesarios. Luego use la ley de gas ideal para encontrar el volumen requerido.
M = mol L−1
3.20m=xmol1.25L
x = 4.00 mol HCl
Antes de usar la ley de gas ideal, cambie la presión a atmósferas y convierta la temperatura de °C a kelvin.
\ [1\; atmx = 760torr745torr
x = 0.9803 atm
V= NRtP = (4.000molHCl) (0.08206LATmK−1mol−1) (303.15K) 0.9803atm=102 L HCl
102 L HCl
más http://cnx.org/contents/ 2488Fw6w @2 /Solubilidad
11.5: Propiedades coligativas
Q11.5.1
¿Cuáles es/son parte del dominio macroscópico de las soluciones y cuáles es/son parte del dominio microscópico: elevación del punto de ebullición, ley de Henry, enlace de hidrógeno, atracción ión-dipolo, molaridad, no electrolito, compuesto no estequiométrico, ósmosis, ion solvatado?
Q11.5.2
¿Cuál es la explicación microscópica del comportamiento macroscópico ilustrado en [link]?
S11.5.2
La fuerza de los enlaces entre moléculas similares es más fuerte que la fuerza entre moléculas diferentes. Por lo tanto, existirán algunas regiones en las que las moléculas de agua excluirán las moléculas de aceite y existirán otras regiones en las que las moléculas de aceite excluirán las moléculas de agua, formando una región heterogénea.
Q11.5.3
Dibuje una gráfica cualitativa de la presión versus tiempo para el vapor de agua por encima de una muestra de agua pura y una solución de azúcar, ya que los líquidos se evaporan a la mitad de su volumen original.
Q11.5.4
Una solución de nitrato de potasio, un electrolito y una solución de glicerina (C 3 H 5 (OH) 3), un no electrolito, ambos hierven a 100.3 °C. ¿Qué otras propiedades físicas de las dos soluciones son idénticas?
S11.5.4
Ambos forman soluciones homogéneas; sus elevaciones de punto de ebullición son las mismas, así como su disminución de las presiones de vapor. La presión osmótica y el descenso del punto de congelación también son los mismos para ambas soluciones.
Q11.5.5
¿Cuáles son las fracciones molares de H 3 PO 4 y agua en una solución de 14.5 g de H 3 PO 4 en 125 g de agua?
Q11.5.6
¿Cuáles son las fracciones molares de HNO 3 y agua en una solución concentrada de ácido nítrico (68.0% HNO 3 en masa)?
S11.5.6
- Encuentra el número de moles de HNO 3 y H 2 O en 100 g de la solución. Encuentra las fracciones molares para los componentes.
- La fracción molar de HNO 3 es 0.378. La fracción molar de H 2 O es 0.622.
Q11.5.7
Calcular la fracción molar de cada soluto y disolvente:
- 583 g de H 2 SO 4 en 1.50 kg de agua: la solución ácida utilizada en una batería de automóvil
- 0.86 g de NaCl en 1.00 × 10 2 g de agua: una solución de cloruro de sodio para inyección intravenosa
- 46.85 g de codeína, C 18 H 21 NO 3, en 125.5 g de etanol, C 2 H 5 OH
- 25 g de I 2 en 125 g de etanol, C 2 H 5 OH
S11.5.7
a.\(583\:g\:\ce{H2SO4}\times\dfrac{1\:mole\:\ce{H2SO4}}{98.08\:g\:\ce{H2SO4}}=5.94\:mole\:\ce{H2SO4}\)\(\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\)\(1.50\:kg\:\ce{H2O}\times\dfrac{1000\:g}{1\:kg}\times\dfrac{1\:mole\:\ce{H2O}}{18.02\:g\:\ce{H2O}}=83.2\:moles\:\ce{H2O}\)
Q11.5.8
Calcular la fracción molar de cada soluto y disolvente:
- 0.710 kg de carbonato de sodio (sosa de lavado), Na 2 CO 3, en 10.0 kg de agua, una solución saturada a 0 °C
- 125 g de NH 4 NO 3 en 275 g de agua, una mezcla utilizada para hacer una capa de hielo instantánea
- 25 g de Cl 2 en 125 g de diclorometano, CH 2 Cl 2
- 0.372 g de histamina, C 5 H 9 N, en 125 g de cloroformo, CHCl 3
S11.5.8
- \(X_\mathrm{Na_2CO_3}=0.0119\);\(X_\mathrm{H_2O}=0.988\);
- \(X_\mathrm{NH_4NO_3}=0.9927\);\(X_\mathrm{H_2O}=0.907\);
- \(X_\mathrm{Cl_2}=0.192\);\(X_\mathrm{CH_2CI_2}=0.808\);
- \(X_\mathrm{C_5H_9N}=0.00426\);\(X_\mathrm{CHCl_3}=0.997\)
Q11.5.9
Calcular las fracciones molares de metanol, CH 3 OH; etanol, C 2 H 5 OH; y agua en una solución que es 40% metanol, 40% etanol y 20% agua en masa. (Supongamos que los datos son buenos a dos cifras significativas.)
Q11.5.10
¿Cuál es la diferencia entre una solución de 1 M y una solución de 1 m?
S11.5.10
En una solución 1 M, el mol está contenido exactamente en 1 L de solución. En una solución de 1 m, el mol está contenido exactamente en 1 kg de disolvente.
Q11.5.11
¿Cuál es la molalidad del ácido fosfórico, H 3 PO 4, en una solución de 14.5 g de H 3 PO 4 en 125 g de agua?
Q11.5.12
¿Cuál es la molalidad del ácido nítrico en una solución concentrada de ácido nítrico (68.0% HNO 3 en masa)?
S11.5.12
a) Determinar la masa molar de HNO 3. Determinar el número de moles de ácido en la solución. A partir del número de moles y la masa de disolvente, determinar la molalidad. b) 33.7 m
Q11.5.13
Calcular la molalidad de cada una de las siguientes soluciones:
- 583 g de H 2 SO 4 en 1.50 kg de agua: la solución ácida utilizada en una batería de automóvil
- 0.86 g de NaCl en 1.00 × 10 2 g de agua: una solución de cloruro de sodio para inyección intravenosa
- 46.85 g de codeína, C 18 H 21 NO 3, en 125.5 g de etanol, C 2 H 5 OH
- 25 g de I 2 en 125 g de etanol, C 2 H 5 OH
Q11.5.14
Calcular la molalidad de cada una de las siguientes soluciones:
- 0.710 kg de carbonato de sodio (sosa de lavado), Na 2 CO 3, en 10.0 kg de agua, una solución saturada a 0°C
- 125 g de NH 4 NO 3 en 275 g de agua, una mezcla utilizada para hacer una capa de hielo instantánea
- 25 g de Cl 2 en 125 g de diclorometano, CH 2 Cl 2
- 0.372 g de histamina, C 5 H 9 N, en 125 g de cloroformo, CHCl 3
S11.5.14
a) 6.70 × 10 −1 m; (b) 5.67 m; (c) 2.8 m; (d) 0.0358 m
Q11.5.15
La concentración de glucosa, C 6 H 12 O 6, en el líquido cefalorraquídeo normal es\(\mathrm{\dfrac{75\:mg}{100\:g}}\). ¿Cuál es la molalidad de la solución?
Q11.5.16
Una solución de 13.0% de K 2 CO 3 en masa tiene una densidad de 1.09 g/cm 3. Calcular la molalidad de la solución.
S11.5.16
1.08 m
Q11.5.17
- ¿Por qué 1 mol de cloruro de sodio deprime el punto de congelación de 1 kg de agua casi el doble que 1 mol de glicerina?
- ¿Cuál es el punto de ebullición de una solución de 115.0 g de sacarosa, C 12 H 22 O 11, en 350.0 g de agua?
S11.5.17
- Determinar la masa molar de sacarosa; determinar el número de moles de sacarosa en la solución; convertir la masa de disolvente a unidades de kilogramos; a partir del número de moles y la masa de disolvente, determinar la molalidad; determinar la diferencia entre el punto de ebullición del agua y el punto de ebullición del solución; determinar el nuevo punto de ebullición.
- 100.5 °C
Q11.5.18
¿Cuál es el punto de ebullición de una solución de 9.04 g de I 2 en 75.5 g de benceno, asumiendo que el I 2 es no volátil?
Q11.5.19
¿Cuál es la temperatura de congelación de una solución de 115.0 g de sacarosa, C 12 H 22 O 11, en 350.0 g de agua, que se congela a 0.0 °C cuando está pura?
S11.5.19
a) Determinar la masa molar de sacarosa; determinar el número de moles de sacarosa en la solución; convertir la masa de disolvente a unidades de kilogramos; a partir del número de moles y la masa de disolvente, determinar la molalidad; determinar la diferencia entre la temperatura de congelación del agua y la congelación temperatura de la solución; determinar la nueva temperatura de congelación. (b) −1.8 °C
Q11.5.20
¿Cuál es el punto de congelación de una solución de 9.04 g de I 2 en 75.5 g de benceno?
Q11.5.21
¿Cuál es la presión osmótica de una solución acuosa de 1.64 g de Ca (NO 3) 2 en agua a 25 °C? El volumen de la solución es de 275 mL.
S11.5.21
a) Determinar la masa molar de Ca (NO 3) 2; determinar el número de moles de Ca (NO 3) 2 en la solución; determinar el número de moles de iones en la solución; determinar la molaridad de los iones, luego la presión osmótica. (b) 2.67 atm
Q11.5.22
¿Cuál es la presión osmótica de una solución de insulina bovina (masa molar, 5700 g mol −1) a 18 °C si 100.0 mL de la solución contiene 0.103 g de la insulina?
Q11.5.23
¿Cuál es la masa molar de una solución de 5.00 g de un compuesto en 25.00 g de tetracloruro de carbono (bp 76.8 °C; K b = 5.02 °C/ m) que hierve a 81.5 °C a 1 atm?
S11.5.24
a) Determinar la concentración de molal a partir del cambio en el punto de ebullición y K b; determinar los moles de soluto en la solución a partir de la concentración de molal y masa de disolvente; determinar la masa molar a partir del número de moles y la masa de soluto. (b) 2.1 × 10 2 g mol −1
Q11.5.25
Una muestra de un compuesto orgánico (un no electrolito) que pesaba 1.35 g disminuyó el punto de congelación de 10.0 g de benceno en 3.66 °C. Calcular la masa molar del compuesto.
Q11.5.26
Una solución de 1.0 m de HCl en benceno tiene un punto de congelación de 0.4 °C. ¿El HCl es un electrolito en benceno? Explique.
S11.5.26
No. El benceno puro se congela a 5.5 °C, por lo que el punto de congelación observado de esta solución se reduce en Δ T f = 5.5 − 0.4 = 5.1 °C. El valor calculado, suponiendo que no hay ionización de HCl, es Δ T f = (1.0 m) (5.14 °C/ m) = 5.1 °C. Acuerdo de estos valores apoya la suposición de que el HCl no está ionizado.
Q11.5.27
Una solución contiene 5.00 g de urea, CO (NH 2) 2, un compuesto no volátil, disuelto en 0.100 kg de agua. Si la presión de vapor del agua pura a 25 °C es de 23.7 torr, ¿cuál es la presión de vapor de la solución?
Q11.5.28
Una muestra de 12.0-g de un no electrolito se disuelve en 80,0 g de agua. La solución se congela a −1.94 °C. Calcula la masa molar de la sustancia.
S11.5.28
144 g mol −1
Q11.5.29
Arregle las siguientes soluciones en orden por sus puntos de congelación decrecientes: 0.1 m Na 3 PO 4, 0.1 m C 2 H 5 OH, 0.01 m CO 2, 0.15 m NaCl y 0.2 m CaCl 2.
Q11.5.30
Calcular la elevación del punto de ebullición de 0.100 kg de agua que contiene 0.010 mol de NaCl, 0.020 mol de Na 2 SO 4 y 0.030 mol de MgCl 2, asumiendo la disociación completa de estos electrolitos.
S11.5.30
0.870 °C
Q11.5.31
¿Cómo se podría preparar una solución acuosa de glicerina de 3.08 m, C 3 H 8 O 3? ¿Cuál es el punto de congelación de esta solución?
Q11.5.32
Una muestra de azufre que pesaba 0.210 g se disolvió en 17.8 g de disulfuro de carbono, CS 2 (K b = 2.43 °C/ m). Si la elevación del punto de ebullición fue de 0.107 °C, ¿cuál es la fórmula de una molécula de azufre en disulfuro de carbono?
S11.5.32
S 8
Q11.5.33
En un experimento significativo realizado hace muchos años, 5.6977 g de yoduro de cadmio en 44.69 g de agua elevaron el punto de ebullición 0.181 °C ¿Qué sugiere esto sobre la naturaleza de una solución de CdI 2?
Q11.5.34
La lisozima es una enzima que escinde las paredes celulares. Una muestra de 0.100-L de una solución de lisozima que contiene 0.0750 g de la enzima exhibe una presión osmótica de 1.32 × 10 −3 atm a 25 °C. ¿Cuál es la masa molar de la lisozima?
S11.5.34
1.39 × 10 4 g mol −1
Q11.5.35
La presión osmótica de una solución que contiene 7.0 g de insulina por litro es de 23 torr a 25 °C. ¿Cuál es la masa molar de insulina?
Q11.5.36
La presión osmótica de la sangre humana es de 7.6 atm a 37 °C. ¿Qué masa de glucosa, C 6 H 12 O 6, se requiere para elaborar 1.00 L de solución acuosa para alimentación intravenosa si la solución debe tener la misma presión osmótica que la sangre a temperatura corporal, 37 °C?
S11.5.36
54 g
Q11.5.37
¿Cuál es el punto de congelación de una solución de dibromobenceno, C 6 H 4 Br 2, en 0.250 kg de benceno, si la solución hierve a 83.5 °C?
Q11.5.38
¿Cuál es el punto de ebullición de una solución de NaCl en agua si la solución se congela a −0.93 °C?
S11.5.38
100.26 °C
Q11.5.39
El azúcar fructosa contiene 40.0% C, 6.7% H y 53.3% O en masa. Una solución de 11.7 g de fructosa en 325 g de etanol tiene un punto de ebullición de 78.59 °C, el punto de ebullición del etanol es 78.35 °C, y K b para etanol es 1.20 °C/ m. ¿Cuál es la fórmula molecular de la fructosa?
Q11.5.40
La presión de vapor del metanol, CH 3 OH, es de 94 torr a 20 °C; la presión de vapor del etanol, C 2 H 5 OH, es de 44 torr a la misma temperatura.
- Calcular la fracción molar de metanol y de etanol en una solución de 50.0 g de metanol y 50.0 g de etanol.
- El etanol y el metanol forman una solución que se comporta como una solución ideal. Calcular la presión de vapor del metanol y del etanol por encima de la solución a 20 °C.
- Calcular la fracción molar de metanol y de etanol en el vapor por encima de la solución.
S11.5.40
(a)\(X_\mathrm{CH_3OH}=0.590\);\(X_\mathrm{C_2H_5OH}=0.410\); (b) Las presiones de vapor son: CH 3 OH: 55 torr; C 2 H 5 OH: 18 torr; (c) CH 3 OH: 0.75; C 2 H 5 OH: 0.25
Q11.5.41
El punto triple del agua libre de aire se define como 273.15 K. ¿Por qué es importante que el agua esté libre de aire?
Q11.5.42
La carne se puede clasificar como fresca (no congelada) aunque se almacene a −1 °C. ¿Por qué no se congelaría la carne a esta temperatura?
S11.5.42
Los iones y compuestos presentes en el agua de la carne de res bajan el punto de congelación de la carne por debajo de −1 °C.
Q11.5.43
Un compuesto orgánico tiene una composición de 93.46% C y 6.54% H en masa. Una solución de 0.090 g de este compuesto en 1.10 g de alcanfor se funde a 158.4 °C. El punto de fusión del alcanfor puro es 178.4 °C. K f para alcanfor es 37.7 °C/m. ¿Cuál es la fórmula molecular del soluto? Muestra tus cálculos.
Q11.5.44
Se disuelve una muestra de HgCl 2 que pesa 9.41 g en 32.75 g de etanol, C 2 H 5 OH (K b = 1.20 °C/ m). La elevación del punto de ebullición de la solución es de 1.27 °C. ¿El HgCl 2 es un electrolito en etanol? Muestra tus cálculos.
S11.5.44
\(\mathrm{Δbp}=K_\ce{b}m=(1.20\:°\ce C/m)\mathrm{\left(\dfrac{9.41\:g×\dfrac{1\:mol\: HgCl_2}{271.496\:g}}{0.03275\:kg}\right)=1.27\:°\ce C}\)
El cambio observado es igual al cambio teórico; por lo tanto, no se produce disociación.
Q11.5.45
Se sabe que una sal es un fluoruro de metal alcalino. Una rápida determinación aproximada del punto de congelación indica que 4 g de la sal disuelta en 100 g de agua produce una solución que se congela a aproximadamente −1.4 °C. ¿Cuál es la fórmula de la sal? Muestra tus cálculos.
11.6: Coloides
Q11.6.1
Identificar la fase dispersa y el medio de dispersión en cada uno de los siguientes sistemas coloidales: dispersión de almidón, humo, niebla, perla, crema batida, jabón flotante, gelatina, leche y rubí.
S11.6.1
| Sistema coloidal | Fase Dispersada | Medio de dispersión |
|---|---|---|
| dispersión de almidón | almidón | agua |
| humo | partículas sólidas | aire |
| niebla | agua | aire |
| perla | agua | carbonato de calcio (CaCo 3) |
| crema batida | aire | crema |
| jabón flotante | aire | jabón |
| jalea | jugo de frutas | gel de pectina |
| leche | grasa de mantequilla | agua |
| rubí | óxido de cromo (III) (Cr 2 O 3) | óxido de aluminio (Al 2 O 3) |
Q11.6.2
Distinguir entre métodos de dispersión y métodos de condensación para preparar sistemas coloidales.
S11.6.2
Los métodos de dispersión utilizan un dispositivo de molienda o algún otro medio para provocar la subdivisión de partículas más grandes. Los métodos de condensación reúnen unidades más pequeñas para formar una unidad más grande. Por ejemplo, las moléculas de agua en estado de vapor se unen para formar gotitas muy pequeñas que vemos como nubes.
Q11.6.3
¿En qué se diferencian los coloides de las soluciones en cuanto al tamaño de partícula dispersa y la homogeneidad?
S11.6.3
Las dispersiones coloidales consisten en partículas que son mucho más grandes que los solutos de las soluciones típicas. Las partículas coloidales son moléculas muy grandes o agregados de especies más pequeñas que generalmente son lo suficientemente grandes como para dispersar la luz. Los coloides son homogéneos en una escala macroscópica (visual), mientras que las soluciones son homogéneas en una escala microscópica (molecular).
Q11.6.4
Explicar la acción limpiadora del jabón.
S11.6.4
Las moléculas de jabón tienen un extremo hidrófobo y otro hidrófilo. El extremo cargado (hidrófilo), que generalmente se asocia con un ion de metal alcalino, asegura la solubilidad en agua. El extremo hidrófobo permite la atracción hacia el aceite, la grasa y otras sustancias no polares similares que normalmente no se disuelven en agua pero son arrastradas a la solución por las moléculas de jabón.
Q11.6.5
¿Cómo se puede demostrar que las partículas coloidales están cargadas eléctricamente?
S11.6.5
Si se colocan en una celda electrolítica, las partículas dispersas se moverán hacia el electrodo que lleva una carga opuesta a su propia carga. En este electrodo, las partículas cargadas serán neutralizadas y coagularán como precipitado.
Colaboradores y Atribuciones
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).


