11.5: Coloides
- Page ID
- 75340
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir la composición y propiedades de las dispersiones coloidales
- Enumerar y explicar varias aplicaciones tecnológicas de coloides
De niño, es posible que hayas hecho suspensiones como mezclas de barro y agua, harina y agua, o una suspensión de pigmentos sólidos en agua, conocida como pintura témpera. Estas suspensiones son mezclas heterogéneas compuestas por partículas relativamente grandes que son visibles (o que se pueden ver con una lupa). Están turbias, y las partículas suspendidas se depositan después de mezclarlas. Por otro lado, cuando hacemos una solución, preparamos una mezcla homogénea en la que no se produce sedimentación y en la que las especies disueltas son moléculas o iones. Las soluciones exhiben un comportamiento completamente diferente al de las suspensiones. Una solución puede ser coloreada, pero es transparente, las moléculas o iones son invisibles, y no se asientan al estar de pie. Un grupo de mezclas llamadas coloides (o dispersiones coloidales) exhiben propiedades intermedias entre las de suspensiones y soluciones (Figura\(\PageIndex{1}\)). Las partículas en un coloide son más grandes que la mayoría de las moléculas simples; sin embargo, las partículas coloidales son lo suficientemente pequeñas como para que no se depositen al estar de pie.

Las partículas en un coloide son lo suficientemente grandes como para dispersar la luz, un fenómeno llamado efecto Tyndall. Esto puede hacer que las mezclas coloidales aparezcan turbias u opacas, como los haces reflectores mostrados en la Figura\(\PageIndex{2}\). Las nubes son mezclas coloidales. Están compuestas por gotitas de agua que son mucho más grandes que las moléculas, pero que son lo suficientemente pequeñas como para que no se asienten.

El término “coloide” —de las palabras griegas kolla, que significa “pegamento” y eidos, que significa “como”, fue utilizado por primera vez en 1861 por Thomas Graham para clasificar mezclas como almidón en agua y gelatina. Muchas partículas coloidales son agregados de cientos o miles de moléculas, pero otras (como proteínas y moléculas poliméricas) consisten en una sola molécula extremadamente grande. Las moléculas de proteínas y polímeros sintéticos que forman coloides pueden tener masas moleculares que van desde unos pocos miles hasta muchos millones de unidades de masa atómica.
Análogamente a la identificación de los componentes de la solución como “soluto” y “disolvente”, los componentes de un coloide también se clasifican de acuerdo con sus cantidades relativas. El componente particulado típicamente presente en una cantidad relativamente menor se denomina fase dispersa y la sustancia o solución a lo largo de la cual se dispersa el particulado se denomina medio de dispersión. Los coloides pueden involucrar prácticamente cualquier combinación de estados físicos (gas en líquido, líquido en sólido, sólido en gas, etc.), como se ilustra por los ejemplos de sistemas coloidales dados en la Tabla\(\PageIndex{1}\).
| Fase Dispersada | Medio de Dispersión | Ejemplos Comunes | Nombre |
|---|---|---|---|
| sólido | gas | humo, polvo | — |
| sólido | líquido | almidón en agua, algunas tintas, pinturas, leche de magnesia | sol |
| sólido | sólido | algunas gemas de colores, algunas aleaciones | — |
| líquido | gas | nubes, nieblas, nieblas, aerosoles | aerosol |
| líquido | líquido | leche, mayonesa, mantequilla | emulsión |
| líquido | sólido | gelatinas, geles, perla, ópalo (H 2 O en SiO 2) | gel |
| gas | líquido | espumas, crema batida, claras de huevo batidas | espuma |
| gas | sólido | piedra pómez, jabones flotantes | — |
Preparación de Sistemas Coloidales
Podemos preparar un sistema coloidal produciendo partículas de dimensiones coloidales y distribuyendo estas partículas a través de un medio de dispersión. Las partículas de tamaño coloidal se forman por dos métodos:
- Métodos de dispersión: es decir, descomponiendo partículas más grandes. Por ejemplo, los pigmentos de pintura se producen dispersando partículas grandes moliendo en molinos especiales.
- Métodos de condensación: es decir, crecimiento a partir de unidades más pequeñas, como moléculas o iones. Por ejemplo, las nubes se forman cuando las moléculas de agua se condensan y forman gotitas muy pequeñas.
Algunas sustancias sólidas, cuando se ponen en contacto con el agua, se dispersan espontáneamente y forman sistemas coloidales. La gelatina, el pegamento, el almidón y la leche deshidratada en polvo se comportan de esta manera. Las partículas ya son de tamaño coloidal; el agua simplemente las dispersa. Las partículas de leche en polvo de tamaño coloidal se producen mediante la deshidratación de leche en aerosol. Algunos atomizadores producen dispersiones coloidales de un líquido en el aire.
Podemos preparar una emulsión agitando juntos o mezclando dos líquidos inmiscibles. Esto rompe un líquido en gotitas de tamaño coloidal, que luego se dispersan por el otro líquido. Los derrames de petróleo en el océano pueden ser difíciles de limpiar, en parte porque la acción de las olas puede hacer que el petróleo y el agua formen una emulsión. En muchas emulsiones, sin embargo, la fase dispersa tiende a unirse, formar grandes gotas y separarse. Por lo tanto, las emulsiones suelen ser estabilizadas por un agente emulsionante, sustancia que inhibe la coalescencia del líquido disperso. Por ejemplo, un poco de jabón estabilizará una emulsión de queroseno en agua. La leche es una emulsión de grasa de mantequilla en agua, con la proteína caseína como agente emulsionante. La mayonesa es una emulsión de aceite en vinagre, con componentes de yema de huevo como agentes emulsionantes.
Los métodos de condensación forman partículas coloidales por agregación de moléculas o iones. Si las partículas crecen más allá del rango de tamaño coloidal, se forman gotas o precipitados, y no se produce ningún sistema coloidal. Las nubes se forman cuando las moléculas de agua se agregan y forman partículas de tamaño coloidal. Si estas partículas de agua se unen para formar gotas de agua adecuadamente grandes de agua líquida o cristales de agua sólida, se asientan del cielo como lluvia, aguanieve o nieve. Muchos métodos de condensación implican reacciones químicas. Podemos preparar una suspensión coloidal roja de hidróxido de hierro (III) mezclando una solución concentrada de cloruro de hierro (III) con agua caliente:
\[\mathrm{Fe^{3+}}_{(aq)}+\mathrm{3Cl^-}_{(aq)}+\mathrm{6H_2O}_{(l)}⟶\mathrm{Fe(OH)}_{3(s)}+\mathrm{H_3O^+}_{(aq)}+\mathrm{3Cl^-}_{(aq)} \label{11.6.1} \]
Un sol coloidal de oro resulta de la reducción de una solución muy diluida de cloruro de oro (III) mediante un agente reductor como formaldehído, cloruro de estaño (II) o sulfato de hierro (II):
\[\ce{Au}^{3+}+ \ce{3e}^− \rightarrow \ce{Au} \label{11.6.2} \]
Algunos soles de oro preparados en 1857 siguen intactos (las partículas no se han unido y sedimentado), lo que ilustra la estabilidad a largo plazo de muchos coloides.
Jabones y Detergentes
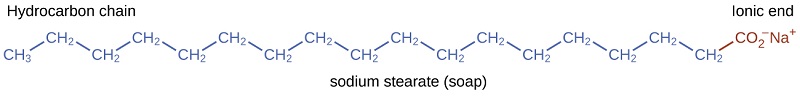
Los pioneros elaboraron jabón hirviendo grasas con una solución fuertemente básica elaborada por lixiviación de carbonato de potasio,\(\ce{K_2CO_3}\), a partir de cenizas de madera con agua caliente. Las grasas animales contienen poliésteres de ácidos grasos (ácidos carboxílicos de cadena larga). Cuando las grasas animales se tratan con una base como carbonato de potasio o hidróxido de sodio, se forman glicerol y sales de ácidos grasos como el ácido palmítico, oleico y esteárico. Las sales de los ácidos grasos se llaman jabones. La sal sódica del ácido esteárico, estearato de sodio, tiene la fórmula\(\ce{C_{17}H_{35}CO_2Na}\) y contiene una cadena hidrocarbonada no polar no cargada, la\(\mathrm{C_{17}H_{35}-}\) unidad, y un grupo carboxilato iónico, la\(-\mathrm{\sideset{ }{_{2}^{-}}{CO}}\) unidad (Figura\(\PageIndex{3}\)).
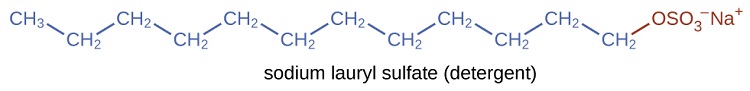
Los detergentes (sustitutos del jabón) también contienen cadenas hidrocarbonadas no polares\(\mathrm{C_{12}H_{25}—}\), como, y un grupo iónico, como un sulfato\(—\mathrm{\sideset{ }{_{3}^{-}}{OSO}}\) o un sulfonato\(—\mathrm{\sideset{ }{_{3}^{-}}{SO}}\) (Figura\(\PageIndex{4}\)). Los jabones forman compuestos insolubles de calcio y magnesio en agua dura; los detergentes forman productos solubles en agua, una ventaja definitiva para los detergentes.
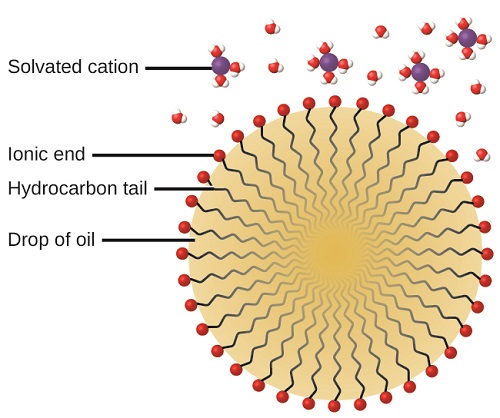
La acción limpiadora de los jabones y detergentes puede explicarse en términos de las estructuras de las moléculas involucradas. El extremo hidrocarbonado (no polar) de una molécula de jabón o detergente se disuelve en, o es atraído por, sustancias no polares como aceite, grasa o partículas de suciedad. El extremo iónico es atraído por el agua (polar), ilustrado en la Figura\(\PageIndex{5}\). Como resultado, las moléculas de jabón o detergente se orientan en la interfaz entre las partículas de suciedad y el agua por lo que actúan como una especie de puente entre dos tipos diferentes de materia, no polar y polar. Moléculas como esta se denominan anfifílicas ya que tienen tanto una parte hidrófoba (“temerosa del agua”) como una parte hidrófila (“amante del agua”). Como consecuencia, las partículas de suciedad se suspenden como partículas coloidales y se eliminan fácilmente por lavado.
El estallido de la plataforma de perforación petrolera Deepwater Horizon el 20 de abril de 2010, en el Golfo de México cerca de Mississippi inició el mayor derrame de petróleo marino en la historia del petróleo. En los 87 días siguientes al estallido, un estimado de 4.9 millones de barriles (210 millones de galones) de petróleo fluyeron del pozo roto a 5000 pies por debajo de la superficie del agua. El pozo finalmente fue declarado sellado el 19 de septiembre de 2010.
El petróleo crudo es inmiscible y menos denso que el agua, por lo que el aceite derramado se elevó a la superficie del agua. Se utilizaron auges flotantes, barcos skimmer y quemaduras controladas para eliminar petróleo de la superficie del agua en un intento de proteger playas y humedales a lo largo de la costa del Golfo. Además de la remoción del petróleo, también se intentó disminuir su impacto ambiental volviéndolo “soluble” (en el sentido flojo del término) y permitiendo así que se diluya a niveles esperadamente menos dañinos por el vasto volumen de agua oceánica. Este enfoque utilizó 1.84 millones de galones del dispersante petrolero Corexit 9527, la mayor parte del cual se inyectó bajo el agua en el sitio de la fuga, con pequeñas cantidades siendo rociadas sobre el derrame. Corexit 9527 contiene 2-butoxietanol (C 6 H 14 O 2), una molécula anfifílica cuyos extremos polares y no polares son útiles para emulsionar el aceite en pequeñas gotas, aumentando la superficie del aceite y haciéndolo más disponible para las bacterias marinas para su digestión (Figura \(\PageIndex{6}\)). Si bien este enfoque evita muchos de los peligros inmediatos que el petróleo a granel representa para los ecosistemas marinos y costeros, introduce la posibilidad de efectos a largo plazo resultantes de la introducción de los componentes tóxicos complejos y potenciales del petróleo en la cadena alimentaria del océano. Diversas organizaciones participan en el monitoreo del impacto extendido de este derrame de petróleo, entre ellas la Administración Nacional Oceánica y Atmosférica.

Propiedades Eléctricas de Partículas Coloidales
Las partículas coloidales dispersas a menudo se cargan eléctricamente. Una partícula coloidal de hidróxido de hierro (III), por ejemplo, no contiene suficientes iones hidróxido para compensar exactamente las cargas positivas en los iones de hierro (III). Así, cada partícula coloidal individual lleva una carga positiva, y la dispersión coloidal consiste en partículas coloidales cargadas y algunos iones hidróxido libres, que mantienen la dispersión eléctricamente neutra. La mayoría de los coloides de hidróxido metálico tienen cargas positivas, mientras que la mayoría de los metales y sulfuros metálicos forman dispersiones cargadas negativamente. Todas las partículas coloidales en cualquier sistema tienen cargas del mismo signo. Esto ayuda a mantenerlos dispersos porque las partículas que contienen cargas similares se repelen entre sí.
Podemos aprovechar la carga sobre partículas coloidales para eliminarlas de una variedad de mezclas. Si colocamos una dispersión coloidal en un recipiente con electrodos cargados, las partículas cargadas positivamente, como las partículas de hidróxido de hierro (III), se moverían al electrodo negativo. Allí, las partículas coloidales pierden su carga y se coagulan como precipitado.
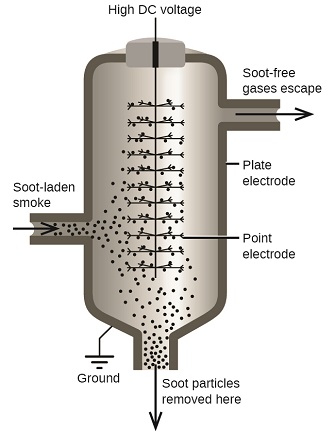
Las partículas de carbono y polvo en el humo a menudo se dispersan coloidalmente y se cargan eléctricamente. Las partículas cargadas son atraídas por electrodos altamente cargados, donde se neutralizan y se depositan como polvo (Figura\(\PageIndex{7}\). Este es uno de los métodos importantes utilizados para limpiar el humo de una variedad de procesos industriales. El proceso también es importante en la recuperación de productos valiosos del humo y el polvo de combustión de las fundiciones, hornos y hornos. También hay filtros de aire iónicos diseñados para uso doméstico para mejorar la calidad del aire interior.
Geles
Cuando hacemos gelatina, como la Jell-O, estamos haciendo un tipo de coloide (Figura\(\PageIndex{8}\)). La gelatina se enfría debido a que la mezcla acuosa caliente de gelatina se coagula a medida que se enfría y toda la masa, incluido el líquido, se establece en un cuerpo extremadamente viscoso conocido como gel, un coloide en el que el medio dispersante es un sólido y la fase dispersa es un líquido. Parece que las fibras del medio dispersante forman una compleja red tridimensional, llenándose los intersticios con el medio líquido o con una solución diluida del medio dispersante. Debido a que la formación de un gel va acompañada de la toma de agua o algún otro disolvente, se dice que el gel está hidratado o solvatado.

La pectina, un carbohidrato de los jugos de frutas, es una sustancia formadora de gel importante en la fabricación de jaleas. El gel de sílice, una dispersión coloidal de dióxido de silicio hidratado, se forma cuando se agrega ácido clorhídrico diluido a una solución diluida de silicato de sodio. El calor enlatado es un gel hecho mezclando alcohol y una solución acuosa saturada de acetato de calcio.
Resumen
Los coloides son mezclas en las que una o más sustancias se dispersan como partículas sólidas o gotitas líquidas relativamente grandes a través de un medio sólido, líquido o gaseoso. Las partículas de un coloide permanecen dispersas y no se asientan debido a la gravedad, y a menudo se cargan eléctricamente. Los coloides son de naturaleza muy extendida y están involucrados en muchas aplicaciones tecnológicas.
Glosario
- anfifílico
- moléculas que poseen partes hidrófobas (no polares) e hidrófilas (polares)
- coloide
- (también, dispersión coloidal) mezcla en la que partículas sólidas o líquidas relativamente grandes se dispersan uniformemente a través de un gas, líquido o sólido
- medio de dispersión
- sólido, líquido o gas en el que se dispersan partículas coloidales
- fase dispersa
- sustancia presente como partículas sólidas o líquidas relativamente grandes en un coloide
- agente emulsionante
- Sustancia anfifílica utilizada para estabilizar las partículas de algunas emulsiones
- emulsión
- coloide formado a partir de líquidos inmiscibles
- gel
- dispersión coloidal de un líquido en un sólido
- Efecto Tyndall
- dispersión de la luz visible por una dispersión coloidal


