18.5: Ocurrencia, preparación y compuestos de hidrógeno
- Page ID
- 75458
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir las propiedades, preparación y compuestos del hidrógeno
El hidrógeno es el elemento más abundante del universo. El sol y otras estrellas están compuestos en gran parte de hidrógeno. Los astrónomos estiman que el 90% de los átomos en el universo son átomos de hidrógeno. El hidrógeno es un componente de más compuestos que cualquier otro elemento. El agua es el compuesto de hidrógeno más abundante que se encuentra en la tierra. El hidrógeno es una parte importante del petróleo, muchos minerales, celulosa y almidón, azúcar, grasas, aceites, alcoholes, ácidos y miles de otras sustancias.
A temperaturas ordinarias, el hidrógeno es un gas incoloro, inodoro, insípido y atóxico que consiste en la molécula diatómica H 2. El hidrógeno está compuesto por tres isótopos, y a diferencia de otros elementos, estos isótopos tienen diferentes nombres y símbolos químicos: protio, 1 H, deuterio, 2 H (o “D”) y tritio 3 H (o “T”). En una muestra natural de hidrógeno, hay un átomo de deuterio por cada 7000 átomos de H y un átomo de tritio radiactivo por cada 10 átomos de 18 H. Las propiedades químicas de los diferentes isótopos son muy similares porque tienen estructuras electrónicas idénticas, pero difieren en algunas propiedades físicas debido a sus diferentes masas atómicas. El deuterio elemental y el tritio tienen una presión de vapor menor que el hidrógeno ordinario. En consecuencia, cuando el hidrógeno líquido se evapora, los isótopos más pesados se concentran en las últimas porciones para evaporarse. La electrólisis del agua pesada, D 2 O, produce deuterio. La mayor parte del tritio se origina en reacciones nucleares.
Preparación de Hidrógeno
El hidrógeno elemental debe prepararse a partir de compuestos rompiendo enlaces químicos. Siguen los métodos más comunes para preparar hidrógeno.
De Vapor y Carbono o Hidrocarburos
El agua es la fuente de hidrógeno más barata y abundante. Pasar vapor sobre coque (una forma impura de carbono elemental) a 1000 °C produce una mezcla de monóxido de carbono e hidrógeno conocida como gas de agua:
\[\ce{C}(s)+\ce{H2O}(g)\:\mathrm{\xrightarrow{1000\:°C}}\:\underset{\Large\mathrm{water\: gas}}{\ce{CO}(g)+\ce{H2}(g)} \nonumber \]
El gas de agua es como combustible industrial. Es posible producir hidrógeno adicional mezclando el gas de agua con vapor en presencia de un catalizador para convertir el CO en CO 2. Esta reacción es la reacción de desplazamiento de gas de agua.
También es posible preparar una mezcla de hidrógeno y monóxido de carbono haciendo pasar hidrocarburos de gas natural o petróleo y vapor sobre un catalizador a base de níquel. El propano es un ejemplo de un reactivo hidrocarbonado:
\[\ce{C3H8}(g)+\ce{3H2O}(g)\:\mathrm{\underset{catalyst}{\xrightarrow{900\:°C}}}\:\ce{3CO}(g)+\ce{7H2}(g) \nonumber \]
Electrólisis
El hidrógeno se forma cuando la electricidad de corriente continua pasa a través del agua (electrólisis) que contiene un electrolito como H 2 SO 4, (Figura\(\PageIndex{1}\).) Se forman burbujas de hidrógeno en el cátodo y el oxígeno evoluciona en el ánodo. La reacción neta es:
\[\ce{2H2O}(l)+\ce{electrical\: energy}⟶\ce{2H2}(g)+\ce{O2}(g) \nonumber \]
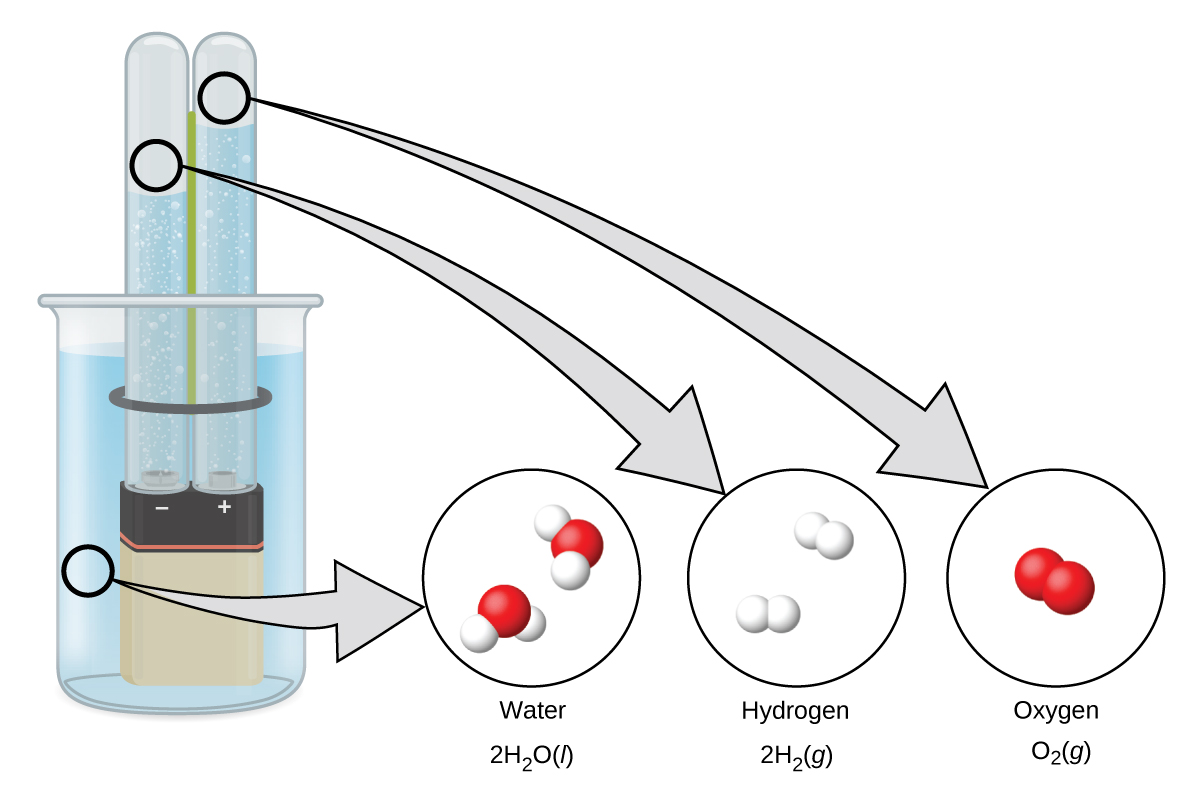
Reacción de Metales con Ácidos
Este es el método de laboratorio más conveniente para producir hidrógeno. Los metales con menores potenciales de reducción reducen el ión hidrógeno en ácidos diluidos para producir gas hidrógeno y sales metálicas. Por ejemplo, como se muestra en la Figura\(\PageIndex{2}\), el hierro en ácido clorhídrico diluido produce gas hidrógeno y cloruro de hierro (II):
\[\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{2Cl-}(aq)⟶\ce{Fe^2+}(aq)+\ce{2Cl-}(aq)+\ce{H2}(g)+\ce{2H2O}(l) \nonumber \]

Reacción de Hidruros de Metal Iónico con Agua
Es posible producir hidrógeno a partir de la reacción de hidruros de los metales activos, que contienen el anión H − muy fuertemente básico, con agua:
\[\ce{CaH2}(s)+\ce{2H2O}(l)⟶\ce{Ca^2+}(aq)+\ce{2OH-}(aq)+\ce{2H2}(g) \nonumber \]
Los hidruros metálicos son fuentes costosas pero convenientes de hidrógeno, especialmente donde el espacio y el peso son factores importantes. Son importantes en la inflación de chalecos salvavidas, balsas salvavidas y globos militares.
Reacciones
En condiciones normales, el hidrógeno es relativamente inactivo químicamente, pero cuando se calienta, entra en muchas reacciones químicas.
Dos tercios de la producción mundial de hidrógeno se dedican a la fabricación de amoníaco, que es un fertilizante y se utiliza en la fabricación de ácido nítrico. Grandes cantidades de hidrógeno también son importantes en el proceso de hidrogenación, discutido en el capítulo sobre química orgánica.
Es posible utilizar hidrógeno como combustible no contaminante. La reacción de hidrógeno con oxígeno es una reacción muy exotérmica, liberando 286 kJ de energía por mol de agua formada. Quemaduras de hidrógeno sin explosión bajo condiciones controladas. El soplete de oxígeno-hidrógeno, debido al alto calor de combustión del hidrógeno, puede alcanzar temperaturas de hasta 2800 °C. La llama caliente de esta antorcha es útil para cortar láminas gruesas de muchos metales. El hidrógeno líquido también es un combustible importante para cohetes (Figura\(\PageIndex{3}\)).

Un átomo de hidrógeno no combinado consiste en un núcleo y un electrón de valencia en el orbital de 1 s. La capa de valencia n = 1 tiene una capacidad para dos electrones, y el hidrógeno puede ocupar legítimamente dos ubicaciones en la tabla periódica. Es posible considerar el hidrógeno como un elemento del grupo 1 porque el hidrógeno puede perder un electrón para formar el catión, H +. También es posible considerar que el hidrógeno es un elemento del grupo 17 porque solo necesita un electrón para llenar su valencia orbital para formar un ion hidruro, H −, o puede compartir un electrón para formar un enlace sencillo y covalente. En realidad, el hidrógeno es un elemento único que casi merece su propia ubicación en la tabla periódica.
Reacciones con Elementos
Cuando se calienta, el hidrógeno reacciona con los metales del grupo 1 y con Ca, Sr y Ba (los metales más activos en el grupo 2). Los compuestos formados son hidruros iónicos cristalinos que contienen el anión hidruro, H −, un agente reductor fuerte y una base fuerte, que reacciona vigorosamente con agua y otros ácidos para formar gas hidrógeno.
Las reacciones del hidrógeno con los no metales generalmente producen compuestos ácidos de hidrógeno con hidrógeno en el estado de oxidación 1+. Las reacciones se vuelven más exotérmicas y vigorosas a medida que aumenta la electronegatividad del no metal. El hidrógeno reacciona con nitrógeno y azufre solo cuando se calienta, pero reacciona explosivamente con flúor (formando HF) y, bajo algunas condiciones, con cloro (formando HCl). Una mezcla de hidrógeno y oxígeno explota si se enciende. Debido a la naturaleza explosiva de la reacción, es necesario tener precaución al manipular hidrógeno (o cualquier otro gas combustible) para evitar la formación de una mezcla explosiva en un espacio confinado. Aunque la mayoría de los hidruros de los no metales son ácidos, el amoníaco y la fosfina (PH 3) son ácidos muy, muy débiles y generalmente funcionan como bases. Se presenta un resumen de estas reacciones de hidrógeno con los elementos en la Tabla\(\PageIndex{1}\).
| Ecuación General | Comentarios |
|---|---|
| \(\ce{MH\: or\: MH2⟶MOH\: or\: M(OH)2 + H2}\) | hidruros iónicos con el grupo 1 y Ca, Sr y Ba |
| \(\ce{H2 + C⟶ (no\: reaction)}\) | |
| \(\ce{3H2 + N2 ⟶ 2NH3}\) | requiere alta presión y temperatura; bajo rendimiento |
| \(\ce{2H2 + O2 ⟶ 2H2O}\) | exotérmico y potencialmente explosivo |
| \(\ce{H2 + S ⟶ H2S}\) | requiere calentamiento; bajo rendimiento |
| \(\ce{H2 + X2 ⟶ 2HX}\) | X = F, Cl, Br e I; explosivo con F 2; bajo rendimiento con I 2 |
Reacción con compuestos
El hidrógeno reduce los óxidos calentados de muchos metales, con la formación del metal y vapor de agua. Por ejemplo, pasar hidrógeno sobre CuO calentado forma cobre y agua. El hidrógeno también puede reducir los iones metálicos en algunos óxidos metálicos a estados de oxidación inferiores:
\[\ce{H2}(g)+\ce{MnO2}(s)\xrightarrow{Δ}\ce{MnO}(s)+\ce{H2O}(g) \nonumber \]
Compuestos de Hidrógeno
Aparte de los gases nobles, cada uno de los no metales forma compuestos con hidrógeno. Por brevedad, discutiremos aquí solo unos pocos compuestos de hidrógeno de los no metales.
Nitrógeno Hidrógeno Compuestos
El amoníaco, NH 3, se forma naturalmente cuando cualquier material orgánico que contiene nitrógeno se descompone en ausencia de aire. La preparación de laboratorio de amoníaco es por la reacción de una sal de amonio con una base fuerte como el hidróxido de sodio. La reacción ácido-base con el ion amonio débilmente ácido da amoníaco, ilustrado en la Figura\(\PageIndex{4}\). El amoníaco también se forma cuando los nitruros iónicos reaccionan con el agua. El ion nitruro es una base mucho más fuerte que el ion hidróxido:
\[\ce{Mg3N2}(s)+\ce{6H2O}(l)⟶\ce{3Mg(OH)2}(s)+\ce{2NH3}(g) \nonumber \]
La producción comercial de amoníaco es por la combinación directa de los elementos en los procesos Haber s:
\[\ce{N2}(g)+\ce{3H2}(g)\xrightleftharpoons{\ce{catalyst}}\ce{2NH3}(g) \hspace{20px} ΔH°=\mathrm{−92\: kJ} \nonumber \]
El amoníaco es un gas incoloro con un olor fuerte y acre. Las sales olorosas utilizan este poderoso olor. El amoníaco gaseoso se licua fácilmente para dar un líquido incoloro que hierve a −33 °C. Debido al enlace de hidrógeno intermolecular, la entalpía de vaporización del amoníaco líquido es mayor que la de cualquier otro líquido excepto el agua, por lo que el amoníaco es útil como refrigerante. El amoníaco es bastante soluble en agua (658 L a STP se disuelve en 1 L H 2 O).
Las propiedades químicas del amoníaco son las siguientes:
- El amoníaco actúa como base de Brønsted, como se discute en el capítulo sobre química ácido-base. El ion amonio es similar en tamaño al ion potasio; los compuestos de los dos iones exhiben muchas similitudes en sus estructuras y solubilidades.
- El amoníaco puede mostrar un comportamiento ácido, aunque es un ácido mucho más débil que el agua. Al igual que otros ácidos, el amoníaco reacciona con los metales, aunque es tan débil que son necesarias altas temperaturas. Se forman hidrógeno y (dependiendo de la estequiometría) amidas (sales de\(\ce{NH2-}\)), imidas (sales de NH 2 −) o nitruros (sales de N 3−).
- El átomo de nitrógeno en el amoníaco tiene su estado de oxidación más bajo posible (3−) y por lo tanto no es susceptible a la reducción. Sin embargo, se puede oxidar. El amoníaco se quema en el aire, dando NO y agua. El amoníaco caliente y el ion amonio son agentes reductores activos. De particular interés son las oxidaciones de ión amonio por ion nitrito\(\ce{NO2-}\),, para producir nitrógeno puro y por ion nitrato para producir óxido nitroso, N 2 O.
- Hay una serie de compuestos que podemos considerar derivados del amoníaco a través de la sustitución de uno o más átomos de hidrógeno por algún otro átomo o grupo de átomos. Las derivaciones inorgánicas incluyen cloramina, NH 2 Cl e hidrazina, N 2 H 4:
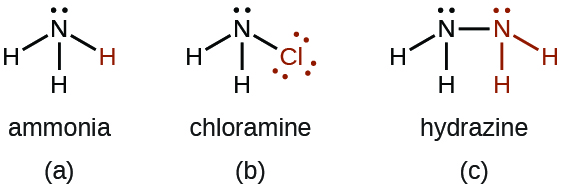
La cloramina, NH 2 Cl, resulta de la reacción del hipoclorito de sodio, NaOCl, con amoníaco en solución básica. En presencia de un gran exceso de amoniaco a baja temperatura, la cloramina reacciona adicionalmente para producir hidrazina, N 2 H 4:
\[\ce{NH3}(aq)+\ce{OCl-}(aq)⟶\ce{NH2Cl}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{NH2Cl}(aq)+\ce{NH3}(aq)+\ce{OH-}(aq)⟶\ce{N2H4}(aq)+\ce{Cl-}(aq)+\ce{H2O}(l) \nonumber \]
La hidrazina anhidra es relativamente estable a pesar de su energía positiva libre de formación:
\[\ce{N2}(g)+\ce{2H2}(g)⟶\ce{N2H4}(l) \hspace{20px} ΔG^\circ_\ce{f}=\mathrm{149.2\:kJ\:mol^{−1}} \nonumber \]
La hidrazina es un líquido fumante e incoloro que tiene algunas propiedades físicas notablemente similares a las de H 2 O (se funde a 2 °C, hierve a 113.5 °C y tiene una densidad a 25 °C de 1.00 g/mL). Se quema rápida y completamente en el aire con una sustancial evolución de calor:
\[\ce{N2H4}(l)+\ce{O2}(g)⟶\ce{N2}(g)+\ce{2H2O}(l) \hspace{20px} ΔH°=\mathrm{−621.5\:kJ\:mol^{−1}} \nonumber \]
Al igual que el amoníaco, la hidrazina es tanto una base de Brønsted como una base de Lewis, aunque es más débil que el amoníaco. Reacciona con ácidos fuertes y forma dos series de sales que contienen los\(\ce{N2H6^2+}\) iones\(\ce{N2H5+}\) y, respectivamente. Algunos cohetes usan hidrazina como combustible.
Compuestos de hidrógeno y fósforo
El hidruro de fósforo más importante es la fosfina, PH 3, un análogo gaseoso del amoníaco tanto en términos de fórmula como de estructura. A diferencia del amoníaco, no es posible formar fosfina por unión directa de los elementos. Existen dos métodos para la preparación de fosfina. Un método es por la acción de un ácido sobre un fosfuro iónico. El otro método es la desproporción de fósforo blanco con base concentrada caliente para producir fosfina y el ion fosfito de hidrógeno:
\[\ce{AlP}(s)+\ce{3H3O+}(aq)⟶\ce{PH3}(g)+\ce{Al^3+}(aq)+\ce{3H2O}(l) \nonumber \]
\[\ce{P4}(s)+\ce{4OH-}(aq)+\ce{2H2O}(l)⟶\ce{2HPO3^2-}(aq)+\ce{2PH3}(g) \nonumber \]
La fosfina es un gas incoloro, muy venenoso, que tiene un olor como el de los peces en descomposición. El calor descompone fácilmente la fosfina\((\ce{4PH3}⟶\ce{P4}+\ce{6H2})\) y el compuesto se quema en el aire. Los principales usos de la fosfina son como fumigante para granos y en el procesamiento de semiconductores. Al igual que el amoníaco, la fosfina gaseosa se une con haluros de hidrógeno gaseosos, formando compuestos de fosfonio como PH 4 Cl y PH 4 I. La fosfina es una base mucho más débil que el amoníaco; por lo tanto, estos compuestos se descomponen en agua, y el PH 3 insoluble escapa de la solución.
Compuestos de hidrógeno y azufre
El sulfuro de hidrógeno, H 2 S, es un gas incoloro que es responsable del olor ofensivo de los huevos podridos y de muchas aguas termales. El sulfuro de hidrógeno es tan tóxico como el cianuro de hidrógeno; por lo tanto, es necesario tener mucho cuidado en su manejo. El sulfuro de hidrógeno es particularmente engañoso porque paraliza los nervios olfativos; después de una breve exposición, uno no lo huele.
La producción de sulfuro de hidrógeno por reacción directa de los elementos (H 2 + S) es insatisfactoria debido a que el rendimiento es bajo. Un método de preparación más efectivo es la reacción de un sulfuro metálico con un ácido diluido. Por ejemplo:
\[\ce{FeS}(s)+\ce{2H3O+}(aq)⟶\ce{Fe^2+}(aq)+\ce{H2S}(g)+\ce{2H2O}(l) \nonumber \]
Es fácil oxidar el azufre en sulfuros metálicos y en sulfuro de hidrógeno, haciendo que los sulfuros metálicos y H 2 S sean buenos agentes reductores. En soluciones ácidas, el sulfuro de hidrógeno reduce Fe 3 + a Fe 2 +,\(\ce{MnO4-}\) a Mn 2 +,\(\ce{Cr2O7^2-}\) a Cr 3 + y HNO 3 a NO 2. El azufre en H 2 S usualmente se oxida a azufre elemental, a menos que esté presente un gran exceso del agente oxidante. En cuyo caso, el sulfuro puede oxidarse a\(\ce{SO3^2-}\) o\(\ce{SO4^2-}\) (o a SO 2 o SO 3 en ausencia de agua):
\[\ce{2H2S}(g)+\ce{O2}(g)⟶\ce{2S}(s)+\ce{2H2O}(l) \nonumber \]
Este proceso de oxidación conduce a la eliminación del sulfuro de hidrógeno que se encuentra en muchas fuentes de gas natural. Los depósitos de azufre en regiones volcánicas pueden ser el resultado de la oxidación de H 2 S presente en los gases volcánicos.
El sulfuro de hidrógeno es un ácido diprótico débil que se disuelve en agua para formar ácido hidrosulfúrico. El ácido se ioniza en dos etapas, produciendo iones sulfuro de hidrógeno, HS −, en la primera etapa y iones sulfuro, S 2−, en la segunda. Dado que el sulfuro de hidrógeno es un ácido débil, las soluciones acuosas de sulfuros solubles y sulfuros de hidrógeno son básicas:
\[\ce{S^2-}(aq)+\ce{H2O}(l)⇌\ce{HS-}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{HS-}(aq)+\ce{H2O}(l)⇌\ce{H2S}(g)+\ce{OH-}(aq) \nonumber \]
Compuestos de Hidrógeno Halógeno
Los compuestos binarios que contienen solo hidrógeno y un halógeno son haluros de hidrógeno. A temperatura ambiente, los haluros de hidrógeno puros HF, HCl, HBr e HI son gases.
En general, es posible preparar los haluros mediante las técnicas generales utilizadas para preparar otros ácidos. El flúor, el cloro y el bromo reaccionan directamente con el hidrógeno para formar el haluro de hidrógeno respectivo. Esta es una reacción comercialmente importante para preparar cloruro de hidrógeno y bromuro de hidrógeno.
La reacción ácido-base entre un ácido fuerte no volátil y un haluro metálico producirá un haluro de hidrógeno. El escape del haluro de hidrógeno gaseoso conduce la reacción a su finalización. Por ejemplo, el método habitual para preparar fluoruro de hidrógeno es calentando una mezcla de fluoruro de calcio, CaF 2 y ácido sulfúrico concentrado:
\[\ce{CaF2}(s)+\ce{H2SO4}(aq)⟶\ce{CaSO4}(s)+\ce{2HF}(g) \nonumber \]
El fluoruro de hidrógeno gaseoso también es un subproducto en la preparación de fertilizantes de fosfato por reacción de fluoroapatita, Ca 5 (PO 4) 3 F, con ácido sulfúrico. La reacción de ácido sulfúrico concentrado con una sal de cloruro produce cloruro de hidrógeno tanto comercialmente como en el laboratorio.
En la mayoría de los casos, el cloruro de sodio es el cloruro de elección porque es el cloruro menos costoso. El bromuro de hidrógeno y el yoduro de hidrógeno no se pueden preparar usando ácido sulfúrico porque este ácido es un agente oxidante capaz de oxidar tanto bromuro como yoduro. Sin embargo, es posible preparar tanto bromuro de hidrógeno como yoduro de hidrógeno usando un ácido como el ácido fosfórico porque es un agente oxidante más débil. Por ejemplo:
\[\ce{H3PO4}(l)+\ce{Br-}(aq)⟶\ce{HBr}(g)+\ce{H2PO4-}(aq) \nonumber \]
Todos los haluros de hidrógeno son muy solubles en agua, formando ácidos hidrohalogenados. A excepción del fluoruro de hidrógeno, que tiene un fuerte enlace hidrógeno-fluoruro, son ácidos fuertes. Las reacciones de los ácidos hidrohalogenados con metales, hidróxidos metálicos, óxidos o carbonatos producen sales de los haluros. La mayoría de las sales de cloruro son solubles en agua. AgCl, PbCl 2 y Hg 2 Cl 2 son las excepciones comúnmente encontradas.
Los iones haluro dan a las sustancias las propiedades asociadas con X − (aq). Los iones haluro más pesados (Cl −, Br − e I −) pueden actuar como agentes reductores, y los halógenos más ligeros u otros agentes oxidantes los oxidarán:
\ [\ ce {Cl2} (aq) +\ ce {2e-} ⟶\ ce {2Cl-} (aq)\ hspace {20px} E°=\ mathrm {1.36\ :V}\\
\ ce {Br2} (aq) +\ ce {2e-} ⟶\ ce {2Br-} (aq)\ hspace {20px} E°=\ mathrm {1.09\ :V}\\
\ ce {I2} (aq) +\ ce {2e-} ⟶\ ce {2I-} (aq)\ hspace {20px} E°=\ mathrm {0.54\ :V}\ nonumber\]
Por ejemplo, el bromo oxida el yodo:
\[\ce{Br2}(aq)+\ce{2HI}(aq)⟶\ce{2HBr}(aq)+\ce{I2}(aq) \hspace{20px} E°=\mathrm{0.55\:V} \nonumber \]
El ácido fluorhídrico es único en sus reacciones con la arena (dióxido de silicio) y con el vidrio, que es una mezcla de silicatos:
\[\ce{SiO2}(s)+\ce{4HF}(aq)⟶\ce{SiF4}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{CaSiO3}(s)+\ce{6HF}(aq)⟶\ce{CaF2}(s)+\ce{SiF4}(g)+\ce{3H2O}(l) \nonumber \]
El tetrafluoruro de silicio volátil escapa de estas reacciones. Debido a que el fluoruro de hidrógeno ataca el vidrio, puede congelar o grabar vidrio y se usa para grabar marcas en termómetros, oficinas y otros artículos de vidrio.
El mayor uso del fluoruro de hidrógeno es en la producción de hidroclorofluorocarbonos para refrigerantes, en plásticos y en propelentes. El segundo mayor uso se encuentra en la fabricación de criolita, Na 3 AlF 6, la cual es importante en la producción de aluminio. El ácido también es importante en la producción de otros fluoruros inorgánicos (como el BF 3), que sirven como catalizadores en la síntesis industrial de ciertos compuestos orgánicos.
El ácido clorhídrico es relativamente económico. Es un ácido importante y versátil en la industria y es importante para la fabricación de cloruros metálicos, colorantes, pegamento, glucosa y varios otros productos químicos. Una cantidad considerable también es importante para la activación de pozos de petróleo y como licor de pepinillo, un ácido que se usa para eliminar el recubrimiento de óxido del hierro o el acero que se va a galvanizar, estañar o esmaltar. Las cantidades de ácido bromhídrico y ácido yodhídrico utilizadas comercialmente son insignificantes en comparación.
Resumen
El hidrógeno es el elemento más abundante del universo y su química es verdaderamente única. Aunque tiene cierta reactividad química que es similar a la de los metales alcalinos, el hidrógeno tiene muchas de las mismas propiedades químicas de un no metal con una electronegatividad relativamente baja. Forma hidruros iónicos con metales activos, compuestos covalentes en los que tiene un estado de oxidación de 1− con menos elementos electronegativos, y compuestos covalentes en los que tiene un estado de oxidación de 1+ con más no metales electronegativos. Reacciona explosivamente con oxígeno, flúor y cloro, menos fácilmente con bromo y mucho menos fácilmente con yodo, azufre y nitrógeno. El hidrógeno reduce los óxidos de metales con menores potenciales de reducción que el cromo para formar el metal y el agua. Los haluros de hidrógeno son todos ácidos cuando se disuelven en agua.
Glosario
- Proceso Haber
- principal proceso industrial utilizado para producir amoníaco a partir de nitrógeno e hidrógeno; implica el uso de un catalizador de hierro y temperaturas y presiones elevadas
- haluro de hidrógeno
- compuesto binario formado entre hidrógeno y los halógenos: HF, HCl, HBr y HI
- hidrogenación
- adición de hidrógeno (H 2) para reducir un compuesto


