18.4: Estructura y Propiedades Generales de los No Metales
- Page ID
- 75454
- Describir la estructura y las propiedades de los no metales
Los no metales son elementos ubicados en la parte superior derecha de la tabla periódica. Sus propiedades y comportamiento son bastante diferentes a los de los metales del lado izquierdo. En condiciones normales, más de la mitad de los no metales son gases, uno es líquido y el resto incluye algunos de los sólidos más blandos y duros. Los no metales exhiben una rica variedad de comportamientos químicos. Incluyen los elementos más reactivos y menos reactivos, y forman muchos compuestos iónicos y covalentes diferentes. En esta sección se presenta una visión general de las propiedades y comportamientos químicos de los no metales, así como la química de elementos específicos. Muchos de estos no metales son importantes en los sistemas biológicos.
En muchos casos, las tendencias en electronegatividad nos permiten predecir el tipo de unión y los estados físicos en compuestos que involucran a los no metales. Sabemos que la electronegatividad disminuye a medida que bajamos un grupo determinado y aumenta a medida que avanzamos de izquierda a derecha a lo largo de un periodo. Los no metales tienen electronegatividades más altas que los metales, y los compuestos formados entre metales y no metales son generalmente de naturaleza iónica debido a las grandes diferencias de electronegatividad entre ellos. Los metales forman cationes, los no metales forman aniones y los compuestos resultantes son sólidos en condiciones normales. Por otro lado, los compuestos formados entre dos o más no metales tienen pequeñas diferencias en la electronegatividad entre los átomos, y los resultados de unión covalente, intercambio de electrones. Estas sustancias tienden a ser de naturaleza molecular y son gases, líquidos o sólidos volátiles a temperatura y presión ambiente.
En los procesos químicos normales, los no metales no forman iones positivos monatómicos (cationes) debido a que sus energías de ionización son demasiado altas. Todos los iones monatómicos no metálicos son aniones; los ejemplos incluyen el ion cloruro, Cl −, el ion nitruro, N 3− y el ion seleniuro, Se 2 −. Los estados de oxidación comunes que los no metales exhiben en sus compuestos iónicos y covalentes se muestran en la Figura\(\PageIndex{1}\). Recuerde que un elemento exhibe un estado de oxidación positivo cuando se combina con un elemento más electronegativo y que exhibe un estado de oxidación negativo cuando se combina con un elemento menos electronegativo.
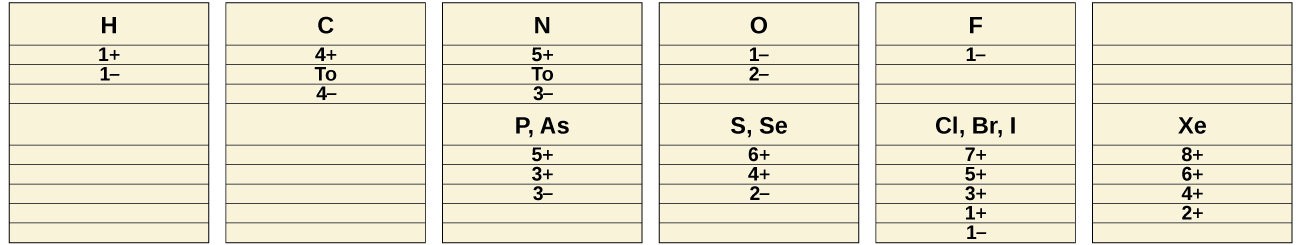
El primer miembro de cada grupo no metálico exhibe comportamientos diferentes, en muchos aspectos, de los otros miembros del grupo. Las razones de esto incluyen menor tamaño, mayor energía de ionización y (lo más importante) el hecho de que el primer miembro de cada grupo tiene solo cuatro orbitales de valencia (uno 2 s y tres 2 p) disponibles para la unión, mientras que otros miembros del grupo tienen orbitales d vacíos en sus conchas de valencia, haciendo posible cinco, seis, o incluso más enlaces alrededor del átomo central. Por ejemplo, el nitrógeno forma solo NF 3, mientras que el fósforo forma tanto PF 3 como PF 5.
Recuerde que un elemento exhibe un estado de oxidación positivo cuando se combina con un elemento más electronegativo y que exhibe un estado de oxidación negativo cuando se combina con un elemento menos electronegativo.
Otra diferencia entre el primer miembro del grupo y los miembros subsiguientes es la mayor capacidad del primer miembro para formar enlaces π. Esto es principalmente una función del menor tamaño del primer miembro de cada grupo, lo que permite una mejor superposición de orbitales atómicos. Los no metales, distintos del primer miembro de cada grupo, rara vez forman enlaces π a los no metales que son el primer miembro de un grupo. Por ejemplo, los enlaces π azufre-oxígeno son bien conocidos, mientras que el azufre normalmente no forma enlaces π estables consigo mismo.
La variedad de estados de oxidación mostrados por la mayoría de los no metales significa que muchas de sus reacciones químicas implican cambios en el estado de oxidación a través de reacciones de oxidación-reducción. Hay cinco aspectos generales de la química de oxidación-reducción:
- Los no metales oxidan la mayoría de los metales. El estado de oxidación del metal se vuelve positivo a medida que sufre oxidación y el del no metal se vuelve negativo a medida que experimenta reducción. Por ejemplo:
\[4 \underset{0}{\ce{Fe}} \left( s \right) + 3 \underset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \underset{+3}{\ce{Fe_2}} \underset{-2}{\ce{O_3}} \left( s \right) \nonumber \] - A excepción del nitrógeno y el carbono, que son agentes oxidantes pobres, un no metal más electronegativo oxida un no metal menos electronegativo o el anión del no metal:
\[\underset{0}{\ce{S}} \left( s \right) + \underset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \underset{+4}{\ce{S}} \underset{-2}{\ce{O_2}} \left( s \right) \nonumber \]
\[\underset{0}{\ce{Cl_2}} \left( g \right) + 2 \ce{I^-} \left( aq \right) \rightarrow \underset{0}{\ce{I_2}} \left( s \right) + 2 \ce{Cl^-} \left( aq \right) \nonumber \]
- El flúor y el oxígeno son los agentes oxidantes más fuertes dentro de sus respectivos grupos; cada uno oxida todos los elementos que se encuentran debajo de él en el grupo. Dentro de cualquier periodo, el agente oxidante más fuerte se encuentra en el grupo 17. Un no metal a menudo oxida un elemento que se encuentra a su izquierda en el mismo periodo. Por ejemplo:
\[2 \underset{0}{\ce{As}} \left( s \right) + 3 \underset{0}{\ce{Br_2}} \left( l \right) \rightarrow 2 \underset{+3}{\ce{As}} \underset{-1}{\ce{Br_3}} \left( s \right) \nonumber \]
- Cuanto más fuerte es un no metal como agente oxidante, más difícil es oxidar el anión formado por el no metal. Esto significa que los iones negativos más estables están formados por elementos en la parte superior del grupo o en el grupo 17 del periodo.
- El flúor y el oxígeno son los elementos oxidantes más fuertes conocidos. El flúor no forma compuestos en los que exhiba estados de oxidación positivos; el oxígeno presenta un estado de oxidación positivo solo cuando se combina con flúor. Por ejemplo:\[2 \underset{0}{\ce{F_2}} \left( g \right) + 2 \ce{OH^-} \left( aq \right) \rightarrow \underset{+2}{\ce{O}} \underset{-1}{\ce{F_2}} \left( g \right) + 2 \ce{F^-} \left( aq \right) + \ce{H_2O} \left( l \right) \nonumber \]
Con la excepción de la mayoría de los gases nobles, todos los no metales forman compuestos con oxígeno, produciendo óxidos covalentes. La mayoría de estos óxidos son ácidos, es decir, reaccionan con el agua para formar oxiácidos. Recordemos del capítulo ácido-base que un oxiácido es un ácido que consiste en hidrógeno, oxígeno y algún otro elemento. Excepciones notables son monóxido de carbono, CO, óxido nitroso, N 2 O, y óxido nítrico, NO. Existen tres características de estos óxidos ácidos:
- Óxidos como SO 2 y N 2 O 5, en los que el no metal exhibe uno de sus estados de oxidación comunes, son los anhidros ácidos y reaccionan con el agua para formar ácidos sin cambio en el estado de oxidación. El producto es un oxiácido. Por ejemplo:\[\ce{SO2}(g)+\ce{H2O}(l)⟶\ce{H2SO3}(aq) \nonumber \]\[\ce{N2O5}(s)+\ce{H2O}(l)⟶\ce{2HNO3}(aq) \nonumber \]
- Aquellos óxidos como NO 2 y ClO 2, en los que el no metal no presenta uno de sus estados de oxidación comunes, también reaccionan con el agua. En estas reacciones, el no metal se oxida y se reduce a la vez. Por ejemplo:\[3 \underset{+4}{\ce{N}} \ce{O_2} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow 2 \ce{H} \underset{+5}{\ce{N}} \ce{O_3} \left( aq \right) + \underset{+2}{\ce{N}} \ce{O} \left( g \right) \nonumber \] Las reacciones en las que el mismo elemento está oxidado y reducido se denominan reacciones de desproporción.
- La fuerza ácida aumenta a medida que aumenta la electronegatividad del átomo central. Para conocer más, vea la discusión en el capítulo sobre química ácido-base.
Los compuestos binarios de hidrógeno de los no metales también presentan un comportamiento ácido en el agua, aunque solo HCl, HBr e HI son ácidos fuertes. La fuerza ácida de los compuestos de hidrógeno no metálicos aumenta de izquierda a derecha a lo largo de un período y un grupo descendente. Por ejemplo, el amoníaco, NH 3, es un ácido más débil que el agua, H 2 O, que es más débil que el fluoruro de hidrógeno, HF. El agua, H 2 O, también es un ácido más débil que el sulfuro de hidrógeno, H 2 S, que es más débil que el seleniuro de hidrógeno, H 2 Se. El carácter ácido más débil implica un mayor carácter básico.
Estructuras de los no metales
Las estructuras de los no metales difieren drásticamente de las de los metales. Los metales cristalizan en matrices estrechamente empaquetadas que no contienen moléculas ni enlaces covalentes. Las estructuras no metálicas contienen enlaces covalentes, y muchos no metales consisten en moléculas individuales. Los electrones en los no metales se localizan en enlaces covalentes, mientras que en un metal, hay deslocalización de los electrones a lo largo del sólido.
Los gases nobles son todos monatómicos, mientras que los otros gases no metálicos —hidrógeno, nitrógeno, oxígeno, flúor y cloro— normalmente existen como las moléculas diatómicas H 2, N 2, O 2, F 2 y Cl 2. Los otros halógenos también son diatómicos; Br 2 es un líquido y I 2 existe como un sólido en condiciones normales. Los cambios de estado a medida que se baja en la familia halógena ofrecen excelentes ejemplos de la creciente fuerza de las fuerzas intermoleculares de Londres con el aumento de la masa molecular y el aumento de la polarizabilidad.
El oxígeno tiene dos alótropos: O 2, dioxígeno y O 3, ozono. El fósforo tiene tres alótropos comunes, comúnmente referidos por sus colores: blanco, rojo y negro. El azufre tiene varios alótropos. También hay muchos alótropos de carbono. La mayoría de la gente sabe de diamante, grafito y carbón vegetal, pero menos personas conocen el reciente descubrimiento de fullerenos, nanotubos de carbono y grafeno.
A continuación se describen las propiedades físicas de tres no metales que son características de los sólidos moleculares.
Carbono
El carbono se presenta en el estado no combinado (elemental) en muchas formas, como diamante, grafito, carbón vegetal, coque, negro de humo, grafeno y fullereno.
El diamante, mostrado en la Figura\(\PageIndex{2}\), es un material cristalino muy duro que es incoloro y transparente cuando es puro. Cada átomo forma cuatro enlaces simples con otros cuatro átomos en las esquinas de un tetraedro (hibridación sp 3); esto convierte al diamante en una molécula gigante. Los enlaces simples carbono-carbono son muy fuertes y, debido a que se extienden por todo el cristal para formar una red tridimensional, los cristales son muy duros y tienen altos puntos de fusión (~4400 °C).

El grafito, también mostrado en la Figura\(\PageIndex{2}\), es un sólido blando, resbaladizo, de color negro grisáceo que conduce la electricidad. Estas propiedades se relacionan con su estructura, que consiste en capas de átomos de carbono, con cada átomo rodeado por otros tres átomos de carbono en una disposición plana trigonal. Cada átomo de carbono en grafito forma tres enlaces σ, uno a cada uno de sus vecinos más cercanos, por medio de orbitales híbridos sp 2. El orbital p no hibridado en cada átomo de carbono se superpondrá a orbitales no hibridados en átomos de carbono adyacentes en la misma capa para formar enlaces π. Muchas formas de resonancia son necesarias para describir la estructura electrónica de una capa de grafito; la Figura\(\PageIndex{3}\) ilustra dos de estas formas.
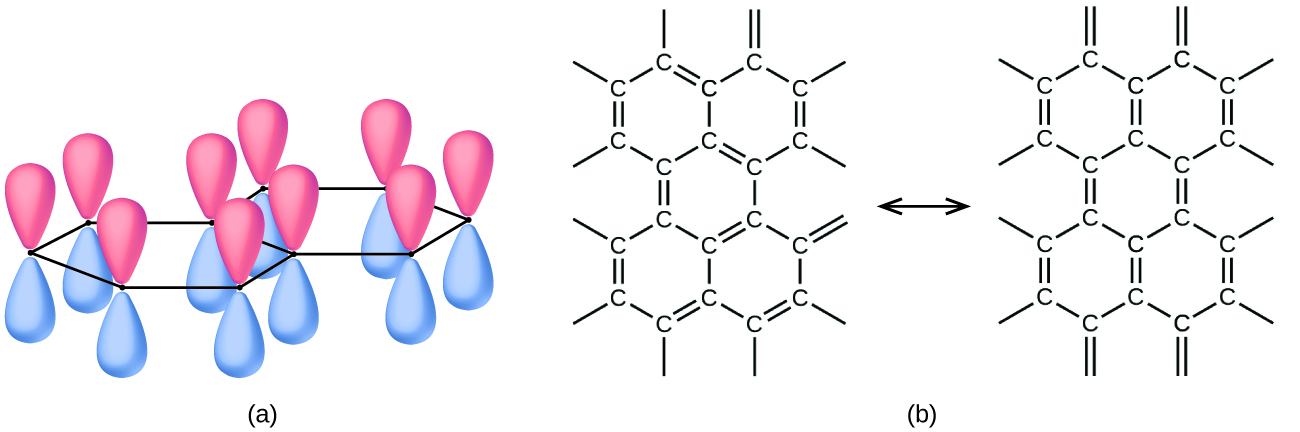
Los átomos dentro de una capa de grafito están unidos fuertemente por los enlaces σ y π; sin embargo, las fuerzas entre las capas son débiles. Las fuerzas de dispersión de Londres mantienen unidas las capas. Para conocer más, vea la discusión de estas fuerzas débiles en el capítulo sobre líquidos y sólidos. Las débiles fuerzas entre capas le dan al grafito el carácter suave y escamoso que lo hace útil como el llamado “plomo” en los lápices y el carácter resbaladizo que lo hace útil como lubricante. Los electrones holgados en los enlaces π resonantes pueden moverse por todo el sólido y son responsables de la conductividad eléctrica del grafito.
Otras formas de carbono elemental incluyen negro de carbón, carbón y coque. El negro de carbón es una forma amorfa de carbono preparada por la combustión incompleta del gas natural, CH 4. Es posible producir carbón y coque calentando madera y carbón, respectivamente, a altas temperaturas en ausencia de aire.
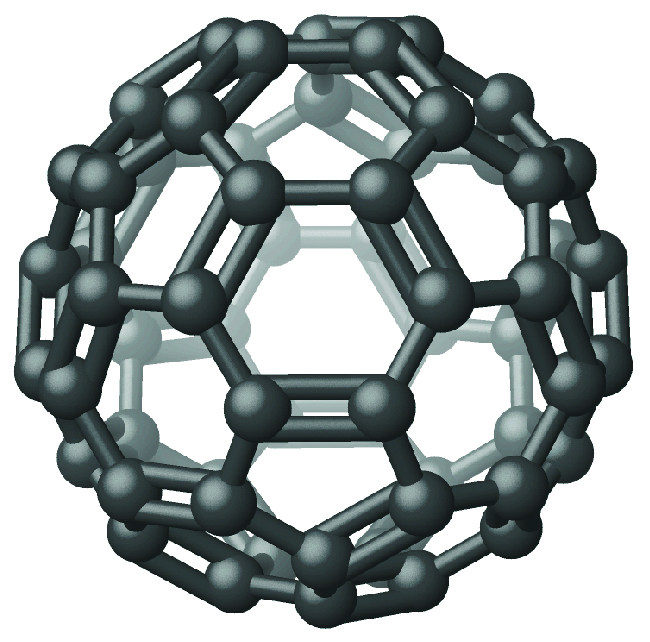
Recientemente, se han identificado nuevas formas de moléculas elementales de carbono en el hollín generado por una llama ahumada y en el vapor producido cuando el grafito se calienta a temperaturas muy altas en vacío o en helio. Una de estas nuevas formas, aislada por primera vez por el profesor Richard Smalley y compañeros de trabajo de la Universidad Rice, consiste en moléculas icosaédricas (en forma de bola de fútbol) que contienen 60 átomos de carbono, C 60. Se trata de buckminsterfullereno (a menudo llamado bolas bucky) según el arquitecto Buckminster Fuller, quien diseñó estructuras abovedadas, que tienen una apariencia similar (Figura\(\PageIndex{4}\)).
Nanotubos y Grafeno
El grafeno y los nanotubos de carbono son dos alótropos de carbono descubiertos recientemente. Ambas formas tienen alguna relación con el grafito. El grafeno es una sola capa de grafito (un átomo de espesor), como se ilustra en la Figura\(\PageIndex{2}\) d, mientras que los nanotubos de carbono enrollan la capa en un tubo pequeño, como se ilustra en la Figura\(\PageIndex{5}\).

El grafeno es un conductor de calor y electricidad muy fuerte, ligero y eficiente descubierto en 2003. Al igual que en el grafito, los átomos de carbono forman una capa de anillos de seis miembros con átomos de carbono hibridados sp 2 en las esquinas. La resonancia estabiliza el sistema y conduce a su conductividad. A diferencia del grafito, no hay apilamiento de las capas para dar una estructura tridimensional. Andre Geim y Kostya Novoselov de la Universidad de Manchester ganaron el Premio Nobel de Física 2010 por su trabajo pionero en la caracterización del grafeno.
El procedimiento más sencillo para preparar grafeno es utilizar un trozo de cinta adhesiva para eliminar una sola capa de grafeno de la superficie de una pieza de grafito. Este método funciona porque solo hay débiles fuerzas de dispersión londinenses entre las capas en grafito. Los métodos alternativos son depositar una sola capa de átomos de carbono sobre la superficie de algún otro material (rutenio, iridio o cobre) o sintetizarlo en la superficie del carburo de silicio mediante la sublimación de silicio.
Actualmente no hay aplicaciones comerciales de grafeno. Sin embargo, sus propiedades inusuales, como la alta movilidad de los electrones y la conductividad térmica, deberían hacerlo adecuado para la fabricación de muchos dispositivos electrónicos avanzados y para aplicaciones de gestión térmica.
Los nanotubos de carbono son alótropos de carbono, los cuales tienen una estructura cilíndrica. Al igual que el grafito y el grafeno, los nanotubos consisten en anillos de átomos de carbono hibridados sp 2. A diferencia del grafito y el grafeno, que ocurren en capas, las capas se envuelven en un tubo y se unen para producir una estructura estable. Las paredes del tubo pueden ser de un átomo o múltiples átomos de espesor.
Los nanotubos de carbono son materiales extremadamente fuertes que son más duros que el diamante. Dependiendo de la forma del nanotubo, puede ser un conductor o semiconductor. Para algunas aplicaciones, es preferible la forma conductora, mientras que otras aplicaciones utilizan la forma semiconductora.
La base para la síntesis de nanotubos de carbono es la generación de átomos de carbono en un vacío. Es posible producir átomos de carbono mediante una descarga eléctrica a través del grafito, la vaporización del grafito con un láser y la descomposición de un compuesto de carbono.
La fuerza de los nanotubos de carbono eventualmente conducirá a algunas de sus aplicaciones más emocionantes, ya que un hilo producido a partir de varios nanotubos soportará un peso enorme. Sin embargo, las aplicaciones actuales solo emplean nanotubos a granel. La adición de nanotubos a los polímeros mejora las propiedades mecánicas, térmicas y eléctricas del material a granel. Actualmente hay nanotubos en algunas piezas de bicicletas, esquís, bates de béisbol, cañas de pescar y tablas de surf.
Fosforo
El nombre fósforo proviene de las palabras griegas que significan traer luz. Cuando el fósforo se aisló por primera vez, los científicos señalaron que brillaba en la oscuridad y se quemaba cuando se exponía al aire. El fósforo es el único miembro de su grupo que no se presenta en el estado no combinado en la naturaleza; existe en muchas formas alotrópicas. Consideraremos dos de esas formas: fósforo blanco y fósforo rojo.
El fósforo blanco es un sólido ceroso blanco que se funde a 44.2 °C y hierve a 280 °C, es insoluble en agua, es muy soluble en disulfuro de carbono y estalla en llamas en el aire. Como sólido, como líquido, como gas, y en solución, el fósforo blanco existe como moléculas P 4 con cuatro átomos de fósforo en las esquinas de un tetraedro regular (Figura\(\PageIndex{5}\)). Cada átomo de fósforo se une covalentemente a los otros tres átomos en la molécula por enlaces covalentes simples. El fósforo blanco es el alótropo más reactivo y es muy tóxico.

Calentar fósforo blanco a 270—300 °C en ausencia de aire produce fósforo rojo. El fósforo rojo es más denso, tiene un punto de fusión más alto (~600 °C), es mucho menos reactivo, es esencialmente no tóxico y es más fácil y seguro de manejar que el fósforo blanco. Su estructura es altamente polimérica y parece contener redes tridimensionales de tetraedros P 4 unidos por enlaces simples P-P. El fósforo rojo es insoluble en disolventes que disuelven el fósforo blanco. Cuando el fósforo rojo se calienta, las moléculas de P 4 subliman del sólido.
Azufre
La alotropía del azufre es mucho mayor y más compleja que la de cualquier otro elemento. El azufre es el azufre al que se hace referencia en la Biblia y otros lugares, y las referencias al azufre ocurren a lo largo de la historia registrada, hasta el descubrimiento relativamente reciente de que es un componente de las atmósferas de Venus y de Io, una luna de Júpiter. El alótropo de azufre más común y estable es el azufre amarillo, rómbico, llamado así por la forma de sus cristales. El azufre rómbico es la forma a la que todos los demás alótropos revierten a temperatura ambiente. Los cristales de azufre rómbico se funden a 113 °C. El enfriamiento de este líquido da largas agujas de azufre monoclínico. Esta forma es estable desde 96 °C hasta el punto de fusión, 119 °C. A temperatura ambiente, vuelve gradualmente a la forma rómbica.
Tanto el azufre rómbico como el azufre monoclínico contienen moléculas S 8 en las que los átomos forman anillos arrugados de ocho miembros que se asemejan a coronas (Figura\(\PageIndex{6}\)). Cada átomo de azufre está unido a cada uno de sus dos vecinos en el anillo por enlaces sencillos covalentes S-S.
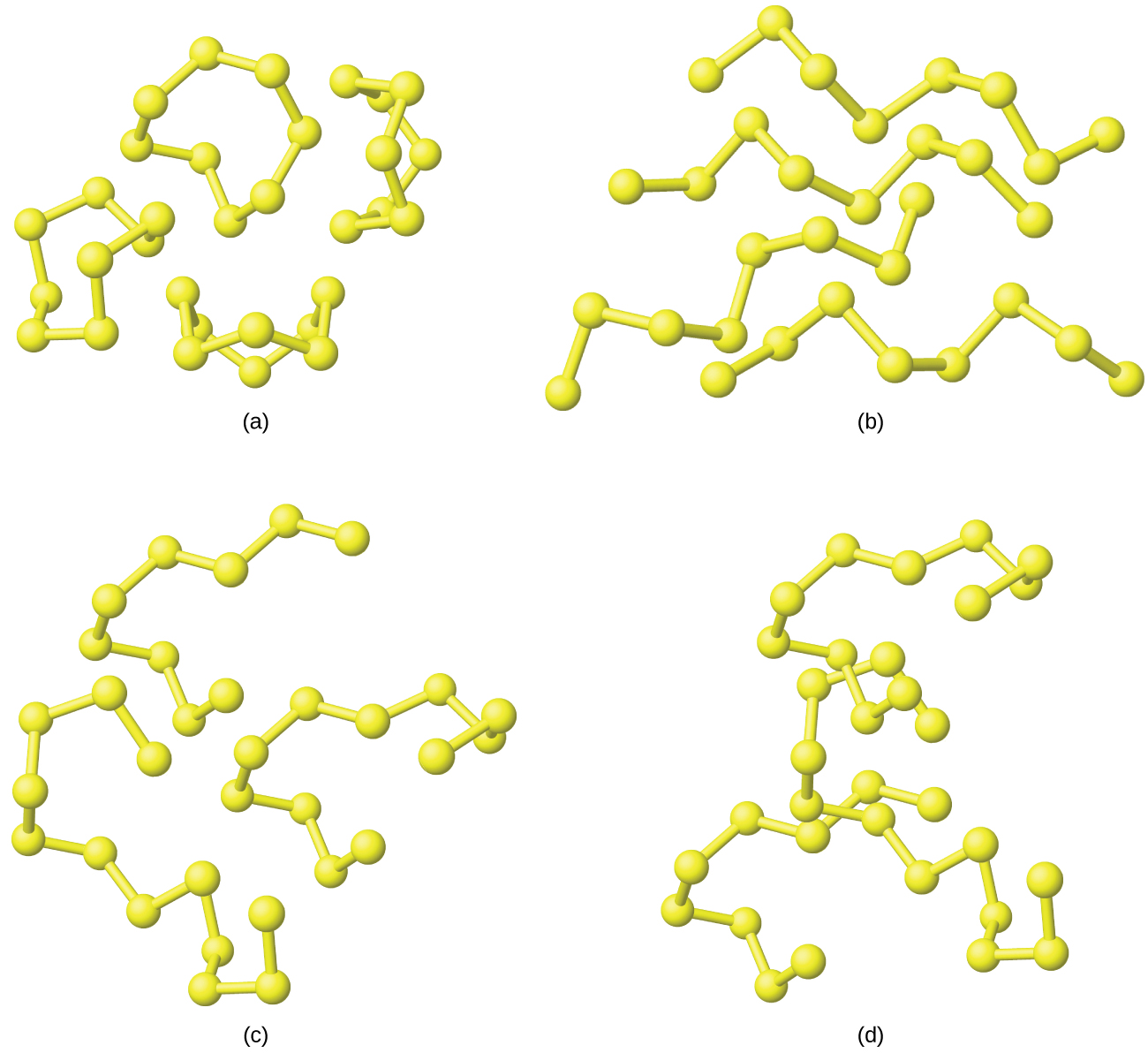
Cuando el azufre rómbico se funde, el líquido de color pajizo es bastante móvil; su viscosidad es baja debido a que las moléculas S 8 son esencialmente esféricas y ofrecen relativamente poca resistencia a medida que pasan unas de otras. A medida que aumenta la temperatura, los enlaces S-S en los anillos se rompen y resultan cadenas poliméricas de átomos de azufre. Estas cadenas combinan extremo a extremo, formando cadenas aún más largas que se enredan entre sí. El líquido gradualmente se oscurece de color y se vuelve tan viscoso que finalmente (a aproximadamente 230 °C) no se vierte fácilmente. Los átomos colgantes en los extremos de las cadenas de átomos de azufre son responsables del color rojo oscuro porque su estructura electrónica difiere de la de los átomos de azufre que tienen enlaces a dos átomos de azufre adyacentes. Esto hace que absorban la luz de manera diferente y da como resultado un color visible diferente. El enfriamiento del líquido produce rápidamente una masa amorfa similar al caucho, llamada azufre plástico.
El azufre hierve a 445 °C y forma un vapor que consiste en moléculas S 2, S 6 y S 8; a aproximadamente 1000 °C, la densidad de vapor corresponde a la fórmula S2, que es una molécula paramagnética como O 2 con una estructura electrónica similar y un azufre débil. doble enlace de azufre.
Como se ve en esta discusión, una característica importante del comportamiento estructural de los no metales es que los elementos suelen ocurrir con ocho electrones en sus conchas de valencia. Si es necesario, los elementos forman suficientes enlaces covalentes para complementar los electrones ya presentes para poseer un octeto. Por ejemplo, los miembros del grupo 15 tienen cinco electrones de valencia y solo requieren tres electrones adicionales para llenar sus conchas de valencia. Estos elementos forman tres enlaces covalentes en su estado libre: triples enlaces en la molécula N 2 o enlaces simples a tres átomos diferentes en arsénico y fósforo. Los elementos del grupo 16 requieren solo dos electrones adicionales. El oxígeno forma un doble enlace en la molécula O 2, y el azufre, el selenio y el teluro forman dos enlaces simples en varios anillos y cadenas. Los halógenos forman moléculas diatómicas en las que cada átomo está involucrado en un solo enlace. Esto proporciona el electrón necesario para completar el octeto en el átomo de halógeno. Los gases nobles no forman enlaces covalentes con otros átomos de gas noble porque ya tienen una capa externa llena.
Resumen
Los no metales tienen estructuras que son muy diferentes a las de los metales, principalmente porque tienen mayor electronegatividad y electrones que están más estrechamente unidos a átomos individuales. La mayoría de los óxidos no metálicos son anhidridos ácidos, lo que significa que reaccionan con el agua para formar soluciones ácidas. Las estructuras moleculares son comunes para la mayoría de los no metales, y varios tienen múltiples alótropos con propiedades físicas variables.
Glosario
- anhídrido de ácido
- compuesto que reacciona con el agua para formar una solución ácida o ácida
- reacción de desproporción
- reacción química donde un solo reactivo se reduce y oxida simultáneamente; es tanto el agente reductor como el agente oxidante


