18.7: Ocurrencia, preparación y propiedades del nitrógeno
- Page ID
- 75473
- Describir las propiedades, preparación y usos del nitrógeno
La mayor parte del nitrógeno puro proviene de la destilación fraccionada del aire líquido. La atmósfera consiste en 78% de nitrógeno en volumen. Esto significa que hay más de 20 millones de toneladas de nitrógeno por cada milla cuadrada de la superficie terrestre. El nitrógeno es un componente de las proteínas y del material genético (ADN/ARN) de todas las plantas y animales.
En condiciones ordinarias, el nitrógeno es un gas incoloro, inodoro e insípido. Hierve a 77 K y se congela a 63 K. El nitrógeno líquido es un refrigerante útil porque es económico y tiene un punto de ebullición bajo. El nitrógeno es muy poco reactivo debido al triple enlace muy fuerte entre los átomos de nitrógeno. Las únicas reacciones comunes a temperatura ambiente ocurren con litio para formar Li 3 N, con ciertos complejos de metales de transición, y con hidrógeno u oxígeno en bacterias fijadoras de nitrógeno. La falta general de reactividad del nitrógeno hace que la notable capacidad de algunas bacterias para sintetizar compuestos nitrogenados utilizando gas nitrógeno atmosférico como fuente sea uno de los eventos químicos más emocionantes de nuestro planeta. Este proceso es un tipo de fijación de nitrógeno. En este caso, la fijación de nitrógeno es el proceso donde los organismos convierten el nitrógeno atmosférico en químicos biológicamente útiles. La fijación de nitrógeno también ocurre cuando los rayos pasan a través del aire, lo que hace que el nitrógeno molecular reaccione con el oxígeno para formar óxidos de nitrógeno, que luego son transportados al suelo.
Fijación de nitrógeno
Todos los organismos vivos requieren compuestos nitrogenados para su supervivencia. Desafortunadamente, la mayoría de estos organismos no pueden absorber nitrógeno de su fuente más abundante: la atmósfera. El nitrógeno atmosférico consiste en moléculas de N 2, las cuales son muy poco reactivas debido al fuerte triple enlace nitrógeno-nitrógeno. Sin embargo, algunos organismos pueden superar este problema a través de un proceso conocido como fijación de nitrógeno, ilustrado en la Figura\(\PageIndex{1}\).
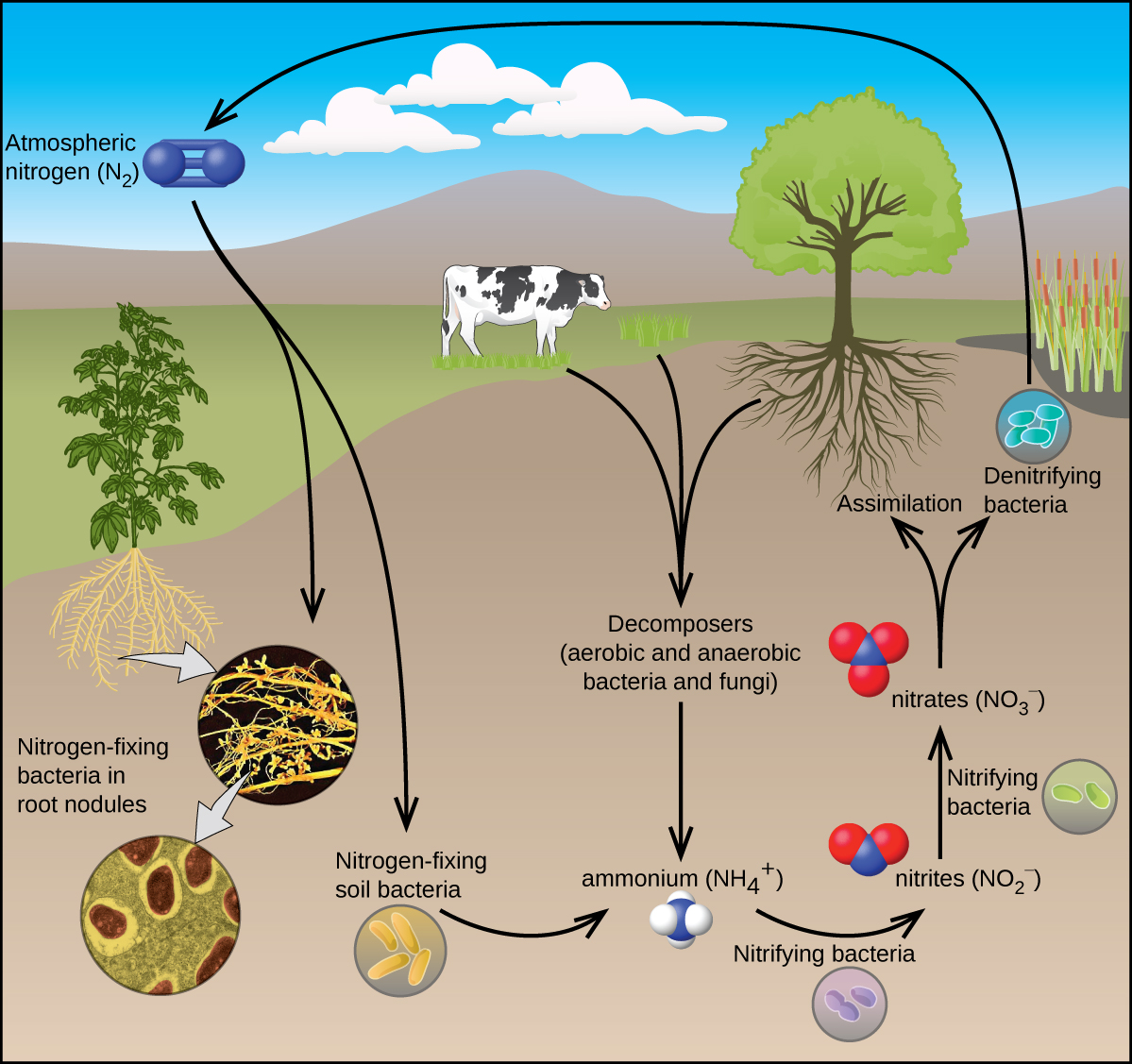
La fijación de nitrógeno es el proceso en el que los organismos convierten el nitrógeno atmosférico en químicos biológicamente útiles. A la fecha, el único tipo conocido de organismos biológicos capaces de fijar nitrógeno son los microorganismos. Estos organismos emplean enzimas llamadas nitrogenasas, que contienen hierro y molibdeno. Muchos de estos microorganismos viven en una relación simbiótica con las plantas, siendo el ejemplo más conocido la presencia de rizobios en los nódulos radiculares de las leguminosas.
Se necesitan grandes volúmenes de nitrógeno atmosférico para fabricar amoníaco, el principal material de partida utilizado para la preparación de grandes cantidades de otros compuestos que contienen nitrógeno. La mayoría de los otros usos del nitrógeno elemental dependen de su inactividad. Es útil cuando un proceso químico requiere una atmósfera inerte. Los alimentos enlatados y las carnes de almuerzo no pueden oxidarse en una atmósfera de nitrógeno puro, por lo que conservan un mejor sabor y color, y se echan a perder menos rápidamente, cuando se sellan en nitrógeno en lugar de aire. Esta tecnología permite que los productos frescos estén disponibles durante todo el año, independientemente de la temporada de crecimiento.
Existen compuestos con nitrógeno en todos sus estados de oxidación de 3− a 5+. Gran parte de la química del nitrógeno implica reacciones de oxidación-reducción. Algunos metales activos (como los metales alcalinos y los metales alcalinotérreos) pueden reducir el nitrógeno para formar nitruros metálicos. En el resto de esta sección, examinaremos la química del nitrógeno-oxígeno.
Existen óxidos de nitrógeno bien caracterizados en los que el nitrógeno exhibe cada uno de sus números de oxidación positivos de 1+ a 5+. Cuando el nitrato de amonio se calienta cuidadosamente, se forman óxido nitroso (óxido de dinitrógeno) y vapor de agua. Un calentamiento más fuerte genera gas nitrógeno, gas oxígeno y vapor de agua. Nadie debería intentar jamás esta reacción, puede ser muy explosiva. En 1947, hubo una gran explosión de nitrato de amonio en Texas City, Texas, y, en 2013, hubo otra explosión importante en West, Texas. En los últimos 100 años, hubo cerca de 30 desastres similares en todo el mundo, resultando en la pérdida de numerosas vidas. En esta reacción de oxidación-reducción, el nitrógeno en el ion nitrato oxida el nitrógeno en el ión amonio. El óxido nitroso, mostrado en la Figura\(\PageIndex{2}\), es un gas incoloro que posee un olor suave y agradable y un sabor dulce. Encuentra aplicación como anestésico para operaciones menores, especialmente en odontología, bajo el nombre de “gas de la risa”.

Se forman bajos rendimientos de óxido nítrico, NO, al calentar nitrógeno y oxígeno juntos. NO también se forma cuando los rayos pasan a través del aire durante las tormentas eléctricas. La quema de amoníaco es el método comercial de preparación de óxido nítrico. En el laboratorio, la reducción del ácido nítrico es el mejor método para preparar el óxido nítrico. Cuando el cobre reacciona con ácido nítrico diluido, el óxido nítrico es el principal producto de reducción:
\[\ce{3Cu}(s)+\ce{8HNO3}(aq)⟶\ce{2NO}(g)+\ce{3Cu(NO3)2}(aq)+\ce{4H2O}(l) \nonumber \]
El óxido nítrico gaseoso es el más estable térmicamente de los óxidos de nitrógeno y es la molécula térmicamente estable más simple conocida con un electrón desapareado. Es uno de los contaminantes atmosféricos generados por los motores de combustión interna, resultante de la reacción del nitrógeno atmosférico y el oxígeno durante el proceso de combustión.
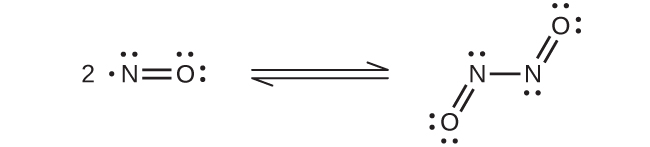
A temperatura ambiente, el óxido nítrico es un gas incoloro que consiste en moléculas diatómicas. Como suele ser el caso de las moléculas que contienen un electrón desapareado, dos moléculas se combinan para formar un dímero emparejando sus electrones desapareados para formar un enlace. Tanto el NO líquido como el sólido contienen dímeros N 2 O 2, como el mostrado en la Figura\(\PageIndex{3}\). La mayoría de las sustancias con electrones desapareados exhiben color al absorber la luz visible; sin embargo, el NO es incoloro porque la absorción de luz no está en la región visible del espectro.
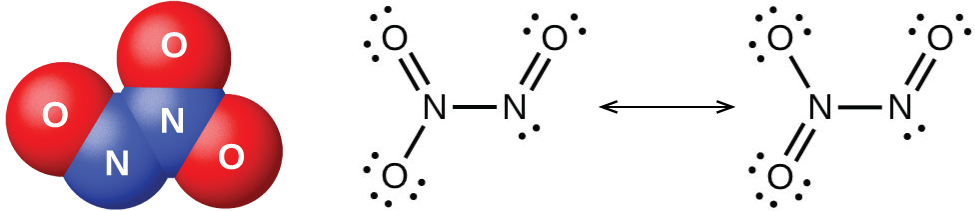
Enfriar una mezcla de partes iguales de óxido nítrico y dióxido de nitrógeno a −21 °C produce trióxido de dinitrógeno, un líquido azul que consiste en moléculas de N 2 O 3 (Figura\(\PageIndex{4}\)). El trióxido de dinitrógeno solo existe en los estados líquido y sólido. Cuando se calienta, vuelve a una mezcla de NO y NO 2.
Es posible preparar dióxido de nitrógeno en el laboratorio calentando el nitrato de un metal pesado, o por la reducción de ácido nítrico concentrado con cobre metálico, como se muestra en la Figura\(\PageIndex{5}\). Comercialmente, es posible preparar dióxido de nitrógeno oxidando óxido nítrico con aire.

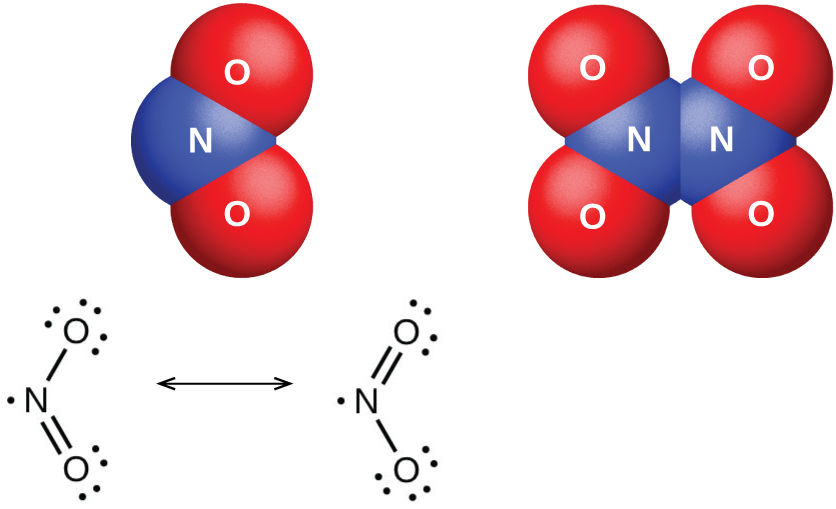
La molécula de dióxido de nitrógeno (Figura\(\PageIndex{6}\)) contiene un electrón desapareado, el cual es responsable de su color y paramagnetismo. También es responsable de la dimerización del NO 2. A bajas presiones o a altas temperaturas, el dióxido de nitrógeno tiene un color marrón profundo que se debe a la presencia de la molécula de NO 2. A bajas temperaturas, el color desaparece casi por completo a medida que se forma tetraóxido de dinitrógeno, N 2 O 4. A temperatura ambiente, existe un equilibrio:
\[\ce{2NO2}(g)⇌\ce{N2O4}(g) \hspace{20px} K_P=6.86 \nonumber \]
El pentaóxido de dinitrógeno, N 2 O 5 (Figura\(\PageIndex{7}\)), es un sólido blanco que se forma por la deshidratación de ácido nítrico por óxido de fósforo (V) (decoxido de tetraposforo):
\[\ce{P4O10}(s)+\ce{4HNO3}(l)⟶\ce{4HPO3}(s)+\ce{2N2O5}(s) \nonumber \]
Es inestable por encima de la temperatura ambiente, descomponiéndose a N 2 O 4 y O 2.
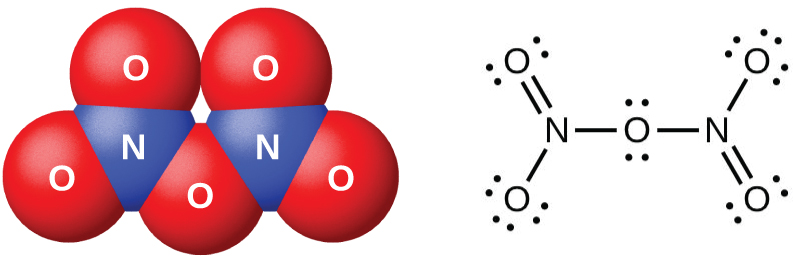
Los óxidos de nitrógeno (III), nitrógeno (IV) y nitrógeno (V) reaccionan con el agua y forman oxiácidos que contienen nitrógeno. El óxido de nitrógeno (III), N 2 O 3, es el anhídrido del ácido nitroso; el HNO 2 se forma cuando N 2 O 3 reacciona con el agua. No hay oxiácidos estables que contengan nitrógeno con un estado de oxidación de 4+; por lo tanto, el óxido de nitrógeno (IV), NO 2, se desproporciona de una de dos maneras cuando reacciona con el agua. En agua fría, se forma una mezcla de HNO 2 y HNO 3. A temperaturas más altas, se formarán HNO 3 y NO. El óxido de nitrógeno (V), N 2 O 5, es el anhídrido del ácido nítrico; HNO 3 se produce cuando N 2 O 5 reacciona con agua:
\[\ce{N2O5}(s)+\ce{H2O}(l)⟶\ce{2HNO3}(aq) \nonumber \]
Los óxidos de nitrógeno presentan un comportamiento extensivo de oxidación-reducción. El óxido nitroso se asemeja al oxígeno en su comportamiento cuando se calienta con sustancias combustibles. N 2 O es un agente oxidante fuerte que se descompone cuando se calienta para formar nitrógeno y oxígeno. Debido a que un tercio del gas liberado es oxígeno, el óxido nitroso soporta la combustión mejor que el aire (una quinta parte de oxígeno). Una astilla brillante estalla en llamas cuando se introduce en una botella de este gas. El óxido nítrico actúa tanto como agente oxidante como reductor. Por ejemplo:
\[\textrm{oxidizing agent: }\ce{P4}(s)+\ce{6NO}(g)⟶\ce{P4O6}(s)+\ce{3N2}(g) \nonumber \]
\[\textrm{reducing agent: }\ce{Cl2}(g)+\ce{2NO}(g)⟶\ce{2ClNO}(g) \nonumber \]
El dióxido de nitrógeno (o tetraóxido de dinitrógeno) es un buen agente oxidante. Por ejemplo:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{NO}(g)+\ce{CO2}(g) \nonumber \]
\[\ce{NO2}(g)+\ce{2HCl}(aq)⟶\ce{NO}(g)+\ce{Cl2}(g)+\ce{H2O}(l) \nonumber \]
Resumen
El nitrógeno exhibe estados de oxidación que van de 3− a 5+. Debido a la estabilidad del triple enlace N=N, requiere una gran cantidad de energía para hacer compuestos a partir del nitrógeno molecular. Los metales activos como los metales alcalinos y los metales alcalinotérreos pueden reducir el nitrógeno para formar nitruros metálicos. Los óxidos de nitrógeno y los hidruros de nitrógeno también son sustancias importantes.
Glosario
- Fijación de nitrógeno
- formación de compuestos nitrogenados a partir de nitrógeno molecular


