18.8: Ocurrencia, preparación y propiedades del fósforo
- Page ID
- 75493
- Describir las propiedades, preparación y usos del fósforo
La preparación industrial de fósforo es calentando fosfato de calcio, obtenido de roca de fosfato, con arena y coque:
\[\ce{2Ca3(PO4)2}(s)+\ce{6SiO2}(s)+\ce{10C}(s) \xrightarrow{Δ} \ce{6CaSiO3}(l)+\ce{10CO}(g)+\ce{P4}(g) \nonumber \]
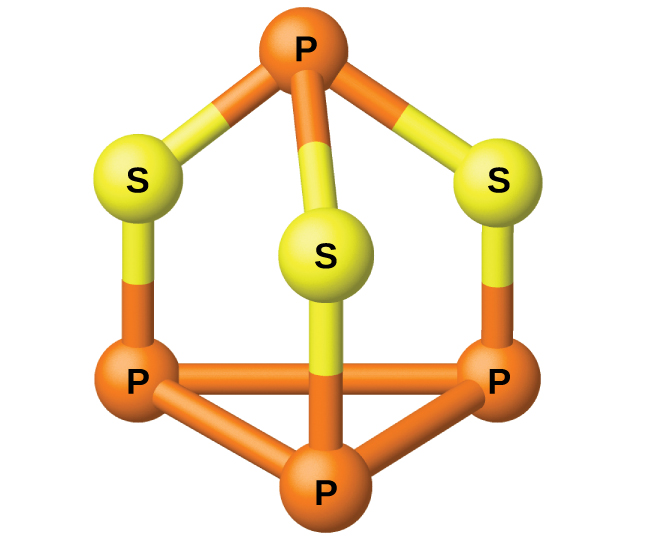
El fósforo se destila fuera del horno y se condensa en un sólido o se quema para formar P 4 O 10. La preparación de muchos otros compuestos de fósforo comienza con P 4 O 10. Los ácidos y fosfatos son útiles como fertilizantes y en la industria química. Otros usos son en la fabricación de aleaciones especiales como el ferrofósforo y el bronce fosforoso. El fósforo es importante en la fabricación de pesticidas, fósforos y algunos plásticos. El fósforo es un no metal activo. En los compuestos, el fósforo suele ocurrir en estados de oxidación de 3−, 3+ y 5+. El fósforo presenta números de oxidación que son inusuales para un elemento del grupo 15 en compuestos que contienen enlaces fósforo-fósforo; ejemplos incluyen tetrahidruro de difósforo, H 2 P-PH 2, y trisulfuro de tetraposforo, P 4 S 3, ilustrados en la Figura\(\PageIndex{1}\).
Compuestos de oxígeno de fósforo
El fósforo forma dos óxidos comunes, el óxido de fósforo (III) (o hexaóxido de tetraposforo), P 4 O 6, y el óxido de fósforo (V) (o decaóxido de tetraposforo), P 4 O 10, ambos mostrados en la Figura\(\PageIndex{2}\). El óxido de fósforo (III) es un sólido cristalino blanco con olor a ajo. Su vapor es muy venenoso. Se oxida lentamente en el aire y se inflama cuando se calienta a 70 °C, formando P 4 O 10. El óxido de fósforo (III) se disuelve lentamente en agua fría para formar ácido fosforoso, H 3 PO 3.
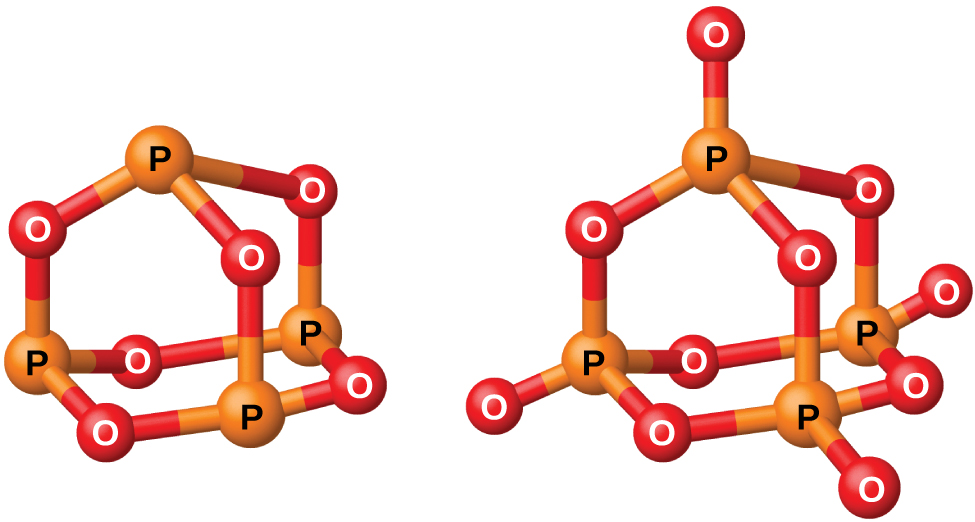
El óxido de fósforo (V), P 4 O 10, es un polvo blanco que se prepara quemando fósforo en exceso de oxígeno. Su entalpía de formación es muy alta (−2984 kJ), y es bastante estable y un agente oxidante muy pobre. Dejar caer P 4 O 10 en el agua produce un silbido, calor y ácido ortofosfórico:
\[\ce{P4O10}(s)+\ce{6H2O}(l)⟶\ce{4H3PO4}(aq) \nonumber \]
Debido a su gran afinidad por el agua, el óxido de fósforo (V) es un excelente agente de secado para gases y disolventes, y para eliminar el agua de muchos compuestos.
Compuestos halógenos de fósforo
El fósforo reaccionará directamente con los halógenos, formando trihaluros, PX 3, y pentahalidos, PX 5. Los trihaluros son mucho más estables que los correspondientes trihaluros de nitrógeno; los pentahalidos de nitrógeno no se forman debido a la incapacidad del nitrógeno para formar más de cuatro enlaces.
Los cloruros PCl 3 y PCl 5, ambos mostrados en la Figura\(\PageIndex{3}\), son los haluros de fósforo más importantes. El tricloruro de fósforo es un líquido incoloro que se prepara pasando cloro sobre fósforo fundido. El pentacloruro de fósforo es un sólido blanquecino que se prepara oxidando el tricloruro con exceso de cloro. El pentacloruro se sublima cuando se calienta y forma un equilibrio con el tricloruro y el cloro cuando se calienta.
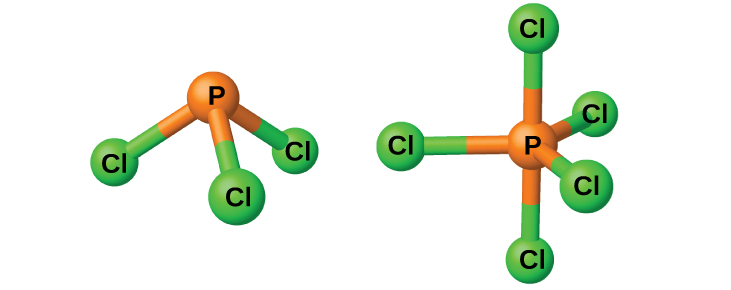
Como la mayoría de los otros haluros no metálicos, ambos cloruros de fósforo reaccionan con un exceso de agua y producen cloruro de hidrógeno y un oxiácido: PCl 3 produce ácido fosforoso H 3 PO 3 y PCl 5 produce ácido fosfórico, H 3 PO 4.
Las pentahalidas de fósforo son ácidos de Lewis debido a la valencia vacía d orbitales del fósforo. Estos compuestos reaccionan fácilmente con iones haluro (bases de Lewis) para dar el anión\(\ce{PX6-}\). Mientras que el pentafluoruro de fósforo es un compuesto molecular en todos los estados, los estudios de rayos X muestran que el pentacloruro de fósforo sólido es un compuesto iónico\(\ce{[PCl4+][PCl6- ]}\), al igual que la pentabromida de fósforo,\(\ce{[PBr4+]}\) [Br −] y el pentaiodido de fósforo,\(\ce{[PI4+]}\) [I −].
Resumen
El fósforo (grupo 15) comúnmente exhibe estados de oxidación de 3− con metales activos y de 3+ y 5+ con no metales más electronegativos. Los halógenos y el oxígeno oxidarán el fósforo. Los óxidos son óxido de fósforo (V), P 4 O 10, y óxido de fósforo (III), P 4 O 6. Los dos métodos comunes para preparar ácido ortofosfórico, H 3 PO 4, son la reacción de un fosfato con ácido sulfúrico o la reacción de agua con óxido de fósforo (V). El ácido ortofosfórico es un ácido triprótico que forma tres tipos de sales.


