18.11: Ocurrencia, preparación y propiedades de halógenos
- Page ID
- 75406
- Describir la preparación, las propiedades y los usos de los halógenos
- Describir las propiedades, preparación y usos de los compuestos halógenos
Los elementos en el grupo 17 son los halógenos. Estos son los elementos flúor, cloro, bromo, yodo y astatina. Estos elementos son demasiado reactivos para ocurrir libremente en la naturaleza, pero sus compuestos están ampliamente distribuidos. Los cloruros son los más abundantes; aunque los fluoruros, bromuros y yoduros son menos comunes, están razonablemente disponibles. En esta sección, examinaremos la ocurrencia, preparación y propiedades de los halógenos. A continuación, examinaremos los compuestos halógenos con los metales representativos seguido de un examen de los interhalógenos. Esta sección concluirá con algunas aplicaciones de halógenos.
Ocurrencia y preparación
Todos los halógenos se encuentran en el agua de mar como iones haluro. La concentración del ion cloruro es 0.54 M; la de los otros haluros es menor a 10 —4 M. El fluoruro también se presenta en minerales como CaF 2, Ca (PO 4) 3 F y Na 3 AlF 6. El cloruro también se encuentra en el Gran Lago Salado y el Mar Muerto, y en extensos lechos de sal que contienen NaCl, KCl o MgCl 2. Parte del cloro en tu cuerpo está presente como ácido clorhídrico, que es un componente del ácido estomacal. Los compuestos de bromo ocurren en el Mar Muerto y salmueras subterráneas. Los compuestos de yodo se encuentran en pequeñas cantidades en salitre de Chile, salmueras subterráneas y algas marinas. El yodo es esencial para la función de la glándula tiroides.
Las mejores fuentes de halógenos (excepto yodo) son las sales de haluro. Es posible oxidar los iones haluro para liberar moléculas halógenas diatómicas por diversos métodos, dependiendo de la facilidad de oxidación del ion haluro. El fluoruro es el más difícil de oxidar, mientras que el yoduro es el más fácil.
El principal método para preparar flúor es la oxidación electrolítica. El procedimiento de electrólisis más común es usar una mezcla fundida de fluoruro de hidrógeno y potasio, KHF 2 y fluoruro de hidrógeno anhidro. La electrólisis hace que el HF se descomponga, formando gas flúor en el ánodo e hidrógeno en el cátodo. Es necesario mantener los dos gases separados para evitar su recombinación explosiva para reformar el fluoruro de hidrógeno.
La mayor parte del cloro comercial proviene de la electrólisis del ion cloruro en soluciones acuosas de cloruro de sodio; este es el proceso cloro-álcali discutido anteriormente. El cloro también es un producto de la producción electrolítica de metales como sodio, calcio y magnesio a partir de sus cloruros fundidos. También es posible preparar cloro mediante la oxidación química del ion cloruro en solución ácida con agentes oxidantes fuertes como el dióxido de manganeso (\(\ce{MnO2}\)) o el dicromato de sodio (\(\ce{Na2Cr2O7}\)). La reacción con el dióxido de manganeso es:
\[\ce{MnO}_{2(s)}+\ce{2Cl^-}_{(aq)}+\ce{4H_3O^+}_{(aq)}⟶\ce{Mn}^{2+}_{(aq)}+\ce{Cl}_{2(g)}+\ce{6H_2O}_{(l)}\nonumber \]
La preparación comercial de bromo implica la oxidación del ion bromuro por cloro:
\[\ce{2Br^-}_{(aq)}+\ce{Cl}_{2(g)}⟶\ce{Br}_{2(l)}+\ce{2Cl^-}_{(aq)} \nonumber \]
El cloro es un agente oxidante más fuerte que el bromo. Este método es importante para la producción de esencialmente todo el bromo doméstico.
Algo de yodo proviene de la oxidación del cloruro de yodo\(\ce{ICl}\), o ácido yódico,\(\ce{HlO_3}\). La preparación comercial de yodo utiliza la reducción de yodato de sodio\(\ce{NaIO_3}\), una impureza en depósitos de salitre de Chile, con hidrógeno sulfito de sodio:
\[\ce{2IO^-}_{3(aq)}+\ce{5HSO^-}_{3(aq)}⟶\ce{3HSO^-}_{4(aq)}+\ce{2SO^{2-}}_{4(aq)}+\ce{H_2O}_{(l)}+\ce{I}_{2(s)} \nonumber \]
Propiedades de los halógenos
El flúor es un gas amarillo pálido, el cloro es un gas amarillo verdoso, el bromo es un líquido marrón rojizo profundo y el yodo es un sólido cristalino de color negro grisáceo. El bromo líquido tiene una alta presión de vapor, y el vapor rojizo es fácilmente visible en la Figura\(\PageIndex{1}\). Los cristales de yodo tienen una presión de vapor notable. Cuando se calientan suavemente, estos cristales subliman y forman un hermoso vapor violeta profundo.

El bromo es solo ligeramente soluble en agua, pero es miscible en todas las proporciones en disolventes menos polares (o no polares) como cloroformo, tetracloruro de carbono y disulfuro de carbono, formando soluciones que varían de amarillo a marrón rojizo, dependiendo de la concentración.
El yodo es soluble en cloroformo, tetracloruro de carbono, disulfuro de carbono y muchos hidrocarburos, dando soluciones violetas de I 2 moléculas. El yodo se disuelve solo ligeramente en agua, dando soluciones marrones. Es bastante soluble en soluciones acuosas de yoduros, con lo que forma soluciones marrones. Estas soluciones marrones resultan porque las moléculas de yodo tienen valencia vacía d orbitales y pueden actuar como ácidos de Lewis débiles hacia el ión yoduro. La ecuación para la reacción reversible del yodo (ácido de Lewis) con el ión yoduro (base de Lewis) para formar el ion triyoduro,\(\ce{I3-}\), es:
\[\ce{I}_{2(s)}+\ce{I^-}_{(aq)}⟶\ce{I^-}_{3(aq)} \label{4} \]
Cuanto más fácil es oxidar el ion haluro, más difícil es para el halógeno actuar como agente oxidante. El flúor generalmente oxida un elemento a su estado de oxidación más alto, mientras que los halógenos más pesados pueden no hacerlo. Por ejemplo, cuando el exceso de flúor reacciona con el azufre, se\(\ce{SF_6}\) forma. El cloro da\(\ce{SCl_2}\) y bromo,\(\ce{S_2Br_2}\). El yodo no reacciona con el azufre.
El flúor es el agente oxidante más potente de los elementos conocidos. Oxida espontáneamente la mayoría de los demás elementos; por lo tanto, la reacción inversa, la oxidación de fluoruros, es muy difícil de lograr. El flúor reacciona directamente y forma fluoruros binarios con todos los elementos excepto los gases nobles más ligeros (He, Ne y Ar). El flúor es un agente oxidante tan fuerte que muchas sustancias se encienden al contacto con él. Las gotas de agua se inflaman en flúor y forman\(\ce{O_2}\)\(\ce{OF_2}\),\(\ce{H_2O_2}\),\(\ce{O_3}\), y\(\ce{HF}\). La madera y el amianto se encienden y se queman en gas flúor. La mayoría de los metales calientes se queman vigorosamente en flúor. Sin embargo, es posible manejar flúor en recipientes de cobre, hierro o níquel porque una película adherente de la sal de fluoruro pasiva sus superficies. El flúor es el único elemento que reacciona directamente con el gas noble xenón.
Aunque es un agente oxidante fuerte, el cloro es menos activo que el flúor. Mezclar cloro e hidrógeno en la oscuridad hace que la reacción entre ellos sea imperceptiblemente lenta. La exposición de la mezcla a la luz hace que los dos reaccionen explosivamente. El cloro también es menos activo hacia los metales que el flúor, y las reacciones de oxidación generalmente requieren temperaturas más altas. El sodio fundido se enciende en cloro. El cloro ataca a la mayoría de los no metales (C, N2 y O2 son excepciones notables), formando compuestos moleculares covalentes. El cloro generalmente reacciona con compuestos que contienen solo carbono e hidrógeno (hidrocarburos) mediante la adición a múltiples enlaces o por sustitución.
En agua fría, el cloro sufre una reacción de desproporción:
\[\ce{Cl}_{2(aq)}+\ce{2H_2O}_{(l)}⟶\ce{HOCl}_{(aq)}+\ce{H_3O^+}_{(aq)}+\ce{Cl^-}_{(aq)} \nonumber \]
La mitad de los átomos de cloro se oxidan al estado de oxidación 1+ (ácido hipocloroso), y la otra mitad se reduce al estado de oxidación 1− (ion cloruro). Esta desproporción es incompleta, por lo que el agua con cloro es una mezcla de equilibrio de moléculas de cloro, moléculas de ácido hipocloroso, iones hidronio e iones cloruro. Cuando se expone a la luz, esta solución experimenta una descomposición fotoquímica:
\[\ce{2HOCl}_{(aq)}+\ce{2H_2O}_{(l)}\xrightarrow{\ce{sunlight}} \ce{2H_3O^+}_{(aq)}+\ce{2Cl^-}_{(aq)}+\ce{O}_{2(g)} \nonumber \]
El cloro no metálico es más electronegativo que cualquier otro elemento excepto flúor, oxígeno y nitrógeno. En general, los elementos muy electronegativos son buenos agentes oxidantes; por lo tanto, esperaríamos que el cloro elemental oxidara todos los demás elementos excepto estos tres (y los gases nobles no reactivos). Su propiedad oxidante, de hecho, es responsable de su uso principal. Por ejemplo, el cloruro de fósforo (V), un intermedio importante en la preparación de insecticidas y armas químicas, se fabrica oxidando el fósforo con cloro:
\[\ce{P}_{4(s)}+\ce{10Cl}_{2(g)}⟶\ce{4PCl}_{5(l)} \nonumber \]
Una gran cantidad de cloro también se utiliza para oxidar, y así destruir, materiales orgánicos o biológicos en la purificación del agua y en el blanqueo.
Las propiedades químicas del bromo son similares a las del cloro, aunque el bromo es el agente oxidante más débil y su reactividad es menor que la del cloro.
El yodo es el menos reactivo de los halógenos. Es el agente oxidante más débil, y el ion yoduro es el ion haluro más fácilmente oxidado. El yodo reacciona con los metales, pero a menudo se requiere calentamiento. No oxida otros iones haluro.
Comparado con los otros halógenos, el yodo reacciona solo ligeramente con el agua. Las trazas de yodo en el agua reaccionan con una mezcla de almidón e ión yoduro, formando un color azul profundo. Esta reacción es una prueba muy sensible para la presencia de yodo en el agua.
Halouros de los Metales Representativos
Se han preparado miles de sales de los metales representativos. Los haluros binarios son una subclase importante de sales. Una sal es un compuesto iónico compuesto por cationes y aniones, distintos de los iones hidróxido u óxido. En general, es posible preparar estas sales a partir de los metales o a partir de óxidos, hidróxidos o carbonatos. Ilustraremos los tipos generales de reacciones para la preparación de sales a través de reacciones utilizadas para preparar haluros binarios.
Los compuestos binarios de un metal con los halógenos son los haluros. La mayoría de los haluros binarios son iónicos. Sin embargo, el mercurio, los elementos del grupo 13 con estados de oxidación 3+, estaño (IV) y plomo (IV) forman haluros binarios covalentes. La reacción directa de un metal y un halógeno producen el haluro del metal. Ejemplos de estas reacciones de oxidación-reducción incluyen:
\[\ce{Cd}_{(s)}+\ce{Cl}_{2(g)}⟶\ce{CdCl}_{2(s)} \nonumber \]
\[\ce{2Ga}_{(l)}+\ce{3Br}_{2(l)}⟶\ce{2GaBr}_{3(s)} \nonumber \]
Video\(\PageIndex{1}\): Las reacciones de los metales alcalinos con halógenos elementales son muy exotérmicas y a menudo bastante violentas. Bajo condiciones controladas, brindan emocionantes demostraciones para estudiantes de química en ciernes. Se puede ver el calentamiento inicial del sodio que elimina el recubrimiento de hidróxido de sodio, peróxido de sodio y aceite mineral residual para exponer la superficie reactiva. La reacción con gas cloro procede entonces muy bien.
Si un metal puede presentar dos estados de oxidación, puede ser necesario controlar la estequiometría para obtener el haluro con el estado de oxidación inferior. Por ejemplo, la preparación de cloruro de estaño (II) requiere una relación 1:1 de Sn a\(\ce{Cl_2}\), mientras que la preparación de cloruro de estaño (IV) requiere una relación 1:2:
\[\ce{Sn}_{(s)}+\ce{Cl}_{2(g)}⟶\ce{SnCl}_{2(s)} \nonumber \]
\[\ce{Sn}_{(s)}+\ce{2Cl}_{2(g)}⟶\ce{SnCl}_{4(l)}\nonumber \]
Los metales representativos activos, aquellos que son más fáciles de oxidar que el hidrógeno, reaccionan con haluros de hidrógeno gaseosos para producir haluros metálicos e hidrógeno. La reacción del zinc con fluoruro de hidrógeno es:
\[\ce{Zn}_{(s)}+\ce{2HF}_{(g)}⟶\ce{ZnF}_{2(s)}+\ce{H}_{2(g)} \nonumber \]
Los metales representativos activos también reaccionan con soluciones de haluros de hidrógeno para formar hidrógeno y soluciones de los haluros correspondientes. Ejemplos de tales reacciones incluyen:
\[\ce{Cd}_{(s)}+\ce{2HBr}_{(aq)}⟶\ce{CdBr}_{2(aq)}+\ce{H}_{2(g)} \nonumber \]
\[\ce{Sn}_{(s)}+\ce{2HI}_{(aq)}⟶\ce{SnI}_{2(aq)}+\ce{H}_{2(g)} \nonumber \]
Hidróxidos, carbonatos y algunos óxidos reaccionan con soluciones de los haluros de hidrógeno para formar soluciones de sales haluros. Es posible preparar sales adicionales mediante la reacción de estos hidróxidos, carbonatos y óxidos con solución acuosa de otros ácidos:
\[\ce{CaCo}_{3(s)}+\ce{2HCl}_{(aq)}⟶\ce{CaCl}_{2(aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \nonumber \]
\[\ce{TlOH}_{(aq)}+\ce{HF}_{(aq)}⟶\ce{TlF}_{(aq)}+\ce{H_2O}_{(l)} \nonumber \]
Algunos haluros y muchas de las otras sales de los metales representativos son insolubles. Es posible preparar estas sales solubles mediante reacciones de metátesis que ocurren cuando se mezclan soluciones de sales solubles (Figura\(\PageIndex{2}\)). Las reacciones de metátesis se examinan en el capítulo sobre la estequiometría de las reacciones químicas.

Varios haluros ocurren en grandes cantidades en la naturaleza. El océano y las salmueras subterráneas contienen muchos haluros. Por ejemplo, el cloruro de magnesio en el océano es la fuente de iones de magnesio utilizados en la producción de magnesio. Grandes depósitos subterráneos de cloruro de sodio, como la mina de sal que se muestra en la Figura\(\PageIndex{3}\), ocurren en muchas partes del mundo. Estos depósitos sirven como fuente de sodio y cloro en casi todos los demás compuestos que contienen estos elementos. El proceso cloro-álcali es un ejemplo.

Interhalógenos
Los compuestos formados a partir de dos o más halógenos diferentes son interhalógenos. Las moléculas interhalógenas consisten en un átomo del halógeno más pesado unido por enlaces simples a un número impar de átomos del halógeno más ligero. Las estructuras de IF 3, IF 5 e IF 7 se ilustran en la Figura Las\(\PageIndex{4}\) fórmulas para otros interhalógenos, cada uno de los cuales proviene de la reacción de los respectivos halógenos, están en la Tabla\(\PageIndex{1}\).
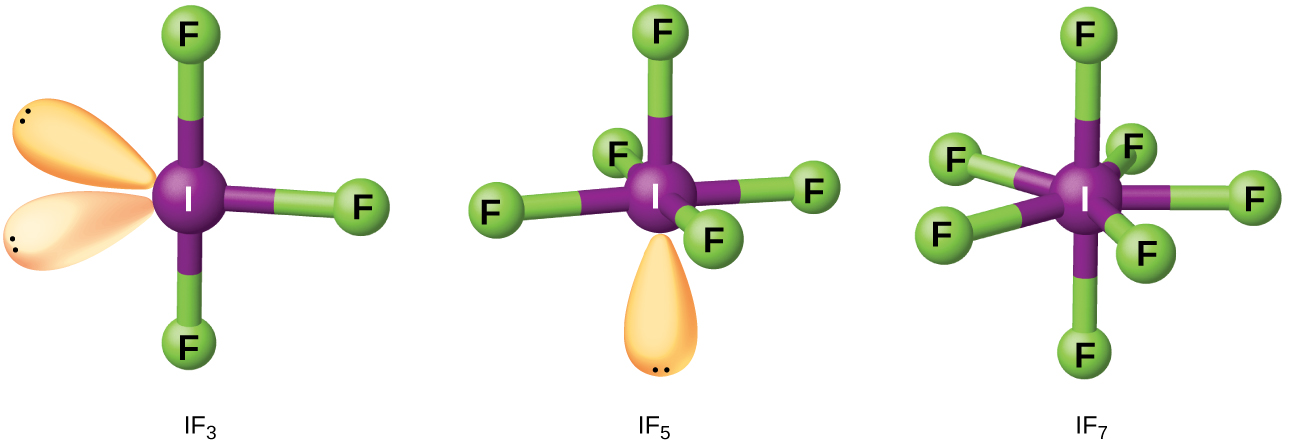
\(\PageIndex{1}\)Obsérvese de la Tabla que el flúor es capaz de oxidar el yodo a su estado máximo de oxidación, 7+, mientras que el bromo y el cloro, que son más difíciles de oxidar, alcanzan solo el estado de oxidación 5+. Un estado de oxidación 7+ es el límite para los halógenos. Debido a que los halógenos más pequeños se agrupan alrededor de uno más grande, el número máximo de átomos más pequeños posible aumenta a medida que aumenta el radio del átomo más grande. Muchos de estos compuestos son inestables y la mayoría son extremadamente reactivos. Los interhalógenos reaccionan como sus haluros componentes; los fluoruros de halógeno, por ejemplo, son agentes oxidantes más fuertes que los cloruros de halógeno.
| YX | YX 3 | YX | YX |
|---|---|---|---|
| BrCl (g) | |||
| BrF (g) | BrF 3 (l) | BrF 5 (l) | |
| CLf (g) | ClF 3 (g) | ClF 5 (g) | |
| iBR (s) | |||
| iCL (l) | iCL 3 (s) | ||
| SI (s) | SI 3 (s) | SI 5 (l) | SI 7 (g) |
Los polihaluros iónicos de los metales alcalinos, tales como KI 3, KiCl 2, KiCl 4, CSiBr 2 y CsBrCl 2, que contienen un anión compuesto por al menos tres átomos de halógeno, están estrechamente relacionados con los interhalógenos. Como se vio anteriormente, la formación del anión polihaluro\(\ce{I_3^-}\) es responsable de la solubilidad del yodo en soluciones acuosas que contienen un ión yoduro.
Aplicaciones
El ion fluoruro y los compuestos de flúor tienen muchos usos importantes. Los compuestos de carbono, hidrógeno y flúor están reemplazando a los freones (compuestos de carbono, cloro y flúor) como refrigerantes. El teflón es un polímero compuesto por unidades —CF 2 CF 2 —. El ion fluoruro se agrega a los suministros de agua y a algunas pastas dentales como SnF 2 o NaF para combatir la caries dental. El fluoruro convierte parcialmente los dientes de Ca 5 (PO 4) 3 (OH) en Ca 5 (PO 4) 3 F.
El cloro es importante para blanquear la pulpa de madera y la tela de algodón. El cloro reacciona con el agua para formar ácido hipocloroso, que oxida las sustancias coloreadas a incoloras. Grandes cantidades de cloro son importantes en la cloración de hidrocarburos (reemplazando hidrógeno por cloro) para producir compuestos como tetracloruro (CCl 4), cloroformo (CHCl 3) y cloruro de etilo (C 2 H 5 Cl), y en la producción de cloruro de polivinilo (PVC) y otros polímeros. El cloro también es importante para matar las bacterias en los suministros de agua de la comunidad.
El bromo es importante en la producción de ciertos colorantes, y los bromuros de sodio y potasio se utilizan como sedantes. En un momento, el bromuro de plata sensible a la luz fue un componente de la película fotográfica.
El yodo en solución de alcohol con yoduro de potasio es un antiséptico (tintura de yodo). Las sales yoduro son esenciales para el buen funcionamiento de la glándula tiroides; una deficiencia de yodo puede conducir al desarrollo de un bocio. La sal de mesa yodada contiene 0.023% de yoduro de potasio. El yoduro de plata es útil en la siembra de nubes para inducir lluvia; fue importante en la producción de película fotográfica y el yodoforme, CHI 3, es un antiséptico.
Resumen
Los halógenos forman haluros con menos elementos electronegativos. Los haluros de los metales varían de iónicos a covalentes; los haluros de los no metales son covalentes. Los interhalógenos se forman por la combinación de dos o más halógenos diferentes. Todos los metales representativos reaccionan directamente con halógenos elementales o con soluciones de los ácidos hidrohalogenados (HF, HCl, HBr e HI) para producir haluros metálicos representativos. Otras preparaciones de laboratorio implican la adición de ácidos hidrohalogenados acuosos a compuestos que contienen tales aniones básicos, como hidróxidos, óxidos o carbonatos.


