18.10: Ocurrencia, preparación y propiedades del azufre
- Page ID
- 75510
- Describir las propiedades, preparación y usos del azufre
El azufre existe en la naturaleza como depósitos elementales, así como sulfuros de hierro, zinc, plomo y cobre, y sulfatos de sodio, calcio, bario y magnesio. El sulfuro de hidrógeno suele ser un componente del gas natural y se presenta en muchos gases volcánicos, como los que se muestran en la Figura\(\PageIndex{1}\). El azufre es un constituyente de muchas proteínas y es esencial para la vida.

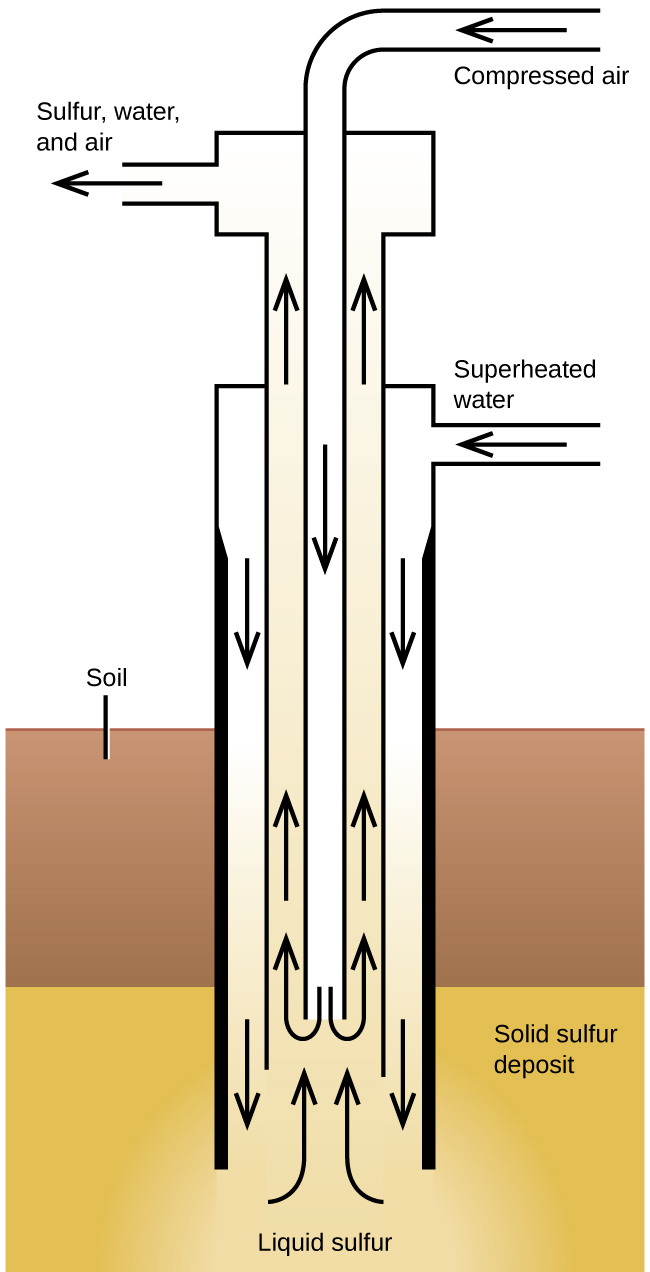
El proceso de Frasch, ilustrado en la Figura\(\PageIndex{2}\), es importante en la extracción de azufre libre de enormes yacimientos subterráneos en Texas y Luisiana. El agua sobrecalentada (170 °C y 10 atm de presión) es forzada a bajar por la parte más externa de las tres tuberías concéntricas hasta el depósito subterráneo. El agua caliente derrite el azufre. La tubería más interna conduce aire comprimido hacia el azufre líquido. El aire obliga al azufre líquido, mezclado con aire, a fluir hacia arriba a través de la tubería de salida. La transferencia de la mezcla a grandes cubas de sedimentación permite que el azufre sólido se separe al enfriarse. Este azufre es 99.5% a 99.9% puro y no requiere purificación para la mayoría de los usos.
Las mayores cantidades de azufre también provienen del sulfuro de hidrógeno recuperado durante la purificación del gas natural.
El azufre existe en varias formas alotrópicas. La forma estable a temperatura ambiente contiene anillos de ocho miembros, por lo que la verdadera fórmula es S 8. Sin embargo, los químicos suelen utilizar S para simplificar los coeficientes en las ecuaciones químicas; seguiremos esta práctica en este libro.
Al igual que el oxígeno, que también es miembro del grupo 16, el azufre exhibe un comportamiento claramente no metálico. Oxida metales, dando una variedad de sulfuros binarios en los que el azufre exhibe un estado de oxidación negativo (2−). El azufre elemental oxida menos no metales electronegativos, y los no metales más electronegativos, como el oxígeno y los halógenos, lo oxidarán. Otros agentes oxidantes fuertes también oxidan el azufre. Por ejemplo, el ácido nítrico concentrado oxida el azufre al ion sulfato, con la formación concurrente de óxido de nitrógeno (IV):
\[\ce{S}(s)+\ce{6HNO3}(aq)⟶\ce{2H3O+}(aq)+\ce{SO4^2-}(aq)+\ce{6NO2}(g) \nonumber \]
La química del azufre con un estado de oxidación de 2− es similar a la del oxígeno. A diferencia del oxígeno, sin embargo, el azufre forma muchos compuestos en los que exhibe estados de oxidación positivos.
Resumen
El azufre (grupo 16) reacciona con casi todos los metales y forma fácilmente el ion sulfuro, S 2−, en el que tiene como estado de oxidación de 2−. El azufre reacciona con la mayoría de los no metales.
Glosario
- Proceso Frasch
- importante en la extracción de azufre libre de enormes yacimientos subterráneos


