1.1: Día 1- Química, Materia, Energía, Modelos
- Page ID
- 78742
1
Día 1: Química, Materia, Energía, Modelos
¡Bienvenido a Química 109!
Si aún no has trabajado a través de la Introducción, hazlo antes de comenzar esta sección.
El trabajo de hoy comienza con una revisión de importantes fundamentos de la química. Esperamos que estés familiarizado con estas ideas y estés listo para usarlas para ayudarte a aprender más química. Luego introducimos ideas fundamentales sobre energía y materia. Estas ideas se repetirán a lo largo de este curso y esperamos que te sirvan bien durante toda tu carrera
D1.1 Sustancias y Reacciones Químicas
Un aspecto fundamental de la química es que las sustancias se transforman en otras sustancias. Un proceso en el que una o más sustancias se transforman en una o más sustancias diferentes se denomina reacción química. Este curso tiene como objetivo mejorar su comprensión de sustancias y reacciones químicas. Para una sustancia específica, ¿qué propiedades puedes esperar? Dadas una o dos sustancias, ¿es probable una reacción? Cuando ocurre una reacción, ¿qué nuevas sustancias se forman? ¿Cómo se relaciona la energía con las reacciones químicas? ¿Podemos fabricar nuevas sustancias que tengan propiedades que queramos (como aliviar enfermedades)? La capacidad para responder a tales preguntas es valiosa en una amplia gama de campos, desde la física hasta la farmacia.
Actividad 1: Reacciones Químicas
Aquí hay videos de algunas reacciones químicas. Observe cuidadosamente cada reacción y anote sus observaciones.
Reacción de cobre con aire y de óxido de cobre con hidrógeno:
https://mediaspace.wisc.edu/id/1_ly43nvus
Reacción de solución acuosa de nitrato de plomo con solución de yoduro de potasio:https://mediaspace.wisc.edu/id/1_init9r1n
Reacciones de Li, Na y K con aire y de Li, Na, K, Rb y Cs con agua:https://mediaspace.wisc.edu/id/1_k9nbvl8a
Por cada reacción química, escribe algunas frases en tu cuaderno de clase describiendo la reacción: ¿Cómo sabes que ocurrió una reacción? ¿Cuáles son las similitudes y diferencias entre las reacciones que observaste? ¿Cómo afectan la temperatura y otras variables a las reacciones?Decir que una sustancia se transforma en otra no es muy preciso sin una definición de lo que es una sustancia. En química, una sustancia es materia que, cuando se purifica, tiene propiedades y composición específicas, características. Por ejemplo, todas las muestras de cobre puro tienen una superficie naranja brillante; todas conducen la electricidad igualmente bien; todas reaccionan con aire seco para producir una sustancia negra; y todas consisten únicamente en cobre. La American Chemical Society actualmente enumera más de 160 millones de sustancias químicas en una base de datos. Cada día se sintetizan nuevas sustancias.
Debido a que hay tantas sustancias químicas, es útil desarrollar categorías y clasificaciones para ayudar a guiar nuestro pensamiento. Lo más importante es que las sustancias químicas están compuestas por sólo unos pocos elementos químicos (118 de los cuales han sido descubiertos hasta el momento). Un elemento químico es una sustancia que no se puede cambiar por reacción química en dos o más sustancias diferentes. Los elementos se combinan para formar compuestos químicos, sustancias que pueden descomponerse por reacciones químicas en dos o más sustancias nuevas. Si sabes algo sobre los elementos químicos y cómo se combinan para formar compuestos químicos, puedes predecir las propiedades de una amplia gama de sustancias y a menudo predecir qué sustancias son susceptibles de reaccionar para formar qué productos.
Otra clasificación útil es dividir los elementos en metales y no metales. Los metales conducen la electricidad como sólidos y líquidos, tienen superficies brillantes cuando están puros, pueden golpearse en diferentes formas y estirarse en cables, y conducir bien el calor. Los no metales tienen una conductividad eléctrica muy pequeña y tienen una amplia gama de otras propiedades. Seis elementos, los metaloides, tienen propiedades intermedias entre metales y no metales.
Las reacciones químicas y las clasificaciones de sustancias discutidas hasta el momento se basan en lo que se denomina observaciones macroscópicas. Macroscópico se refiere a cosas lo suficientemente grandes como para ser vistas y manipuladas en un laboratorio (o en cualquier otro lugar). Mejorar tu comprensión del mundo macroscópico es un objetivo de este curso.
D1.2 Átomos, Moléculas e Iones
Un aspecto fundamental diferente de la química es que podemos comprender mejor los elementos, compuestos y reacciones si construimos modelos basados en partículas diminutas que están constantemente en movimiento: átomos y moléculas.
Un átomo es la partícula más pequeña de un elemento que tiene las propiedades químicas de ese elemento. Los átomos son extremadamente pequeños, con tamaños del orden de 100pm a 350pm (1 pm = 10 −12 m). Lo más pequeño discernible con el microscopio óptico más potente es más de 1000 veces más grande que un átomo. Una molécula es dos o más átomos conectados por enlaces químicos. La escala atómica o escala submicroscópica se refiere a cosas aproximadamente del mismo tamaño que los átomos y las moléculas. Los químicos construyen modelos a escala atómica para interpretar y predecir fenómenos macroscópicos. Por ejemplo, muchas sustancias consisten en moléculas; las propiedades de estas sustancias moleculares se pueden predecir si sabemos qué átomos componen sus moléculas y cómo están dispuestos esos átomos.
Los átomos contienen tres tipos de partículas: protones, neutrones y electrones. Los átomos se identifican por el número de protones en el núcleo, el número atómico. Los protones están cargados positivamente. Los neutrones no tienen carga eléctrica. Los electrones tienen carga negativa con la misma magnitud que la carga positiva de un protón. Los protones y neutrones tienen una masa mucho mayor que los electrones y se encuentran en el núcleo, un volumen muy pequeño en el centro de un átomo que contiene la mayor parte de la masa del átomo. Los electrones, que constituyen menos de 1/1000 la masa de un átomo ocupan 99.99999999999% del espacio que ocupa el átomo. Cuando ocurre una reacción química, los átomos permanecen sin cambios, excepto que algunos electrones en la parte externa de un átomo pueden transferirse a la parte externa de otro átomo. Antes y después de cualquier reacción química está presente el mismo número de átomos de cada tipo; esto se conoce como la ley de conservación de la materia. Cuando el cobre metálico reaccionó con oxígeno del aire para formar óxido de cobre en el primer video de la Actividad 1, el óxido de cobre incluyó todos los átomos de cobre que originalmente estaban en el cobre que reaccionó. Cuando el hidrógeno reaccionó con el óxido de cobre, esos átomos de cobre permanecieron en la superficie como cobre metálico.
Los iones se pueden formar a partir de átomos o moléculas. Un ion es un átomo o molécula que ha ganado o perdido uno o más electrones y por lo tanto tiene una carga eléctrica negativa o positiva. Por ejemplo, cuando el cobre reacciona con el oxígeno, el producto consiste en iones de cobre (II) e iones de óxido. En un ion cobre (II) un átomo de Cu ha perdido dos electrones para formar un ion con dos unidades de exceso de carga positiva, Cu 2 +; en un ion óxido un átomo de O ha ganado dos electrones para formar un ion con dos unidades de exceso de carga negativa, O 2−. Cuando una molécula gana o pierde electrones, se forman iones poliatómicos: la molécula NO 2 forma tanto un ion positivo, NO 2 + como un ion negativo, NO 2 −, por pérdida y ganancia de un electrón.
D1.3 Símbolos Químicos, Fórmulas y Ecuaciones
Es conveniente tratar con propiedades macroscópicas y modelos a escala atómica definiendo símbolos para representar elementos, compuestos, átomos, moléculas y estructuras. Por ejemplo, el símbolo Li puede representar el elemento litio o puede representar un átomo de litio. Cuando Li se usa para representar el elemento, debe traer a la mente diversas propiedades: Li es un metal que se puede cortar con un cuchillo; Li reacciona bastante rápido con el aire; Li reacciona vigorosamente con el agua. Cuando Li se usa para representar un átomo de litio, podemos usar números para indicar cuántos átomos de Li están presentes. Por ejemplo, 2 Li representa dos átomos de litio. En Li 2 O, la fórmula para una sustancia que se forma cuando el litio reacciona con el oxígeno, el subíndice “2” indica que hay dos átomos de Li por cada átomo de O. Li 2 O también representa la sustancia macroscópica óxido de litio, que tiene propiedades específicas incluyendo alto punto de fusión (1438 °C) y alta solubilidad en agua.
Los símbolos también pueden representar reacciones químicas. Cuando el litio reacciona con el agua, la ecuación química es
2 Li (s) + 2 H 2 O (l) → H 2 (g) + 2 LiOH (aq)
Las letras entre paréntesis (s, l, g y aq) indican que el litio, el agua, el hidrógeno y el hidróxido de litio son sólidos, líquidos, gaseosos y una solución acuosa. Los símbolos y fórmulas químicas indican que el litio y el agua son reactivos y que la solución de hidrógeno e hidróxido de litio son productos. Los coeficientes indican cuánto de cada reactivo reacciona y cuánto forma de cada producto. Las cantidades pueden expresarse en la escala atómica como dos átomos de litio que reaccionan con dos moléculas de agua para dar una molécula de hidrógeno y dos iones de litio y dos iones hidróxido en solución. (El hidróxido de litio consiste en iones de litio, cada uno con una unidad de carga positiva, e iones hidróxido, cada uno con una unidad de carga negativa). Las cantidades pueden ser escaladas por un factor de 6.02214076 × 10 23 (número de Avogadro) y la ecuación dice que dos moles de litio sólido reaccionan con 2 moles de agua líquida para dar un mol de hidrógeno gaseoso y dos moles de hidróxido de litio disueltos en agua.
Para las moléculas, el simbolismo puede indicar qué átomos están unidos a qué otros átomos, qué tipos de enlaces están presentes y cómo están dispuestos los átomos en el espacio tridimensional. Estas estructuras ilustran algunas de las posibilidades:
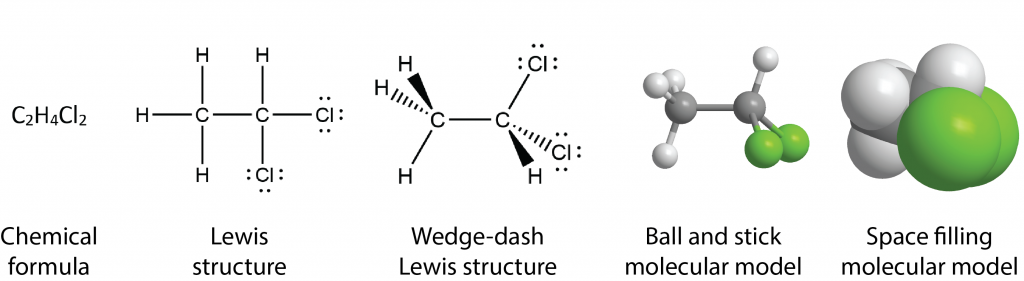
La fórmula química dice solo el número de cada tipo de átomo en la molécula. La estructura de Lewis indica qué átomos están unidos a cuáles. La estructura cuna-guión indica que la molécula es tridimensional, lo que se muestra más claramente en el modelo de bola y varilla. (Para ver y manipular un modelo tridimensional de bola y palo, haga clic aquí.) Finalmente, en el modelo de relleno de espacios se muestran los tamaños de todos los átomos y la molécula como un todo; es evidente que un átomo de cloro es mayor que un átomo de carbono, que es mayor que un átomo de hidrógeno. Los dos últimos modelos son más pictóricos que simbólicos, pero siguen siendo representaciones de algo que no podemos ver. Ninguna de estas representaciones es la propia molécula; todas proporcionan información útil sobre sus propiedades.
Los químicos utilizan representaciones como estas todo el tiempo y se mueven sin esfuerzo de una a otra a medida que piensan en moléculas. Algo de imaginación y mucha experiencia utilizando estas representaciones simbólicas te permitirán hacer predicciones sobre las propiedades de las sustancias y las reacciones químicas.
D1.4 La Tabla Periódica
Como viste en los videos de la Actividad 1, los elementos Li, Na, K, Rb y Cs tienen propiedades similares y reaccionan con el aire y el agua de manera similar. Además, todos estos elementos reaccionan con flúor, cloro, bromo y yodo para formar compuestos similares: LiF, NaF, KF, RbF, CsF, LiCl, NaCl etc. (Estos compuestos se denominan colectivamente “sales” porque sus propiedades son similares a las de la sal de mesa, NaCl.) En este video se muestra la reacción de Na (s) con Cl 2 (g) para formar NaCl (s).
https://mediaspace.wisc.edu/id/1_zygntgnp
Los elementos Li, Na, K, Rb y Cs se denominan metales alcalinos. Los elementos F, Cl, Br e I se denominan halógenos. (“Halógeno” proviene del griego hals, halo —” sal”. ) Todos los halógenos consisten en moléculas diatómicas, como Cl 2. Otro grupo de elementos, Be, Mg, Ca, Sr y Ba también tienen propiedades físicas similares, reaccionan con aire y agua (pero más lentamente que los metales alcalinos), y reaccionan con halógenos para formar compuestos con fórmulas como BeF 2, BeCl 2, MgCl 2, etc. Be, Mg, Ca, Sr, y Los Ba son conocidos como metales alcalinotérreos o alcalinotérreos. Justo antes del cambio del siglo XX, los químicos descubrieron otro grupo de elementos similares: He, Ne, Ar, Kr y Xe. Todos son gases que casi no sufren reacciones químicas, por lo que He, Ne, Ar, Kr y Xe se llaman gases nobles. (Un significado de “noble” es “no reactivo”.)
Aquí hay una lista de los primeros veinte elementos en orden de aumento del número atómico:
H Él Li Ser B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
Los gases nobles, los metales alcalinos, los metales alcalinotérreos y los halógenos están codificados por colores. Observe que los colores se repiten periódicamente, cada ocho elementos. Hace unos 150 años, el químico ruso Dmitri Mendeleev reconoció esta periodicidad y creó una tabla con filas horizontales de elementos en orden de peso atómico y grupos de elementos similares en columnas verticales. Desde la época de Mendeleev se han descubierto muchos más elementos: hay 118 en la tabla periódica moderna a continuación. Pero se mantiene la idea de filas (periodos) a través de las cuales varían las propiedades de los elementos y columnas (grupos) de elementos con propiedades similares.
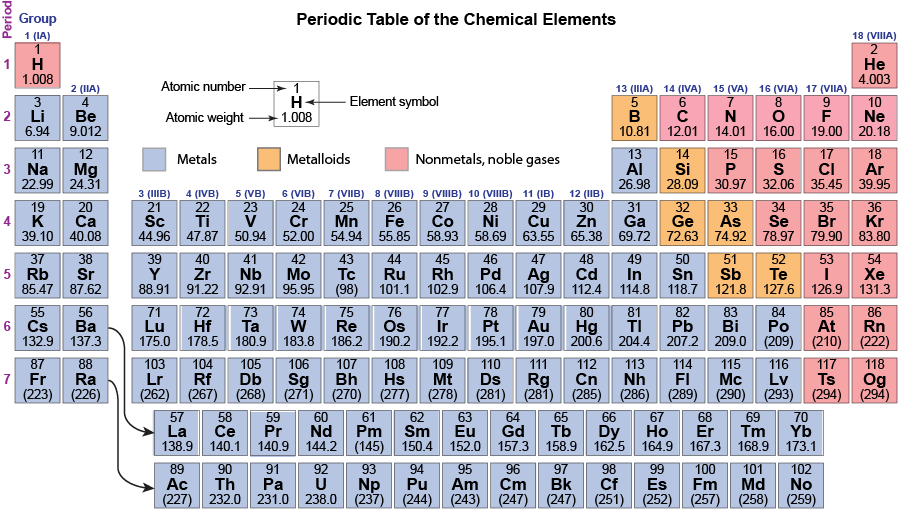
Cada grupo (columna) se identifica por dos números. El grupo de metales alcalinos es el grupo 1 o IA; el grupo alcalinotérreo es el grupo 2 o IIA; el grupo halógeno es el grupo 17 o VIIA; y el grupo de gases nobles es el grupo 18 o VIIIA. El primer número es designado por la Unión Internacional de Química Pura y Aplicada; el segundo es más utilizado en Estados Unidos.
Abajo del lado izquierdo de la tabla, los periodos (filas) se numeran del 1 al 7. El primer periodo contiene sólo dos elementos; el segundo y tercer periodos contienen ocho elementos cada uno; los periodos cuarto y quinto contienen cada uno 18 elementos; y los periodos sexto y séptimo contienen 32 elementos. (Algunos elementos en estos dos últimos periodos se han movido al fondo de la tabla para que pueda caber en una página impresa y ser lo suficientemente grande como para leerlo. Las flechas curvas muestran dónde deben encajar estos elementos.)
La tabla está codificada por colores para indicar si un elemento es un metal, un metaloide o un no metal. Los metales conducen electricidad, tienen superficies lustrosas cuando están puros, se combinan con otros metales para formar aleaciones, y son maleables y dúctiles. La conductividad eléctrica de los metales aumenta a medida que disminuye la temperatura. Los no metales son aislantes eléctricos, generalmente son frágiles como sólidos pero pueden ser líquidos o gases a temperatura ambiente, y se combinan con otros no metales formando enlaces covalentes. Los metaloides son intermedios entre metales y no metales, los metaloides tienen menor conductividad eléctrica que los metales pero su conductividad aumenta a medida que aumenta la temperatura.
La mayoría de los elementos son metales (la gran área azul-gris); solo 20 elementos son no metales y seis son metaloides. Observe que algunos grupos, como los grupos 14 (IVA) y 15 (VA) contienen no metales, metaloides y metales. Esto significa que las propiedades (conductividad eléctrica, por ejemplo) de algunos elementos en estos grupos son significativamente diferentes de las propiedades de otros elementos del grupo; es decir, en algunos grupos los elementos no son tan similares entre sí como en el grupo de los metales alcalinos. En todos los grupos, sin embargo, las fórmulas de los compuestos son similares. Por ejemplo, en el grupo 14 (IVA), todos los elementos forman óxidos con fórmulas XO 2: CO 2, SiO 2, GeO 2, SnO 2 y PbO 2. (Fl, flerovium, se ha formado en cantidades de solo unos pocos átomos en un acelerador de partículas, por lo que la fórmula de su óxido no se ha determinado experimentalmente).
La similitud de fórmulas químicas para elementos en un mismo grupo periódico implica valencia, el poder combinador de un átomo. Por ejemplo, el sodio tiene una valencia de 1 y también el cloro; por lo tanto, el sodio y el cloro forman el compuesto NaCl en el que los átomos de sodio y los átomos de cloro se combinan en una proporción 1:1. El oxígeno tiene una valencia de 2; por lo tanto, la fórmula para el óxido de sodio es Na 2 O; se necesitan dos átomos de sodio de valencia 1 para satisfacer la valencia de oxígeno de 2. A partir de esto se debe poder predecir que la valencia de C (o Si, Ge, Sn o Pb) es 4 porque la fórmula del dióxido de carbono es CO 2.
D1.5 Materia, Energía, Modelos
En este curso se te pedirá examinar datos y sacar conclusiones, explicar fenómenos aplicando principios básicos, y construir modelos a partir de los cuales puedas predecir propiedades físicas y químicas. Dos ideas importantes e interconectadas son fundamentales:
- La disposición espacial de las partículas de nivel atómico (estructura) puede predecir propiedades macroscópicas y reactividad química;
- Las energías de las partículas de nivel atómico se pueden utilizar para explicar las estructuras de nivel atómico y los cambios de energía macroscópicos.
Las partículas a escala atómica adoptan estructuras con energía mínima, a menos que se transfiera energía a ellas desde una fuente externa. Por lo tanto, es útil poder calcular cuantitativamente o predecir cualitativamente si una situación tiene mayor o menor energía que otra. La química a menudo involucra partículas a escala atómica cargadas eléctricamente, como protones, electrones o iones. La energía potencial de dos cargas eléctricas puntuales (cargas que ocupan un solo punto geométrico) se puede calcular usando una ecuación derivada de la ley de Coulomb:
\[E_{\text{p}} = k_e\dfrac{Q_1Q_2}{r} \nonumber \]
En esta ecuación k e es una constante de proporcionalidad igual a 8.99 × 10 9 J m C −2, Q 1 y Q 2 son valores de carga eléctrica, y r es la distancia entre las cargas. Así, la magnitud de la energía potencial de dos partículas cargadas es proporcional al tamaño de cada carga y es inversamente proporcional a la distancia entre las cargas. La energía es positiva si las cargas de las dos partículas tienen el mismo signo (ambas positivas o ambas negativas). La energía es negativa si las cargas son opuestas; las cargas opuestas se atraen y el resultado es menor energía potencial. La proporcionalidad directa a la carga eléctrica y la proporcionalidad inversa a la distancia permiten predicciones cualitativas: Las cargas opuestas más grandes juntas dan como resultado una menor energía y, por lo tanto, una mayor estabilidad.
Actividad 2: Energía Potencial y Distancia entre Iones
Actividad 3: Evaluar y modificar un modelo
A nivel atómico, las partículas son más estables cuando la energía es mínima. Esto sucede para un ion sodio y un ion cloruro cuando los iones están separados 276pm (punto más bajo en la curva azul en la Actividad 3). Curvas como esta pueden usarse para describir fuerzas atractivas entre átomos, moléculas o iones. Las partículas se atraen entre sí por lo que su energía potencial disminuye a medida que se acercan, pero eventualmente hay fuerzas repulsivas que les impiden estar en el mismo lugar al mismo tiempo. El equilibrio de estas fuerzas da como resultado una curva con un mínimo a cierta distancia de separación. La profundidad del mínimo indica qué tan fuerte atraen las partículas.
D 1.6 Estructura, Energía y Estados de la Materia
La idea de que las partículas a escala atómica se atraen entre sí y adoptan una disposición de baja energía a menos que se suministre energía desde una fuente externa se puede aplicar a los cambios de sólido a líquido a gas.
La teoría cinético-molecular establece que las partículas de nivel atómico están en constante movimiento aleatorio. La rapidez con que se mueven las partículas depende de la temperatura. A medida que aumenta la temperatura aumenta la velocidad promedio de las partículas; de ahí que sus energías cinéticas también aumenten. El promedio de las energías de las partículas es proporcional a la temperatura absoluta (en unidades de kelvin). Cerca de 0 K las partículas tienen muy poca energía cinética y adoptan una estructura con mínima energía potencial.
La temperatura y el movimiento de las partículas afectan si una sustancia es sólida, líquida o gaseosa. Vea esta simulación del comportamiento de los átomos de gas noble en sólidos, líquidos y gases. Elija “Estados”, luego elija “Neón” (esquina superior derecha). Haga clic en cada una de las casillas: “Sólido”, “Líquido” y “Gas” (o use “Calor” (debajo del contenedor de moléculas) para elevar la temperatura).
Con base en la simulación, escriba en su cuaderno una descripción de las diferencias de posición y movimiento de las moléculas en sólidos, líquidos y gases.

Apliquemos estas ideas al cloruro de sodio, que es un sólido a baja temperatura. Los iones de sodio y cloruro se empaquetan estrechamente en un patrón regular, como se ve en el diagrama de la derecha. Esta disposición minimiza la energía potencial al acercar las partículas con carga opuesta. Un poco por encima de 0 K los iones están en movimiento: cada uno vibra un poco alrededor de su ubicación específica, pero ningún ion tiene suficiente energía cinética para superar las atracciones de la ley del Coulomb que lo mantienen en su lugar. Por lo tanto, no se colocan intercambios iónicos con ningún otro ion. Esta estructura a escala atómica es consistente con las propiedades macroscópicas: un sólido es rígido porque el patrón regular de su estructura no cambia.
A medida que aumenta la temperatura aumenta la energía cinética promedio de los iones: los iones se mueven más, vibrando más lejos de sus posiciones promedio. En la escala macroscópica, el sólido se expande porque cada ion vibrante empuja contra los iones vecinos. Alejar los iones vecinos agranda el espacio ocupado por cada ion y el volumen del cristal aumenta. Eventualmente, las vibraciones son lo suficientemente grandes como para que los iones puedan moverse entre sí y la disposición regular se vuelve mucho más aleatoria: el sólido se funde. Los iones aún están muy juntos pero pueden pasar unos de otros, por lo que el líquido no tiene una forma específica. El líquido es fluido y se puede verter. Para el cloruro de sodio, debido a que la energía potencial se reduce mucho por las atracciones de la ley de Coulomb entre los iones, la temperatura requerida para fundir es alta: 1074 K (801 °C).
El aumento adicional de la temperatura hace que el movimiento de los átomos sea más rápido y a 1738 K (1465 °C) el cloruro de sodio líquido hierve, formando un gas. Los iones sodio y los iones cloruro se separan mucho más, lo que significa que chocan entre sí con mucha menos frecuencia. El gas es fluido pero se expande para llenar cualquier volumen disponible y tiene una densidad mucho menor que el líquido o sólido.
D1.7 ¿Qué hay por delante?
A lo largo de este curso construirás sobre las ideas fundamentales de la química desarrolladas en esta sección. Comenzarás por estudiar las propiedades de los átomos y cómo esas propiedades varían dependiendo de la posición en la tabla periódica. Esto conducirá a cómo los átomos pierden o ganan electrones para formar iones y cómo los átomos comparten electrones para formar moléculas, ambas relacionadas con la valencia. Con base en las propiedades de los átomos e iones a escala atómica, podrá comprender las propiedades de los metales y compuestos iónicos. El número y variedad de moléculas es muy grande por lo que gran parte de su estudio involucrará cómo los átomos se unen entre sí para formar moléculas y cómo las estructuras moleculares afectan las propiedades y reactividad de las sustancias moleculares. Entonces consideraremos qué tan rápido van las reacciones químicas y en qué medida los productos de esas reacciones pueden formarse a partir de un conjunto dado de reactivos. Estas ideas se aplicarán entonces a dos clases importantes de reacciones: reacciones ácido-base y reacciones de oxidación-reducción.
¡Buen viaje!
Actividad 5: Envoltura
En tu cuaderno, escribe un resumen de las ideas importantes en el trabajo de este día. Escribe tu resumen para que puedas referirte de nuevo a él, en caso de que necesites refrescar tu memoria, y para que puedas usarlo para revisar para exámenes.
Día 1 Pre-Clase Podia Problema: Describir Química
En la mayoría de las tareas previas a la clase incluiremos una pregunta de Podia que puede requerir respuestas numéricas, de texto y/o basadas en imágenes. Cada pregunta de Podia pre-clase se basa en el material de pre-clase y trabajar a través del material de pre-clase te ayudará a formular tu respuesta. Considera el problema y escribe o dibuja tu solución en tu cuaderno de clase.
Dos días antes de la siguiente sesión de toda la clase, la pregunta de Podia preclase se hará visible en Podia (dentro de la sección “Clase completa”), donde podrás enviar tu solución. [Por ejemplo, la pregunta de Podia en una tarea de preclase del miércoles se abrirá antes del lunes por la noche.]
Cuando vengas a la siguiente sesión de toda la clase, el líder de la clase elegirá una o más soluciones presentadas por los estudiantes y explicará por qué son (o no) declaraciones científicas efectivas. Estas preguntas están diseñadas para perfeccionar tus habilidades para que puedas resolver problemas de dominio que encontrarás en los exámenes.
Da clic en la pregunta correspondiente de Podia abierta y envía ahí tu respuesta. Su envío a preguntas abiertas por el instructor será anónimo para sus compañeros de clase, y solo podrá ver su propia presentación. (Si haces una publicación por separado, no serás anónimo).
Puedes encontrar las instrucciones de inicio de sesión de Podia aquí.
Tu primera pregunta de Podia pre-clase está diseñada para ayudarte a aprender cómo funciona Podia. Escribe una oración corta sobre química. Acompaña tu oración con una imagen (esbozada por ti) que creas que es un buen ejemplo de química. Vea si su líder de clase selecciona su presentación como una buena para mostrarla (anónimamente) a la clase.


