1.2: Día 2- Espectros Atómicos y Orbitales Atómicos
- Page ID
- 78743
s2
Día 2: Espectros Atómicos y Orbitales Atómicos
Si aún no has trabajado en la Introducción y el Día 1, hazlo antes de comenzar esta sección.
D2.1 Radiación electromagnética
La tabla periódica (Sección D1.4) resume mucha información sobre los elementos químicos. Esa información se puede entender mejor asumiendo que tanto las propiedades físicas como químicas de los diferentes elementos dependen de las diferencias en las estructuras subyacentes de sus átomos. Una manera importante de aprender sobre las estructuras de los átomos es estudiar cómo la energía, en forma de radiación electromagnética, interactúa con la materia.
Actividad 1: Preparación—Espectros Atómicos y Estructura Atómica
En su cuaderno de curso, haga un rubro para Espectros Atómicos y Estructura Atómica. Después del encabezado anota lo que recuerdes sobre los espectros atómicos de los cursos que ya has tomado. También escribe lo que recuerdes sobre la relación de los espectros con la estructura atómica: cómo los electrones están dispuestos en átomos. Si hay algo de lo que recuerdes estar desconcertado, anota eso también. Te pediremos que vuelvas a referirte a lo que has escrito cuando completes esta sección.
La radiación electromagnética consiste en campos eléctricos y magnéticos oscilantes perpendiculares que viajan por el espacio y pueden transferir energía. Los campos oscilantes (ondas) se caracterizan por longitud de onda (λ, medida en metros, m) y frecuencia (ν, medida en hercios, Hz o s −1). En un vacío, la radiación electromagnética viaja a la velocidad de la luz (c):
\[{\lambda }\nu = c = 2.998\;\times\;10^{8}\;\dfrac{m}{s} \nonumber \]La radiación electromagnética ocurre en pequeñas cantidades indivisibles de energía llamadas fotones. La energía de un fotón, el fotón E, se puede determinar a partir de su frecuencia o de su longitud de onda:
\[E_{\rm{photon}} = h\nu = \dfrac{hc}{\lambda } \nonumber \]
En esta ecuación h representa la constante de Planck; h = 6.626 × 10 −34 J s.
Su cálculo en el Ejercicio 1 mostró que la energía de un solo fotón es bastante pequeña. La mayoría de las interacciones de radiación electromagnética y materia involucran muchos fotones y muchos átomos. La energía total transferida es proporcional al número de fotones, N. Si todos los fotones tienen la misma frecuencia,
\[E_{\rm{electromagnetic\ radiation}} = N\times E_{\rm{photon}} = Nh\nu = N\dfrac{hc}{\lambda } \nonumber \]
Observe que la radiación electromagnética ha sido descrita como involucrando el movimiento de las olas y también como un número de partículas (fotones). Originalmente, los científicos pensaban que la radiación electromagnética podría describirse completamente mediante un modelo de onda, pero ese modelo no pudo predecir todas las observaciones experimentales. En consecuencia, tanto los modelos de onda como de partículas deben combinarse para una comprensión completa de la radiación electromagnética.
La Figura 1 muestra el enorme rango de todos los tipos de radiación electromagnética: Se han observado frecuencias de 10 5 Hz a 10 20 Hz, es decir, longitudes de onda de 10 3 m (km) a 10 −12 m (pm). Lo que podemos ver, la luz visible, es sólo una pequeña porción (380-740 nm) de ese rango.
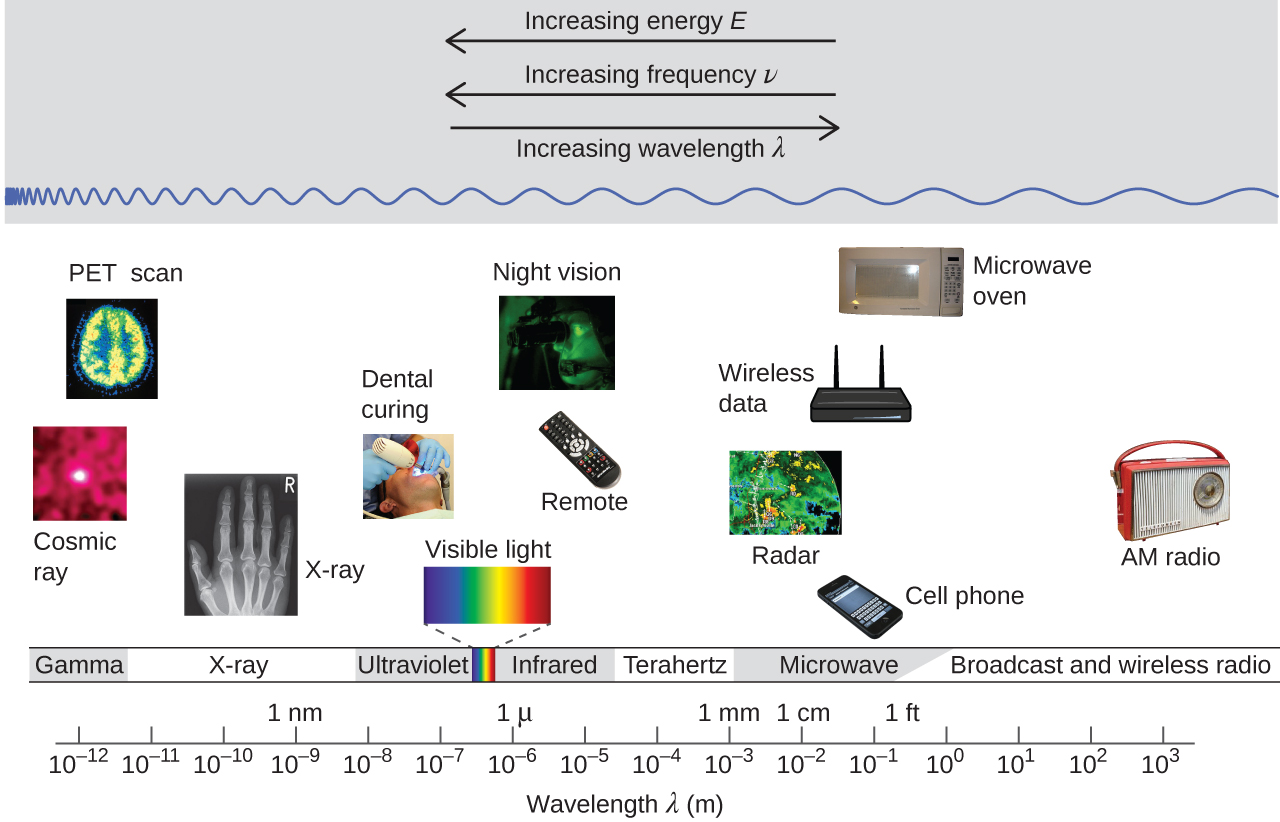
Diferentes partes del espectro electromagnético suelen utilizar diferentes unidades: los fotones de baja energía, como microondas y ondas de radio, se especifican en frecuencias (MHz o GHz); los fotones de energía media, como la luz infrarroja y visible, se especifican en longitudes de onda (μm, nm, pm o Å); fotones de alta energía, como x- rayos y rayos gamma, se especifican en energías (KeV o MeV).
Nuestros ojos detectan fotones de rango visible, lo que nos permite ver el mundo que nos rodea. Pero los instrumentos científicos nos permiten “ver” mucho más detectando fotones sobre un rango mucho más amplio de energías. Por ejemplo, estudios de espectros atómicos, experimentos que involucran la interacción de la materia gaseosa con la luz visible, ultravioleta e infrarroja, condujeron a una mejor comprensión de la estructura de los átomos.
Espectros atómicos D2.2
Calentar un elemento gaseoso a baja presión o pasar una corriente eléctrica a través del gas imparte energía adicional a los átomos. Estos átomos de mayor energía pueden entonces liberar la energía adicional emitiendo fotones. Por ejemplo, los colores de los letreros de “neón” se producen haciendo pasar corriente eléctrica a través de gases de baja presión. Curiosamente, los fotones emitidos por los átomos de mayor energía tienen solo unas pocas energías específicas, produciendo así un espectro lineal que consiste en picos (líneas) muy agudos a unas pocas frecuencias específicas. Los espectros de líneas fueron intrigantes porque no había razón para esperar que algunas frecuencias fueran preferidas sobre otras.
Cada elemento muestra su propio conjunto característico de líneas. Por ejemplo, cuando la electricidad pasa a través de un tubo que contiene gas H 2 a baja presión, las moléculas H 2 se rompen en átomos de H separados y los átomos de H emiten un color púrpura. El paso de la luz púrpura a través de un prisma produce el espectro lineal superior mostrado en la Figura 2: el color púrpura consiste en cuatro longitudes de onda visibles discretas: 656.4 nm, 486.2 nm, 434.1 nm y 410.2 nm.
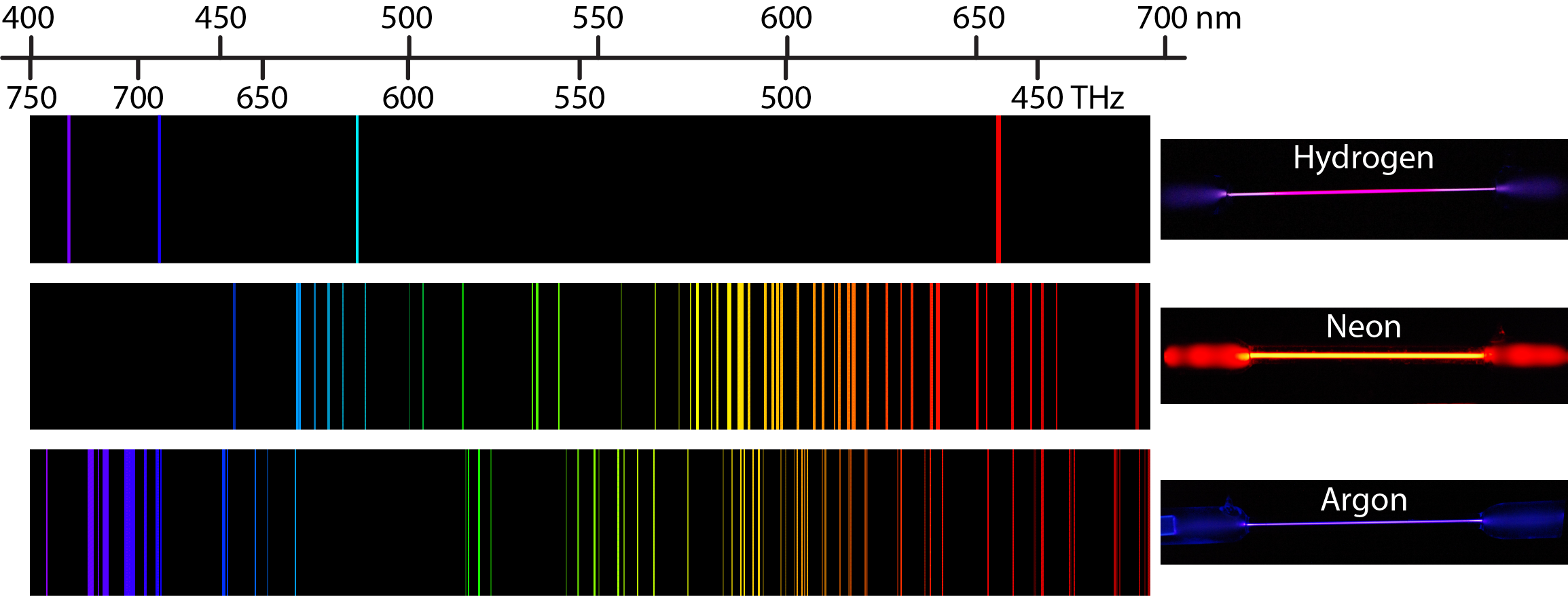
El espectro de emisión de átomos H también contiene líneas en los rangos ultravioleta e infrarrojo. En 1888, Johannes Rydberg desarrolló una ecuación que predice longitudes de onda para todas las líneas de emisión de hidrógeno:
\[\dfrac{1}{\lambda } = R_{\infty} \left(\dfrac{1}{n_2^2} - \dfrac{1}{n_1^2}\right) \nonumber \]
Aquí, n 1 y n 2 son enteros positivos con n 2 < n 1, y la constante de Rydberg R ∞ = 1.09737316 × 10 7 m −1.
Debido a que las longitudes de onda de las líneas de emisión de hidrógeno se midieron con una precisión muy alta, la constante de Rydberg se pudo determinar con mucha precisión. Que una fórmula simple que involucre enteros pudiera dar cuenta de mediciones tan precisas parecía asombrosa en ese momento.
Ejercicio 2: Emisión de átomos de hidrógeno
Utilice la ecuación de Rydberg para calcular la longitud de onda del fotón emitido por un átomo de hidrógeno cuando n 2 = 3 y n 1 = 7.
Niveles de energía atómica D2.3
¿Por qué un átomo de hidrógeno debería emitir solo cuatro colores específicos de luz visible? Para entender esto mejor, necesitamos saber más sobre la energía del átomo y cómo la energía depende de la estructura atómica. Cualquier átomo consiste en un núcleo minúsculo rodeado por uno o más electrones. El átomo más simple, un átomo de hidrógeno, tiene un protón como núcleo y un electrón fuera del núcleo. Según la ley de Coulomb, el electrón y el protón atraen.
Actividad 2: Espectros de Línea y Energías
Piense en las implicaciones de los espectros de línea. Si un átomo de hidrógeno emite solo cuatro longitudes de onda específicas en la región visible, ¿qué implica esto con respecto a las energías de los fotones emitidos? ¿Por qué solo deberían emitirse estas cuatro longitudes de onda, pero ninguna de las otras posibles longitudes de onda? Escribe tu explicación en tu libreta.
El modelo actualmente utilizado para describir la distribución de electrones en un átomo tiene estos atributos:
- Las energías de los electrones en un átomo están restringidas a los niveles de energía, que son energías permitidas específicas.
- Cada línea en el espectro de un elemento resulta cuando la energía de un electrón cambia de un nivel de energía a otro; un cambio de un nivel de energía electrónica a otro se llama transición electrónica.
- Los electrones se distribuyen en regiones centradas en el núcleo, llamadas conchas; cada caparazón tiene una distancia promedio diferente del núcleo.
- Como lo describe la ley de Coulomb, la energía de un electrón aumenta al aumentar la distancia promedio desde el núcleo; es decir, con el aumento del tamaño de una capa de electrones.
- Tanto los niveles de energía como las conchas se describen mediante números cuánticos, números restringidos a valores permitidos específicos; se dice que las energías de electrones están cuantificadas, restringidas a niveles de energía discretos.
Un átomo es más estable cuando tiene la menor energía posible. El estado electrónico de energía más baja de un átomo se llama su estado básico electrónico (o simplemente estado fundamental). Cualquier estado de energía superior de un átomo se llama estado excitado electrónico (o simplemente un estado excitado).
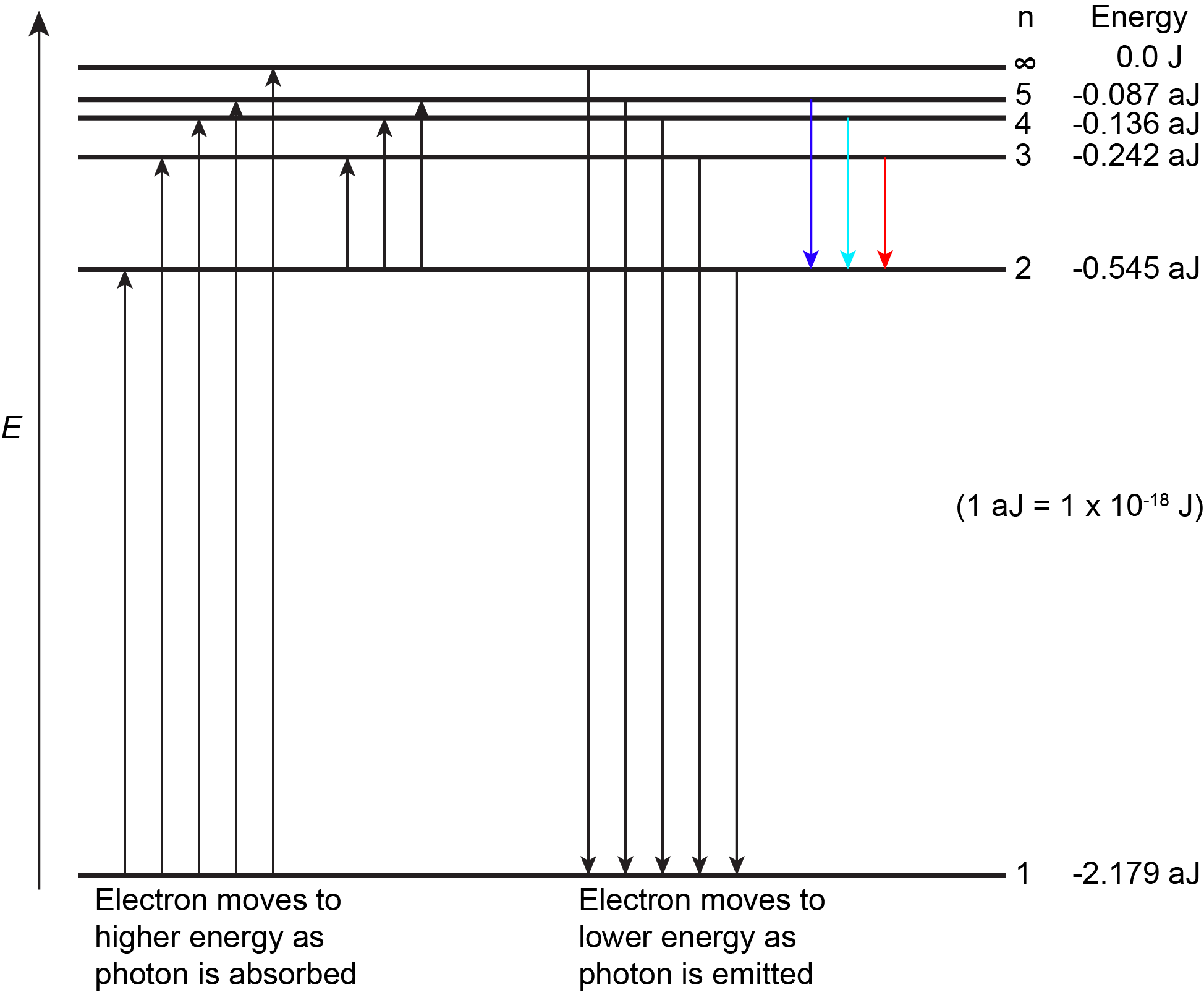
La Figura 3 muestra los primeros niveles de energía de un átomo de hidrógeno. El átomo se encuentra en su estado fundamental cuando su electrón está en el nivel n = 1 (energía más baja). Cuando un fotón es absorbido por un átomo de hidrógeno en estado fundamental, como se muestra en el lado izquierdo de la Figura 3, la energía del fotón mueve el electrón a un nivel más alto de n (energía superior), y el átomo se encuentra ahora en un estado excitado.
Un átomo en estado excitado puede liberar la energía extra como un solo fotón si el electrón regresa a su estado fundamental (digamos, de n = 5 a n = 1), o la energía puede liberarse como dos o más fotones de menor energía si el electrón cae a un estado intermedio y luego al estado fundamental (digamos, de n = 5 a n = 2, emitiendo un fotón, luego de n = 2 a n = 1, emitiendo un segundo fotón).
D2.4 El modelo mecánico cuántico del átomo de hidrógeno
Si pudiéramos calcular la energía para cada nivel de energía, podríamos predecir el espectro de emisión para hidrógeno. En 1926, Erwin Schrödinger aplicó la mecánica cuántica, un modelo que utiliza analogías de ondas y partículas para describir la materia a escala atómica, al átomo de hidrógeno. En lugar de ver el electrón como una partícula, Schrödinger aplicó matemáticas apropiadas para ondas estacionarias tridimensionales restringidas por potencial electrostático (atracción de la ley de culombios entre el electrón y el núcleo). Para cada onda derivó una función matemática para describir la onda, una función de onda. La función de onda se designa típicamente por la letra griega ψ.
Schrödinger demostró que estas funciones de onda podrían ser utilizadas para calcular las energías permitidas de un átomo de hidrógeno. Las energías calculadas vienen dadas por esta ecuación:
\[E_n = -\dfrac{k}{n^2}, n = 1, 2, 3, . . . \nonumber \]
donde la constante de proporcionalidad k = 2.179 × 10 −18 J, y n es un número cuántico restringido a valores enteros positivos.
En una transición electrónica, un electrón se mueve de un nivel de energía a un nivel de energía diferente. La energía del fotón correspondiente es la diferencia de energía entre los dos niveles de energía, un nivel inicial con energía E i y un nivel final con energía E f.
\[\Delta E = E_f - E_i = -k \left(\dfrac{1}{n_f^2} - \dfrac{1}{n_i^2}\right) \nonumber \]
Un Δ E positivo significa que la energía del átomo aumentó, correspondiente a la absorción de un fotón: la energía del fotón se ha agregado a la energía inicial del átomo. De manera similar, un Δ E negativo significa que el átomo ha perdido energía a través de la emisión de un fotón.
La conservación de la energía requiere que la energía del fotón, E fotón = hc /λ, sea igual al valor absoluto de la diferencia de energía, |Δ E|, para emisión o absorción. El signo de Δ E indica si el fotón fue absorbido (+) o emitido (−).
La ecuación obtenida por Schrödinger es equivalente a la ecuación que Rydberg utilizó para calcular las líneas de emisión de hidrógeno:
\[E_{\rm{photon}} = \dfrac{hc}{\lambda } = |\Delta E| = \left|-k \left(\dfrac{1}{n_f^2} - \dfrac{1}{n_i^2}\right) \right| \nonumber \]
\[\dfrac{1}{\lambda} = \dfrac{k}{hc} \left(\dfrac{1}{n_f^2} - \dfrac{1}{n_i^2}\right) = R_{\infty} \left(\dfrac{1}{n_2^2} - \dfrac{1}{n_1^2}\right) \nonumber \]
y así, R ∞ = k/(hc). Al sustituir los valores de k, h y c en esta ecuación se obtiene R ∞ = 1.097× 10 7 m −1, que es lo mismo que la constante experimental de Rydberg a cuatro cifras significativas. Que un modelo de onda pudiera reproducir estos niveles de energía de alta precisión fue una fuerte evidencia de que la mecánica cuántica es un modelo de nivel atómico apropiado.
D2.5 Dualidad Onda-Partícula
El modelo combinado de onda y partícula se conoce como dualidad onda-partícula. Su impacto en la descripción de partículas a escala atómica (protones y electrones) es dramático: la dualidad onda-partícula implica que no solo debemos pensar en un electrón como ubicado en una posición específica alrededor de un núcleo o moviéndose en una dirección específica y con una velocidad específica: el electrón onda-como parece ser todo alrededor del núcleo a la vez! En otras palabras, la naturaleza de onda de un electrón es tan importante para describir sus propiedades como su naturaleza de partículas.
Una consecuencia importante de la dualidad onda-partícula es el principio de incertidumbre de Heisenberg: es imposible determinar la posición exacta y el momento exacto de una partícula de nivel atómico simultáneamente. Esto significa que, si sabemos exactamente dónde está un electrón en un instante, no tenemos idea de dónde estará un instante después; o, si conocemos la velocidad y dirección exactas de un electrón, no tenemos información sobre dónde se encuentra. Como resultado del principio de incertidumbre, lo mejor que podemos hacer es determinar la probabilidad de encontrar un electrón en una posición específica; esa probabilidad es proporcional al cuadrado de la función de onda, ψ 2.
La distribución de densidad de electrones (o simplemente densidad de electrones) es la distribución tridimensional de la probabilidad de electrones, que puede derivarse del cuadrado de una función de onda. Las funciones de onda y sus distribuciones de densidad de electrones se denominan orbitales. Son estos orbitales los que nos ayudan a entender las propiedades atómicas, los enlaces químicos y las fuerzas entre las moléculas.
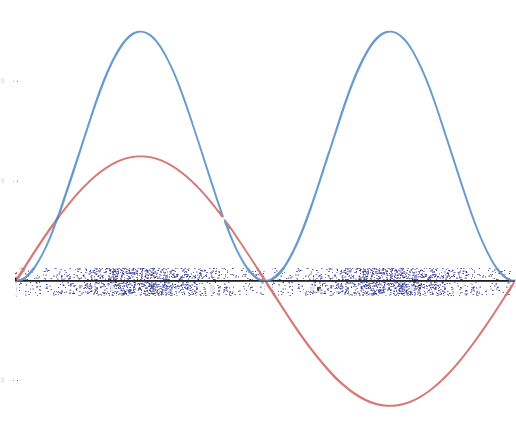
Una forma gráfica de mostrar la distribución de densidad de electrones (representando un orbital) es por la densidad del sombreado o punteado. Es decir, dibujamos muchos puntos o sombreado más oscuro donde la probabilidad es alta y dibujamos menos puntos donde la probabilidad es baja. Por ejemplo, considere la onda que se muestra a continuación en rojo junto con su cuadrado que se muestra en azul. Dondequiera que haya un máximo en el cuadrado de la función de onda (curva azul), hay muchos puntos. Donde la función de onda (y por lo tanto también su cuadrado) se acerca a cero, hay pocos puntos.
Tal manera de visualizar la densidad de electrones es bastante útil para una visión 3-D de la densidad de electrones que rodea un núcleo. Por ejemplo, se puede ver la distribución de densidad de electrones de un átomo de hidrógeno en su estado fundamental en este video, donde el átomo de hidrógeno gira alrededor de su núcleo.
En su cuaderno de clase escriba una descripción de (1) la forma de la distribución de la densidad electrónica para un átomo H de estado fundamental y (2) cómo cambia la densidad de electrones con la distancia desde el núcleo. (El núcleo se encuentra en la intersección de los tres ejes: ejes x, y y z).
En el diagrama de densidad de electrones a continuación, haga clic en la cruz blanca que corresponde a la densidad de electrones más baja.
Con base en la densidad de puntos en el diagrama, hacer una gráfica con densidad electrónica en el eje vertical y distancia desde el núcleo en el eje horizontal. ¿Cómo se relaciona una gráfica de función de onda versus distancia desde el núcleo con la gráfica que hiciste?
Similar a los diagramas de densidad de puntos, pero visualmente más simples a la vez que transportan un poco menos de información, son las gráficas tridimensionales de superficie límite, que muestran una superficie que tiene la misma forma que la distribución de la densidad electrónica y encierra alguna fracción, como el 90%, de la densidad electrónica. Es decir, si pudiéramos localizar repetidamente el electrón exactamente, nueve de cada diez veces el electrón estaría ubicado dentro de la superficie límite. La siguiente figura muestra cómo se relaciona una superficie límite con la gráfica de densidad de puntos que ya has visto. Mueva el control deslizante en la parte inferior para cambiar de densidad de puntos a diagrama de superficie límite.
Visualizar distribuciones de densidad de electrones confirma una idea mencionada anteriormente: hay conchas de densidad electrónica, esferas concéntricas cada una más alejada del núcleo. Los orbitales que pertenecen a un caparazón dado tienen el mismo número cuántico, n y su densidad de electrones es aproximadamente la misma distancia promedio desde el núcleo. El número cuántico principal n dicta el tamaño total de la órbita.

A medida que n se hace más grande, el radio, r, de la capa de electrones se hace más grande, y E n se vuelve menos negativo, más cerca de cero. Por lo tanto, los límites n ⟶ ∞ y r ⟶ ∞ implican que E n = 0 corresponde a la ionización del átomo, separación completa del electrón del núcleo. Así, para un átomo de hidrógeno en estado fundamental, la energía de ionización es:
\[\Delta E = E_{n \rightarrow \infty} - E_1 = 0 - \dfrac{-k}{1^2} = k = 2.179\;\times\;10^{-18}\;\text{J} \nonumber \]
Otro aspecto interesante es que si bien conocemos E n, que es la energía total del electrón, no podemos medir la energía cinética del electrón (o su velocidad) y la energía potencial por separado. Sabemos por la ley de Coulomb que la energía potencial cambia en función de r. Dado que la densidad de electrones se distribuye en un rango de r, hay un rango de energía potencial y, por lo tanto, un rango de energía cinética, cuando la energía potencial del electrón es mayor, su energía cinética sería menor. Esta incertidumbre vuelve a estar relacionada con la naturaleza de onda del electrón. No obstante, ¡conocer la energía total, E n, es bastante suficiente para nosotros!
Actividad 4: Envoltura —Espectros Atómicos y Estructura Atómica
Revisa lo que escribiste sobre los espectros atómicos y la estructura atómica al inicio de esta sección. Actualiza la información en función de lo que hayas aprendido. Escribe un resumen que será una buena ayuda para el estudio cuando revises para un examen.
D2.6 Orbitales atómicos y números cuánticos
Números cuánticos: n, l, m l
Las funciones de onda atómica se pueden definir usando tres números cuánticos: n, l. y m l. Cada función de onda corresponde a un orbital atómico. Cada orbital atómico define una región en el átomo dentro de la cual la densidad de probabilidad de electrones es grande.
La energía de un átomo de hidrógeno orbital depende del número cuántico principal, n:
\[E_n = - \dfrac{2.179\;\times\;10^{-18}\;\text{J}}{n^2}, n = 1, 2, 3, . . . \nonumber \]
Como se discutió anteriormente, el tamaño de la órbita (la distancia promedio del electrón desde el núcleo) aumenta a medida que n aumenta. Cuanto más lejos está el electrón del núcleo, más alta (menos negativa) es la energía.
El segundo número cuántico, l, es el número cuántico orbital (a veces llamado número cuántico acimutal o de momento angular). Determina la forma de la distribución de densidad electrónica. l es un entero con valores que van de 0 a n — 1; es decir, l = 0, 1, 2,..., n — 1. Así, un orbital con n = 1 puede tener sólo un valor de l, l = 0, mientras que n = 2 permite l = 0 y l = 1, y así sucesivamente.
Los valores de l se designan usando letras:
| l.= 0 | s orbitales |
| l.= 1 | p orbitales |
| l.= 2 | d orbitales |
| l.= 3 | f orbitales |
| l.= 4 | g orbitales |
| l.= 5 | h Orbitales |
Vea las formas de los orbitales s, p y d que se muestran en estos videos:
1s orbital 2 p[1] orbital 3d orbital orbital
En tu cuaderno de clase escribe una descripción de la forma de la distribución de densidad de electrones para cada orbital. Además, haga un dibujo aproximado del diagrama de superficie límite correspondiente para cada diagrama de densidad de puntos.
El número cuántico magnético, m l, especifica la orientación espacial de un orbital particular. Los valores de m l pueden ser cualquier número entero de — l a l. Por ejemplo, para un orbital s, l = 0, y el único valor de m l es 0; así solo hay un orbital s único. Para los orbitales p, l = 1, y m l puede ser igual a —1, 0 o +1; así hay tres orbitales p diferentes, que se muestran comúnmente como p x, p y, y p z, orientado a lo largo de los ejes x, y y z.
El número total de orbitales posibles con el mismo valor de l es de 2 l + 1. Hay cinco orbitales d, siete orbitales f, y así sucesivamente. Los tamaños y formas de los orbitales s, p y d en los tres primeros proyectiles se muestran en la Figura 6. Cada uno de estos orbitales corresponde a un conjunto diferente de valores n, l y m l.
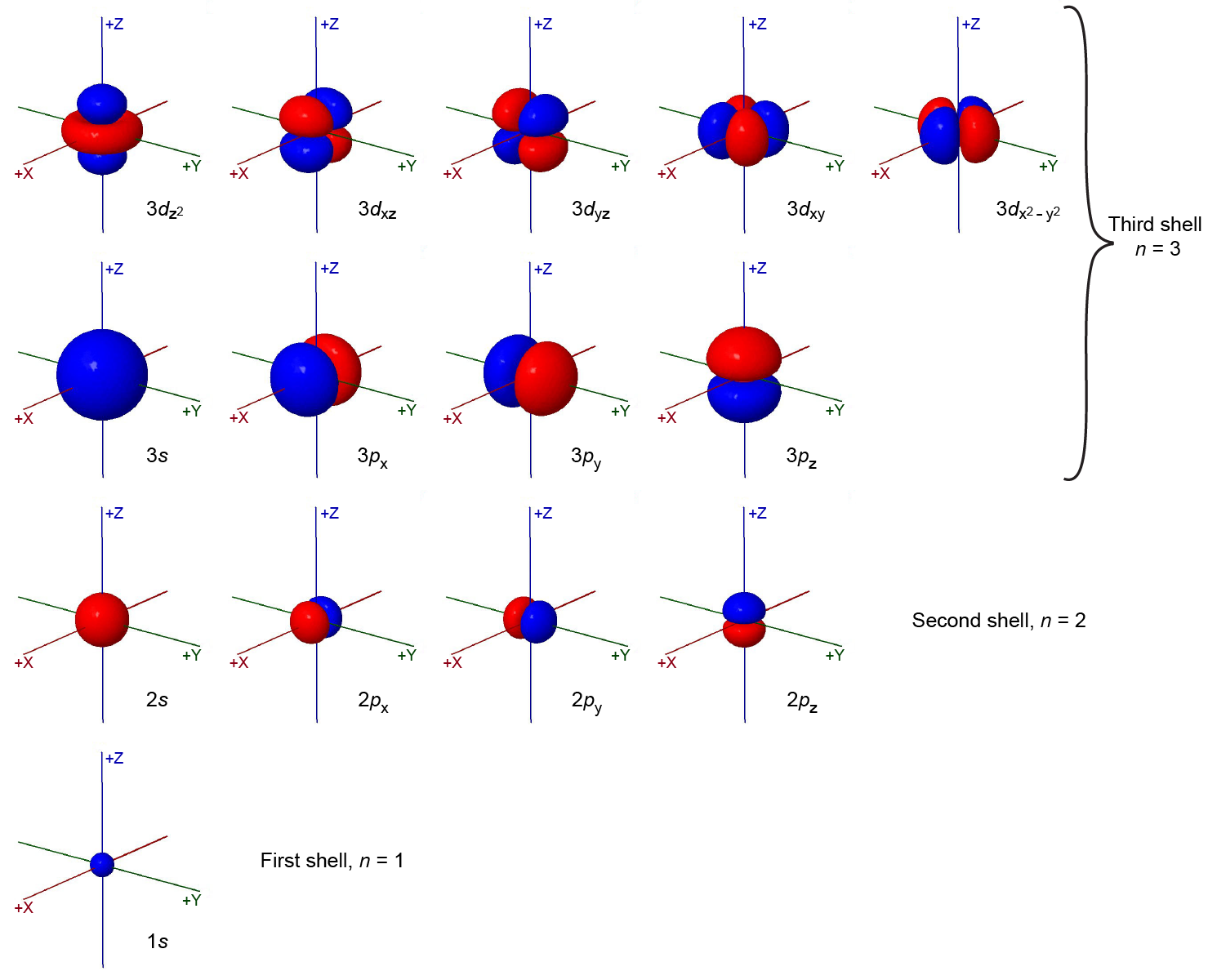
Todos los orbitales con el mismo valor de n y l forman una subcapa. Por ejemplo, los orbitales 2 p x, 2 p y y 2 p z constituyen la subcapa 2 p porque cada uno de estos orbitales tiene n = 2 y l = 1. El número de orbitales en una subcapa es igual al número de diferentes valores para el número cuántico de m l. Cada shell contiene n subshells: por ejemplo, cuando n = 3, hay un subshell de 3 s, un 3 p y un subshell de 3 d, correspondientes a los tres posibles valores de l de 0, 1 y 2.
Fases orbitales y nodos
La Figura 6 muestra algunos orbitales atómicos como todos azules o todos rojos (por ejemplo, 1 s y 2 s), mientras que otros orbitales contienen ambos colores (por ejemplo, los orbitales de 2 p). Los colores azul y rojo muestran el signo matemático de la función de onda, una propiedad llamada fase de la función de onda. La mayoría de las funciones de onda son positivas en algunas regiones y negativas en otras. La fase es importante cuando las funciones de onda en dos átomos interactúan para formar un enlace químico.
La relación entre la función de onda y la densidad de electrones se representa de manera más explícita en la Figura 7. En la fila media, los diagramas de superficie límite de la Figura 6 muestran los tamaños y formas de las distribuciones de densidad de electrones para los orbitales 1 s, 2 s y uno de los 2 p orbitales. En la fila superior están las funciones de onda correspondientes (ψ); la fila inferior muestra densidad electrónica, ψ 2.
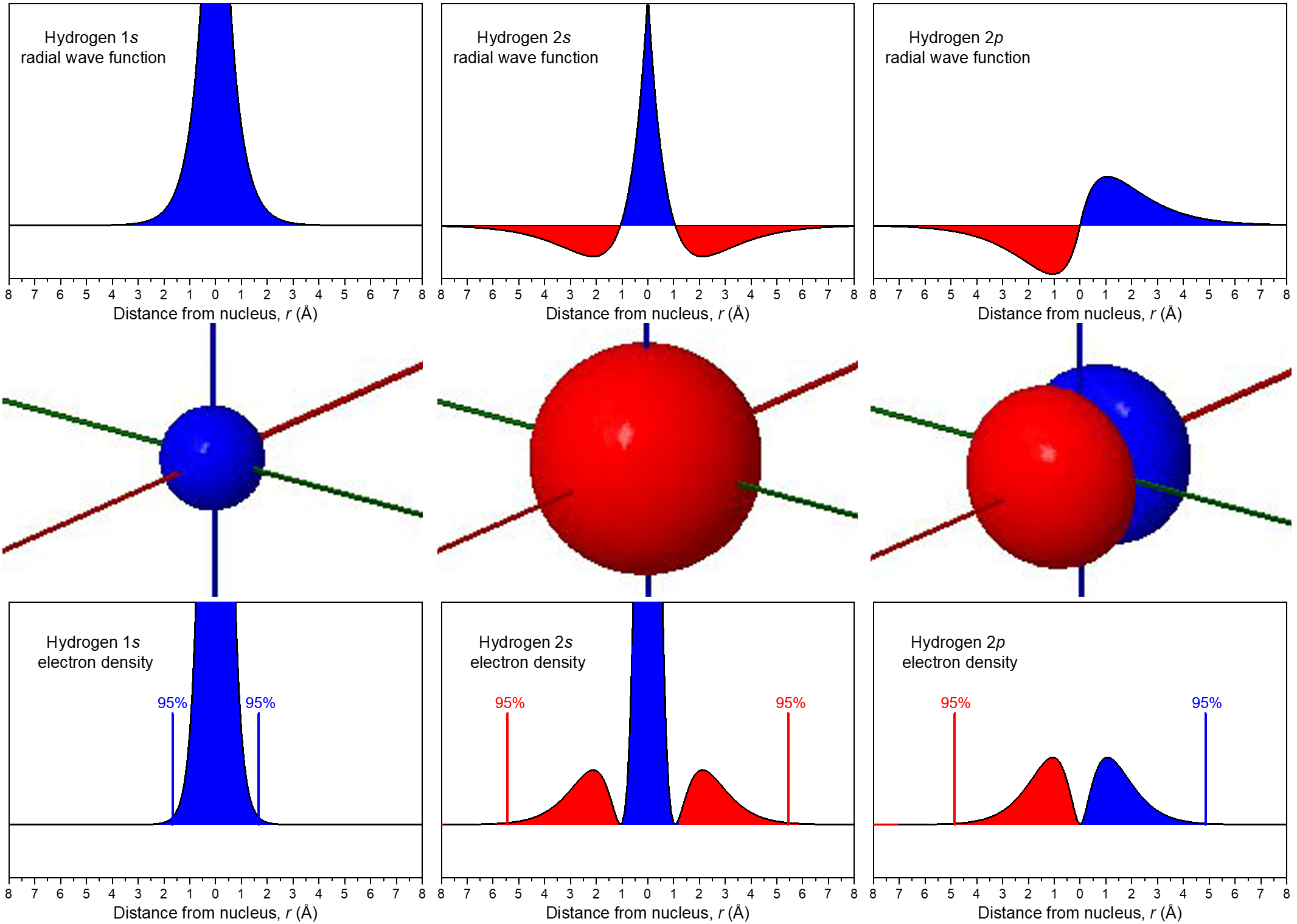
Las funciones de onda y las funciones de densidad de electrones están codificadas por colores para mostrar las regiones donde ψ > 0 como azul y las áreas donde ψ < 0 como rojo. Una superficie donde la función de onda cambia de signo se llama nodo. En un nodo, ψ = 0 y por lo tanto la probabilidad de encontrar el electrón en esa superficie también es 0.
Para el orbital de 1 s, no hay nodos; su función de onda solo tiene valores positivos. Para el orbital de 2 s, hay un nodo a r = 1.05 Å; la función de onda pasa de valores positivos cerca del núcleo a valores negativos más alejados. (No puede ver este nodo en el diagrama de superficie límite, porque el nodo es una esfera que se encuentra dentro del volumen encerrado por la superficie límite). Un nodo que ocurre a un valor específico de r es un nodo radial, y por lo tanto los nodos radiales tienen una forma esférica. El orbital de 3 s, por ejemplo, tiene dos nodos radiales encerrados dentro del diagrama de superficie límite.
Cada orbital 2 p tiene un nodo. Mire el diagrama de superficie límite para verificar que este nodo es plano en lugar de esférico. Los nodos no esféricos son nodos angulares. Por ejemplo, el orbital 2 p x tiene un nodo angular: el plano yz; ψ es igual a 0 en todos los puntos del plano yz, en lugar de en cualquier valor r específico. Se puede ver claramente la presencia de nodos angulares en diagramas de superficie límite.
Un orbital tiene n — 1 nodos, de estos, n — 1 — l son nodos radiales, y el número de nodos angulares corresponde al valor de l. Una generalización que es cierta para todo tipo de ondas es que cuanto mayor sea el número total de nodos, mayor será la energía. La fase de la función de onda difiere a cada lado de un nodo, porque la función de onda cambia de un signo matemático al otro a medida que cruza un nodo. Visualmente, representamos estas diferentes fases, y la presencia de nodos, con diferentes colores en el diagrama de superficie límite.
Cuarto Número Cuántico, m s
El cuarto número cuántico, llamado número cuántico de espín, m s, difiere de los otros tres números cuánticos en que describe el electrón más que el orbital. Un electrón tiene un campo magnético muy pequeño. Mover una carga macroscópica en una trayectoria circular produce un campo magnético, por lo que inicialmente el campo magnético del electrón se atribuyó a su giro como una copa; de ahí el nombre de “número cuántico de giro”. El campo magnético del electrón puede tener dos estados cuantificados: ya sea “arriba” o “abajo”. Esto da dos posibles valores de m s, m s = +½ o m s = -½. Cuando un electrón ocupa un orbital, normalmente representamos estos dos posibles valores de m s como una flecha ↑ o ↓.
En su libreta de clases, haga una tabla que resuma los nombres, símbolos, valores permitidos y propiedades importantes de los cuatro números cuánticos. (Puede utilizar esta tabla para estudiar más adelante.) Si estás estudiando con otra persona, haz tus mesas de forma independiente y luego compara.
Cuando estés satisfecho con tu mesa, compárela con la nuestra.
Día 2 Problema Podia Pre-Clase: Orbitales Atómicos
Este problema de Podia se basa en el material de pre-clase actual; trabajar a través de ese material te ayudará a resolver el problema.
Considera estas dos frases: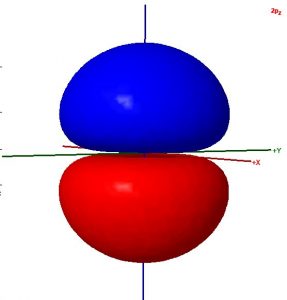
- La superficie mostrada en esta ilustración de un orbital atómico se elige de manera que se encierra la totalidad de la función de onda del electrón.
- Los colores en el diagrama representan regiones de espín de electrones opuestos.
Decidir si cada oración es correcta. Reescribe todo el texto incorrecto para que sea correcto. Sea breve pero incluya todas las ideas importantes y use un lenguaje científicamente apropiado.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


