1.7: Día 7- Sustancias Moleculares Covalentes; Hidrocarburos
- Page ID
- 78753
7
Día 7: Sustancias moleculares covalentes; Hidrocarburos
Aplicación de ideas centrales: comparación de moléculas de hidrógeno y átomos de helio
El punto de ebullición del helio es de 4.22 K (−268.93 °C). El punto de ebullición del hidrógeno es 20.28 K (−252.87 °C). Sin embargo, la fuerza de atracción entre dos átomos de hidrógeno separados por 100pm es casi 5000 veces más fuerte que la fuerza de atracción entre dos átomos de helio separados por 100pm.
Piense en helio e hidrógeno a escala atómica. Entonces escribe en tu cuaderno una explicación para el hecho de que tanto el helio como el hidrógeno tienen puntos de ebullición muy bajos pero el hidrógeno es mayor.
Sustancias Moleculares Covalentes D7.1
Una sustancia hecha de moléculas se llama sustancia molecular covalente. Un punto importante en la actividad que acabas de completar es este: a diferencia de los compuestos iónicos, metales o gases nobles, donde hervir implica liberar iones o átomos entre sí, hervir una sustancia molecular covalente implica liberar moléculas entre sí. No se rompen enlaces covalentes durante el proceso de ebullición y las mismas moléculas están presentes en la fase gaseosa que en la fase líquida. El mismo razonamiento se aplica a la fusión: los enlaces covalentes entre los átomos dentro de las moléculas no se rompen, sino que las fuerzas entre las moléculas deben superarse parcialmente.
Debido a que hay muchos tipos diferentes de átomos no metálicos que pueden formar enlaces covalentes, y debido a que las moléculas pueden consistir en cualquier lugar de dos a muchos miles de átomos, el rango de propiedades de las sustancias moleculares covalentes es mucho más amplio que para compuestos iónicos o metales. Muchas sustancias moleculares covalentes son líquidos o gases: se funden (y algunas hierven) por debajo de la temperatura ambiente o no muy por encima. Las sustancias moleculares covalentes no conducen bien la electricidad como sólidos o líquidos, los sólidos pueden ser débiles y quebradizos o blandos y cerosos, y muchos son insolubles en agua. Comenzaremos a explorar esta amplia gama de moléculas y propiedades en la Unidad 2. Por ahora, consideramos una sola clase de sustancias moleculares covalentes: los hidrocarburos.
D7.2 Hidrocarburos
Muchas propiedades de sustancias que consisten en moléculas unidas covalentemente son ejemplificadas por hidrocarburos, compuestos que contienen solo los elementos carbono e hidrógeno. El carbono es único entre los elementos en que los átomos de carbono pueden formar largas cadenas de enlaces carbono-carbono. Esto sucede porque los átomos de carbono forman enlaces simples fuertes con otros átomos de carbono y porque el carbono' tiene cuatro electrones de valencia, lo que resulta en cuatro enlaces por átomo de carbono. Cuando todos los demás enlaces en una cadena de átomos de carbono son a átomos de hidrógeno, la molécula es un hidrocarburo. Además de las cadenas largas, las moléculas de hidrocarburos pueden tener cadenas con ramas; cadenas plegadas sobre sí mismas para formar anillos; y cadenas, cadenas ramificadas o anillos que incluyen enlaces dobles o triples. Muchos hidrocarburos se encuentran en plantas, animales y sus fósiles; otros hidrocarburos se han preparado en el laboratorio.
La reacción más importante de los hidrocarburos es la combustión. El ejemplo más simple es la combustión de metano:
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g) Δ r H = −802,3 kJ/mol
La combustión de hidrocarburos es altamente exotérmica por lo que los hidrocarburos son excelentes combustibles. Por ejemplo, el metano (CH 4) es el componente principal del gas natural, el gas LP es principalmente propano (C 3 H 8) y butano (C 4 H 10). Otros combustibles hidrocarbonados son acetileno, combustible diesel, combustible para aviones y gasóleo para calefacción. Los familiares plásticos polietileno, polipropileno y poliestireno también son hidrocarburos.
D7.3 Alcanos
Los hidrocarburos más simples, los alcanos, contienen solo enlaces simples entre los átomos de carbono. Cada uno de los átomos de carbono en un alcano está unido a otros cuatro átomos, cada uno de los cuales es carbono o hidrógeno. Las entalpías de enlace para los enlaces C—C y C—H son 346 y 436 kJ/mol, respectivamente. Estos enlaces fuertes son difíciles de romper por lo que los alcanos son relativamente poco reactivos.
Los alcanos que no contienen anillos de átomos de carbono se denominan alcanos acíclicos; tienen la fórmula molecular general C n H 2n +2. Una fórmula molecular, como C 6 H 14 para el alcano llamado hexano, especifica cuántos átomos de cada tipo hay en la molécula; en C 6 H 14 hay 6 átomos de C y 14 átomos de H en cada molécula. Estos alcanos también se denominan hidrocarburos saturados porque cada átomo de C está unido al número máximo posible de átomos de H. Se dice que la molécula de alcano está “saturada” con hidrógeno.
Los alcanos acíclicos no ramificados a menudo se denominan alcanos de “cadena lineal” porque los átomos de carbono se pueden dibujar en una sola fila recta en la estructura de Lewis. Sin embargo, la estructura de Lewis representa solo algunos aspectos de la molécula, no todos. Como muestran los modelos de pentano de bola y palo y relleno de espacio en la Figura 1, los átomos de C no se encuentran en una línea completamente recta. Por qué hay una fila de átomos en zigzag es un tema para la Unidad 2.
Las estructuras de alcanos también pueden estar representadas por fórmulas estructurales condensadas, tales como CH 3 CH 3 para etano y CH 3 CH 2 CH 2 CH 2 CH 3 para pentano. Las fórmulas estructurales condensadas indican cuántos átomos de H están unidos a cada átomo de C; están relacionados con estructuras de Lewis, pero todos los símbolos de enlace han sido eliminados.
Los alcanos ramificados contienen más de una cadena carbonada. Por ejemplo, el 3-metilpentano tiene una rama en el tercer átomo de carbono a lo largo de la cadena. (Los átomos de C están numerados con subíndices para mostrar que la rama se produce en el tercer átomo de C. El número del átomo de C con la rama aparece en el nombre. “Meth yl” se refiere al grupo H 3 C—, que es una molécula de metanano que carece de un núcleo H.)
Un cicloalcano tiene al menos un anillo de átomos de carbono. La comparación de un alcano lineal con un cicloalcano muestra que se debe formar un enlace C—C adicional, que elimina dos átomos de hidrógeno. En consecuencia, la fórmula general para un cicloalcano que contiene un anillo es C n H 2 n.
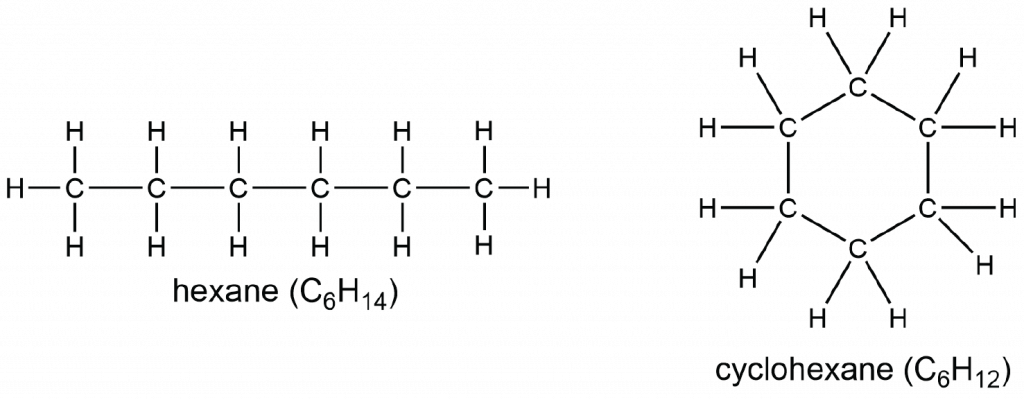
Nos referimos a esta reducción en el número de átomos de hidrógeno como grado de insaturación, Un grado de insaturación corresponde a tener dos átomos de hidrógeno menos; un cicloalcano que contiene un anillo tiene un grado de insaturación. Como en el caso del alcano “de cadena recta” en zigzag, la estructura plana de Lewis no representa todos los aspectos de la estructura del ciclohexano. El anillo en ciclohexano se frunce y no se encuentra plano en un plano, como se muestra en este modelo 3D. Los átomos de H tampoco están en el plano de la pantalla.
D7.4 Alquenos
Los hidrocarburos insaturados que contienen uno o más dobles enlaces se denominan alquenos. La fórmula molecular general para alquenos con un doble enlace es C n H 2n. La fórmula tiene dos átomos de hidrógeno menos que el alcano correspondiente con el mismo número de átomos de carbono, y de ahí 1 grado de insaturación. Es posible tener un anillo de átomos de carbono que contenga un doble enlace. Los alquenos cíclicos tienen un grado de insaturación de cada estructura cíclica y uno de cada doble enlace C=C.
Los átomos de carbono involucrados en el doble enlace son sp 2 hibridados, y por lo tanto la geometría local allí es plana trigonal. La presencia de estos dobles enlaces es significada por el sufijo -ene en el nombre. El eteno, C 2 H 4, comúnmente llamado etileno, es el alqueno más simple. Algunos otros ejemplos incluyen:
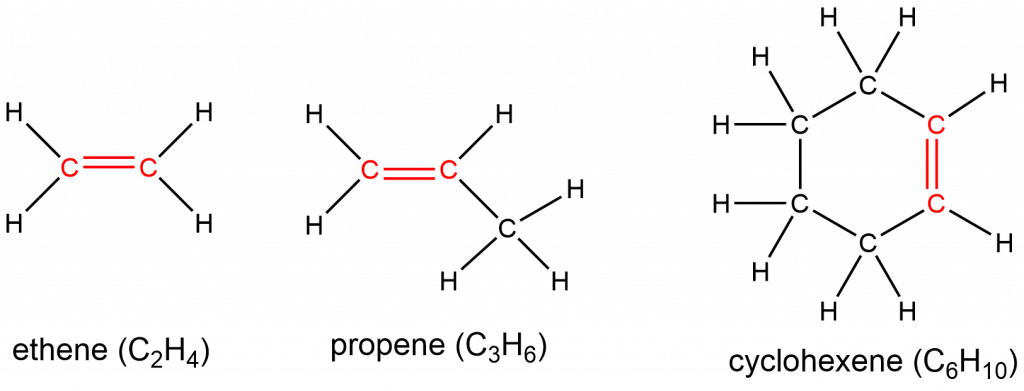
La presencia del enlace π hace que los alquenos sean mucho más reactivos que los alcanos porque un enlace π carbono-carbono suele ser más débil y se rompe más fácilmente que un enlace σ. El doble enlace es, por lo tanto, un grupo funcional, una estructura específica que tiene un comportamiento químico similar en cada molécula donde ocurre. Por ejemplo, todos los alquenos pueden sufrir una reacción característica, llamada reacción de adición, en la que el enlace π se rompe y se reemplaza por dos enlaces σ adicionales. Las moléculas de hidrógeno y halógeno pueden sufrir reacciones de adición con alquenos, por ejemplo:
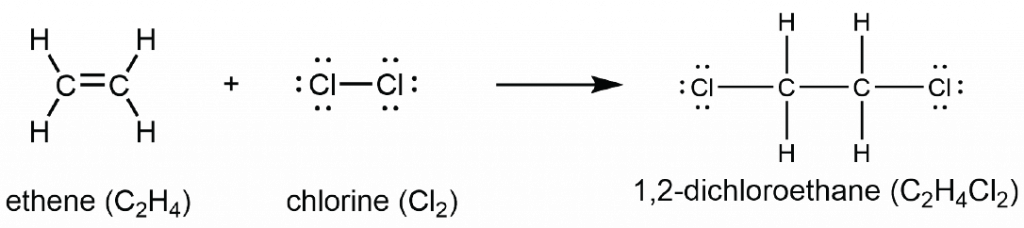
En esta reacción, el enlace π en el doble enlace C=C y el enlace Cl-Cl σ se rompen, y se forman dos enlaces C-Cl σ. El enlace σ en el doble enlace C=C permanece intacto a lo largo de la reacción. La reacción puede ocurrir con relativa facilidad porque el enlace π no es tan fuerte como el enlace σ, es decir, porque el doble enlace C=C (entalpía del enlace = 598 kJ/mol) no es dos veces más fuerte que el enlace sencillo C-C (entalpía del enlace = 346 kJ/mol).
Actividad 1: Análisis de una reacción de adición
Piense en la reacción del cloro con etano, CH 3 CH 3. ¿Puede ser esto una reacción de adición? Explique por qué o por qué no. ¿Qué enlaces deben romperse y formarse si el cloro reacciona con el etano y en qué se diferencia la reacción de la reacción del cloro con el eteno mostrada anteriormente? ¿Esperas que la reacción del cloro con etano sea más rápida o más lenta que la reacción con el eteno? ¿Por qué?
Alquinos D7.5
Un alquino es un hidrocarburo con uno o más triples enlaces carbono-carbono. Dos átomos de carbono unidos por un triple enlace están unidos entre sí por un enlace σ y dos enlaces π. La fórmula molecular general de un alquino con un triple enlace es C n H 2n -2. El alquino tiene cuatro átomos de hidrógeno menos que el alcano correspondiente con el mismo número de carbonos, y de ahí 2 grados de insaturación.
El sufijo -yne se utiliza para indicar la presencia de un triple enlace. El alquino más simple es el etino, C 2 H 2, comúnmente llamado acetileno. La estructura de Lewis para el etino es:
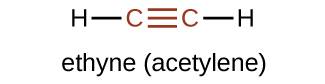
Químicamente, los alquinos tienen reactividad similar a los alquenos. Dado que el grupo funcional C=C tiene dos enlaces π, los alquinos pueden reaccionar con el doble de reactivo en una reacción de adición. Por ejemplo, el acetileno puede reaccionar con bromo en la siguiente reacción:
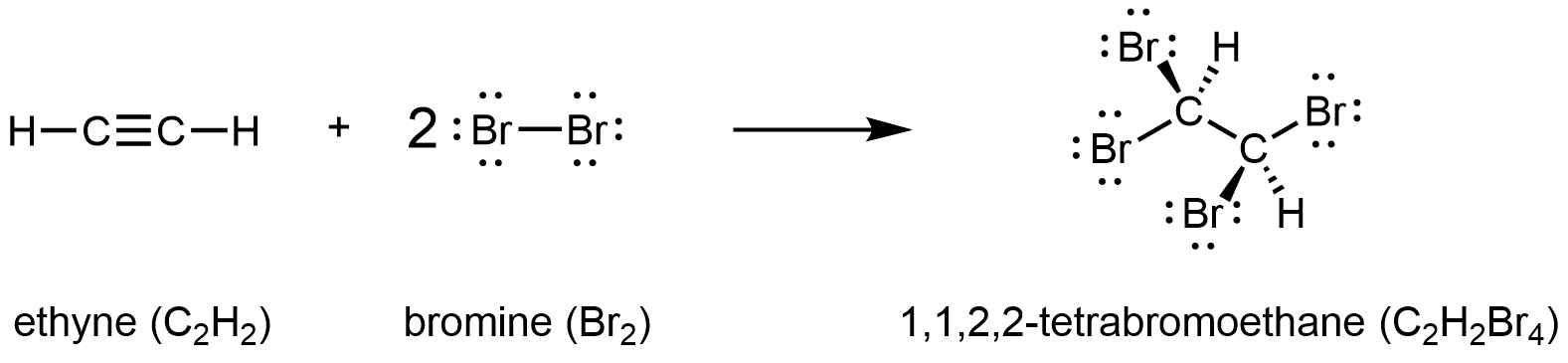
D7.6 Química del Petróleo
Petróleo (del latín, petra: “roca”, oleum: “petróleo”) consiste principalmente de hidrocarburos naturales, en su mayor parte alcanos y cicloalcanos. Las cadenas alcano pueden ser bastante largas, y propiedades como el punto de fusión y el punto de ebullición suelen variar de manera suave y predecible en función del número de electrones en diversas moléculas de alcano (Cuadro 1).
| alcano | Fórmula molecular | Número de electrones | Punto de fusión (°C) | Punto de ebullición (°C) | Fase a temperatura ambiente |
|---|---|---|---|---|---|
| metano | CH 4 | 10 | —182.5 | —161.5 | gas |
| etano | C 2 H 6 | 18 | —183.3 | —88.6 | gas |
| propano | C 3 H 8 | 26 | —187.7 | —42.1 | gas |
| butano | C 4 H 10 | 34 | —138.3 | —0.5 | gas |
| pentano | C 5 H 12 | 42 | —129.7 | 36.1 | líquido |
| hexano | C 6 H 14 | 50 | —95.3 | 68.7 | líquido |
| heptano | C 7 H 16 | 58 | —90.6 | 98.4 | líquido |
| octano | C 8 H 18 | 66 | —56.8 | 125.7 | líquido |
| nonano | C 9 H 20 | 74 | —53.6 | 150.8 | líquido |
| decano | C 10 H 22 | 82 | —29.7 | 174.0 | líquido |
| tetradecano | C 14 H 30 | 114 | 5.9 | 253.5 | sólido |
| octadecano | C 18 H 38 | 146 | 28.2 | 316.1 | sólido |
| Cuadro 1. Puntos de fusión y ebullición de alcanos. | |||||
El petróleo es la principal fuente de combustibles hidrocarbonados, como el gas LP, la gasolina y el fuelóleo. Estos se separan por destilación fraccionada, proceso en el que el petróleo se hierve y los diferentes hidrocarburos se condensan en líquidos a diferentes temperaturas (Figura 2). La destilación fraccionada aprovecha las diferencias de punto de ebullición de las diversas sustancias componentes (Cuadro 1). Los diferentes puntos de ebullición surgen de las diferencias en las fuerzas de dispersión de Londres entre moléculas.
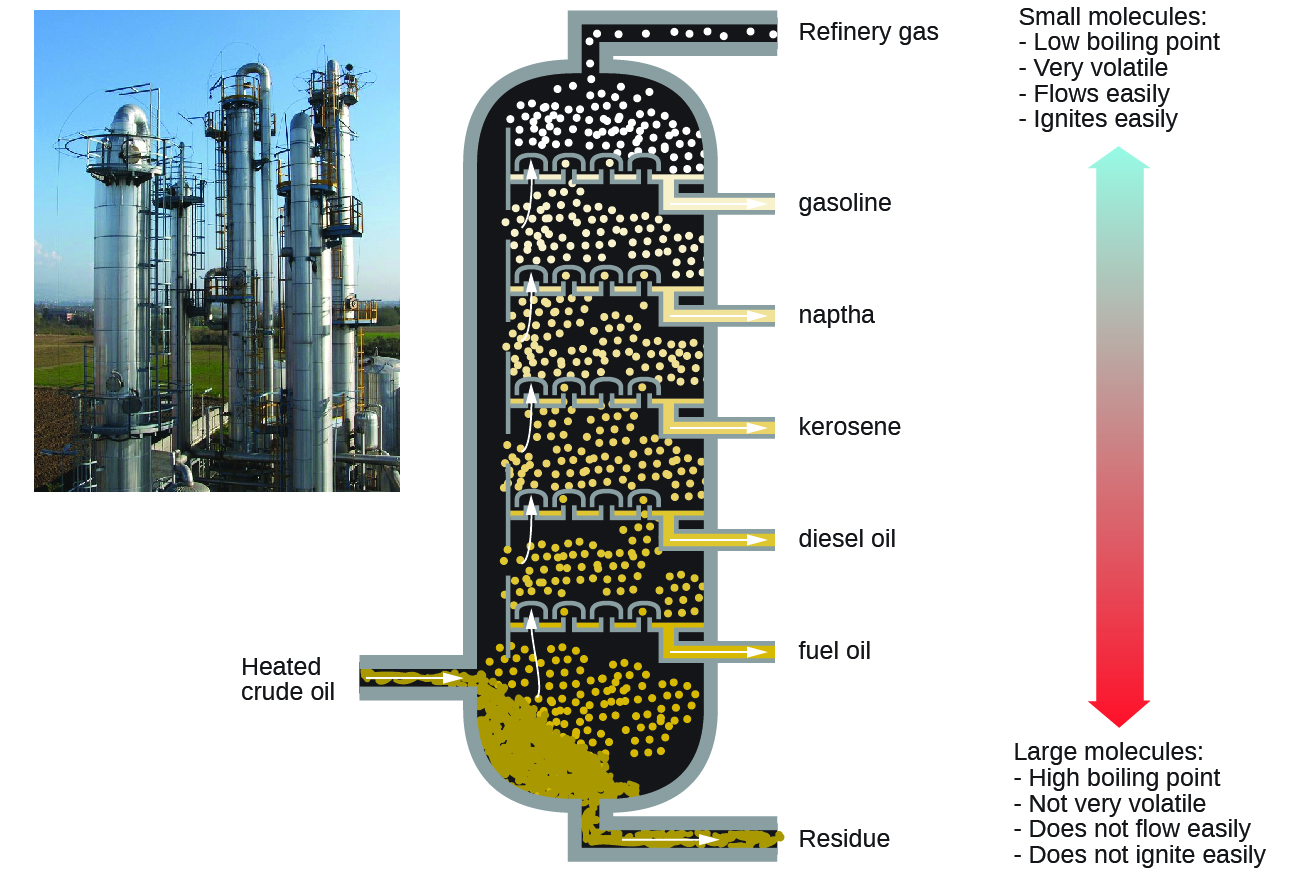
La gasolina es una mezcla líquida de alcanos lineales y ramificados, cada uno con cinco a doce átomos de carbono. La gasolina contiene diversos aditivos para mejorar su desempeño como combustible. El queroseno, el combustible diesel, el aceite de motor y el fuel oil son principalmente mezclas de alcanos hechos de moléculas más grandes con más electrones que las moléculas de gasolina. Siempre que haya suficiente oxígeno disponible, la combustión convierte casi todo el carbono en el combustible alcano en dióxido de carbono y agua. Así, la combustión de alcanos invariablemente agrega vapor de agua y CO 2 a la atmósfera, una contribución humana al calentamiento global.
Debido a que existe una mayor demanda de gasolina que de otros componentes del petróleo, el craqueo catalítico se utiliza en la refinación del petróleo para descomponer moléculas más grandes en moléculas más pequeñas, algunas de las cuales están dentro del rango de gasolina de 5 a 12 átomos de carbono. El craqueo catalítico implica temperaturas de 480—550 °C y un catalizador, condiciones que pueden romper (romper) los enlaces carbono-carbono y reorganizar las estructuras moleculares. Las moléculas de hidrocarburo se descomponen de manera bastante aleatoria para producir mezclas de moléculas más pequeñas, algunas de las cuales tienen dobles enlaces carbono-carbono. Una posible reacción que implique C 15 H 32 podría ser:
C 15 H 32 → 2 C 2 H 4 (eteno) + C 3 H 6 (propeno) + C 8 H 18 (octano)
Los productos alquenos, eteno y propeno, son importantes para producir otros químicos orgánicos. El producto de octano es un componente de la gasolina. Tenga en cuenta que el craqueo catalítico implica temperaturas más altas que la destilación fraccionada, así como un catalizador para romper los enlaces carbono-carbono (en lugar de superar los LDF entre las moléculas de hidrocarburos).
D7.7 Atracciones Entre Partículas a Escala Atómica
Considere las diferentes formas en que las partículas a escala atómica atraen a otras partículas de escala atómica y cómo las fortalezas de esas atracciones afectan las propiedades macroscópicas. Los átomos de gas nobles solo tienen fuerzas de dispersión (LDF) débiles de Londres entre ellos, lo que lleva a puntos de ebullición muy bajos.
Los metales consisten en iones positivos rodeados por electrones de valencia que no están asociados con ningún ion positivo específico (es decir, con ningún núcleo de metal-átomo específico). Las atracciones entre los átomos metálicos involucran iones positivos y electrones y, por lo tanto, son mucho más grandes que las atracciones entre los átomos de gas nobles. La unión metálica se vuelve más fuerte a medida que aumenta el número de electrones de valencia en el átomo metálico. Los átomos metálicos son atraídos lo suficientemente fuerte como para que la mayoría de los metales sean sólidos a temperatura ambiente
Cuando un átomo con baja atracción por electrones (un átomo metálico con baja energía de ionización) se acerca a un átomo con mayores atractivos para los electrones (un no metal con gran afinidad electrónica negativa), la densidad electrónica puede transferirse del átomo metálico al átomo no metálico para formar iones. Las atracciones de la ley de Coulomb entre los iones son grandes y dependen de las cargas de los iones y la distancia entre los iones. Esto da como resultado la formación de redes cristalinas iónicas que requieren un aumento significativo de la temperatura para fundir o hervir.
Cuando se acercan dos átomos no metálicos, el resultado típico es un enlace químico covalente, aunque hay casos como He 2 donde hay suficientes electrones para llenar orbitales moleculares antiadherentes así como unir orbitales moleculares y dar un orden de enlace de cero. Las características de los enlaces covalentes dependen de las propiedades de los átomos unidos, como el tamaño y el número de electrones. Los enlaces covalentes conectan los átomos para formar moléculas. Las fuerzas de los enlaces en las moléculas son típicamente tan grandes como o mayores que las resistencias de los enlaces metálicos y los enlaces iónicos. Así, cuando una sustancia molecular se funde o hierve, los átomos permanecen unidos y las partículas a escala atómica en la fase líquida o gaseosa son moléculas.
Por ejemplo, cuando el NaCl se funde, los iones Na + y los iones Clse rompen de la red cristalina y se mueven libremente unos alrededor de otros. Romper los enlaces iónicos requiere energía significativa y, por lo tanto, el NaCl tiene un alto punto de fusión de 801 °C. En contraste, cuando el metano (CH 4) se funde, las moléculas individuales de metano (CH 4) permanecen intactas, pero pueden moverse libremente alrededor de otras moléculas de metano. Las atracciones entre las moléculas de metano deben superarse parcialmente, pero esas atracciones no son tan fuertes como los enlaces covalentes o los enlaces iónicos. De ahí que el punto de fusión del metano sea mucho menor que para el NaCl. El metano se funde a −182 °C.
Día 7 Problema de Podia Pre-Clase: Fuerzas entre Partículas a Escala Atómica
Este problema de Podia se basa en el material de pre-clase actual; trabajar a través de ese material te ayudará a resolver el problema.
Las fuerzas entre átomos, iones y moléculas generalmente dan como resultado un gráfico de energía versus distancia entre partículas que se ve así:
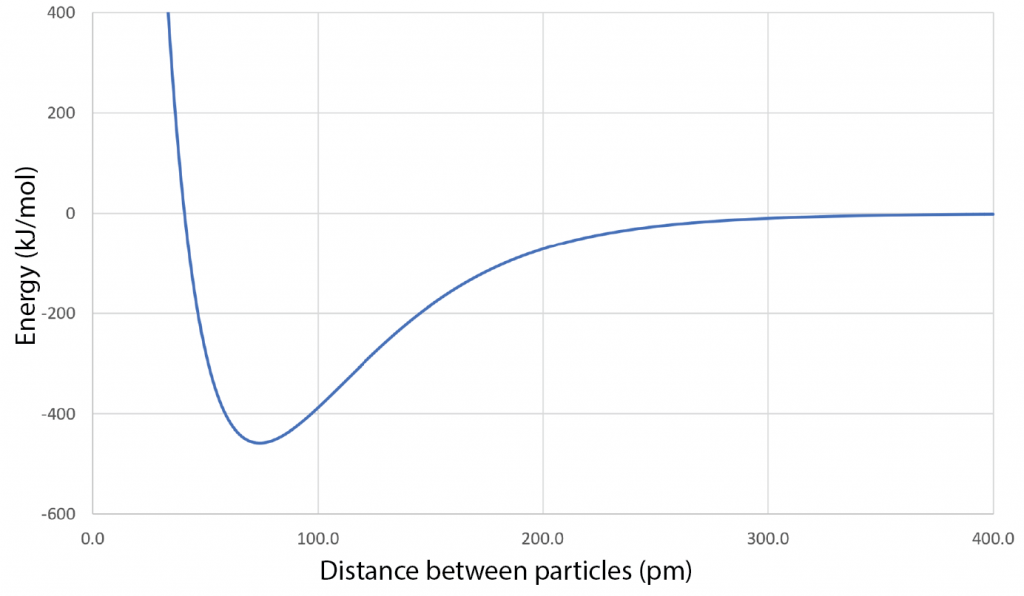
Para cada par de sustancias enumeradas a continuación, haga una gráfica de energía versus distancia entre partículas de escala atómica. Utilice un solo conjunto de ejes de coordenadas para cada par. Después dibuja una curva como la anterior para cada sustancia del par. Tus curvas deben ser a escala relativa entre sí, pero no hay necesidad de poner valores en las marcas de graduación a lo largo de los ejes. Las profundidades relativas de los mínimos y las posiciones relativas de los mínimos a lo largo del eje horizontal son importantes.
- NaCl y CaS
- CH 4 y C 6 H 14
- Cr y Cs
- Ne y CH 4
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


