1.6: Día 6- Orbitales Moleculares; Estructuras de Lewis
- Page ID
- 78782
6
Día 6: Orbitales Moleculares; Estructuras de Lewis
Moléculas diatómicas de segunda fila D6.1
Consideremos algunos ejemplos un poco más complejos de orbitales moleculares. F 2, O 2 y N 2 son moléculas diatómicas formadas por elementos de la segunda fila de la tabla periódica. Estas moléculas contienen muchos más electrones que H 2, y sus orbitales moleculares se derivan de p orbitales atómicos así como de s orbitales atómicos.
Práctica Adicional
Ahora piensa en lo que sucede cuando dos átomos que contienen 2 p orbitales atómicos se acercan entre sí. Supongamos que el eje internuclear es el eje z. Esto significa que los orbitales atómicos 2 p z están alineados a lo largo del eje internuclear mientras que los orbitales atómicos 2 p x y 2 p y están orientados perpendicularmente al eje internuclear.
Cuando los dos átomos se acercan, la superposición de unión y antiunión de los dos orbitales atómicos de 2 p z ocurre a lo largo del eje internuclear (eje z):
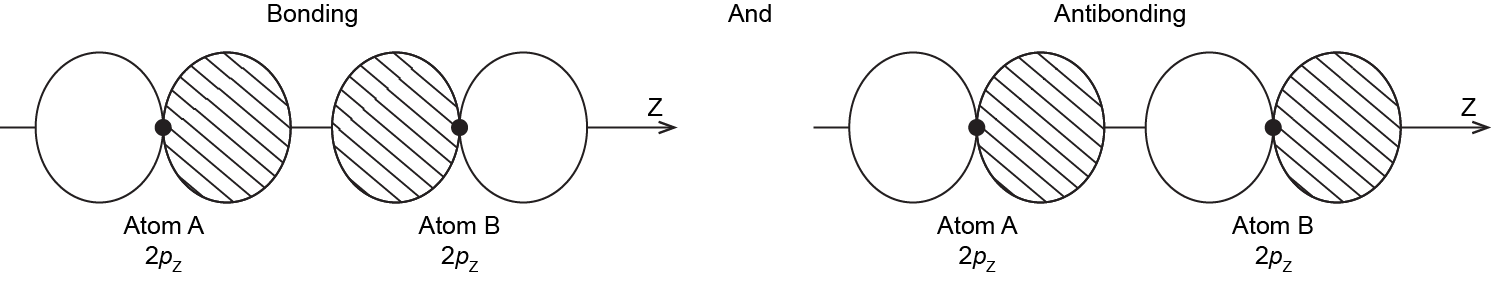
Los MO derivados de estas dos combinaciones están etiquetados σ ²y σ *². Si no entiendes por qué son estos MO tienen la etiqueta σ, revisa la Sección D5.5.
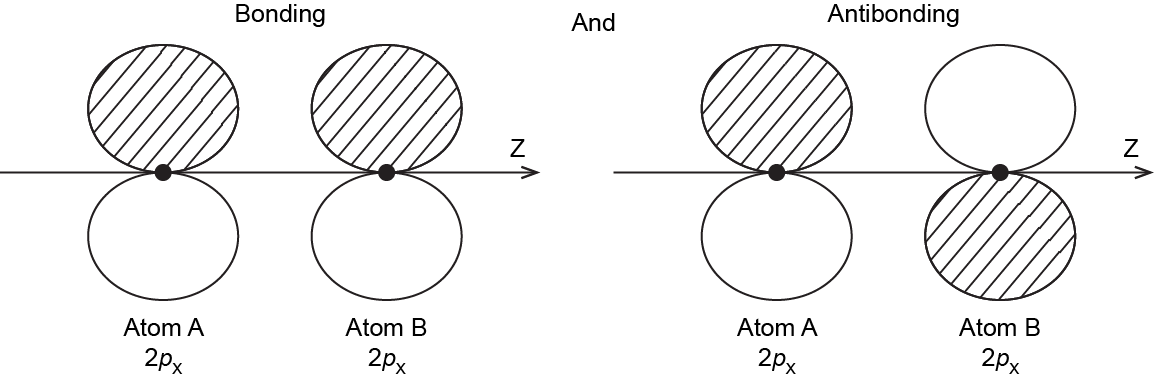
También es posible realizar combinaciones de unión y antiadhesión a partir de los dos AO de 2 p x y de los dos AO de 2 p y. Aquí hay un diagrama para las dos formas en que los 2 p x AO pueden superponerse. Observe que los orbitales se superponen uno al lado del otro, no al final, porque los 2 p x AO están alineados perpendicularmente al eje internuclear (eje z).
Práctica Adicional
Cuando dos AO de 2 p se superponen uno al lado del otro, el MO de unión formado no es simétrico con respecto a la rotación alrededor del eje internuclear. Así, el enlace formado no es un enlace σ. Si miras hacia abajo el eje internuclear (enlace), la “vista lateral” del MO se parece a un orbital atómico de 2 p; este MO se llama orbital π.
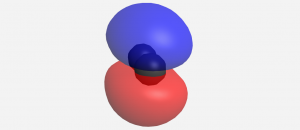
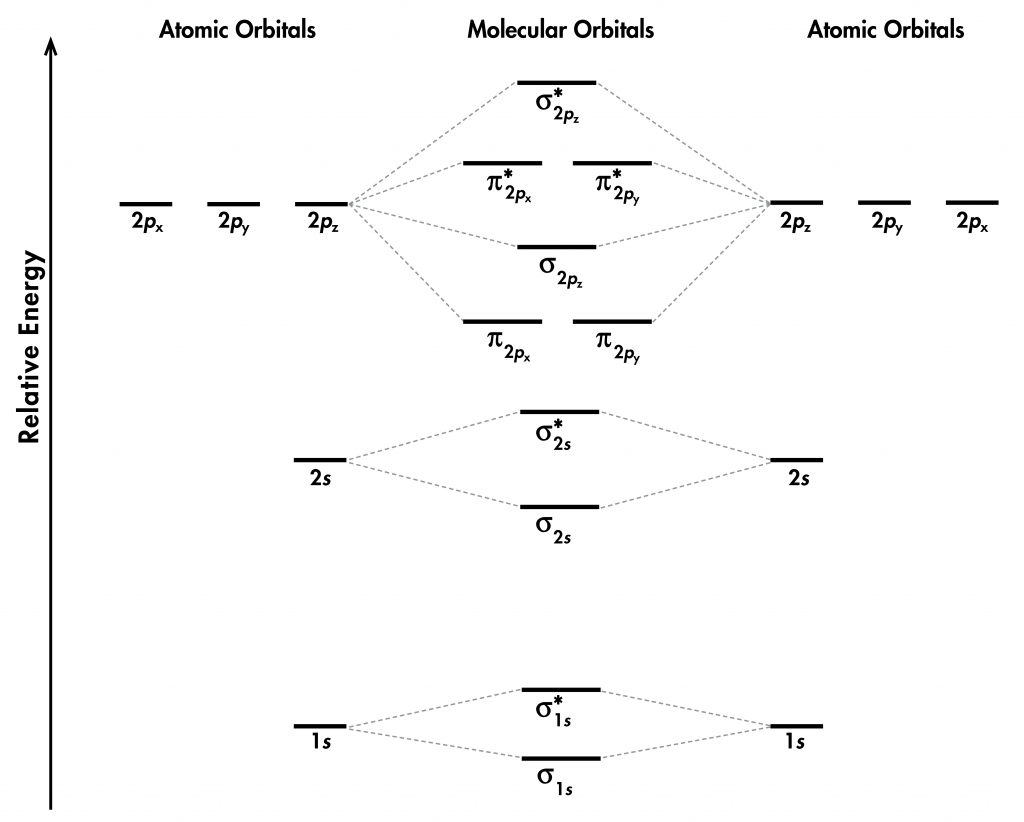
Piense en todos los orbitales atómicos que están ocupados en un átomo de flúor, F: 1 s, 2 s, 2 p z, 2 p x, y 2 p y. Por cada par de AO (como 2s en el átomo A con 2 s en el átomo B), la superposición produce un enlace y un MO antienlace. Hay σ y σ * para 1 s — 1s, 2 s — 2s y 2 p z — 2 p z superposiciones. Hay π y π * para 2 p x — 2 p x, y 2 p y — 2 p y se superpone. Estas ideas dan como resultado el diagrama de nivel de energía MO que se muestra aquí:
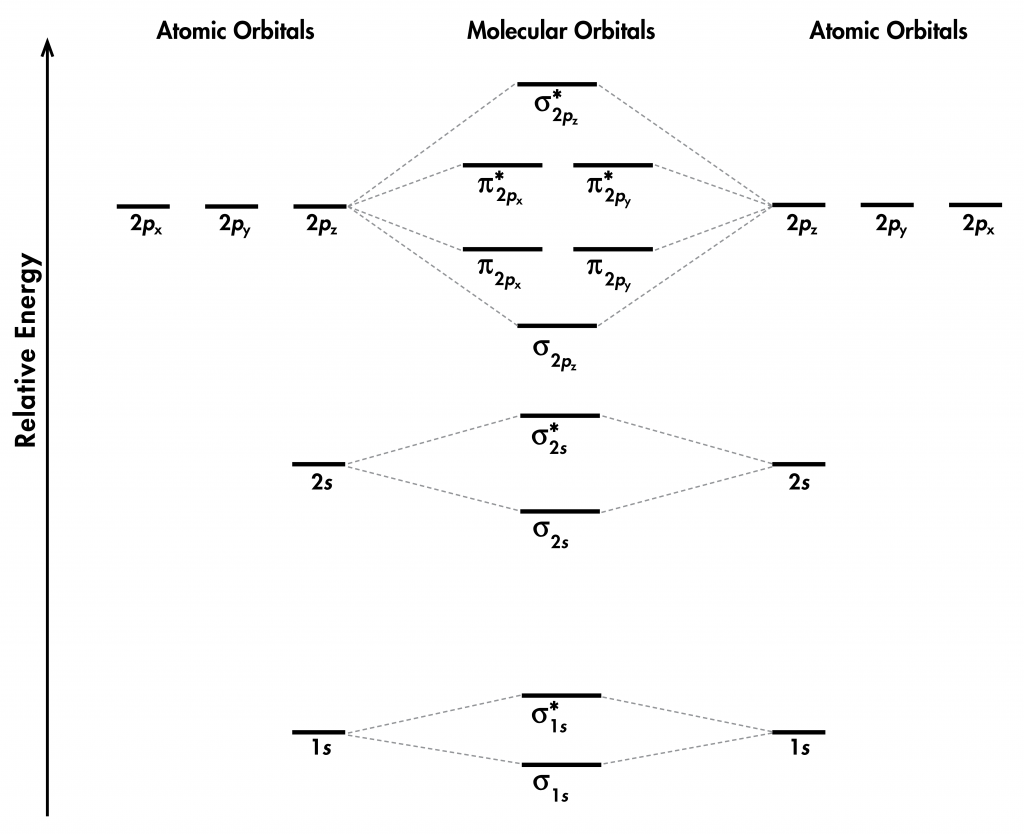 Figura 1. Diagrama de nivel de energía orbital molecular para una molécula F 2.
Figura 1. Diagrama de nivel de energía orbital molecular para una molécula F 2.
De los diez AO (cinco de cada átomo F), diez MO se forman en F 2. Tenga en cuenta que si un MO es unión o antiadhesión depende de si es menor o mayor en energía que los AO de los que se deriva. Por lo tanto, aunque σ *1es menor en energía que σ 1, sigue siendo un MO antienlace.
También vemos en la Figura 1 que los dos MOS de unión π, π²y π²y, son degenerados (tienen la misma energía). Esto se debe a que la superposición lado a lado de dos AOs de 2 p x es idéntica a la superposición lado a lado de dos AOs de 2 p y. Se diferencian sólo en que π2y π2y son perpendiculares entre sí, porque el 2 p x AO es perpendicular al 2 p y AO. Razonamiento similar lleva a la conclusión de que los π*²y π*²y MO también son degenerados. Reconocer MO degenerados es importante cuando se aplica la regla de Hund para determinar configuraciones de electrones moleculares.
La Figura 2 muestra la formación de los dos enlaces π perpendiculares a medida que dos átomos de N se acercan entre sí. (Las dos representaciones moleculares en la figura representan la misma molécula N 2: una muestra el solapamiento orbital 2 p x — 2 p x y y el otro muestra el solapamiento orbital 2 p y — 2 p y).
Práctica Adicional
Con base en la configuración electrónica para la molécula F 2, los MOs π y π * están todos llenos; no hay ningún enlace π neto en la molécula. Esto se refleja en el cálculo del orden de bonos: F 2 tiene un orden de bonos de 1, correspondiente a un enlace sencillo σ.
Longitud de enlace D6.2 y entalpía de enlace
La formación de una molécula covalente estable implica compartir electrones entre dos o más núcleos (los electrones ocupan orbitales moleculares que aumentan la densidad de electrones entre núcleos). La longitud del enlace entre dos núcleos adyacentes cualesquiera en dicha molécula covalente es la distancia entre los dos núcleos a la energía mínima en una gráfica de energía versus separación nuclear. Por ejemplo, la longitud del enlace en una molécula H 2 es de 74 pm, como se muestra en la Figura 3.
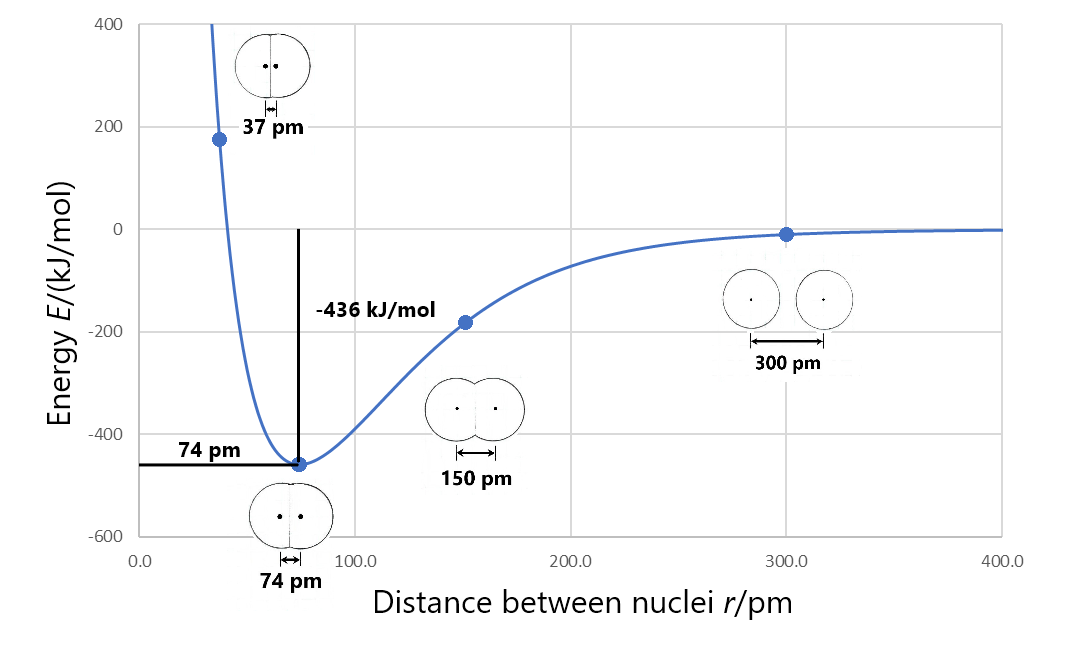
La entalpía de enlace (también llamada energía de enlace) es el cambio de entalpía cuando se rompe un enlace químico; es decir, cuando dos átomos unidos están completamente separados. Por ejemplo, la Figura 3 muestra que los átomos de hidrógeno unidos tienen energía de −436 kJ/mol con respecto a los átomos de hidrógeno separados. Esto significa que la energía de la molécula debe aumentarse en 436 kJ/mol para separar los átomos (romper el enlace). Por lo que la entalpía de enlace para H 2 es 436 kJ/mol.
Las longitudes de los enlaces simples se pueden estimar aproximadamente usando los radios covalentes de los átomos unidos. Por ejemplo, al agregar el radio covalente de C (77 pm) al de O (74 pm), se estima que la longitud de un enlace C-O es de 151pm. Esto es bastante cercano a la longitud promedio del enlace C-O de 143pm. (Ambos valores son estimados porque los radios covalentes y las longitudes de enlace se promedian sobre muchas moléculas y por lo tanto no son exactos para ninguna molécula específica).
En general, cuanto más grandes son los átomos, más largo es el enlace entre ellos. Por ejemplo, considere la siguiente tendencia en las longitudes promedio de enlaces C-X, donde X es un halógeno:
| C-F | 141pm |
| C-Cl | 176pm |
| C-Br | 191pm |
| C-I | 210pm |
Las longitudes de unión también dependen del orden de unión. Por ejemplo, el enlace sencillo C—C tiene una longitud promedio de 154pm, mientras que un doble enlace C=C tiene 134pm de largo, y un triple enlace C=C tiene una longitud promedio de 121pm.
Las comparaciones de los valores promedio de longitud de enlace y entalpía de enlace muestran una tendencia general: un enlace covalente con una longitud de enlace más corta generalmente tiene una entalpía de enlace mayor.
Enlace D6.3 en moléculas con más de dos átomos
Las moléculas con tres o más átomos tienen orbitales moleculares que abarcan toda la molécula. Los MO se derivan de la superposición de AO de todos los átomos de la molécula. Tanto las funciones de onda MO como la estructura del diagrama de nivel de energía son mucho más complicadas que para las moléculas diatómicas, pero existen técnicas matemáticas para calcular y mostrar las densidades de electrones que forman enlaces químicos. En este curso no profundizaremos en estos casos más complicados salvo para hacer varios puntos generales:
- El número de MO para una molécula es igual al número de AO en los átomos que componen la molécula.
- Las energías de los MO aumentan a medida que aumenta el número de nodos en el MO.
- Los MO pueden extenderse sobre toda la estructura molecular; no están necesariamente confinados a pares de átomos.
Si bien los MO proporcionan información física precisa sobre la molécula, como las energías de los electrones de valencia involucrados en una reacción, su visualización no siempre proporciona una comprensión química fácil. Es posible “volver a combinar” los MO de tal manera que las densidades de electrones se muestran como localizadas entre pares de átomos o en átomos individuales; esto nos permite correlacionar las densidades de electrones derivadas de MO con las estructuras de Lewis más familiares, que representan electrones en enlaces químicos como líneas entre pares de átomos y electrones en un solo átomo como puntos. Discutiremos más a fondo las estructuras de Lewis en el Día 7.
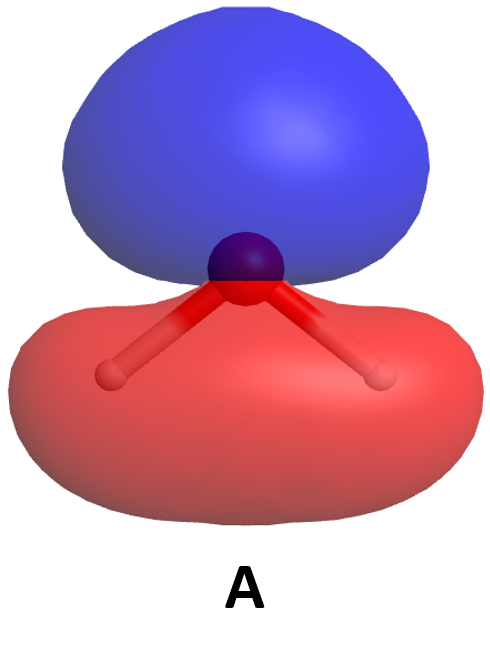
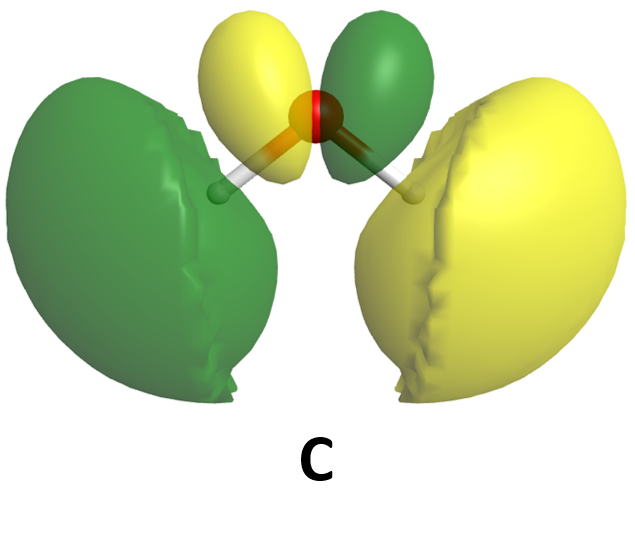
Ejercicio 6: MOs para moléculas poliatómicas
Aquí se muestran algunos de los orbitales moleculares para una molécula de agua. Con base únicamente en lo que se sabe sobre la aparición de orbitales de unión y antiadhesión, clasifique estos MO de la energía más baja a la energía más alta. (Haga clic en cada imagen para obtener una vista 3D giratoria del MO).
Actividad 1: Reflexión
Detente a pensar en orbitales moleculares y enlaces. Haz una lista de las principales cosas que aprendiste mientras estudiabas este tema tanto en el trabajo de hoy como en el trabajo del día anterior. Su lista debe proporcionar un resumen que pueda usar para revisar más adelante para un examen.
Estructuras de Lewis D6.4 para moléculas covalentes
Los orbitales moleculares para moléculas con tres o más átomos son complicados y difíciles de dibujar. Por lo tanto, aunque los MO transmitirían una imagen más descriptiva y precisa de la distribución de electrones dentro de una molécula, los químicos a menudo confían en diagramas más simples para representar el enlace covalente. Te ayudará a entender la química si puedes conectar mentalmente estos diagramas más simples con la imagen más completa dada por los MOs.
La representación dibujada a mano más comúnmente utilizada es la estructura de Lewis: un diagrama que representa núcleos atómicos y electrones centrales por símbolos químicos y electrones de valencia como puntos o líneas. Una estructura de Lewis se construye combinando diagramas de Lewis (Sección D3.4) de los átomos constituyentes.
Actividad 2: Diagramas de Lewis
Considera cada elemento que se enumera a continuación. En su cuaderno de curso escribe la configuración electrónica para un átomo de cada elemento, determina el número de electrones de valencia y escribe un diagrama de Lewis (Sección D3.4). ¿Cómo se relacionan los diagramas de Lewis con la posición de cada elemento en la tabla periódica?
N C S As O Br F Si H
En las estructuras de Lewis, se dibuja un solo enlace covalente como un par de puntos electrónicos compartidos entre dos átomos adyacentes, un par de enlaces. Los electrones de valencia que no están en un enlace se muestran como pares de puntos asociados con átomos individuales, pares solitarios. Por ejemplo:
![]()
En la molécula de Cl 2, cada átomo de Cl tiene tres pares solitarios y los dos átomos de Cl comparten un par de enlaces. De ahí que cada átomo de Cl en Cl 2 haya formado un octeto (está rodeado por ocho electrones de valencia).
Por simplicidad y claridad, un par de enlaces se representa típicamente por una línea en lugar de un par de puntos:

Actividad 3: Estructura de Lewis y intercambio de electrones
La regla del octeto
La regla del octeto establece que los átomos de los elementos del grupo principal tienden a ganar, perder o compartir suficientes electrones para formar un octeto (ocho electrones de valencia). Tales configuraciones de electrones de gas noble con cáscaras de valencia completamente llenas son más estables, y por lo tanto deberían corresponder a cómo se disponen los electrones en una molécula.
El diagrama de Lewis para un átomo puede usarse para predecir el número de enlaces que formará el átomo. Por ejemplo, un átomo de carbono tiene cuatro electrones de valencia y por lo tanto requiere cuatro electrones más para alcanzar un octeto:
Es importante tener en cuenta que es imposible superar un octeto para los átomos en el segundo periodo. Esto es particularmente relevante porque encontrarás numerosas moléculas que contienen los elementos C, N y O.
Finalmente, debido a que un átomo de hidrógeno solo necesita dos electrones para llenar su caparazón de valencia, H es una excepción importante a la regla del octeto y forma solo un enlace.
Bonos Dobles y Triples
Dos átomos pueden necesitar compartir más de un par de electrones para lograr el octeto requerido. En otras palabras, el orden de fianza es mayor que 1. Un doble enlace consiste en dos pares de electrones que se comparten entre dos átomos. Por ejemplo:

Se forma un triple enlace cuando tres pares de electrones se comparten entre dos átomos. Por ejemplo:

Actividad 4: Bonos Dobles y Triples
Escribe las respuestas a estas preguntas en tu cuaderno del curso:
Escriba una estructura de Lewis para N 2 y una estructura de Lewis para O 2. Describir el tipo de vínculo en cada caso.
¿Los átomos de N en N 2 y los átomos de O en O 2 siguen la regla para el número de enlaces en el Ejercicio 7?
Utilice el diagrama de nivel de energía molecular-orbital de la Figura 1 para calcular el orden de enlace para N 2 y para O 2. ¿Cómo se relacionan las órdenes de fianza con las estructuras de Lewis?
D6.5 Guía general para dibujar estructuras de Lewis
A menudo se puede dibujar una estructura de Lewis basada en el número de enlaces formados por cada tipo de átomo. En casos más complicados, aquí hay un procedimiento paso a paso para dibujar estructuras de Lewis de moléculas e iones poliatómicos:
- Determinar el número total de electrones de valencia sumando el número de electrones de valencia en todos los átomos.
- Para un catión poliatómico, restar un electrón por cada carga positiva.
- Para un anión poliatómico, agregue un electrón por cada carga negativa.
- Elija uno o más átomos centrales; un átomo central se une a varios otros átomos y suele ser el átomo que forma el mayor número de enlaces.
- Por lo general, el átomo central se escribe primero en una fórmula química, como P en pCl 3.
- Si hay dos o más átomos centrales, conéctelos usando líneas de enlace sencillo.
- Dibuja una estructura de esqueleto de la molécula disponiendo los otros átomos (que se llaman átomos terminales) alrededor del átomo o átomos centrales.
- Conecte los átomos terminales al átomo (s) central (s) por líneas de enlace sencillo.
- Distribuir los electrones restantes como pares solitarios en los átomos terminales (excepto hidrógeno), completando un octeto alrededor de cada átomo.
- Si todavía hay electrones de valencia disponibles, colóquelos en el/los átomo (s) central (s).
- Si el número de electrones alrededor de un átomo central es menor que un octeto, reorganice los electrones para hacer múltiples enlaces con el átomo o átomos centrales hasta que cada átomo tenga un octeto.
Apliquemos estas reglas a una molécula simple, amoníaco, NH 3.
Aquí hay un caso más complicado: eteno (etileno), C 2 H 4.
Ejercicio 8: Estructuras de Lewis y Electrones de Valencia
Si tuvieras que construir una estructura de Lewis para el ion nitrato (NO 3), ¿cuántos electrones necesitarías asignar en tu estructura? (En otras palabras, ¿cuántos electrones no centrales tienen que haber en tu estructura?)
Ejercicio 9: Identificar estructuras de Lewis incorrectas
Para cada estructura de Lewis, determine si la estructura es correcta. Si la estructura es incorrecta, identifique el error cometido en la representación.
D6.6 Excepciones a la Regla del Octeto
Algunas moléculas covalentes estables contienen uno o más átomos que no tienen octeto. Dichas moléculas se clasifican en tres categorías.
Moléculas de electrones imunes
Una molécula que contiene un número impar de electrones debe tener al menos un electrón desapareado y por lo tanto debe tener un átomo con menos de ocho electrones en su capa de valencia (típicamente son siete electrones). Una molécula con al menos un electrón desapareado se denomina radical libre. El óxido nítrico, NO, que se produce en motores de combustión interna cuando el oxígeno y el nitrógeno reaccionan a altas temperaturas, es un ejemplo.
Para dibujar la estructura de Lewis para una molécula de electrones impares, siga los mismos pasos descritos anteriormente, pero reconozca que una molécula de electrones impares debe tener menos de un octeto en algún átomo. Por ejemplo, la estructura de Lewis para NO es:
![]()
La formación de un triple enlace provocaría que el oxígeno o el nitrógeno superaran un octeto, lo que es una disposición electrónica muy poco probable.
Moléculas con un octeto incompleto sobre un átomo central
Algunas moléculas contienen un átomo central que no tiene una capa de valencia llena. Por lo general, estos átomos centrales son de los grupos 2 (IIA) y 13 (IIIA). Por ejemplo, la estructura de Lewis del cloruro de berilio, BeCl 2, muestra berilio con solo cuatro electrones, y la del trifluoruro de boro, BF 3, muestra boro con solo seis electrones.
Es posible dibujar una estructura para cada una de estas moléculas donde hay dobles enlaces al átomo central y por lo tanto un octeto. Por ejemplo, BF 3 con un doble enlace B=F satisfacería la regla del octeto. Sin embargo, la evidencia experimental nos dice que las longitudes de enlace en BF 3 están más cerca de los enlaces simples B-F. La reactividad observada de BF 3 también es consistente con menos de un octeto sobre boro: BF 3 reacciona fácilmente con NH 3, con el par solitario sobre nitrógeno (rojo) formando un enlace (rojo) que completa el octeto en el átomo de boro:
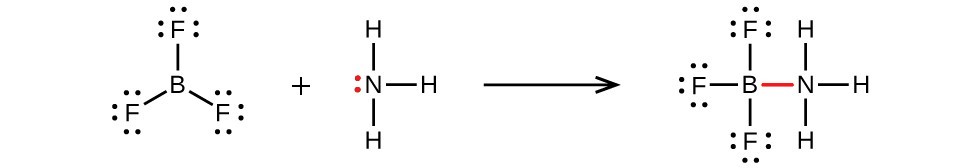
Moléculas con más que un octeto en un átomo central
Algunas estructuras de Lewis muestran más de cuatro pares de electrones alrededor del átomo central. Esto suele ocurrir cuando el átomo central se encuentra en el tercer o un periodo superior (n ≥ 3). Las moléculas con más de un octeto alrededor de un átomo central se denominan moléculas hipervalentes. Por ejemplo, en la estructura de Lewis para PCl 5, el átomo central de fósforo está rodeado por cinco pares de electrones. En SF 6, el azufre tiene seis pares de electrones.
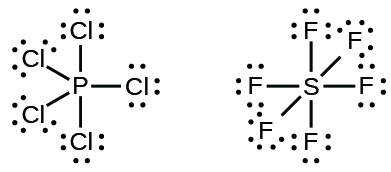
Día 6 Problema Podia Pre-clase: Niveles de Energía Orbital Molecular
Este problema de Podia se basa en el material de pre-clase actual; trabajar a través de ese material te ayudará a resolver el problema.
La molécula C2 es bastante inestable y solo puede aislarse y estudiarse experimentalmente en fase gaseosa. La espectroscopia molecular de C 2 revela que una molécula C 2 en estado fundamental no tiene electrones desapareados.
- Utilice el diagrama de nivel de energía MO en la Figura 1 para predecir la configuración electrónica del estado fundamental de C 2. ¿Su resultado concuerda con la observación experimental?
- Considera el diagrama MO a continuación. ¿Es este un mejor diagrama que la Figura 1 para C 2? Utilizar un lenguaje científicamente apropiado para explicar qué diagrama es mejor.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.