4.8: Día 34- Reacciones ácido-Base
- Page ID
- 78930
31
Día 34: Reacciones ácido-Base
Ácidos polipróticos D34.1
Podemos clasificar los ácidos por el número de protones por molécula que pueden donar en una reacción ácido-base. Los ácidos que contienen un átomo de hidrógeno ionizable por molécula se denominan ácidos monopróticos. Los ejemplos son HCl, HNO 3, CH 3 COOH y HCN.
Aunque contiene cuatro átomos de hidrógeno, el ácido acético también es monoprótico porque solo el átomo de hidrógeno del grupo carboxilo (-COOH) reacciona con bases:

Los tres átomos de hidrógeno en el grupo metilo no son reactivos (los enlaces C-H son similares a los de los alcanos, que no son reactivos).
En el mismo sentido, las bases monopróticas son bases que aceptan un solo protón.
Los ácidos dipróticos contienen dos átomos de hidrógeno ionizables por molécula. La disociación del primer H + siempre se lleva a cabo en mayor medida que la disociación del segundo H +. Por ejemplo, el ácido sulfúrico se ioniza en dos etapas:
| H 2 SO 4 (aq) + H 2 O (l) | ⇌ | HSO 4 — (aq) + H 3 O + (aq) | K a,1 > 10 2 |
| HSO 4 — (aq) + H 2 O (l) | ⇌ | SO 4 2 - (aq) + H 3 O + (aq) | K a,2 = 1.1 × 10 -2 |
Esta ionización paso a paso ocurre para todos los ácidos polipróticos.
Una solución de un ácido diprótico débil contiene una mezcla de ácidos. Por ejemplo, cuando el ácido carbónico pierde un H +, produce iones hidronio e iones bicarbonato en pequeñas cantidades:
H 2 CO 3 (aq) + H 2 O (l) HCO 3 — (aq) + H 3 O + (aq)
\[K_{\text{a, H}_2\text{CO}_3} = \dfrac{[\text{H}_3\text{O}^{+}]_e[\text{HCO}_3^{\;-}]_e}{[\text{H}_2\text{CO}_3]_e} = 4.3\;\times\;10^{-7} \nonumber \]
El ion bicarbonato puede perder un H + para formar iones hidronio e iones carbonato en cantidades aún más pequeñas:
HCO 3 — (aq) + H 2 O (l) CO 3 2 - (aq) + H 3 O + (aq)
\[K_{\text{a, HCO}_3^-} = \dfrac{[\text{H}_3\text{O}^{+}]_e[\text{CO}_3^{\;2-}]_e}{[\text{HCO}_3^{\;-}]_e} = 4.7\;\times\;10^{-11}\;\text{M} \nonumber \]
K a (H 2 CO 3) es mayor que K a (HCO 3) en aproximadamente cuatro órdenes de magnitud (10 4 veces mayor), por lo que H 2 CO 3 es el productor dominante de H 3 O + en el solución. Esto significa que las concentraciones de H 3 O + y HCO 3 — son prácticamente iguales en una solución acuosa pura de H 2 CO 3.
Si K a,1 de un ácido diprótico débil al menos 20 veces mayor que K a,2, es apropiado tratar la primera ionización por separado y calcular las concentraciones resultantes de ella antes de calcular las concentraciones de especies resultantes de la ionización posterior. Esto puede simplificar nuestro trabajo considerablemente porque podemos determinar la concentración de H 3 O + y la base conjugada a partir de la primera ionización, luego determinar la concentración de la base conjugada de la segunda ionización en una solución con concentraciones determinadas por la primera ionización.
Actividad 1: Ionización de un ácido diprótico
Un ácido triprótico es un ácido que tiene tres protones que se someten a ionización gradual: El ácido fosfórico es un ejemplo:
H 3 PO 4 (aq) + H 2 O (l) H 2 PO 4 — (aq) + H 3 O + (aq) K a,1 = 7.2 × 10 -3 M
H 2 PO 4 — (aq) + H 2 O (l) HPO 4 2 - (aq) + H 3 O + (aq) K a,2 = 6.3 × 10 -8 M
HPO 4 2 - (aq) + H 2 O (l) PO 4 3 - (aq) + H 3 O + (aq) K a,3 = 4.6 × 10 -13 M
Nuevamente, las diferencias en las constantes de ionización de estas reacciones nos dicen que el grado de ionización es significativamente más débil en cada paso sucesivo. Esta es una característica general de los ácidos polipróticos. Aquí, debido a que las constantes de ionización sucesivas difieren en un factor de 10 5 -10 6, los cálculos de las concentraciones de equilibrio en una solución de H 3 PO 4 se pueden descomponer en una serie de partes, similares a la actividad 1.
Las bases polipróticas pueden aceptar más de un H +. El ion carbonato es un ejemplo de una base diprótica, ya que puede aceptar hasta dos protones. Las soluciones de carbonatos de metales alcalinos (por ejemplo, K 2 CO 3) son bastante alcalinas, debido a las reacciones:
CO 3 2 - (aq) + H 2 O (l) HCO 3 — (aq) + OH — (aq)
HCO 3 — (aq) + H 2 O (l) H 2 CO 3 (aq) + OH — (aq)
Reacciones ácido-base D34.2
Mezclar una solución de un ácido con una solución de una base da como resultado una reacción de neutralización ácido-base que produce una sal y agua. La termodinámica de una reacción ácido-base dicta que se favorece el lado con el ácido más débil y la base más débil. En otras palabras, si el ácido más débil y la base más débil están en el lado izquierdo de una reacción de equilibrio, la reacción es favorecida por el reactivo en el equilibrio; si el ácido más débil y la base más débil están en el lado derecho, la reacción es favorecida por el producto en equilibrio. Las resistencias de ácidos y bases son cuantitativamente comparables por sus valores K a y K b, los cuales se pueden obtener de una tabla de referencia.
Un ácido fuerte reacciona con una base fuerte para formar una solución neutra (que contiene concentraciones iguales de H 3 O + y OH) siempre que se mezclen cantidades estequiométricamente equivalentes de ácido y base. Por ejemplo: ×
HCl (ac) + NaOH (ac) NaCl (ac) + H 2 O (l)
La sal formada, NaCl (ac), consiste en Na + (aq) y Cl − (aq), cada una de las cuales tiene una fuerza de ácido o base despreciable. De ahí que este equilibrio favorece en gran medida el lado del producto y va esencialmente a su finalización. (Nótese que cualquier sal soluble consiste en iones acuosos, por lo que la fórmula NaCl (ac) representa una solución acuosa que consiste en el mismo número de iones Na + (ac) y Cl − (ac).) Si la mezcla tiene un exceso de uno de los reactivos, entonces la concentración de ácido sobrante (HCl) o base (NaOH) determina el pH de la solución.
Un ácido débil reacciona con una base fuerte para formar una sal que contiene la base conjugada del ácido débil, que suele ser una base débil. Por ejemplo, la reacción de ácido acético con hidróxido de sodio forma acetato de sodio:
CH 3 COOH (ac) + NaOH (ac) CH 3 COONa (aq) + H 2 O (l)
El equilibrio de esta reacción favorece el lado del producto, y la reacción se puede aproximar como que va a completarse. Mezclar cantidades estequiométricamente equivalentes de reactivos da una solución que contiene Na + (ac), que no tiene efecto sobre el pH de la solución, y CH 3 COO — (ac), la base conjugada del ácido acético. Debido a que el anión acetato es una base débil, el pH de la solución es >7 después de que el ácido acético reaccione estequiométricamente con una base fuerte. La reacción de base débil es:
CH 3 COO — (aq) + H 2 O (l) CH 3 COOH (aq) + OH − (aq)
La constante de equilibrio para esta reacción es la constante de ionización, K b, para el anión acetato. (Algunas tablas de referencia solo reportan constantes de ionización para los ácidos; K b se puede calcular a partir de K w y K a del conjugado ácido—ácido acético en este caso). Generalizando este ejemplo, cuando una base fuerte reacciona estequiométricamente con un ácido débil, la solución que resulta es básica.
Un ácido fuerte que reacciona con una base débil forma una sal que contiene el ácido conjugado de la base débil, que suele ser un ácido débil. Por ejemplo, la reacción de HCl con amoníaco forma cloruro de amonio:
NH 3 (ac) + HCl (ac) NH 4 Cl (ac)
El equilibrio de esta reacción favorece el lado del producto, y la reacción puede aproximarse como yendo a complección. Mezclar cantidades estequiométricamente equivalentes de reactivos da una solución que contiene Cl − (ac), que es la base conjugada de un ácido fuerte y no tiene efecto sobre el pH de la solución, y NH 4 + (ac), el ácido conjugado del amoníaco. Debido a que el ion amonio es un ácido débil, el pH de la solución sería <7 después de que el amoníaco reaccione estequiométricamente con un ácido fuerte. La reacción es:
NH 4 + (aq) + H 2 O (l) NH 3 (aq) + H 3 O + (aq)
La constante de equilibrio para esta reacción es la constante de ionización, K a, para el ácido NH 4 +. Generalizando este ejemplo, cuando una base débil reacciona estequiométricamente con un ácido fuerte, la solución que resulta es ácida.
Actividad 2: pH de una sal de amonio
Para predecir el pH de una solución resultante de la reacción entre un ácido débil y una base débil, debemos conocer tanto la K a del ácido débil como la K b de la base débil. Si K a > K b, la solución es ácida; si K b > K a, la solución es básica.
D34.3 Reacción entre especies anfipróticas
Las reacciones ácido-base también pueden ocurrir entre dos especies anfipróticas. Por ejemplo, mezclar una solución que contiene iones sulfato de hidrógeno (HSO 4 —) y una solución que contiene iones hidrogenocarbonato (HCO 3 —) da como resultado una reacción ácido-base. Sin embargo, si ambos reactivos pueden actuar como un ácido o una base, ¿qué reactivo es el ácido y cuál es la base? En la mezcla de ejemplo, hay dos posibilidades:
posibilidad I: HSO 4 — (aq) + HCO 3 — (aq) SO 4 2 - (aq) + H 2 CO 3 (aq)
posibilidad II: HSO 4 — (aq) + HCO 3 — (aq) H 2 SO 4 (aq) + CO 3 2 - (aq)
Cualitativamente, una reacción ácido-base favorecida por el producto implica un ácido más fuerte que reacciona con una base más fuerte para formar un ácido más débil y una base más débil. Las fuerzas ácidas y básicas son comparables por los valores de K a y K b.
En posibilidad I los ácidos son HSO 4 − (K a = 1.1 × 10 -2) y H 2 CO 3 (K a = 4.3 × 10 -7) y las bases son HCO 3 − (K b = 2.3 × 10 -8) y SO 4 2 − (K b = 9.1 × 10 -13). El ácido más fuerte y la base más fuerte están en el lado izquierdo de la ecuación, por lo que esta reacción es favorecida por el producto.
Por otro lado, la posibilidad II se ve favorecida por el reactivo porque produce H 2 SO 4, un ácido fuerte, y CO 3 2 -, una base débil con una K b relativamente grande = 2.1 × 10 −4 (significativamente mayor que la K b para HSO 4 —).
Cuantitativamente, podemos hacer uso de las constantes de ionización para determinar qué reacción ocurre. En posibilidad yo,
HSO 4 — (aq) + H 2 O (l) SO 4 2 - (aq) + H 3 O + (aq)
\[K_1 = K_{\text{a, HSO}_4^-} = 1.1\;\times\;10^{-2} \nonumber \]
HCO 3 — (aq) + H 3 O + (aq) H 2 CO 3 (aq) + H 2 O (l)
\[K_2 = \dfrac{1}{K_{\text{a, H}_2\text{CO}_3}} = \dfrac{1}{4.3\;\times\;10^{-7}} \nonumber \]
La suma de estos dos equilibrios da la reacción global para la posibilidad I: HSO 4 — (aq) + HCO 3 — (aq) SO 4 2 - (aq) + H 2 CO 3 (aq), y la constante de equilibrio total es:
\[K_{\text{total, possibility I}} = K_1 \times K_2 = \dfrac{1.1\;\times\;10^{-2}}{4.3\;\times\;10^{-7}} = 2.6\;\times\;10^{4} \nonumber \]
Claramente, la posibilidad I es favorecida por el producto en equilibrio porque la constante de equilibrio es mucho mayor que 1.
En posibilidad II,
HSO 4 — (aq) + H 3 O + (aq) H 2 CO 3 (aq) + H 2 O (l)
\[K_1 = \dfrac{1}{K_{\text{a, H}_2\text{SO}_4}} ≤ \dfrac{1}{20} \nonumber \]
HCO 3 — (aq) + H 2 O (l) CO 3 2 - (aq) + H 3 O + (aq)
\[K_2 = K_{\text{a, HCO}_3^-} = 4.7\;\times\;10^{-11} \nonumber \]
(K a para H 2 SO 4 es demasiado grande para medirlo en solución acuosa pero es mayor que K a para HNO 3, que es 20, por lo que el valor 20 es un mínimo para K a para H 2 SO 4.) La suma de estos dos equilibrios da la reacción global para la posibilidad II: HSO 4 — (aq) + HCO 3 — (aq) H 2 SO 4 (aq) + CO 3 2 - (aq), y la constante de equilibrio total es:
\[K_{\text{total, possibility II}} = K_1 \times K_2 = \dfrac{4.7\;\times\;10^{-11}}{20} = 2\;\times\;10^{-12} \nonumber \]
La posibilidad II está fuertemente favorecida por los reactivos en el equilibrio. Por lo tanto, de las dos posibilidades, la reacción que procede (y produce productos) es la posibilidad I, donde HSO 4 —actúa como ácido y HCO 3 — actúa como base.
D34.4 Aminoácidos
Los aminoácidos son anfipróticos porque cada molécula de aminoácido contiene un grupo ácido carboxílico que puede donar un protón y un grupo amina que puede aceptar un protón. Los ácidos carboxílicos son moderadamente ácidos, muchos con K a de ~10-5. Las aminas orgánicas son algo básicas, muchas con K b de ~10 -4. Esta combinación crea una situación interesante, donde una reacción ácido-base es posible dentro de una sola molécula de aminoácido:

El grupo ácido carboxílico, con K a = ~10 -5, es un ácido más fuerte que el grupo amina protonada, con K a = K w/K b (amina) = 10 -14 /10 -4 = ~10 -10. El grupo amina (K b = ~10-4) es una base más fuerte que el anión carboxilato (K b = ~10-9). El ácido más fuerte y la base más fuerte están en el lado izquierdo por lo que esta reacción es favorecida por el producto a pH = ~7. De ahí que al pH de un organismo vivo típico, el aminoácido es un zwitterión (alemán para “doble ion”). Un zwitterion es una especie sin carga eléctrica general pero con partes separadas que están cargadas positiva y negativamente.
La formación de un zwitterión es análoga a la reacción ácido-base entre metilamina (K b = 4.4 × 10 -4) y ácido acético (K a = 1.8 × 10 -5):
CH 3 NH 2 (aq) + CH 3 COOH (aq) CH 3 NH 3 + (aq) + CH 3 COO — (aq)
donde el equilibrio favorece los productos porque:
\[K_{total} = \dfrac{1.8\;\times\;10^{-5}}{2.3\;\times\;10^{-11}} = 7.8\;\times\;10^{5} \nonumber \]
Aumentar el pH de una solución de aminoácidos mediante la adición de iones hidróxido puede eliminar el ion hidrógeno del grupo -NH 3 +:
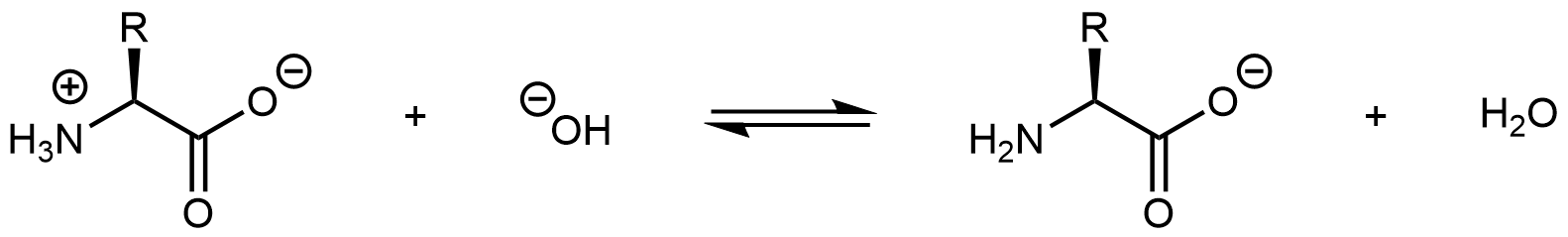
La molécula producto ya no es un zwitterión. En cambio, es un anión con una carga global de -1.
De manera similar, al disminuir el pH al agregar ácido fuerte a una solución de aminoácidos se protonan la parte -COO — del zwitterión:

Nuevamente, la molécula producto no es un zwitterión, sino un catión con una carga global de +1.
Pregunta Podia
Escribir una explicación clara y concisa en un lenguaje científicamente apropiado para cada una de estas afirmaciones correctas.
1. Cuando un ácido poliprótico dona un ión hidrógeno, la especie que permanece suele ser un ácido mucho más débil que el ácido poliprótico original.
2. Cuando el ácido tricloroacético reacciona con el ion hidrogenocarbonato, el equilibrio es significativamente más favorecido por el producto que cuando el ácido acético reacciona con el ion hidrogenocarbonato.
3. Cuando una base fuerte reacciona con un ácido débil en cantidad estequiométricamente equivalente, el pH de la solución es superior a 7.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


