4.7: Día 33- Ácidos y Bases
- Page ID
- 78939
30
Día 33: Ácidos y Bases
Aplicaremos los conocimientos aprendidos hasta ahora, por ejemplo, termodinámica, cinética, estructura molecular, etc., para explorar dos tipos prevalentes de reacciones químicas: reacciones ácido-base y reacciones redox/electroquímicas.
D33.1 Definición de ácidos y bases
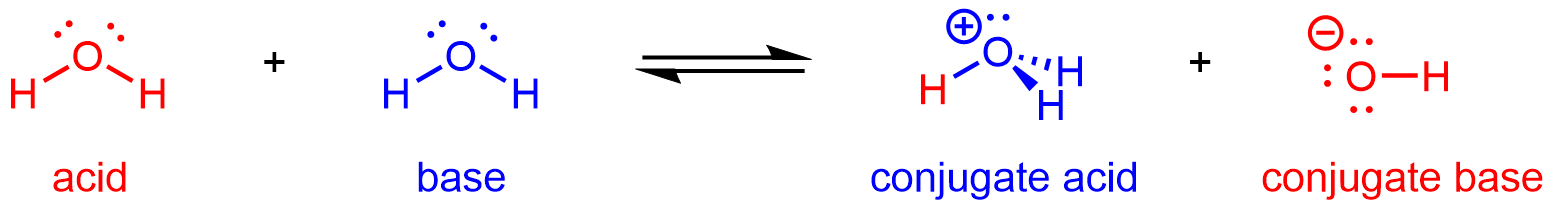
Según la definición ácido-base de Brønsted-Lowry, una especie química que dona un protón (ion hidrógeno, H +) a otra especie química se llama ácido y una especie química que acepta un protón es una base. (Recordemos que cuando un átomo de H pierde un electrón, solo queda el protón en el núcleo, por lo que un protón es un ion H +). Una reacción ácido-base es la transferencia de un protón de un donante de protones (ácido) a un aceptor de protones (base).
La especie química que permanece después de que un ácido ha donado un protón se llama la base conjugada de ese ácido. Considere estos ejemplos de la reacción genérica ácido + H 2 O base conjugada + H 3 O +:
HF + H 2 O F — + H 3 O +
H 2 SO 4 + H 2 O HSO 4 — + H 3 O +
HSO 4 — + H 2 O SO 4 2 - + H 3 O +
NH 4 + H 2 O NH 3 + H 3 O +
De igual manera, la especie química que se forma después de que una base acepta un protón se llama el ácido conjugado de esa base. Considere los siguientes ejemplos de la base de reacción genérica + H 2 O conjugado ácido + OH —:
NH 3 + H 2 O NH 4 + + OH —
S 2- + H 2 O HS — + OH —
CO 3 2 - + H 2 O HCO 3 — + OH —
F — + H 2 O HF + OH —
A partir de estos ejemplos, podemos ver que el ácido conjugado y la base conjugada están emparejados: la base conjugada de un ácido tiene ese ácido como su ácido conjugado. Por ejemplo, NH 3 es la base conjugada de NH 4 +, mientras que NH 4 + es el ácido conjugado de NH 3. De manera similar, Fes la base conjugada de HF, mientras que HF es el ácido conjugado de F.
Es posible que hayas notado en secciones anteriores que escribimos H + (aq) para representar iones hidrógeno en solución acuosa, mientras que en las reacciones anteriores hemos escrito H 3 O +. Un ion H +, un protón, es mucho más pequeño que cualquier otro catión y por lo tanto es una carga positiva altamente concentrada que atrae fuertemente dipolos de molécula de agua y forma fuertes enlaces de hidrógeno. Así, cuando un ácido de Brønsted-Lowry transfiere un protón al agua, más de una sola molécula de agua acepta el protón. Los experimentos muestran que pueden estar involucradas hasta seis moléculas de agua, lo que haría que la fórmula de H + (aq) H 13 O 6 +, pero la estructura cambia continuamente a medida que las moléculas de agua se mueven en el líquido. Para las reacciones ácido-base de Brønsted-Lowry, utilizaremos H 3 O + (aq) para enfatizar que un protón ha sido transferido al agua y representar la estructura real más complicada. En general, H + (aq) es apropiado para representar un protón rodeado de muchas moléculas de agua.
Finalmente, las reacciones ácido-base de Brønsted-Lowry son muy rápidas. Su equilibrio se establece rápidamente y este equilibrio es un aspecto importante cuando consideramos las fortalezas ácidas y básicas más adelante.
D33.2 Autoionización de Agua
En las reacciones de ejemplo anteriores, también hay otros dos pares ácido-base conjugados: H 2 O es la base conjugada de su ácido conjugado H 3 O +, y H 2 O es el ácido conjugado de su base conjugada OH —. (Sin embargo, tenga en cuenta que H 3 O + no es el ácido conjugado de OH —; estas dos especies no son un par ácido-base conjugado porque sus estructuras no difieren en un solo H +.)
De ahí que H 2 O pueda reaccionar como un ácido o una base dependiendo de las otras especies involucradas en la reacción. En agua pura, H 2 O actúa como ácido y base, una fracción muy pequeña de moléculas de agua donan protones a otras moléculas de agua:
Este tipo de reacción, en la que una sustancia se ioniza cuando una molécula de la sustancia reacciona con otra molécula de la misma sustancia, se denomina autoionización.
El agua pura se somete a autoionización en un grado muy leve: solo aproximadamente dos de cada 10 9 moléculas se ionizan a 25 °C Los [H 3 O +] e y [OH —] e dan una constante de autoionización para el agua, K w = 1.0 × 10 −14 a 25 °C Debido a que es el producto matemático de las concentraciones de dos iones, también se le llama la constante ión-producto para el agua.
H 2 O (l) + H 2 O (l) H 3 O + (aq) + OH — (aq) K w = [H 3 O +] e [OH —] e = 1.0 × 10 −14 a 25 °C
Actividad 1: Autoionización de Agua
El agua es un ejemplo de una especie química anfiprótica, una molécula que podría ganar un protón o perder un protón en una reacción ácido-base. Las especies anfipróticas también son anfóteras, un término más general para una especie que puede actuar como ácido o como base por cualquier definición (no solo la definición de Brønsted-Lowry). Por ejemplo, el ion bicarbonato también es anfótero:
HCO 3 — (aq) + H 2 O (l) CO 3 2 - (aq) + H 3 O + (aq)
HCO 3 — (aq) + H 2 O ( l) H 2 CO 3 (aq) + OH — (aq)
Actividad 2: Especies anfipróticas
D33.3 pH y PoH
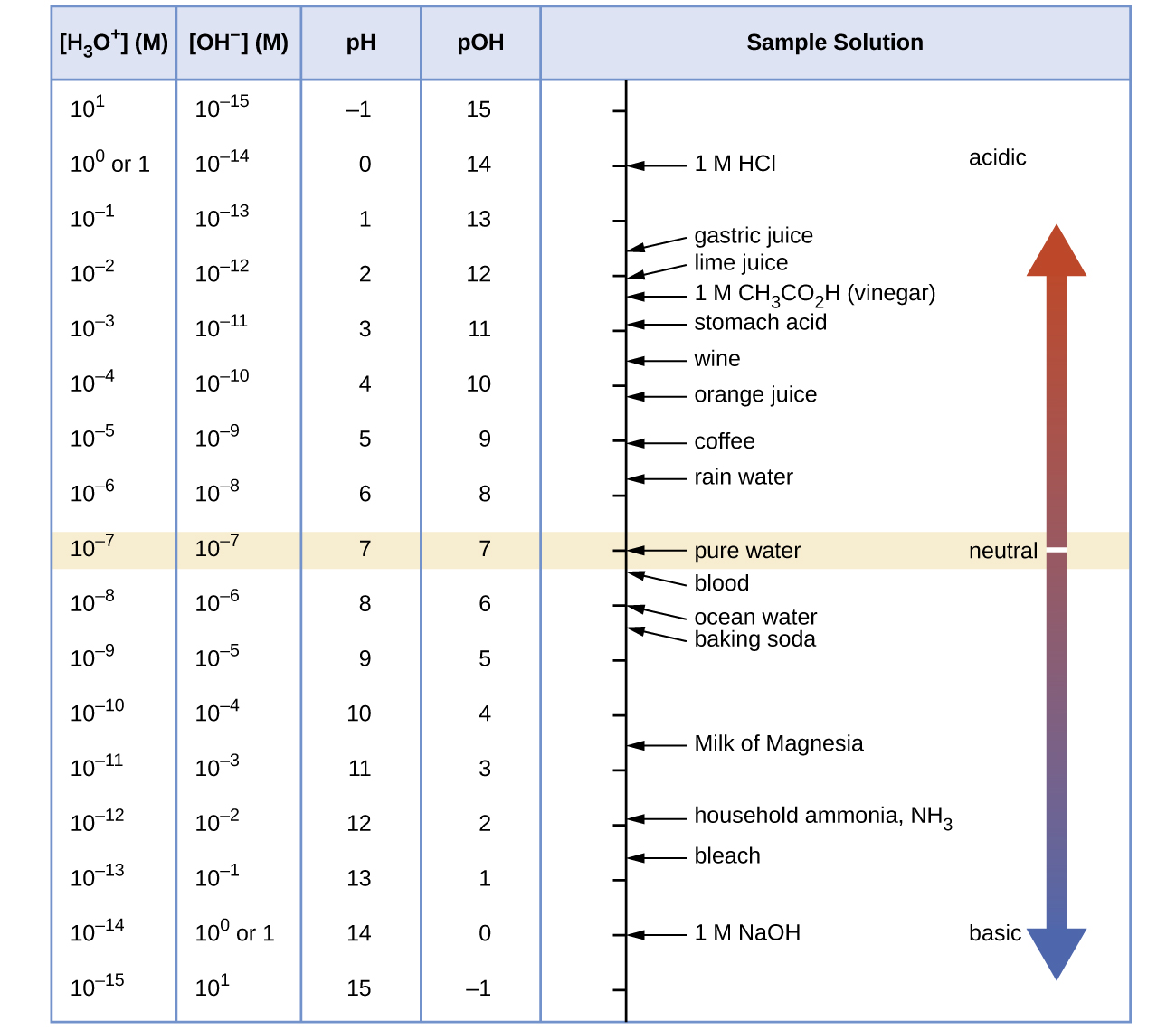
Las concentraciones de H 3 O + y OH — en una solución son importantes para las propiedades ácido-base de la solución y a menudo afectan los comportamientos químicos de otros solutos. Una solución es neutra si su [H 3 O +] e = [OH —] e; ácida si su [H 3 O +] e > [OH —] e; y básica si su [H 3 O +] e < [OH —] e.
Un medio común para expresar valores que abarcan muchos órdenes de magnitud es usar una escala logarítmica. Una de esas escalas se basa en la función p:
p X = -log X
donde “X” es la cantidad de interés y “log” es el logaritmo de base 10. Por lo tanto, el pH de una solución se define como:
\[\text{pH}\; =\; -\text{log}\left(\dfrac{[\text{H}_3\text{O}^+]_e}{mol/L}\right) \nonumber \]
El motivo para dividir por las unidades “mol/L” (M) es que [H 3 O +] tiene unidades de mol/L y tomar el logaritmo de una unidad no tiene sentido. A partir de aquí asumiremos que eres consciente de que solo el valor numérico de una concentración (u otra cantidad) necesita ser usado como argumento de un logaritmo y no dividiremos explícitamente por las unidades.
Si se conoce un valor de pH, se puede calcular la concentración de iones hidronio:
[H 3 O +] e = 10 -pH
Aquí asumimos que usted sabe que se requieren unidades para la concentración obtenida de esta ecuación y las unidades son mol/L; de igual manera, la concentración de iones hidróxido puede expresarse como PoH:
PoH = -log [OH —] e y [OH −] e = 10 −PoH
Finalmente, la relación entre pH y pOH puede derivarse de la expresión de Kw:
| K w | = | [H 3 O +] e [OH —] e |
| -log (K w) | = | -log ([H 3 O +] e [OH —] e) |
| p K w | = | -log ([H 3 O +] e) + (-log ([OH —] e)) |
| p K w | = | pH + PoH |
A 25 °C:
p K w = 14 = pH + PoH
Por lo tanto, a esta temperatura:
| Clasificación | Concentraciones relativas de iones | pH a 25 °C |
|---|---|---|
| ácido | [H 3 O +] > [OH −] | < 7 |
| neutral | [H 3 O +] = [OH −] | 7 |
| básico | [H 3 O +] < [OH −] | > 7 |
Debido a que K w depende de la temperatura, las correlaciones entre los valores de pH y los adjetivos ácido/neutral/básico son diferentes a diferentes temperaturas. Por ejemplo, [H 3 O +] en agua pura a 80 °C es 4.9 × 10 −7 M, lo que corresponde a valores de pH y pOH de:
pH = -log [H 3 O +] e = -log (4.9 × 10 −7) = 6.31
PoH = -log [OH —] e = -log (4.9 × 10 −7) = 6.31
A esta temperatura, las soluciones neutras tienen pH = PoH = 6.31, las soluciones ácidas tienen pH < 6.31 and pOH > 6.31, y las soluciones básicas tienen pH > 6.31 y PoH < 6.31. Esta distinción puede ser importante a la hora de estudiar ciertos procesos que ocurren a temperaturas distintas a los 25 °C, como las reacciones ácido-base en el cuerpo humano donde las temperaturas suelen ser de 37 °C.
A menos que se indique lo contrario, se presume que las referencias a los valores de pH son aquellas a 25 °C. La Figura 1 muestra las relaciones entre [H 3 O +], [OH −], pH y pOH, y da valores para estas propiedades para algunas sustancias comunes.
Actividad 3: pH y fortalezas relativas de los ácidos
La acidez de una solución se determina típicamente midiendo su pH. El PoH de una solución generalmente no se mide, pero se calcula fácilmente a partir de un valor de pH determinado experimentalmente. El pH de una solución puede medirse directamente usando un medidor de pH (Figura 2), o estimarse visualmente usando indicadores coloreados (Figura 3).

 Figura 3. Un indicador universal es una mezcla de indicadores que asume un color diferente a diferentes valores de pH. (a) Se ha agregado un indicador universal a las soluciones en diez tubos de ensayo, cada uno con el pH mostrado en la parte superior de cada tubo. (b) El papel de pH contiene un indicador universal diferente que da diferentes colores cuando se humedece con soluciones de diferentes valores de pH. La escala en la parte superior muestra colores para valores de pH pares de 2 a 10.
Figura 3. Un indicador universal es una mezcla de indicadores que asume un color diferente a diferentes valores de pH. (a) Se ha agregado un indicador universal a las soluciones en diez tubos de ensayo, cada uno con el pH mostrado en la parte superior de cada tubo. (b) El papel de pH contiene un indicador universal diferente que da diferentes colores cuando se humedece con soluciones de diferentes valores de pH. La escala en la parte superior muestra colores para valores de pH pares de 2 a 10.
D33.4 Constante de ácido K a y constante de base K b
Las fuerzas relativas de ácidos y bases se pueden determinar comparando las constantes de equilibrio para sus reacciones de ionización. Para la reacción de un ácido genérico, HA, en agua:
HA (aq) + H 2 O (l) A — (aq) + H 3 O + (aq)
escribimos la expresión de la constante de ionización ácida (K a) como:
\[K_{\text{a}} = \dfrac{[\text{H}_3\text{O}^{+}]_e[\text{A}^{-}]_e}{[\text{HA}]_e} \nonumber \]
(Aunque el agua es un reactivo en la reacción, también es el disolvente con su fase indicada como “l “, por lo que no incluimos [H 2 O] en la expresión.)
Un ácido con una mayor K a tendría una mayor concentración de H 3 O + y A − en relación con la concentración del ácido no ionizado, HA. Así, un ácido más fuerte, que ioniza en mayor medida, tiene una constante de ionización mayor que un ácido más débil.
Por ejemplo, estos datos sobre las constantes de ionización ácida:
| CH 3 COOH (aq) + H 2 O (l) | ⇌ | CH 3 COO — (aq) + H 3 O + (aq) | K a = 1.8 × 10 -5 |
| HNO 2 (aq) + H 2 O (l) | ⇌ | NO 2 — (aq) + H 3 O + (aq) | K a = 7.4 × 10 -4 |
| HSO 4 — (aq) + H 2 O (l) | ⇌ | SO 4 2 - (aq) + H 3 O + (aq) | K a = 1.1 × 10 -2 |
indican que el orden de concentración de ácido es: el ácido acético (CH 3 COOH) es un ácido más débil que el ácido nitroso (HNO 2) que es en sí mismo más débil que el ion sulfato de hidrógeno (HSO 4 —).
Podemos considerar la fuerza de una base (B) de manera similar al considerar la extensión que formará iones hidróxido en una solución acuosa:
B (aq) + H 2 O (l) HB + (aq) + OH — (aq)
donde la expresión de la constante de ionización de base (K b) es:
\[K_{\text{b}} = \dfrac{[\text{HB}^{+}]_e[\text{OH}^{-}]_e}{[\text{B}]_e} \nonumber \]
Una base más fuerte ioniza en mayor medida que una base más débil. Por lo tanto, una base más fuerte tiene una K b mayor que una base más débil.
Observe que K a y K b proporcionan una medida cuantitativa de las fuerzas ácidas y básicas, significativamente más precisas que las descripciones cualitativas de “ácido fuerte” o “ácido débil”.
Considere las reacciones de ionización para un par de bases de ácido conjugado, HA y A −:
HA (aq) + H 2 O (l) A — (aq) + H 3 O + (aq)
\[K_a = \dfrac{[\text{H}_3\text{O}^{+}]_e[\text{A}^-]_e}{[\text{HA}]_e} \nonumber \]
A — (aq) + H 2 O (l) HA (aq) + OH — (aq)
\[K_b = \dfrac{[\text{HA}]_e[\text{OH}^-]_e}{[\text{A}^-]_e} \nonumber \]
Al sumar estas dos ecuaciones químicas se obtiene la ecuación para la autoionización del agua:
HA (aq) + H 2 O (l) + A — (aq) + H 2 O (l) A — (aq) + H 3 O + (aq) + HA (aq) + OH — (aq)
Cuando dos equilibrios se suman a un tercer equilibrio, el producto de las dos primeras constantes de equilibrio es igual a la tercera constante de equilibrio:
\[K_{\text{a}}\;\times\;K_{\text{b}} = \dfrac{[\text{H}_3\text{O}^{+}]_e[\text{A}^{-}]_e}{[\text{HA}]_e}\;\times\;\dfrac{[\text{HA}]_e[\text{OH}^{-}]_e}{[\text{A}^{-}]_e} = [\text{H}_3\text{O}^{+}]_e[\text{OH}^{-}]_e = K_{\text{w}} \nonumber \]
Por ejemplo, a 25 °C, K a de ácido acético (CH 3 COOH) es 1.8 × 10 −5 M, y K b de su base conjugada, anión acetato (CH 3 COO —), es 5.6 × 10 −10 M. El producto de estas dos constantes es de hecho igual a K w:
K a × K b = (1.8 × 10 −5 M) × (5.6 × 10 −10 M) = 1.0 × 10 −14 = K w
Esta relación nos dice que los ácidos más fuertes forman bases conjugadas más débiles, y los ácidos más débiles forman bases conjugadas más fuertes.
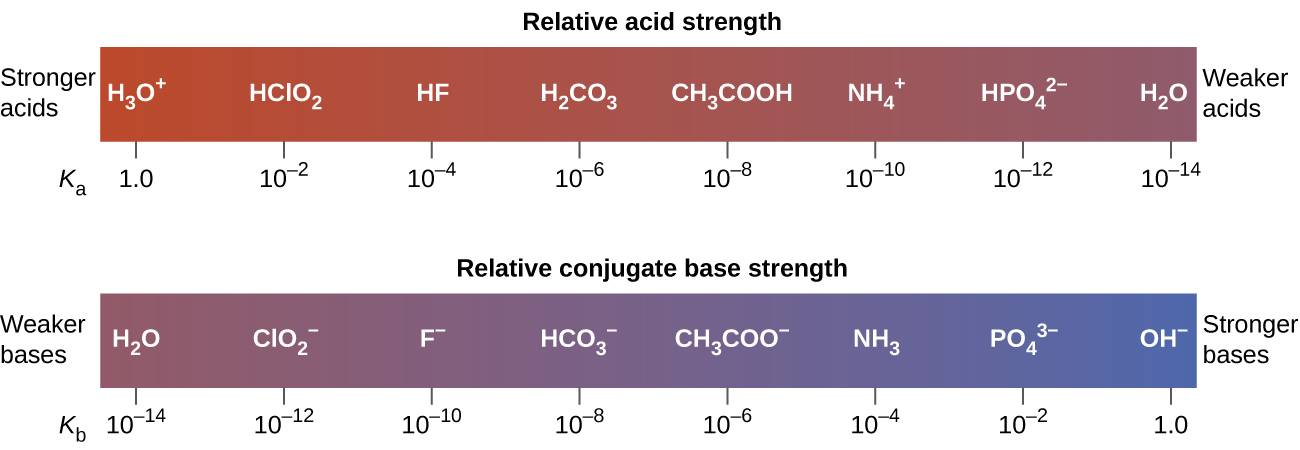
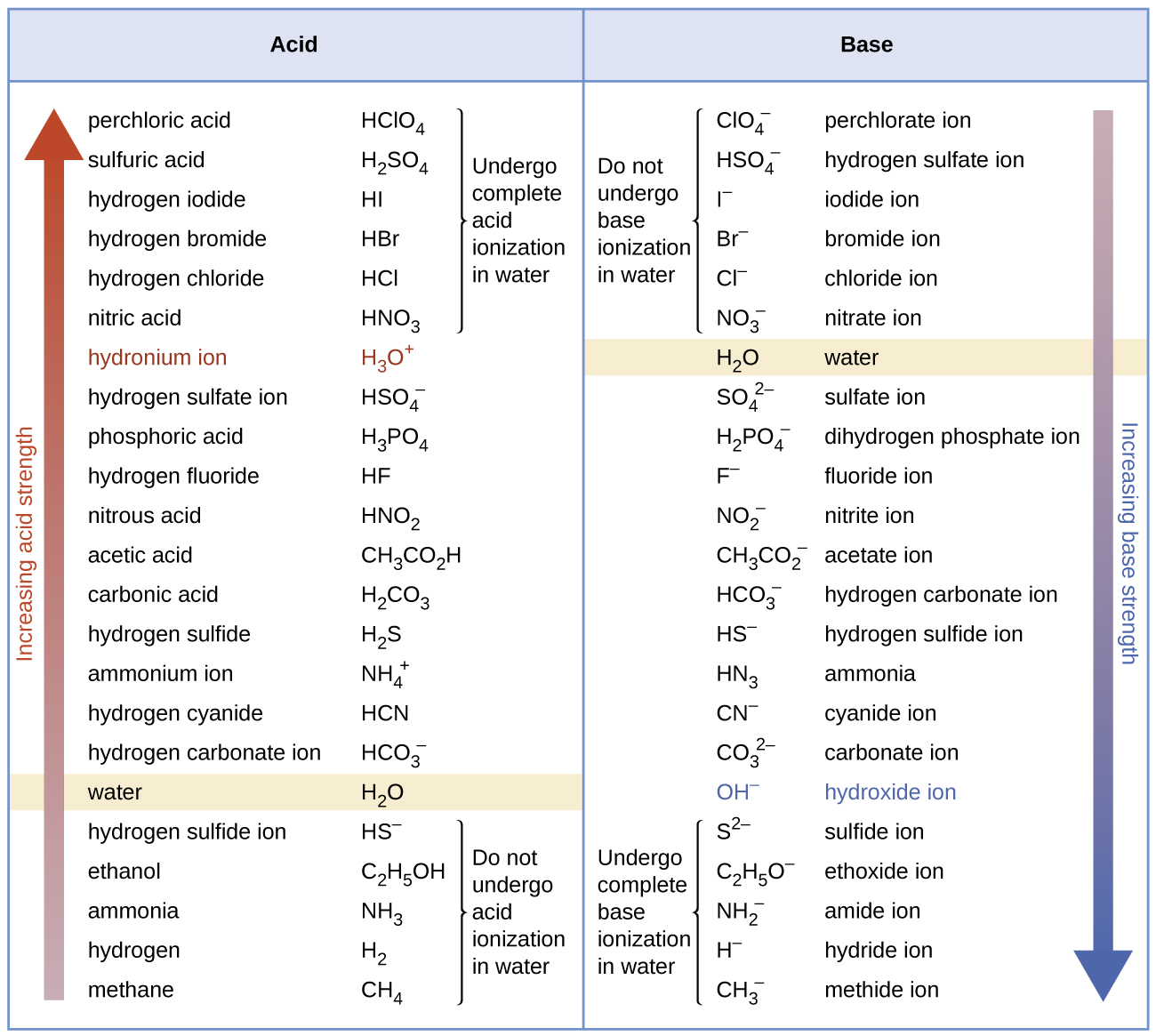
Aunque “fuerte” y “débil” son términos relativos, generalmente, nos referimos a ácidos más fuertes que H 3 O + como ácidos fuertes, y bases más fuertes que OH —como bases fuertes—. Debido a que los ácidos fuertes y las bases fuertes están completamente ionizados en soluciones acuosas, la concentración de ácido o base no ionizada es esencialmente cero. Por ejemplo, en una solución 0.10-M de HCl, [HCl] e = 0, [H 3 0 +] e = 0.10 M, y [Cl −] e = 0.10 M.
Una consecuencia de esta ionización completa es que en solución acuosa no hay manera de saber si un ácido fuerte es más fuerte que otro: HCl, HBr e HI están completamente ionizados. Esto se conoce como el efecto nivelador del agua. Sin embargo, cuando se disuelven en algunos otros disolventes, estos ácidos no se ionizan completamente. El grado de ionización aumenta en el orden HCl < HBr < HI, por lo que el HI es el más fuerte de estos ácidos. El agua ejerce un efecto de nivelación similar sobre bases fuertes.
Muchos ácidos y bases se consideran “débiles”. Una solución de un ácido débil en agua es una mezcla de equilibrio del ácido no ionizado, ion hidronio y la base conjugada del ácido.
Actividad 4: Determinar Ka
Actividad 5: Usando Ka para Calcular Concentraciones
El porcentaje de ionización de un ácido débil es otra medida de la fuerza de un ácido, HA:
\[\text{percent ionization} = \dfrac{[\text{H}_3\text{O}^{+}]_e}{[\text{HA}]_0}\;\times\;100\% \nonumber \]
Un ácido más fuerte, con un K a mayor, tiene mayor porcentaje de ionización que un ácido más débil (para la misma concentración).
El porcentaje de ionización para una solución de un ácido débil aumenta con la disminución de la concentración de ácido; esto se puede ver aplicando el principio de Le Chatelier al equilibrio de ionización:
HA (aq) + H 2 O (l) A — (aq) + H 3 O + (aq)
El aumento del volumen de solución para una cantidad dada de HA añadida hace que el equilibrio se desvíe al lado del producto para contrarrestar parcialmente la disminución en la concentración total de soluto.
D33.5 Fuerza ácida y estructura molecular
Las reacciones ácido-base, como muchas otras reacciones químicas, implican romper y formar enlaces. Por lo tanto, podemos usar nuestra comprensión química de la estructura molecular y la estabilidad para comprender qué hace que algunos ácidos sean más fuertes que otros.
Sabemos que un equilibrio favorece el lado termodinámicamente más estable de la reacción, y que la magnitud de la constante de equilibrio refleja la diferencia de energía (Δ r G°) entre los reactivos y los productos. Por lo tanto, en un equilibrio ácido-base, el equilibrio siempre favorece el lado con ácido y base más débiles (estas son las especies más estables). En consecuencia, cualquier cosa que estabilice la base conjugada de un ácido necesariamente hará que ese ácido sea más fuerte, y cualquier cosa que estabilice al ácido lo convertirá en un ácido más débil. Esta idea se ilustra en la Figura 6.
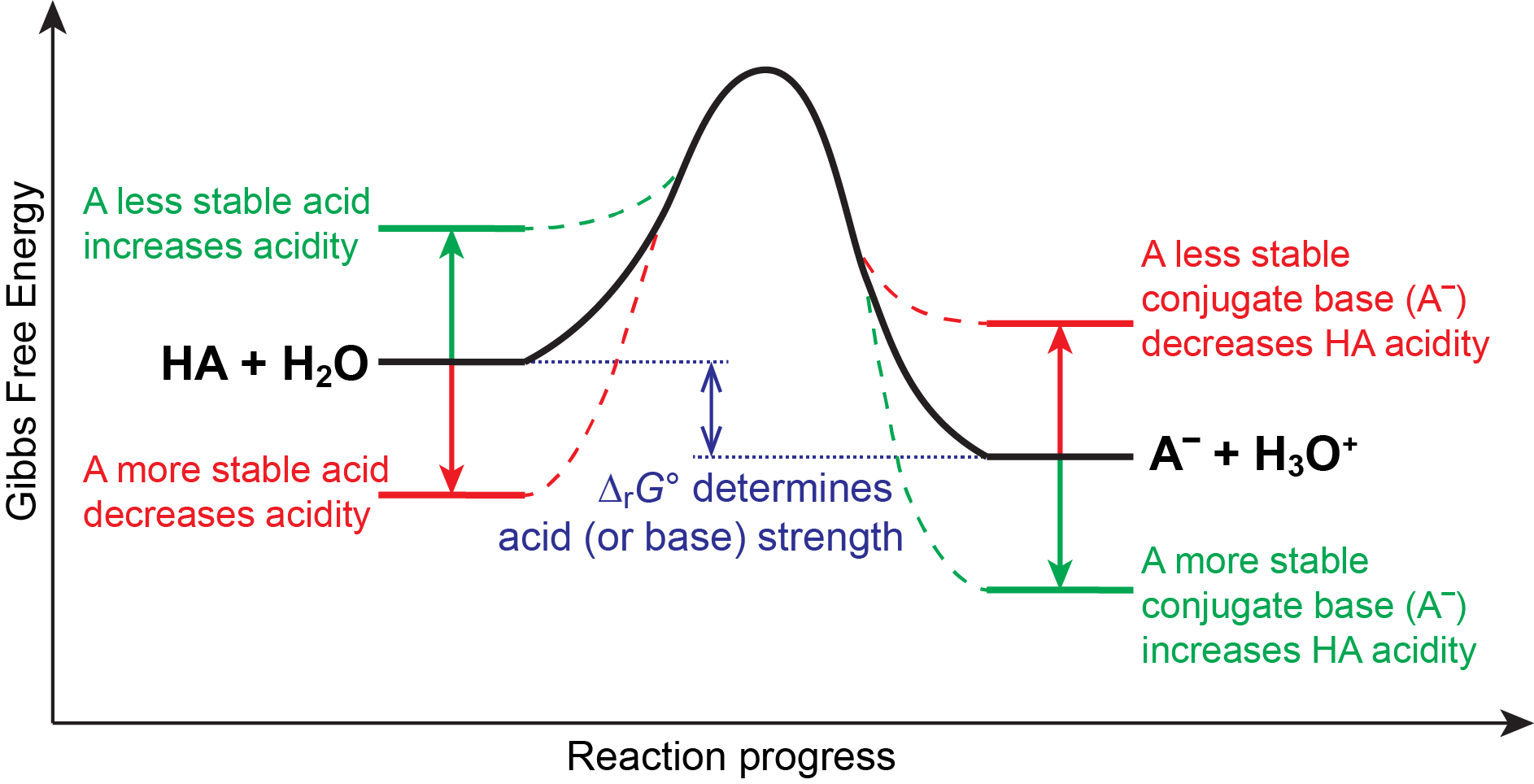
Fuerza de unión
Consideremos un ácido genérico:
HA A — + H +
En general, cuanto más fuerte es el enlace H-A, más estable es la molécula de HA y menos ácida es la sustancia. Este efecto se ilustra por los haluros de hidrógeno:
| Fuerza relativa a los ácidos | HF | HCl | HBr | HOLA |
|---|---|---|---|---|
| Entalpía de enlace H—X (kJ/mol) | 566 | 431 | 366 | 299 |
| p K a | 3.2 | −6.1 | −8.9 | −9.3 |
Tenga en cuenta que los valores de “entalpía de enlace” están asociados con una reacción de ruptura de enlace diferente, que produce un átomo de hidrógeno en lugar de un ión de hidrógeno:
HA A· + H·
Sin embargo, las fuerzas de unión se correlacionan con la fuerza ácida. A medida que desciende por el grupo haluro, el solapamiento entre el orbital de hidrógeno 1 s y el orbital de valencia del átomo de halógeno disminuye, y la entalpía del enlace H-X disminuye, lo que indica enlaces más débiles. Como resultado, la fuerza de ácido HX aumenta a medida que baja del grupo.
Se observa una tendencia similar para otros grupos. Por ejemplo, para el grupo 16:
| H 2 A HA — + H + | ||||
| H 2 O | H 2 S | H 2 Se | H 2 Te | |
| p K a | 14.0 | 7.0 | 3.9 | 2.6 |
Estabilización del exceso de carga sobre la base conjugada
Electronegatividad
Cuando la base conjugada está cargada negativamente, los factores que estabilizan el exceso de carga negativa sobre la base conjugada favorecen la disociación del ácido y hacen que el ácido sea un ácido más fuerte. Por ejemplo, la acidez relativa de los ácidos con elementos de la segunda fila es:
| H n A H n-1 A — + H + | ||||
| CH 4 | NH 3 | H 2 O | HF | |
| p K a | 50 | 36 | 14.0 | 3.2 |
Considere los compuestos en ambos extremos de esta serie: metano y fluoruro de hidrógeno. La base conjugada de CH 4 es CH 3 —, y la base conjugada de HF es F −. Debido a que el flúor es mucho más electronegativo que el carbono, el flúor puede estabilizar mejor la carga extra negativa en el anión F − que el carbono puede estabilizar la carga extra negativa en el anión CH 3 −. En consecuencia, el HF puede disociarse y formar H + y F − en un grado mucho mayor que CH 4 puede formar H + y CH 3 —, haciendo del HF un ácido mucho más fuerte que CH 4.
La misma tendencia se predice analizando también los ácidos: a medida que aumenta la electronegatividad de A en H n A, el enlace A—H se vuelve más polar, favoreciendo la disociación para formar H n-1 A − y H +. Debido tanto a la creciente estabilidad de la base conjugada como a la creciente polarización del enlace A—H en el ácido, las fuerzas ácidas de los hidruros binarios aumentan a medida que avanzamos de izquierda a derecha a través de una fila de la tabla periódica.
Deslocalización de electrones
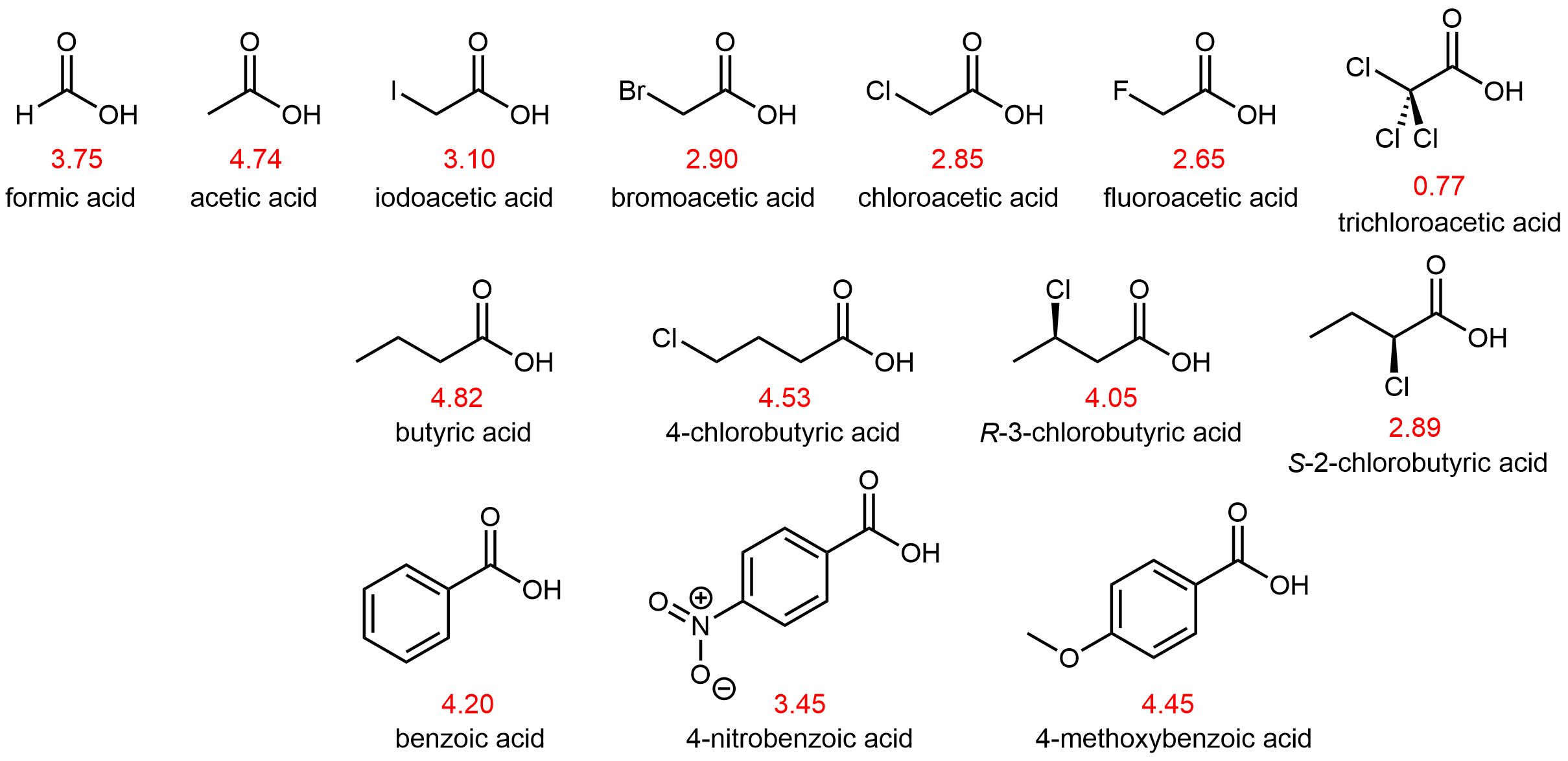
Los valores de p K a de algunos ácidos carboxílicos se muestran en la Figura 7.
El enlace que se rompe en un ácido carboxílico es el enlace O-H:
R-COOH R-COO+ H +
Un enlace O-H también se rompe cuando un alcohol actúa como ácido en una reacción ácido-base:
R-OH R-O+ H +
Sin embargo, cuando comparamos los ácidos carboxílicos p K a con los de alcoholes comparables, tales como:

es claro que los ácidos carboxílicos son ácidos más fuertes que los alcoholes en más de diez órdenes de magnitud. ¿Por qué la presencia de un grupo carbonilo adyacente a un grupo hidroxilo debería tener un efecto tan profundo en la acidez del protón hidroxilo?
Tanto el ácido carboxílico como su base conjugada, anión carboxilato, se estabilizan al tener estructuras de resonancia adicionales que deslocalizan densidades electrónicas. Sin embargo, la estabilización en anión carboxilato es mucho mayor debido a que las dos estructuras de resonancia principales tienen contribuciones iguales al híbrido de resonancia, y la densidad extra de electrones (carga negativa) se comparte por igual entre los dos átomos de oxígeno, los cuales tienen alta electronegatividad. Esta estabilización conduce a un marcado aumento de la acidez de los ácidos carboxílicos.
Efecto Inductivo
Los átomos (o grupos de átomos) en una molécula que no están unidos directamente al H ácido también pueden influir en la acidez de la molécula. Pueden hacerlo a través de un efecto inductivo, es decir, inducen una polarización en la distribución de electrones dentro de la molécula. Esto se puede observar estudiando las estructuras de la Figura 7 anterior. Los sustituyentes electronegativos (F, Cl, Br, I) cerca del grupo carboxilo actúan para aumentar la acidez del ácido carboxílico. Por ejemplo, el ácido fluoroacético, CH 2 FCOOH, es significativamente más ácido que el ácido acético, CH 3 COOH.
La magnitud del efecto inductivo depende tanto de la naturaleza como del número de sustituyentes halógenos, como lo muestran los valores de p K a para varios derivados de ácido acético:
| CH 3 COOH | CH 2 CLCOOH | CHCl 2 COOH | CCl 3 COOH | CF 3 COOH | |
| p K a | 4.74 | 2.85 | 1.35 | 0.77 | 0.52 |
El flúor, que es más electronegativo que el cloro, provoca un mayor efecto inductivo ya que aleja la densidad electrónica del protón ácido en el grupo carboxilo. Además, tener tres halógenos provoca un mayor efecto inductivo que tener dos o uno. Tenga en cuenta que los efectos inductivos pueden ser bastante significativos. Por ejemplo, reemplazar el grupo —CH 3 del ácido acético por un grupo —CF 3 da como resultado un aumento de casi 10,000 veces en la acidez.
En otro ejemplo, la acidez de los ácidos hipohalosos (HOX OX+ H +) varía en aproximadamente tres órdenes de magnitud debido a la diferencia en la electronegatividad de los átomos de halógeno:
| HOX | Electronegatividad de X | pKa |
|---|---|---|
| HOCl | 2.73 | 7.2 |
| HOBr | 2.64 | 8.5 |
| HOI | 2.11 | 10.5 |
A medida que aumenta la electronegatividad de X, los electrones se dibujan con mayor fuerza hacia el átomo de halógeno y, a su vez, se alejan del H en el enlace O—H, debilitando así el enlace O—H, potenciando la ionización del hidrógeno como H + y fortaleciendo el ácido.
Oxoácidos
La acidez de los oxoácidos, con la fórmula general HOXO n (con n = 0−3), depende fuertemente del número de átomos de oxígeno terminales unidos al átomo central X (Figura 8) debido tanto a un efecto inductivo como a una mayor estabilización de la base conjugada.
Debido a que el oxígeno es el segundo elemento más electronegativo, agregar átomos de oxígeno terminales (átomos de oxígeno solo unidos al átomo central) provoca que las densidades de electrones se alejen del enlace O-H, aumentando así la fuerza del ácido. La Figura 9 muestra cómo el átomo de H se vuelve constantemente más azul de HClO a HClO 4, facilitando que el ácido pierda el hidrógeno como un ion H +.
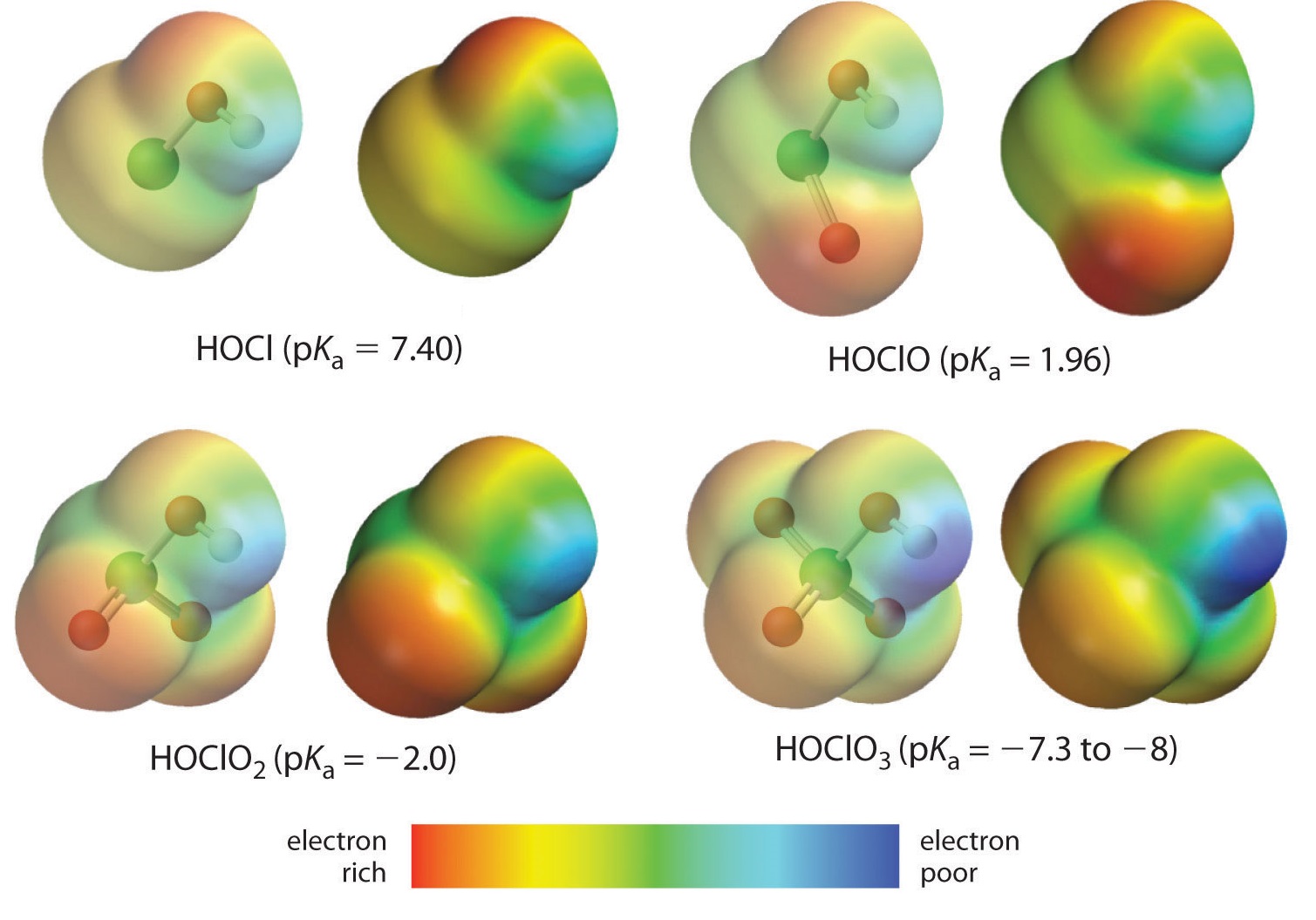
También es importante el efecto de la deslocalización de electrones que estabiliza la carga extra negativa en la base conjugada. Por ejemplo, en el anión clorito (ClO 2), el exceso de densidad electrónica se deslocaliza igualmente sobre ambos átomos de oxígeno, mientras que en el ion hipoclorito (ClO −), la carga negativa se localiza en gran medida en un solo átomo de oxígeno:

Como resultado de esta estabilización de la base conjugada, así como del efecto inductivo adicional, el ácido cloroso es más de 200,000 veces más fuerte que el ácido hipocloroso.
El efecto inductivo es además responsable de la tendencia en las acideces de los oxoácidos que tienen el mismo número de átomos de oxígeno a medida que atravesamos una fila de la tabla periódica. Por ejemplo, H 3 PO 4 es un ácido débil, H 2 SO 4 es un ácido fuerte y HClO 4 es uno de los ácidos más fuertes conocidos. El número de átomos de oxígeno terminales aumenta de manera constante a lo largo de la fila, consistente con el aumento observado en la acidez. Además, la electronegatividad del átomo central aumenta de manera constante de P a S a Cl, lo que provoca que se extraiga más densidades de electrones del grupo OH al átomo central, debilitando el enlace O—H y aumentando la fuerza del oxoácido.
Pregunta Podia
Organizar estos ácidos en orden decreciente de la fuerza ácida (menor p K una primera, mayor p K a última). Analizar los factores que afectan la fuerza de cada ácido y con base en ese análisis explicar el orden de acidez.
CH 3 CH 2 OH CF 3 COOH HocLo 3 CH 2 BRCOOH HocLo 2
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


