5.1: Día 36- Soluciones Buffer
- Page ID
- 78889
32
Día 36: Soluciones Buffer
Soluciones de búfer D36.1
Una mezcla de un ácido débil y su base conjugada, como ácido acético y acetato de sodio (CH 3 COOH + CH 3 COONa), o una mezcla de una base débil y su ácido conjugado, como amoníaco y cloruro amónico (NH 3 + NH 4 Cl), es una solución tampón. Una solución tampón resiste los cambios de pH cuando se agregan pequeñas cantidades de un ácido fuerte o una base fuerte (Figura 1).

Una solución de concentraciones iguales de CH 3 COOH y CH 3 COONa es ligeramente ácida debido a que el anión K a, ácido acético > K b, acetato. Cuando se agrega una base fuerte, como NaOH, a esta solución, los aniones OH — reaccionan con los pocos cationes H 3 O +, disminuyendo las concentraciones de H 3 O +. Esto desplaza el siguiente equilibrio hacia la derecha:
CH 3 COOH (aq) + H 2 O (l) CH 3 COO — (aq) + H 3 O + (aq)
restaurando la concentración de H 3 O + a casi el valor que tenía antes de que se agregara el NaOH. El efecto neto de la mayor parte del NaOH agregado es convertir parte del ácido débil, CH 3 COOH, en una base débil, CH 3 COO −:
CH 3 COOH (aq) + OH — (aq) → CH 3 COO — (aq) + H 2 O (l)
De ahí que solo haya una disminución mínima en la concentración de H 3 O +.
Cuando se agrega un ácido fuerte, como HCl, el efecto neto de la mayor parte del H 3 O + agregado es convertir aniones acetato en moléculas de ácido acético:
CH 3 COO — (aq) + H 3 O + (aq) → CH 3 COOH (aq) + H 2 O (l)
Y nuevamente, sólo hay un incremento mínimo en la concentración de H 3 O +.
Como se ilustra en la Figura 2, una solución tampón puede moderar los cambios al pH porque consiste en un ácido débil que puede reaccionar con una base fuerte añadida así como una base débil que puede reaccionar con ácido fuerte agregado.
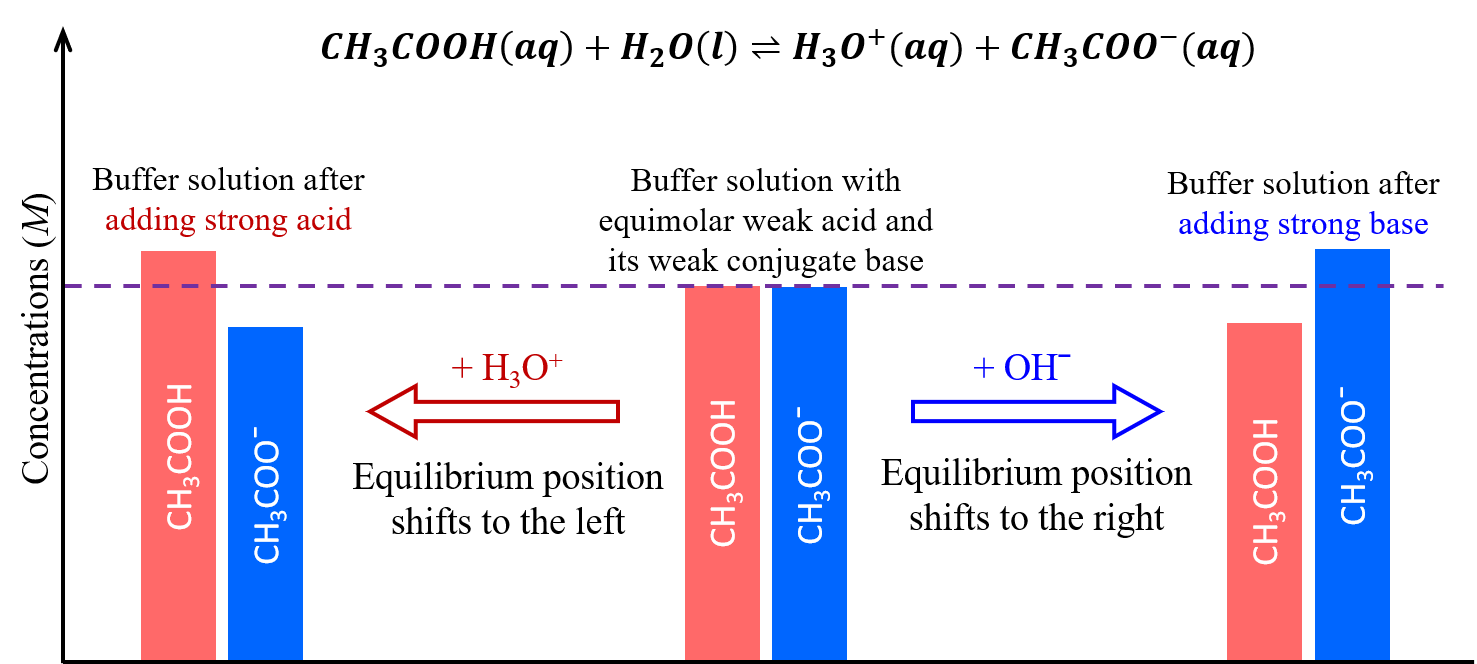
La base débil y el ácido débil en una solución tampón son típicamente un par ácido-base conjugado, que mantiene un equilibrio dinámico que responde a adiciones de otros ácidos y bases. Si no son un par ácido-base conjugado, entonces habría dos equilibrios dinámicos en juego, lo que complica significativamente las acciones de amortiguación.
Actividad 1: pH de una solución tampón
Ecuación de Henderson-Hasselbalch D36.2
La expresión constante de ionización para un AH ácido débil es:
\[K_a = \dfrac{[\text{H}_3\text{O}^{+}]_e[\text{A}^{-}]_e}{[\text{HA}]_e} \nonumber \]
Reorganizar da:
\[[\text{H}_3\text{O}^{+}]_e = K_a\;\times\;\dfrac{[\text{HA}]_e}{[\text{A}^{-}]_e} \nonumber \]
Tomando el logaritmo negativo de ambos lados, tenemos:
\[\begin{array}{rcl} -\text{log}[\text{H}_3\text{O}^{+}]_e &=& -\text{log}\;K_a\;-\;\text{log}\dfrac{[\text{HA}]_e}{[\text{A}^{-}]_e} \\[1 em] \text{pH} &=& \text{p}K_a\;-\;\text{log}\dfrac{[\text{HA}]_e}{[\text{A}^{-}]_e} \\[1 em] \text{pH} &=& \text{p}K_a\;+\;\text{log}\dfrac{[\text{A}^{-}]_e}{[\text{HA}]_e} \end{array} \nonumber \]
Es mucho más conveniente tratar las concentraciones iniciales del ácido débil y la base débil al preparar una solución tampón. (La concentración inicial es la cantidad de ácido débil y base débil añadida a la mezcla de solución que se divide por el volumen). Por lo tanto:
\[\text{pH} = \text{p}K_a\;+\;\text{log}\dfrac{[\text{A}^{-}]_0\;+\;x}{[\text{HA}]_0\;-\;x} \nonumber \]
“x” es el aumento en la concentración de H 3 O + a medida que la solución alcanza el equilibrio (ver actividad 1 anterior) y [HA] 0 y [A −] 0 son la concentración de HA y A − antes de que ocurra cualquier reacción. Cuando la aproximación de que x es al menos 100 veces menor que las concentraciones de HA y A − es válida, tenemos la ecuación de Henderson-Hasselbalch:
\[\text{pH} = \text{p}K_a\;+\;\text{log}\dfrac{[\text{A}^{-}]_0}{[\text{HA}]_0} \nonumber \]
Tenga en cuenta que cuando [A−] 0 = [HA] 0, pH = p K a + log (1) = p K a.
La ecuación de Henderson-Hasselbalch puede ser utilizada para calcular el pH de la solución tampón, dada la K a y las concentraciones iniciales, o bien puede ser utilizada para determinar la relación de concentraciones iniciales de ácido débil y base requerida para lograr un pH deseado.
La ecuación de Henderson-Hasselbalch se aplica únicamente a soluciones tampón en las que la relación
\[\dfrac{[\text{A}^{-}]_0}{[\text{HA}_0} \nonumber \]
está entre 0.1 y 10. Si se agrega suficiente ácido fuerte o base fuerte a la solución tampón para superar este rango, el pH comienza a cambiar significativamente (en otras palabras, la solución ya no es una solución tampón).
D36.3 Selección de un tampón adecuado
Una solución tampón modera los cambios en el pH porque contiene tanto un ácido débil que puede reaccionar con una base fuerte añadida como una base débil que puede reaccionar con ácido fuerte agregado. Esto conduce a varios criterios para seleccionar una solución tampón adecuada para un propósito dado.
- El pK a del ácido débil en el tampón debe estar cerca del pH deseado de la solución tampón. De acuerdo con la ecuación de Henderson-Hasselbalch, si las concentraciones de ácido débil y base débil son iguales, el pH de la solución tampón es igual a la p K a del ácido débil involucrado.
- Una solución tampón debe tener concentraciones aproximadamente iguales de ácido débil y base débil. A
\[\dfrac{[\text{A}^{-}]_0}{[\text{HA}_0} \nonumber \]
de >10 o <0.1 hace que la solución tampón sea pobre. La Figura 3 muestra cómo aumenta el pH de un tampón de iones ácido acético-acetato a medida que se agrega una base fuerte. El pH inicial es p K a = 4.74. Cuando el pH alcanza 5.74, un cambio de 1 unidad de pH, la relación
\[\dfrac{[\text{acetic acid}]}{[\text{acetate anion}]} = 0.11 = 11\text{%} \nonumber \]
Después de eso, el pH aumenta más rápidamente y la solución ya no proporciona un tamponamiento significativo.
![Se muestra una gráfica con un eje horizontal etiquetado como “Agregado m L de 0.10 M N a O H” que tiene marcas y cuadrículas verticales cada 10 unidades de 0 a 110. El eje vertical está etiquetado como “p H” y se marca cada 1 unidad comenzando en 0 extendiéndose a 11. Se muestra una rotura en el eje vertical entre 0 y 4. En la gráfica se dibuja una curva roja que aumenta gradualmente desde el punto (0, 4.8) hasta aproximadamente (100, 7) después de lo cual la gráfica tiene una sección vertical hasta aproximadamente (100, 11). La curva está etiquetada [C H subíndice 3 C O subíndice 2 H] es 11 por ciento de [C H subíndice 3 CO subíndice 2 superíndice negativo].](https://chem.libretexts.org/@api/deki/files/403031/CNX_Chem_14_06_buffer.jpg)
- Cuanto mayores sean las cantidades (mol) de ácido débil y base débil, mayor es la cantidad (mol) de base fuerte o ácido fuerte que se puede agregar antes de que haya un cambio significativo en el pH.
Al diseñar un sistema tampón, busque pares ácido-base conjugados débiles que tengan pK a del ácido débil cerca del pH deseado. Luego ajuste la relación de la base débil a las concentraciones de ácido débil para lograr el pH exacto deseado. Cerciórese de que las concentraciones de base débil y ácido débil sean lo suficientemente grandes como para reaccionar con las cantidades de ácido o base que podrían agregarse a la solución tampón.
Actividad 2: Preparación de una solución tampón con un pH deseado
Capacidad de búfer D36.4
Podemos ver cómo funciona una solución tampón comparando cuantitativamente el pH de una solución tamponada con el pH de una solución no tamponada tras la adición de un ácido o base fuerte.
Actividad 3: Cálculo del cambio de pH para una solución tampón
Actividad 4: Cambio de pH en una Solución No Bufferada
Podemos ver a partir de las actividades anteriores que el cambio en el pH es mucho más significativo en la solución no tamponada en comparación con la solución tamponada.
Sin embargo, las soluciones tampón no tienen una capacidad ilimitada para mantener el pH relativamente constante (Figura 4). Por ejemplo, si añadimos suficiente base fuerte a un tampón para que todo el ácido débil haya reaccionado, no es posible más acción tamponadora hacia la base. De manera similar, si añadimos un exceso de ácido fuerte, la base débil reaccionaría y no sería posible más acción tamponadora hacia ningún ácido adicional. De hecho, ni siquiera necesitamos reaccionar todo el ácido o base débil en un tampón para hacer un cambio significativo en el pH: la acción de tamponamiento disminuye rápidamente a medida que un componente dado se acerca al agotamiento. Esto se observó en la Figura 3 de la sección anterior, donde reducir la concentración de ácido débil a 11% de la concentración de base débil provocó un cambio de 1 unidad de pH. La curva en la Figura 3 sube rápidamente después de eso, lo que indica que el tampón se ha “roto” y ya no resiste los cambios en el pH.

La capacidad tampón es la cantidad (mol) de ácido o base que se puede agregar a un volumen dado de una solución tampón antes de que el pH cambie ±1 del pK a del ácido débil. (Recordemos que si concentraciones iguales de ácido débil y base conjugada están en una solución tampón, pH = pK a.)
La capacidad de tampón depende de la cantidad (mol) de ácido débil y su base conjugada que se encuentran en una mezcla de tampón. Por ejemplo, una solución de 1 L de CH 3 COOH 1.0 M y CH 3 COONa 1.0 M tiene una mayor capacidad tampón que una solución de 1 L de CH 3 COOH 0.10 M y CH 3 COONa 0.10 M, a pesar de que ambas soluciones tienen el mismo pH. La primera solución tiene más capacidad tampón debido a que contiene más moles de ácido acético e ion acetato.
Se necesitan 0.82 mol HCl para cambiar el pH del tampón de 4.74 a 3.74 en la primera solución:
\[\begin{array}{rcl} 3.74 &=& 4.74\;+\;\text{log}\dfrac{[\text{CH}_3\text{COO}^-]_0}{[\text{CH}_3\text{COOH}]_0}\\[0.5em] 10^{3.74-4.74} &=& \dfrac{[\text{CH}_3\text{COO}^-]_0}{[\text{CH}_3\text{COOH}]_0} \\[0.5em] 0.10 &=& \dfrac{(1.0\;\text{mol}\;-\;x)/(1\;\text{L})}{(1.0\;\text{mol}\;+\;x)/(1\;\text{L})} \\[0.5em] 0.10(1.0\;\text{mol}\;+\;x) &=& 1.0\;\text{mol}\;-\;x \\[0.5em] 1.1x &=& 0.90\\[0.5em] x &=& 0.82\;\text{mol} \end{array} \nonumber \]
Por otro lado, para la solución donde las concentraciones de ácido débil y base conjugada son 0.10 M, se necesita solo una décima parte de HCl, 0.082 mol HCl, para cambiar el pH del tampón de 4.74 a 3.74:
\[\dfrac{[\text{CH}_3\text{COO}^-]_0}{[\text{CH}_3\text{COOH}]_0}\;=\;10^{-1}\;=\;0.1\;=\;\dfrac{0.1\;\text{mol}\;-\;x}{0.1\;\text{mol}\;+\;x}\;\;\;\;\;x\;=\;0.082\;\text{mol} \nonumber \]
Si una solución tampón no tiene concentraciones iguales de ácido débil y base débil, la capacidad tampón cuando se agrega ácido fuerte es diferente de la capacidad tampón cuando se agrega base fuerte.
Pregunta Podia
Se prepara una solución añadiendo 50.0 mL de ácido acético 0.50-M y 50.0 mL de NaOH 0.30-M a un vaso de precipitados y agitando. ¿Es esta solución una solución tampón? Si es así, calcule el pH del tampón. Si no, explique por qué la solución no resiste el cambio de pH cuando se agrega 1.0 mL de HCl 0.5-M.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


