5.2: Día 37- Titulación ácido-Base
- Page ID
- 78888
33
Día 37: Titulación ácido-Base
Titulación D37.1
En este punto, ya has realizado varios experimentos de titulación en laboratorio. En una titulación, se agrega una solución a una segunda solución de manera que permita medir con precisión la cantidad de cada solución. Por lo general, se agrega una solución de una bureta, un tubo de vidrio calibrado con una llave de paso en la parte inferior. La bureta permite adiciones de incrementos muy pequeños de volumen de solución y determinación del volumen total agregado. La solución añadida de la bureta es el valorante. El valorante se agrega a un volumen cuidadosamente medido de una segunda solución en un matraz o vaso de precipitados.
Se produce una reacción química entre los solutos en las dos soluciones, y cuando se ha agregado el valorante justo suficiente para completar la reacción con la segunda solución, se ha alcanzado el punto de equivalencia de la titulación. A partir de la ecuación química equilibrada para la reacción de titulación, el volumen de cada solución en el punto de equivalencia, y la concentración de una de las dos soluciones, se puede determinar la concentración de la otra solución.
El punto de equivalencia de una titulación puede detectarse visualmente si hay un cambio de color que acompaña a la finalización de la reacción. Por lo general, se agrega un tinte especial llamado indicador a la solución que se valora para proporcionar un cambio de color en o muy cerca del punto de equivalencia. Los puntos de equivalencia también pueden detectarse midiendo una propiedad de solución que cambia de manera predecible durante el transcurso de la titulación, como el pH.
Independientemente del enfoque adoptado para detectar el punto de equivalencia de una titulación, el volumen total medido de valorante agregado se denomina punto final. Una valoración adecuadamente diseñada normalmente asegura que la diferencia entre el punto de equivalencia y el punto final sea insignificante.
Aunque cualquier tipo de reacción química puede servir como base para un análisis de titulación, las valoraciones de precipitación, ácido-base y oxidación-reducción son las más comunes.
Curvas de valoración D37.2
La valoración es efectiva para analizar cuantitativamente la concentración ácida (o base) de una solución porque el pH cambia rápidamente cerca del punto de equivalencia. Es decir, hay un gran cambio observable que acompaña a una pequeña adición de valorante, lo que minimiza la incertidumbre experimental. Por ejemplo, un indicador ácido-base generalmente cambia de color en un rango de aproximadamente 2 unidades de pH, por lo que si el pH aumenta (o disminuye) en 2 o más unidades de pH cuando se agregan 0.01 mL de valorante en el punto de equivalencia, el cambio de color señalaría efectivamente el punto final de la titulación.
La Figura 1 muestra una curva de titulación, una gráfica del pH en función del volumen de valorante, para la valoración de una muestra de 50.00-mL de ácido clorhídrico 0.100-M con hidróxido de sodio 0.100-M.
Consideremos ahora la titulación de 50.00 mL de ácido acético 0.100- M (un ácido débil) con hidróxido de sodio 0.100- M (Figura 2). Comparando la Figura 2 con la Figura 1, vemos que aunque los volúmenes y concentraciones iniciales de los ácidos (ácido acético vs HCl) son los mismos, el pH para el ácido acético comienza en un valor mayor y la curva de titulación mantiene valores de pH más altos hasta el punto de equivalencia. Esto se debe a que, a diferencia del HCl, el ácido acético solo está parcialmente ionizado.
El pH en el punto de equivalencia también es mayor (8.72 en lugar de 7.00) debido a la presencia de anión acetato, una base débil que eleva el pH:
CH 3 COO — (aq) + H 2 O (l) CH 3 COOH (aq) + OH — (aq)
Después del punto de equivalencia, las dos curvas (Figura 1 y Figura 2) son idénticas porque el pH depende del exceso de ión hidróxido de NaOH agregado en ambos casos.
Actividad 1: Punto de Equivalencia de Titulación
El punto medio de una titulación es cuando hemos agregado la mitad del volumen de valorante necesario para alcanzar el punto de equivalencia. Como muestra la parte (b) en el ejercicio anterior, al valorar un ácido débil con una base fuerte, el pH de la solución es igual al p K a del ácido débil en el punto medio porque hemos agregado la mitad de la cantidad de base fuerte necesaria para reaccionar con todo el ácido débil. Por lo tanto, según la ecuación de Henderson-Hasselbalch:
\[\text{pH} = \text{p}K_a + \text{log}\dfrac{[\text{weak base}]_0}{[\text{weak acid}]_0} = \text{p}K_a + \text{log}(1) = \text{p}K_a + 0 = \text{p}K_a \nonumber \]
Actividad 2: Titulación de una Base Débil con un Ácido Fuerte
Indicadores Ácido-Base D37.3
Los indicadores ácido-base son sustancias con colores intensos que cambian de color cuando [H 3 O +] alcanza un valor particular. Los indicadores ácido-base son ácidos orgánicos débiles o bases orgánicas débiles y pueden usarse para determinar el pH de una solución. Por ejemplo, la fenolftaleína es incolora en una solución acuosa con pH < 8.3 ([H 3 O +] > 5.0 × 10 −9 M), y se vuelve roja o rosa cuando pH > 8.3.
El equilibrio en una solución del indicador ácido-base naranja de metilo, un ácido débil, se puede representar por una ecuación en la que usamos “hIN” como representación simple para la molécula compleja de naranja de metilo:
\[\begin{array}{ccccccc} \text{HIn}(aq) & + & \text{H}_2\text{O}(l) & {\leftrightharpoons} & \text{H}_3\text{O}^{+}(aq) & + & \text{In}^{-}(aq) \\[0.5em] \text{red} & & & & & & \text{yellow} \end{array} \nonumber \]
\[K_{\text{a}} = \dfrac{[\text{H}_3\text{O}^{+}][\text{In}^{-}]}{[\text{HIn}]} = 4.0\;\times\;10^{-4} \nonumber \]
Cuando añadimos ácido a una solución de naranja de metilo, el aumento de [H 3 O +] desplaza el equilibrio hacia la forma roja no ionizada, de acuerdo con el principio de Le Chatelier. Si agregamos base, el equilibrio se desplaza hacia la forma amarilla aniónica. El color general de la solución es el resultado visible de la relación de las concentraciones de las dos especies, In − y HaN. Si la mayor parte del indicador está presente como In −, entonces vemos el color amarillo. Si la mayoría está presente como Hin, entonces vemos el color rojo. Podemos reorganizar la ecuación para Ka y escribir:
\[\dfrac{[\text{In}^{-}]}{[\text{HIn}]} = \dfrac{[\text{substance with yellow color}]}{[\text{substance with red color}]} = \dfrac{K_{\text{a}}}{[\text{H}_3\text{O}^{+}]} \nonumber \]
Cuando [H 3 O +] = K a, hIN, el 50% del indicador está presente en la forma roja (hIN) y el 50% está en la forma iónica amarilla (In −), y la solución aparece de color naranja. Cuando [H 3 O +] aumenta a 8 × 10 −4 M (pH = 3.1), la solución se vuelve roja. No es visible ningún cambio de color para un mayor incremento en [H 3 O +]. Cuando [H 3 O +] disminuye a 4 × 10 −5 M (pH = 4.4), la mayor parte del indicador está en la forma iónica amarilla, y una disminución adicional en [H 3 O +] no produce un cambio de color visible. El rango de pH de 3.1 — 4.4 es el intervalo de cambio de color del naranja de metilo, el rango de valores de pH sobre el cual se produce el cambio de color.
Hay muchos indicadores ácido-base diferentes. Sus cambios de color tienen un amplio rango de valores de pH (Figura 3). Los indicadores universales y el papel de pH contienen una mezcla de indicadores y exhiben diferentes colores a diferentes valores de pH.
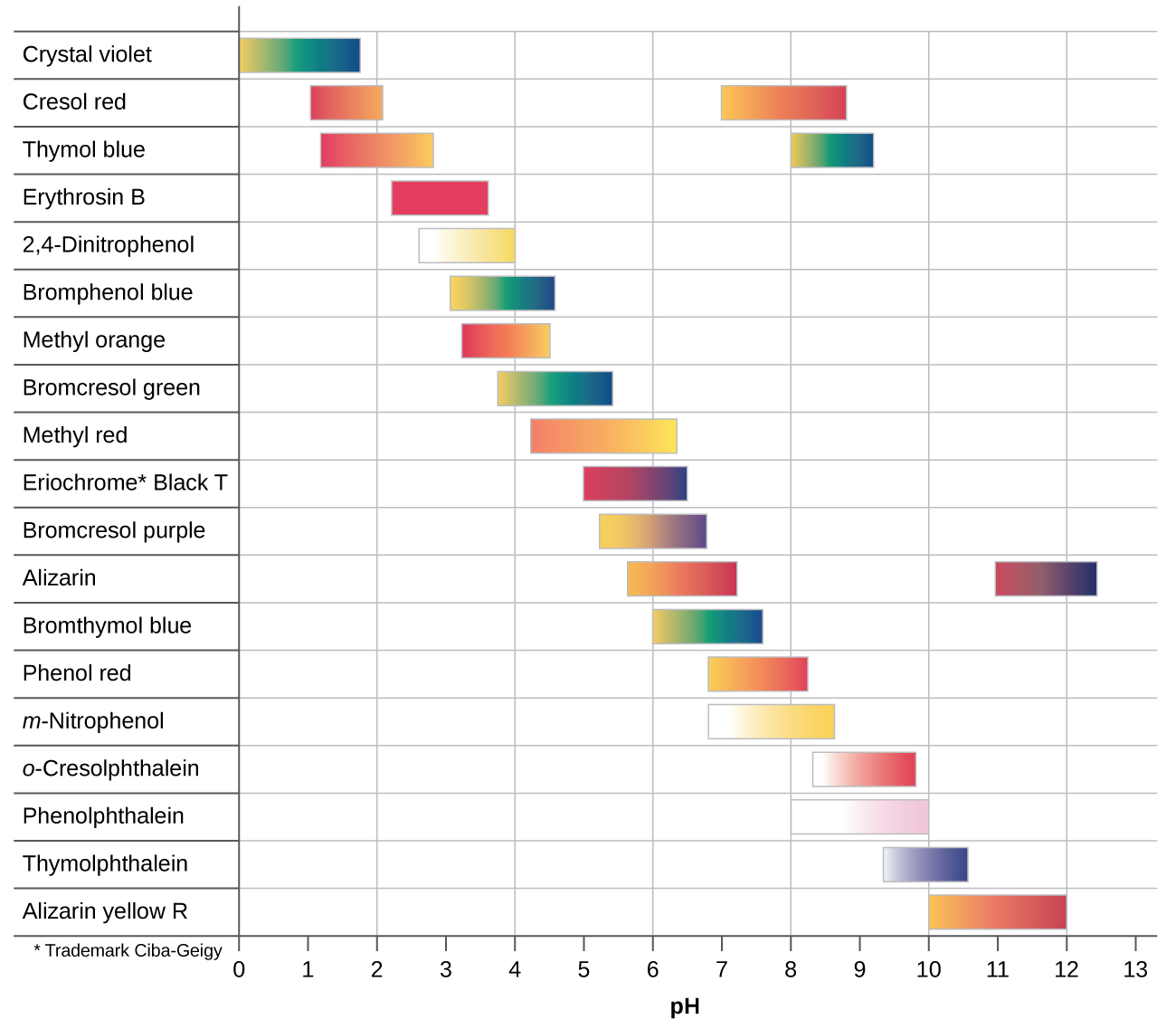
Las curvas de valoración pueden ayudarnos a seleccionar un indicador que proporcione un cambio de color nítido en el punto de equivalencia. La mejor selección es un indicador con un intervalo de cambio de color que entre paréntesis el pH en el punto de equivalencia de la titulación. (También podemos basar nuestra elección de indicador en el pH calculado en el punto de equivalencia).
Los intervalos de cambio de color de tres indicadores se muestran en la Figura 4. La sección pronunciada de las curvas de titulación tanto de la titulación de HCl como de CH 3 COOH se localizan en el intervalo de cambio de color de la fenolftaleína. Podemos usarlo para titulaciones de cualquiera de los dos ácidos.
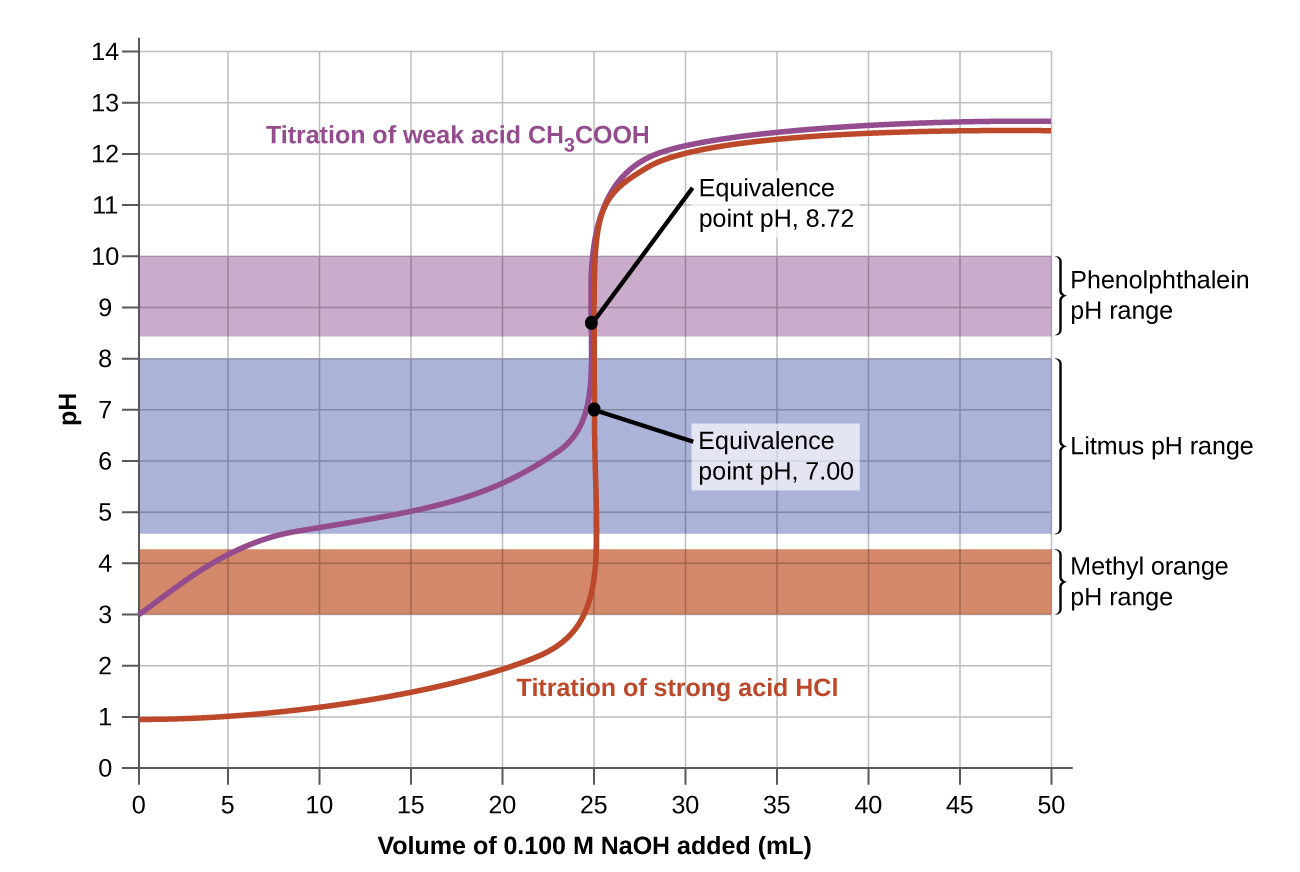
El tornasol es un indicador adecuado para la titulación de HCl. Sin embargo, no debemos usarlo para la titulación de CH 3 COOH porque el pH se encuentra dentro del intervalo de cambio de color de tornasol cuando solo se han agregado 8 mL de NaOH, y no deja el rango hasta que se han agregado 25 mL. El cambio de color sería muy gradual, ocurriendo durante la adición de 17 mL de NaOH, haciendo inútil el tornasol como indicador del punto de equivalencia.
Podemos usar naranja de metilo para la titulación de HCl, pero no daría resultados muy precisos: (1) Completa su cambio de color ligeramente antes de que se alcance el punto de equivalencia (pero muy cerca de él, por lo que esto no es demasiado grave); (2) cambia de color durante la adición de 0.5 mL de NaOH, que no es tan agudo a cambio de color como el de tornasol o fenolftaleína. El naranja de metilo sería completamente inútil como indicador para la titulación de CH 3 COOH. Su cambio de color se completa mucho antes de que se alcance el punto de equivalencia y por lo tanto no proporciona ninguna indicación del punto de equivalencia.
D37.4 Titulación de ácidos y bases polipróticos
Cuando se titula un ácido poliprótico, generalmente hay múltiples puntos de equivalencia. Por ejemplo, cuando H 2 SO 3 se titula con NaOH, hay dos puntos de equivalencia correspondientes a los dos protones ácidos de la molécula H 2 SO 3. También hay tantos puntos medios como puntos de equivalencia.
Cuando se agrega una base monoprótica fuerte a una solución de un ácido poliprótico, la reacción de neutralización ocurre por etapas. El protón más ácido (K a,1) se titula primero, seguido del siguiente más ácido (K a,2), y así sucesivamente. Si los valores de K a difieren en al menos tres órdenes de magnitud, entonces la curva de titulación general mostrará “pasos” bien resueltos correspondientes a la titulación de cada protón ácido.
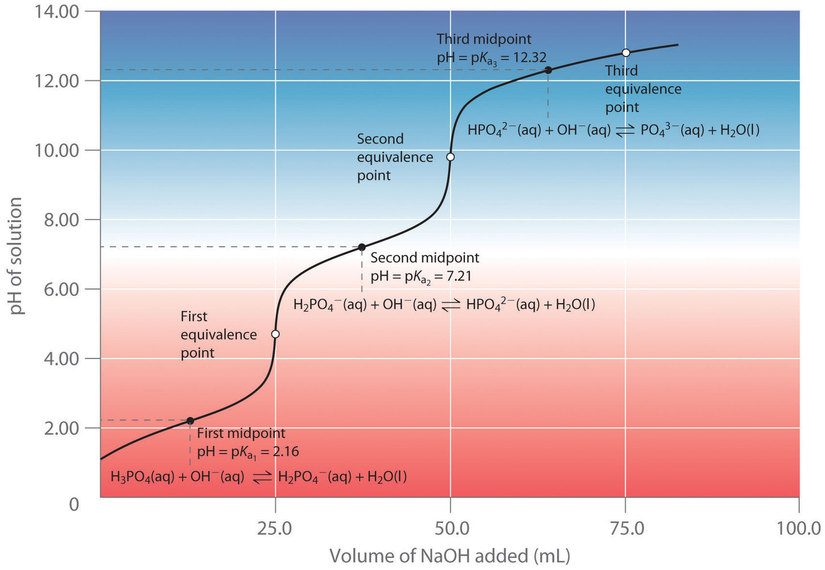
Considere la titulación de un ácido poliprótico débil genérico H 3 A con NaOH como se muestra en la Figura 5. El primer punto de equivalencia corresponde al punto donde se ha agregado 1 mol de NaOH por mol de H 3 A en la solución que se está valorando. A medida que se agrega más valorante, la curva de titulación cruza otro punto medio y alcanza el segundo punto de equivalencia, correspondiente a un total de 2 moles de NaOH que se agregan por mol de H 3 A en la solución. La valoración finalmente se completa cuando se han alcanzado los tres puntos de equivalencia.
No siempre es posible detectar todos los puntos de equivalencia en la titulación de un ácido poliprótico. En la Figura 6 se ilustra una valoración real del ácido triprótico H 3 PO 4 con NaOH. Se muestran dos pasos bien definidos: el primer punto medio corresponde a p K a ,1, y el segundo punto medio corresponde a p K a ,2. Debido a que HPO 4 2 − es un ácido tan débil, p K a ,3 tiene un valor tan alto que la tercera etapa no se puede resolver usando NaOH 0.100 M como valorante.
La curva de valoración para la reacción de una base poliprótica con un ácido fuerte se invierte en la escala de pH. El pH inicial es alto; a medida que se agrega ácido, el pH disminuye en etapas si los valores sucesivos de p K b están bien separados.
Pregunta Podia
Dibujar la estructura del aminoácido alanina a pH = 2.
Esbozar una curva de valoración para la valoración de una solución de alanina comenzando a pH = 2 y terminando en pH = 13. La concentración de alanina es de 0.100 M y hay 25.00 mL inicialmente, a pH = 2. Esta solución se titula con NaOH 0.100-M. Los valores de p K a para alanina son 2.85 y 9.87. No se requieren cálculos, pero la curva debe ser lo más precisa posible.
Hay dos puntos de equivalencia y dos puntos medios en esta titulación. Marque cada punto medio con el volumen y el pH. Explica cómo determinaste el pH en cada punto medio.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.
Comentarios. Si encontraste alguna inconsistencia, error u otras cosas que te gustaría reportar sobre este módulo, por favor usa este enlace para reportarlos. Se incluirá un enlace similar en el material de cada día. Agradecemos sus comentarios.


