7.4: A fondo: el principio de incertidumbre de Heisenberg
- Page ID
- 78931
45
A fondo: El principio de incertidumbre de Heisenberg
D3.2 El principio de incertidumbre de Heisenberg
Esta incapacidad para localizar un electrón precisamente parece extraña, pero es cierto para todas las partículas de escala atómica. En 1927, Werner Heisenberg introdujo el principio de incertidumbre de Heisenberg: es fundamentalmente imposible determinar simultánea y exactamente tanto el impulso como la posición de una partícula. Matemáticamente,
\[(\Delta x)(m \Delta v_x) = (\Delta x)(\Delta p_x) \ge \dfrac{h}{4\pi} \nonumber \]
donde Δ x es la incertidumbre en la posición y Δ p x es la incertidumbre en el impulso a lo largo de la dirección x. De ahí que cuanto más exactamente medimos el impulso de una partícula, menos precisión podremos determinar su posición en ese momento, y viceversa.
El resultado de tu cálculo muestra que si un electrón tiene Δ x = 1 pm, la incertidumbre en su velocidad es de al menos 5 × 10 7 m/s Es decir, esencialmente no tenemos idea de lo rápido que se mueve.
El principio de Heisenberg impone límites finales a lo que es mensurable en la ciencia. Es posible hablar de la probabilidad de que el electrón se encuentre en una ubicación específica, o la probabilidad de que se mueva a una velocidad dada, pero también habrá alguna probabilidad de encontrarlo en otro lugar de la caja o moverse a alguna otra velocidad.
El principio de incertidumbre puede parecer extraño, pero podemos decir que la probabilidad de encontrar un electrón similar a una partícula en una ubicación determinada depende de la forma de la onda asociada con el electrón. Las diversas formas de onda que dibujaste en la Actividad 2 se pueden describir matemáticamente usando funciones como senos o cosenos; es decir, hay una función de onda matemática que describe cada onda. La función de onda suele estar representada por una letra griega
\[\psi \nonumber \]
Poco después de que se propusiera el principio de incertidumbre, el físico alemán Max Born (1882 a 1969) sugirió que el cuadrado de la magnitud de la onda funcionaba,
\[|\psi|^2 \nonumber \]
en cualquier posición es proporcional a la probabilidad de encontrar el electrón (como una partícula) en esa misma posición. Si podemos determinar la función de onda asociada a un electrón, también podemos determinar la probabilidad relativa de que el electrón se ubique en un punto opuesto a otro. Así, cada forma de onda que dibujaste en la Actividad 2 puede ser representada por una función diferente,
\[\psi_n \nonumber \]
cada uno tiene una distribución diferente de carga eléctrica en toda la caja, y cada uno está asociado con un valor energético diferente y específico.
Una forma gráfica de indicar la probabilidad de encontrar el electrón en una ubicación particular es por la densidad de sombreado o punteado; es decir, donde la probabilidad es alta dibujamos muchos puntos o sombreado más oscuro y donde la probabilidad es baja dibujamos menos puntos. Decimos que donde la probabilidad es alta tenemos una gran densidad de probabilidad de electrones (o simplemente densidad de electrones). (En la analogía de guitarra-cuerda dibujaríamos muchos puntos en lugares donde la cuerda vibraba bastante lejos de su posición de reposo. Por ejemplo, considere la onda que se muestra a continuación en rojo junto con su cuadrado que se muestra en azul. Dondequiera que haya un máximo en el cuadrado de la función de onda, trazaríamos muchos puntos.)
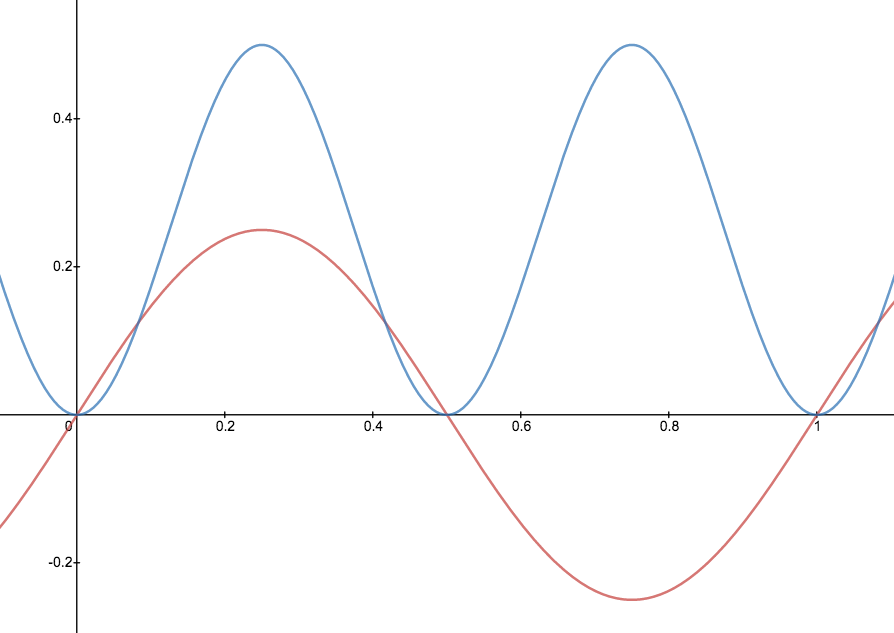
En tu cuaderno de curso, anota cada uno de tus dibujos de la cuerda vibrante con puntos de tal manera que la densidad de puntos indique la densidad de probabilidad de electrones.
En la teoría de Bohr un electrón tenía una órbita bien definida alrededor del núcleo, pero según el principio de incertidumbre, lo mejor que podemos hacer es indicar densidad electrónica en diversas regiones. En consecuencia, utilizamos una palabra ligeramente diferente para referirnos a la función de onda y su distribución de densidad de electrones: orbital. La densidad electrónica de los orbitales de un átomo o molécula es muy útil porque indica dónde hay carga negativa (densidad electrónica) relativa a carga positiva (núcleos atómicos). Esto nos ayuda a comprender las propiedades atómicas, los enlaces químicos y las fuerzas entre las moléculas.


