7.1: Evaporación
- Page ID
- 79173
Hay un par de métodos de purificación muy básicos que se utilizan rutinariamente en el laboratorio, y que en realidad son pasos clave en otros métodos. La evaporación es una de ellas.
La evaporación comienza con una solución. En una solución, un compuesto se disuelve en otro. Por ejemplo, el agua azucarada y el agua salada son soluciones. Las moléculas de azúcar pueden disolverse en el agua debido a los enlaces de hidrógeno; estas fuertes atracciones intermoleculares permiten que las moléculas de agua separen las moléculas de azúcar entre sí. Las moléculas de azúcar interactúan con las moléculas de agua en lugar de entre sí.
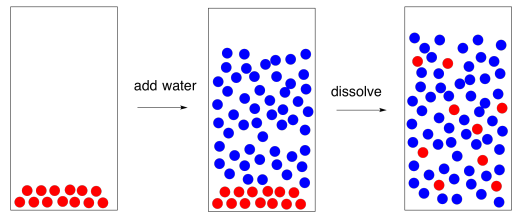
En agua salada, las interacciones ión-dipolo separan los iones de sodio de los iones cloruro en la sal. En lugar de interactuar directamente entre sí, los iones interactúan con las cargas parciales en las moléculas polares de agua.
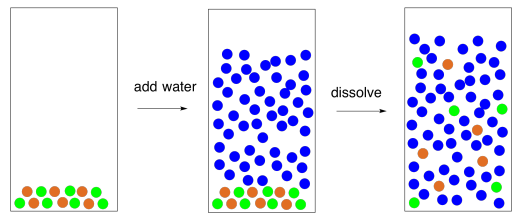
En una solución, siempre hay un compuesto líquido que disuelve el otro compuesto. Este compuesto líquido se llama el “solvente”. El agua es un solvente muy común, pero también hay otros. El compuesto que se disuelve se llama el “soluto”. Este compuesto podría ser un sólido, un líquido o incluso un gas. La vida en los océanos depende del oxígeno en fase gaseosa de la atmósfera que se disuelve en el agua para que la respiración sea posible en los organismos marinos. La vida en la tierra depende de que los minerales sólidos se disuelvan en el agua para que puedan ser absorbidos por las plantas y otros organismos.
En la evaporación, estamos deshaciendo el proceso de disolución. Estamos retirando el disolvente para que el soluto quede solo. Eso sería bastante difícil de hacer si el soluto fuera un gas, pero puede ser relativamente fácil si el soluto es líquido o sólido.
El caso más sencillo sería si el disolvente tuviera un punto de ebullición muy bajo. Para aislar el soluto, sería una simple cuestión de esperar mientras todas las moléculas de disolvente se mueven de la fase líquida a la fase gaseosa. El cambio de fase líquida a fase gaseosa se denomina evaporación. Una vez que el solvente hubiera entrado en fase gaseosa y escapado, nos quedaríamos solo con el soluto.
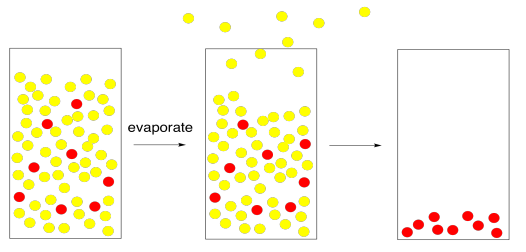
Hoy en día, la sal marina a veces es utilizada por los cocineros porque sienten que sabe mejor que la sal normal. La sal de mesa regular proviene de las minas de sal; los mineros la eliminan de los depósitos minerales en el suelo. La sal marina, por supuesto, viene directamente del mar. Para sacar la sal del agua de mar se requiere evaporación. El problema es que el agua no tiene un punto de ebullición muy bajo. No se evapora todo tan rápido.
Para sortear este problema, el agua de mar suele calentarse en sartenes hasta que el agua se evapore, dejando atrás la sal. El calor agregado ayuda a dar a las moléculas de agua suficiente energía para entrar en la fase gaseosa. El calor puede provenir de los fuegos de turba o leña, o incluso de la luz solar.
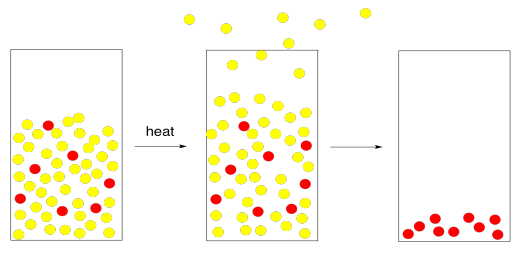
Agregar calor es una manera perfectamente buena de producir sal marina a partir del agua de mar. En el laboratorio, sin embargo, no siempre queremos calentar cosas que deseamos evaporar. Hay un par de razones para ello. Primero, el soluto que deseamos aislar puede ser sensible al calor. Se puede descomponer si lo calentamos. Segundo, el disolvente que deseamos eliminar puede ser inflamable. Se puede incendiar si lo calentamos. En definitiva, podemos preferir no usar calor porque no queremos quemar cosas.
¿Cómo resolvemos este problema? Un químico físico te diría que pienses en la presión. La presión es un factor siempre presente en la química, pero no solemos pensar en ello porque estamos acostumbrados a pasar nuestras vidas bajo una presión atmosférica bastante constante. Para entender cómo la presión juega un papel en la evaporación, necesitamos obtener una imagen más completa de la evaporación.
En nuestras fotos anteriores de evaporación, ignoramos la atmósfera por encima de la solución. El aire es importante aquí. Todas esas moléculas de nitrógeno y oxígeno zumbando alrededor en el aire ejercen una presión sobre nosotros, y sobre la solución. Si una molécula solvente comienza a moverse fuera de la fase líquida y a la fase gaseosa, ¿qué es probable que suceda? Probablemente colisionará con una de esas moléculas de oxígeno o nitrógeno en la atmósfera por encima de la solución. Cuando choca, lo más probable es que pueda volver a caer en la fase líquida.
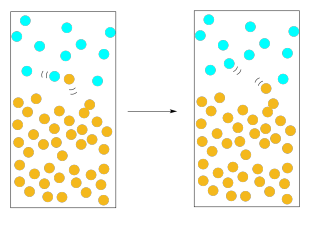
El solvente tendría una mayor probabilidad de escapar si hubiera muchas moléculas moviéndose a la fase gaseosa a la vez. Estadísticamente, si hay muchas moléculas emergiendo del líquido, las posibilidades son bastante buenas de que un número sustancial de ellas se escape sin ser derribadas. Además, cuantas más moléculas tengamos escapando del líquido, más probable es que invertiremos la imagen: en lugar de que las moléculas de nitrógeno vuelvan a golpear las moléculas de disolvente al líquido, las moléculas de disolvente están sacando del camino a las moléculas de nitrógeno, despejando un camino para que otros sigan.
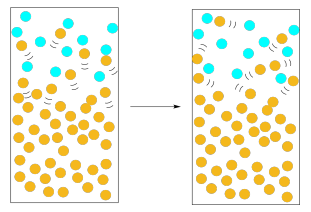
Esta idea nos lleva al concepto de presión de vapor. La presión de vapor es la presión ejercida por las moléculas de disolvente en la fase gaseosa por encima del líquido. Cuanto mayor es la presión de vapor, más fácilmente se evapora el líquido. Cuando la presión de vapor del líquido excede la presión atmosférica, el líquido llega a ebullición y se evapora rápidamente.
La forma de aumentar la presión de vapor es calentando el líquido. La energía impartida a las moléculas de disolvente pondrá más de ellas en la fase gaseosa, y esas moléculas en la fase gaseosa ejercerán más presión por encima del líquido.
- El punto de ebullición es una función de la presión de vapor.
- La presión de vapor es una función de la temperatura.
Ahora, podemos usar el concepto de presión de vapor de manera opuesta. Podemos calentar el líquido hasta que alcance su punto de ebullición —es decir, hasta que su presión de vapor sea mayor que la presión atmosférica. Alternativamente, podríamos bajar la presión atmosférica hasta que sea menor que la presión de vapor del líquido. Una vez que la presión de vapor del líquido excede la de la atmósfera, el líquido hervirá.
- El punto de ebullición es una función de la presión.
Para lograr esa tarea, todo lo que necesitamos es una bomba de vacío. La bomba de vacío barre las moléculas de la fase gaseosa, disminuyendo la presión atmosférica. En algún momento, hay tan pocas moléculas de nitrógeno y oxígeno que su presión de vapor llega a ser menor que la del disolvente. El solvente hierve, a pesar de que su temperatura no ha sido elevada.
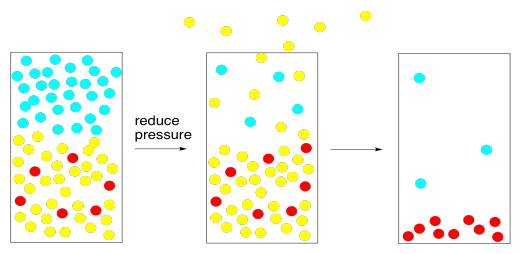
Este enfoque se suele tomar en el laboratorio utilizando un evaporador rotatorio. Un evaporador rotatorio utiliza algún método para bajar la presión atmosférica por encima de la solución que se pretende evaporar. Puede requerir una bomba de vacío o un aspirador. Trabajar con presión reducida puede ser difícil. El problema más común es que, cuando se reduce la presión atmosférica, la solución rápidamente hierve demasiado, haciendo un desastre en todas partes. El uso de un evaporador rotatorio requiere que el usuario esté al tanto de algunos pasos para evitar problemas.
Primero, la solución se coloca en un matraz seco de fondo redondo, y es importante que el matraz esté siempre menos de la mitad lleno de la solución. Un cuarto lleno está bien; un tercio lleno está bien. La mitad llena puede ocasionar problemas. Cuanto más lleno esté el matraz, más probable es que, si la solución llega a hervir por completo, necesitará expandirse todo el camino fuera del matraz (hervirá demasiado).
Segundo, un evaporador rotatorio tiene un motor que hace girar el matraz sobre su eje. Por lo general, es una buena idea hacer girar el matraz muy rápidamente. La fuerza centrípeta resultante puede ayudar a mantener la solución en el matraz donde pertenece, en lugar de sobrehervir. Además, esa fuerza centrípeta mantendrá la solución extendida sobre las paredes del matraz. Eso maximizará la superficie del líquido, maximizando la velocidad de evaporación.
Tercero, los evaporadores rotativos cuentan con un baño de agua que permite calentar la solución. Esta capacidad contrarresta el hecho de que la evaporación es un proceso que consume energía. Si el solvente comienza a evaporarse, las moléculas que se evaporan extraerán calor de sus alrededores. El matraz y la solución comenzarán a enfriarse. La presión de vapor caerá. El solvente dejará de evaporarse. Para cortar ese proceso, colocamos el matraz en un baño de agua. El agua tiene una alta capacidad calorífica, por lo que puede almacenar mucho calor sin mucho cambio de temperatura. También puede liberar algo de calor al matraz sin que se ponga mucho más frío. Estabiliza la temperatura, para que la presión de vapor del disolvente no baje, y la evaporación puede continuar. En muchos casos, un baño de agua a temperatura ambiente es todo lo que se requiere para una evaporación constante. Si es necesario, el agua se puede calentar, pero el calor y el vacío siempre deben combinarse con mucha cautela. No quieres exagerar y que la solución hierva demasiado.
Indicar el orden en que se evaporarían los siguientes líquidos, de lo más rápido a lo más lento.
- hexano, bp = 69°C; diclorometano, bp = 39°C; agua, bp = 100°C
- tolueno, bp = 111°C; dimetilsulfóxido, bp = 189°C; acetona, bp = 56°C
- benceno, bp = 101°C; acetato de etilo, bp = 89°C; pentano, bp = 35°C
- Contestar a
-
Lo más rápido: diclorometano > hexano > agua: más lenta
- Respuesta b
-
Lo más rápido: acetona > tolueno > dimetilsulfóxido: más lento
- Respuesta c
-
Lo más rápido: pentano > acetato de etilo > benceno: más lento

