1.2: Adhesión química
- Page ID
- 80139
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Las configuraciones electrónicas de los elementos, como se especifica en el capítulo anterior, se aplican en principio solo a átomos aislados, átomos separados por distancias sobre las cuales no pueden ocurrir interacciones mutuas de sus orbitales electrónicos (distancia infinita). Esta condición nunca se cumple en fases condensadas (es decir, líquidos y sólidos); solo se encuentra en altas vacuas donde los átomos se mueven a largas distancias sin interacción mutua. En condiciones normales, particularmente en las fases condensadas mencionadas, los átomos se separan en distancias controladas, en esencia, por la dimensión de sus respectivos orbitales electrónicos ocupados más exteriores. Siempre que las capas externas de electrones de dos o más átomos entran en contacto entre sí (se superponen en cualquier medida), existe el potencial de interacción (reacción). La reacción espontánea (consistente en un reordenamiento de los orbitales electrónicos y/o transferencia real de electrones de un átomo a otro) tendrá lugar siempre que tal reordenamiento dé como resultado una configuración de energía más baja. Esto significa que la fuerza impulsora para la interacción mutua y el reordenamiento de las configuraciones electrónicas se manifiesta en la mayoría de los casos (pero no siempre) a través de la liberación de calor (una forma de energía) al medio ambiente. [Caso típico: Producto de\(\mathrm{Mg}+1 / 2 \mathrm{O}_{2} \rightarrow\) reacción\((\mathrm{MgO})+(\) luz + calor) es decir energía.] Dado que la misma cantidad de energía debe ser suministrada al sistema para que se restablezca el estado original -es decir, la separación de la especie-, los compañeros de reacción están “unidos” por energías comparables. La “fuerza” de los bonos obviamente puede variar de un sistema a otro con la naturaleza del reordenamiento electrónico.
Incluso los gases inertes, particularmente los más pesados como el xenón, son capaces de formar asociaciones con otros átomos. A veces encontramos que dos átomos asumen un estado más estable al compartir electrones; otras veces, un átomo puede transferir electrones a otro átomo para lograr una mayor estabilidad. En otros casos, el reordenamiento puede ser simplemente una distorsión orbital o una redistribución de carga interna. En cualquier caso el beneficio mutuo que se acumula es la formación de lo que comúnmente se llama un enlace químico. A través de estos enlaces los átomos se combinan entre sí para formar tipos muy diferentes de partículas denominadas moléculas e iones.
NATURALEZA DE LOS ENLACES QUÍMICOS
Para que se forme un enlace químico entre dos átomos, debe haber una disminución neta en la energía del sistema (los dos átomos): los iones o moléculas producidas por reordenamientos electrónicos deben estar en un estado de energía más bajo que los átomos antes de la interacción, previo a la formación del enlace.
Dado que los átomos de cada uno de los elementos tienen diferentes estructuras electrónicas, la variedad de posibles enlaces químicos (que difieren entre sí en al menos alguna pequeña forma) es considerable y se incrementa aún más por los efectos de los átomos vecinos en el enlace bajo consideración. Los modos de formación de enlaces se pueden clasificar en dos tipos básicos, cada uno de los cuales representa un tipo de unión. Los tipos de unión se denominan enlaces electrovalentes (o iónicos) y enlaces covalentes. La unión electrovalente surge de la transferencia completa de uno o más electrones de un átomo a otro; la unión covalente surge de la distribución de dos o más electrones entre átomos. Dado que estos modelos representan los casos limitantes, podemos anticipar que la mayoría de los bonos reales caerán entre estos dos extremos. (Dos tipos adicionales de unión, unión metálica y unión Van der Waals, se discutirán más adelante).
Antes de discutir estos modelos en detalle es apropiado considerar las relaciones entre las estructuras electrónicas de los átomos y su reactividad química. Los gases inertes (Grupo VIII) son los elementos más estables con respecto a la formación de enlaces, es decir, hacia reordenamientos electrónicos. Por lo tanto, es útil examinar las razones de su estabilidad. Todos los gases inertes tienen estructuras electrónicas que consisten en subcarcasas rellenas. Para todos menos el helio, la capa exterior (o valencia) contiene ocho electrones, con relleno\(s\) y\(p\) subniveles\(\left(n s^{2} p^{6}\right)\). La estructura electrónica del helio es\(1 s^{2}\), que es equivalente a la estructura de los otros gases inertes ya que no hay\(1 \mathrm{p}\) subnivel. Los gases inertes tienen altas energías de ionización debido a que cada electrón en el subnivel de energía más alta es pobremente tamizado desde el núcleo por otros electrones en su mismo subnivel. Cada electrón “ve” una carga positiva relativamente alta en el núcleo, y se requiere una gran cantidad de energía para eliminarlo del átomo. Los gases inertes tienen una afinidad electrónica muy baja debido a que cualquier electrón agregado debe ingresar a un nivel de energía significativamente mayor. Encontramos, por lo tanto, que las estructuras electrónicas de los gases inertes son particularmente resistentes a los cambios ya sea por pérdida o ganancia de electrones y, además, que los átomos de otros elementos con menos o más electrones que la configuración del gas inerte tienden a ganar o perder electrones, respectivamente, para lograr dicho gas inerte estructura.
UNIÓN ELECTROVALENTE (IÓNICA)
Un enlace electrovalente se forma por la transferencia de uno o más electrones de un átomo a otro. Considera los primeros átomos que tienen estructuras electrónicas que difieren de una estructura de gas inerte en solo unos pocos, (1, 2 o 3) electrones. Estos incluyen los elementos representativos de los Grupos I, II y III en la Tabla Periódica, que tienen respectivamente 1, 2 y 3 electrones más que un gas inerte vecino, y los elementos representativos de los Grupos V, VI y VII, que tienen respectivamente 3, 2 y 1 electrones menores que un gas inerte vecino (fig. 1).

Fig.1 Configuraciones de Carcasa de Valencia Estable e Inestable.
Los elementos de los Grupos I, II y III pueden formar la estructura electrónica de un gas inerte al perder sus electrones exteriores 1, 2 y 3 (valencia). (Las especies resultantes son iones cargados positivamente).
En una transferencia de electrones similar que, sin embargo, implica la adquisición de electrones en los niveles de valencia externa, los elementos de los Grupos V, VI y VII forman una estructura electrónica de gas inerte (por formación de iones cargados negativamente).
Es a través de la transferencia de electrones entre un elemento de pérdida de electrones y un elemento de ganancia de electrones que se forman compuestos que implican atracción electrostática (enlaces electrovalentes) de especies cargadas opositivamente llamadas iones.
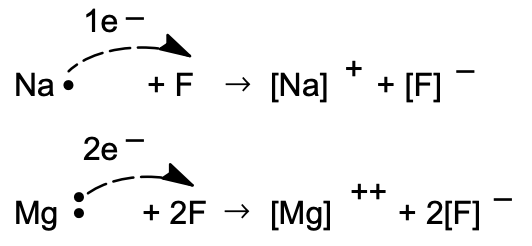
(En la notación [Na•], el punto indica el electrón más externo que está en exceso de la configuración de gas raro. Se le conoce como un electrón de valencia.)
Los elementos inmediatamente posteriores a los gases inertes (en las columnas horizontales de la Tabla Periódica) pierden electrones, y los inmediatamente anteriores a los gases inertes ganan electrones en la interacción. Los compuestos resultantes se denominan electrovalentes; el número de valencia (carga sobre el ion) de un elemento en particular cuando forma un compuesto electrovalente viene dado por el número de electrones perdidos o ganados al cambiar del estado atómico al iónico.
La fórmula estequiométrica de un compuesto electrovalente refleja la relación (generalmente muy simple) de iones positivos a negativos que da un agregado neutro. De ahí que los iones\(\mathrm{Na}^{+}\) y\(\mathrm{F}^{-}\) formen un compuesto cuya fórmula se\(\mathrm{NaF}\) debe a que estos iones están cargados individualmente y están presentes en el compuesto en una relación uno a uno. El nitruro de magnesio, compuesto por\(\mathrm{Mg}^{2+}\) y\(\mathrm{N}^{3-}\), tiene la fórmula\(\mathrm{Mg}_{3} \mathrm{~N}_{2}\) porque esta composición representa electroneutralidad.
El enlace electrovalente es el resultado de la atracción electrostática entre iones de carga opuesta. Esta fuerza atractiva explica la estabilidad de estos compuestos, tipificada por\(\mathrm{NaF}, \mathrm{LiCl}, \mathrm{CaO}\), y\(\mathrm{KCl}\). Los iones poseen individualmente las estructuras electrónicas de los gases inertes vecinos; su carga residual surge de un desequilibrio en el número de electrones y protones en sus estructuras. Los iones aislados y los pares aislados simples de iones, representados por la fórmula\(\mathrm{NaCl}\), existen solo en estado gaseoso. Sus fuerzas electrostáticas están activas en todas las direcciones; atraen especies cargadas opositivamente y así pueden formar matrices regulares, dando como resultado estructuras reticulares ordenadas, es decir, el estado sólido (fig. 2). Incluso en estado líquido y en soluciones (donde las fuerzas térmicas disruptivas alcanzan valores cercanos a los de las atractivas fuerzas de unión electrostática) la atracción entre iones y con otras especies sigue siendo efectiva.

Energética de la Unión Iónica
La unión iónica es el tipo de unión química más simple de visualizar, ya que es de naturaleza totalmente (o casi totalmente) electrostática. El principio de la energía de la formación de enlaces iónicos se realiza al considerar la formación de\(\mathrm{NaCl}\) (nuestra sal común) a partir de sus constituyentes\(\mathrm{Na}\) (metal) y\(\mathrm{Cl}_{2}\) (gas cloro). Formalmente, esta reacción es:
\ begin {alineado}
&\ mathrm {Na} (\ mathrm {s}) +1/2\ mathrm {Cl} _ {2} (\ mathrm {~g})\ rightarrow\ mathrm {NaCl} (\ mathrm {s})\\
&\ Delta\ mathrm {H} =-414\ mathrm {~kJ}/\ mathrm {mol}
\ end {alineado}
La ecuación tal como está escrita indica que 1 mol de sodio reacciona con\(1 / 2\) mol de cloro\(\left(\mathrm{Cl}_{2}\right)\) bajo formación de 1 mol (unido iónicamente) de cloruro de sodio; esta reacción va acompañada\((-)\)\(414 \mathrm{~kJ}\) de la liberación de energía\((\Delta \mathrm{H})\), denominada el calor de reacción. De consideraciones anteriores es claro que el reordenamiento electrónico (reacción o formación de enlaces) tiene lugar porque el producto sólido resultante\((\mathrm{NaCl})\) se encuentra en un estado energético menor que la suma total de las energías de los componentes originales.
La energía asociada con la formación de enlaces iónicos se puede determinar cuantitativamente considerando los cambios de energía asociados con los pasos individuales que conducen desde los materiales de partida hasta el producto final (ciclo Haber-Born).
La formación de enlaces en NaCl puede presentarse formalmente como una reacción de transferencia de electrones:

Las reacciones involucradas en este proceso que dan como resultado la formación de 1 mol de sal sólida son:
(1) Ionización de\(\mathrm{Na}\):
\(\mathrm{Na}\)(gas)\(\rightarrow \mathrm{Na}^{+}+1 \mathrm{e}\) (E.I.\(=+497 \mathrm{~kJ} / \mathrm{mole})\)
El cambio energético asociado a este paso, la energía de ionización (E.I.), es
\(+497 \mathrm{~kJ} /\)mole.
(2) Adquisición de un electrón por\(\mathrm{Cl}\):
\(\mathrm{Cl}\)(gas)\(+1 \mathrm{e} \rightarrow \mathrm{Cl}^{-}\) (E.A.\(=-364 \mathrm{~kJ} / \mathrm{mole}\))
El cambio energético asociado a este paso, la afinidad electrónica (E.A.), es\(-364 \mathrm{~kJ} / \mathrm{mole}\). El signo menos refleja una liberación de energía, una disminución del estado energético asociado con el logro de una configuración estable de gas raro por el cloro.
Hasta el momento, el balance energético parece positivo (\(\Delta \mathrm{E}=+133 \mathrm{~kJ}\)); esto significa que la reacción no se ve favorecida ya que los productos finales se encuentran en un estado energético más alto que los productos de partida. Sin embargo, hay pasos adicionales involucrados ya que:
(3) Vaporización de\(\mathrm{Na}\):
\(\mathrm{Na}\)(metal)\(\rightarrow \mathrm{Na}\) (gas)\(\left(\Delta \mathrm{H}_{\mathrm{V}}=+109 \mathrm{~kJ} /\right.\) mol)
La energía requerida para transformar\(\mathrm{Na}\) (metal) en\(\mathrm{Na}\) (gas), el calor latente de vaporización\(\left(\Delta \mathrm{H}_{\mathrm{v}}\right)\), es\(109 \mathrm{~kJ} /\) molar (ahora la reacción parece aún menos favorable).
(4) Disociación de\(\mathrm{Cl}_{2}\):
\(\mathrm{Cl}_{2} \rightarrow 2 \mathrm{Cl} \quad(\text { E.D. }=+242 \mathrm{~kJ} \text { ) }\)
La energía asociada con la descomposición de la molécula de cloro (estable) en dos átomos reactivos de cloro, la energía de disociación (E.D.), es\(+242 \mathrm{~kJ} / \mathrm{mole}\). (Dado que la formación de un mol\(\mathrm{NaCl}\) implica sólo 1 mol\(\mathrm{Cl}\), y dado que se forman 2 moles a partir de un mol\(\mathrm{Cl}_{2}\), la energía requerida en esta etapa es\(1 / 2 \mathrm{E} . D\)., o\(121 \mathrm{~kJ}\).)
El cambio energético total asociado con las reacciones (1) a (4),\(\Delta \mathrm{H}_{\mathrm{T}}=+364 \mathrm{~kJ}\) Esto indica que una o más reacciones básicas que conducen a una disminución general de la energía aún no se consideran.
(5) Aún no se considera la atracción coulómbica de los productos de reacción que son de carga opuesta y un término energético asociado a la formación del producto de “estado sólido”,\(\mathrm{NaCl}\). Las dos especies iónicas, originalmente a energía cero (distancia infinita de separación), se atraen entre sí con un cambio de energía acompañante (disminución).
La energética asociada al acercamiento de los compañeros de reacción (fig. 3) se considera mejor fijando la posición de uno, por ejemplo\(\mathrm{Na}^{+}\), y dejando que el otro se\(\left(\mathrm{Cl}^{-}\right)\) acerque: a medida que\(\mathrm{Cl}^{-}\) se acerca\(\mathrm{Na}^{+}\), E disminuye de acuerdo con la ley de Coulomb con\(\mathrm{e}^{2} / 4 \pi \varepsilon_{0} r\). Con la aproximación de los dos iones con carga opuesta, las conchas electrónicas más externas entrarán en contacto y una fuerza repulsiva se activará a medida que las conchas se interpenetren. La fuerza repulsiva\(\left(E_{\text {rep }}\right)\) aumenta con\(+b / r^{12}\) y por lo tanto solo es activa en las inmediaciones del ion sodio, pero en esa etapa aumenta rápidamente. Los dos iones en estrecha proximidad están bajo la influencia de fuerzas tanto atractivas como repulsivas y asumirán una distancia de separación en la que las dos fuerzas se equilibran entre sí, una distancia que se conoce como la separación de equilibrio (\(r_o\)) y que corresponde al mínimo de energía para el NaCl moléculas:
\(E_{\text {coul }}=-\dfrac{e^{2}}{4 \pi \varepsilon_{0} r_{0}}+\dfrac{b}{r_{0}^{12}}\)
donde carga\(e=\) electrónica,\(\varepsilon_{0}=\) permitividad de espacio libre\(\left(8.85 \times 10^{-12} \mathrm{~F} / \mathrm{m}\right)\) y\((\mathrm{b})\) es una constante. (\(r_{0}\)para moléculas gaseosas pueden obtenerse a partir de mediciones físicas.)

Si se toma en consideración el término energético coulómbico (atractivo) actualmente considerado como reacción (5), disminuirá el cambio energético positivo general,\(\Delta \mathrm{H}_{\bar{T}}\); sin embargo, no hará que cambie de signo de (+) a (-). Por lo tanto,\(\mathrm{NaCl}\) las moléculas en forma gaseosa no son el producto final de la reacción; ni se produciría la reacción si\(\Delta \mathrm{H}_{\mathrm{T}}\) permaneciera positiva.
Considerando una\(\mathrm{Na}^{+} \mathrm{Cl}^{-}\) molécula gaseosa iónicamente unida, es claro que sus fuerzas electrostáticas\((+)\) y no\((-)\) están saturadas, permanecen activas en todas las direcciones posibles. Esto significa que\(\mathrm{Cl}^{-}\) atraerá\(\mathrm{Na}^{+}\) iones de otras direcciones al igual que los\(\mathrm{Na}^{+}\) átomos atraerán\(\mathrm{Cl}^{-}\) iones adicionales. El resultado de estas fuerzas atractivas en todas las direcciones es la formación de un cuerpo iónico de “tamaño gigante”, un cuerpo “sólido” de dimensiones macroscópicas. De lo anterior se reconoce que la configuración de energía mínima viene dada por un cuerpo en el que\(\mathrm{Na}^{+}\) y\(\mathrm{Cl}^{-}\) están dispuestos con periodicidad y orden extremos ya que cualquier ion ubicado fuera de su “posición de equilibrio” estará en una “configuración de energía superior”; se refiere a dicho cuerpo ordenado a como un sólido cristalino, o frecuentemente simplemente llamado sólido (fig. 2).
El cambio de energía total asociado con la formación de un mol de sólido iónico cristalino a partir de sus constituyentes iónicos se da como:
\(\mathrm{E}_{\text {cryst }}=-\dfrac{M \mathrm{~N}_{\mathrm{A}} \mathrm{e}^{2}\left(\mathrm{Q}_{1} \mathrm{Q}_{2}\right)}{4 \pi \varepsilon_{0} r_{o}}\left(1-\dfrac{1}{\mathrm{n}}\right)\)
donde\(\mathrm{M}=1.747\) (constante “Madelung” para\(\mathrm{NaCl}\), reflejando múltiples interacciones para la disposición geométrica particular de los iones en el sólido), número de\(\mathrm{N}_{\mathrm{A}}=\) Avogadro,\(\mathrm{Q}=\) número de cargas por ión (1 para\(\mathrm{Na}^{+}\) y distancia de\(\left.\mathrm{Cl}^{-}\right), \mathrm{r}_{0}=\) equilibrio de separación de iones, y \(n=\)exponente repulsivo\((n=12\) para\(\mathrm{NaCl})\).
[La relación para la energía cristalina\(\left(\Delta \mathrm{E}_{\text {cryst }}\right)\) se obtiene fácilmente a partir de consideraciones de energía de equilibrio:
\(\mathrm{E}_{\text {coul }}=-\dfrac{\mathrm{e}^{2}}{4 \pi \varepsilon_{0} r}+\dfrac{\mathrm{b}}{4 \pi \varepsilon_{0} r^{n}}\)
A distancia de equilibrio de separación de iones\(\left(r_{0}\right),(\mathrm{dE} / \mathrm{dr})=0\). Así:
\(\left(\dfrac{d E}{d r}\right)_{r_{0}}=\dfrac{e^{2}}{4 \pi \varepsilon_{0} r_{o}^{2}}-\dfrac{n b}{4 \pi \varepsilon_{0} r_{o}^{n+1}}=0\)
y
\(\mathrm{b}=\dfrac{\mathrm{e}^{2} \mathrm{r}_{\mathrm{o}}^{\mathrm{n}-1}}{\mathrm{n}}\)
y
\ begin {alineado}
&E_ {o (\ text {Coul})} =-\ frac {e^ {2}} {4\ pi\ varepsilon_ {o} r_ {o}} +\ frac {e^ {2}} {n 4\ pi\ varepsilon_ {o} r_ {o}}\\
&E_ {o (\ texto Coul})} =-\ frac {e^ {2}} {4\ pi\ varepsilon_ {o} r_ {o}}\ izquierda (1-\ frac {1} {n}\ derecha)
\ final {alineado}
Para un cristal “molar” con cargas iónicas\(\mathrm{Q}_{1}\) y\(\mathrm{Q}_{2}\), el molar\(\Delta \mathrm{E}_{\mathrm{o}(\text { Coul) }}\) se da así como:
\(\Delta \mathrm{E}_{\text {cryst }}=-\dfrac{\mathrm{MN}_{\mathrm{A}} \mathrm{Q}_{1} \mathrm{Q}_{2} \mathrm{e}^{2}}{4 \pi \varepsilon_{\mathrm{o}} \mathrm{r}_{\mathrm{o}}}\left(1-\dfrac{1}{\mathrm{n}}\right)\)
Aquí\(M\) y\(N_{A}\) plantémonos, como se indicó anteriormente, para los términos convencionales, la constante de Madelung y el número de Avogadro.]
Para el sistema actual (\(\mathrm{NaCl})\):
\(\Delta \mathrm{E}_{\text {cryst }}=-777 \mathrm{~kJ} /\)mole.
Ahora considerando las reacciones (1) a (5):
\(\Delta \mathrm{H}_{\text {Total }}=-414 \mathrm{~kJ} /\)mole
que es idéntico al valor determinado experimentalmente y dado para la reacción:
\ begin {alineado}
&\ mathrm {Na} (\ text {metal}) +\ mathrm {Cl} _ {2}\ text {(gas)}\ rightarrow\ mathrm {NaCl}\ text {(sólido)}\\
&\ Delta\ mathrm {H} _ {\ text {Reacción}} =-414\ mathrm {~kJ}/\ texto {mole}
\ end {alineado}
En el ciclo Haber-Born, la energía de reacción\((\Delta \mathrm{H})\) asociada a la formación de\(\mathrm{NaCl}\) from\(\mathrm{Na}+\mathrm{Cl}_{2}\) puede resumirse como:
\(\Delta \mathrm{H}=\text { E.I. }+\text { E.A. }+\Delta \mathrm{H}_{\mathrm{V}}+1 / 2 \text { E.D. }+\Delta \mathrm{H}_{\text {cryst }}\)
\(\Delta \mathrm{H}\), el calor de reacción, se puede obtener así de la energía de las etapas que conducen al producto final. En la mayoría de los casos, sin embargo, la energía de reacción\((\Delta \mathrm{H})\) se determina experimentalmente en un calorímetro y se utiliza el ciclo Haber-Born para obtener el valor de\(\Delta \mathrm{E}_{\text {cryst }}\) o\(\mathrm{E} . \mathrm{A} .\), que son ambos extremadamente difíciles de conseguir.
Conclusiones: Un impulso primario para las interacciones atómicas que conducen a la “unión” es el logro de octetos de concha de valencia que presentan un alto grado de estabilidad. Si los átomos en el lado izquierdo y derecho de la Tabla Periódica interactúan, es decir, átomos con una gran diferencia en la afinidad electrónica (\(\triangle \mathrm{E} . \mathrm{A} .)\), la estabilización se logra mediante la formación de octeto de electrones a través de transferencia de carga. Los productos de reacción exhiben cargas opuestas (\(\oplus\)cationes,\(\ominus\) aniones) y están sujetos a atracción coulómbica - se forman enlaces iónicos. Dado que las fuerzas electrostáticas son no direccionales y no saturadas, la minimización de energía dará como resultado la formación de cuerpos macroscópicos altamente ordenados en la escala atómica, sólidos iónicos cristalinos. Los sólidos iónicos tienen principalmente propiedades básicas predecibles:
- las disposiciones atómicas son una función de la relación de tamaño de iones, la relación de carga de los iones y su estructura electrónica;
- se espera que las conductividades eléctricas y térmicas sean bajas porque la alta estabilidad de los octetos formados da como resultado electrones unidos que no contribuyen a la conducción (hay una gran “brecha de energía” que debe cruzarse para que los electrones pasen a un estado de mayor energía);
- ópticamente, los sólidos iónicos son en su mayoría transparentes o translúcidos, reflejando la estabilidad del octeto de los electrones y la macrocristalinidad o microcristalinidad;
- los puntos de fusión son altos, aumentando con las cargas electrónicas en los cationes y aniones;
- Los sólidos iónicos son normalmente duros y quebradizos.
ENLACE COVALENTE
Conceptos y Conclusiones Mecánicas
En 1924 L. DeBroglie avanzó la hipótesis de que toda la materia en movimiento posee propiedades de onda y se le puede atribuir una longitud de onda de partícula
\(\lambda_{P}=\mathrm{h} / \mathrm{mv}\)
donde\(\mathrm{h}\) está la constante de Planck,\(\mathrm{m}\) es la masa de la materia y\(v\) es su velocidad.
La credibilidad de esta hipótesis fue establecida por Davisson y Germer en 1927 cuando demostraron que los electrones (como la radiación electromagnética) son difractados por redes cristalinas. Una consecuencia importante de la naturaleza dual de la materia (exhibe propiedades tanto de partículas como de onda) es el principio de incertidumbre establecido en 1927 por W. Heisenberg. Afirma que es imposible conocer simultáneamente con certeza tanto el impulso como la posición de una partícula en movimiento:
\(\left(\Delta p_{x}\right)(\Delta x) \gtrsim h\)
Podemos parafrasear el principio de incertidumbre de la siguiente manera: Si la energía de una partícula se conoce (mide) con alta precisión, su ubicación se asocia con un alto grado de incertidumbre.
Si los electrones ocuparan órbitas simples (como postula Bohr-Sommerfeld), su impulso y posición podrían determinarse exactamente en cualquier momento -en violación del principio de incertidumbre. Según Heisenberg, si la energía de un electrón se especifica con precisión (nitidez de líneas espectrales), su ubicación sólo puede especificarse en términos de la probabilidad de encontrar este electrón en una determinada ubicación (elemento de volumen). Estos argumentos dan lugar a los conceptos de densidad de probabilidad y nube de electrones que son inherentes al concepto onda-electrón mecánico que emana de las soluciones de la ecuación de onda de Schrödinger que relaciona la energía de un electrón en órbita con su onda propiedades. Al resolver exactamente la ecuación de onda de Schrödinger para un electrón en un átomo de hidrógeno, resulta una cuantificación según la cual los electrones solo pueden asumir ciertas energías que están en concordancia cuantitativa con las obtenidas de la teoría de Bohr.
En comparación con la teoría de Bohr, se observan diferencias significativas para la cuantificación orbital (número cuántico orbital\(I\)) que especifica la forma orbital. Para\(n=1\),\(I=0\) (1s orbital), la mecánica de ondas predice una distribución esférica de densidad electrónica con una densidad de probabilidad máxima\(\left(\psi^{2}\right)\) a una\(0.529 \AA\left(\mathrm{a}_{0}\right)\) distancia del núcleo. Para\(I=1\) (p orbitales), sin embargo, se encuentra que los orbitales (tres) forman lóbulos alineados con coordenadas rectangulares (ver LN-1, fig. 3). Para\(I=2\) (d orbitales) se obtienen cinco configuraciones orbitales complejas.
Consideraciones anteriores sugieren que todos los elementos intentan asumir una configuración estable de octeto con ocho electrones en la capa de valencia. (Para el hidrógeno, con solo un caparazón ocupado, la configuración estable consiste en dos electrones en el\(\mathrm{K}\) caparazón, que es el número máximo de electrones que se pueden acomodar). La formación estable de octeto es posible mediante transferencia de electrones (y formación de enlaces iónicos) cuando, por ejemplo, los elementos de las columnas IA, IIA y IIIA reaccionan con elementos en las columnas VA, VIA y VIIA, respectivamente. En estos casos, los compañeros de reacción exhiben diferencias bastante pronunciadas en la afinidad electrónica y tras la reacción uno asume la configuración de octeto al perder uno o más electrones mientras que el otro lo hace adquiriendo el número faltante de electrones.
Este mecanismo claramente no es posible si\(\mathrm{H}\) reacciona con\(\mathrm{H}\) para formar una\(\mathrm{H}_{2}\) molécula donde dos átomos están unidos entre sí. El mismo argumento sostiene para la formación de\(\mathrm{O}_{2}\) moléculas\(\mathrm{N}_{2}, \mathrm{Cl}_{2}\) y. La configuración de gas inerte (configuración de octeto) en tales elementos se logra mediante un mecanismo llamado reparto orbital y el enlace resultante se denomina enlace covalente, o enlace de par de electrones.
Un enlace covalente es algo más difícil de visualizar que un enlace iónico o electrovalente porque implica compartir un par de electrones entre átomos. La estabilidad de este enlace puede atribuirse a la compleja atracción mutua de dos núcleos cargados positivamente por el par compartido de electrones. En principio, el enlace puede entenderse si se reconoce que ambos electrones en el orbital de unión pasan más tiempo entre los dos núcleos que alrededor de ellos y así deben ejercer fuerzas atractivas que constituyen el enlace. En esta disposición es claro que cada electrón, independientemente de su fuente, ejerce una fuerza atractiva sobre cada uno de los núcleos “unidos”. El par de electrones en un enlace covalente es único en la medida en que el principio de exclusión de Pauli excluye la presencia de electrones adicionales en el mismo orbital. Además, el fenómeno de emparejamiento neutraliza los espines electrónicos separados de los electrones individuales, y el par de electrones resultante con su momento de giro cero interactúa menos fuertemente con su entorno que dos electrones independientes. [Los enlaces covalentes se simbolizan convenientemente a través de la notación de puntos, introducida primero por Lewis (fig. 4).]
NOTACIÓN LEWIS:
En la notación LEWIS el enlace molecular covalente se indica como una BAR o como dos DOTS (que representan los electrones emparejados)

La estabilización formal del octeto de concha de valencia se puede lograr mediante el intercambio de electrones, H mediante el cual un electrón de cada compañero de reacción comparte - espín emparejado - el orbital de enlace molecular.
La mecánica cuántica permite describir rigurosamente estos enlaces para casos muy simples como la molécula de hidrógeno, que está compuesta por dos protones y dos electrones. Así se puede demostrar que la energía potencial para el sistema alcanza un mínimo para una cierta distancia de equilibrio entre los núcleos, con una densidad de electrones incrementada entre los núcleos. A distancias más cortas entre los núcleos se encuentra que las fuerzas repulsivas aumentan muy rápidamente.
En la molécula de hidrógeno\(\left(\mathrm{H}_{2}\right)\), los dos átomos de hidrógeno están efectivamente unidos entre sí por un orbital de electrones moleculares, denominado\(\sigma\) orbital, que comprende ambos átomos y contiene dos electrones. (fig. 5) Se puede considerar que cada uno de estos dos electrones se originó a partir de uno de los dos átomos; originalmente ambos eran\(1 \mathrm{~s}\) electrones con el mismo valor de espín\((s=+1 / 2)\). En la órbita molecular que comprende ambos átomos, los espines de

los dos electrones deben alinearse antiparalelos (giro opuesto). Este proceso de espín-emparejamiento da como resultado una liberación considerable de energía y por lo tanto contribuye significativamente a la estabilidad (fuerza) del enlace covalente formado. Es interesante que según la mecánica newtoniana, ninguna configuración estable puede surgir de la colocación de dos electrones en la misma región (órbita); la mecánica de ondas (ver más abajo), sin embargo, predice una mayor estabilidad a partir de tales configuraciones. (El emparejamiento de espín similar ocurre en el llenado de orbitales atómicos). En el caso molecular, el emparejamiento por espín tiene la consecuencia de que tanto las distribuciones\(\left(\psi^{2}\right)\) de probabilidad como la distribución espacial de los electrones son tales que se produce la superposición máxima de orbitales de átomos combinantes.
El enlace formado en hidrógeno es un enlace sencillo, que contiene dos electrones con espines emparejados. Esta formulación predice que habrá una separación internuclear fija que, para la molécula de hidrógeno, tiene el valor de\(0.74 \AA\). [\(\sigma\)los enlaces se forman no solo por superposición orbital s, sino también por superposición orbital p-s y p-p así como por el solapamiento de\(s\) o\(p\) orbitales con orbitales hibridados; para ser discutidos a continuación (ver fig. 5).]
Es importante reconocer que la estabilización del octeto por compartición orbital de electrones da como resultado propiedades de enlace que difieren fundamentalmente de las encontradas en el enlace iónico (electrovalente): con la formación del enlace covalente entre la formación de\(\left(\mathrm{H}_{2}\right.\) moléculas de átomos de hidrógeno) el enlace las capacidades de formación de los dos átomos de hidrógeno están saturadas; el producto final es una molécula distinta\(\left(\mathrm{H}_{2}\right)\) en lugar de un cuerpo sólido de tamaño gigante que se obtiene como el producto final con formación de enlaces iónicos. Sin embargo, también existen cuerpos sólidos covalentes: se forman si los elementos involucrados tienen la capacidad de formar más de un enlace. Por ejemplo, el carbono formará cuatro enlaces covalentes en configuración tetraédrica; el resultado es diamante, una red tridimensional unida covalentemente.
Moléculas diatómicas que involucran átomos diferentes
Considera el compuesto cloruro de hidrógeno (en estado gaseoso, líquido o sólido). Este compuesto no es iónico (porque el estado energético en la ionización completa sería mayor. En cambio, el enlace entre los átomos de hidrógeno y cloro se logra mediante el intercambio de electrones en un orbital molecular, formando así un único enlace covalente (fig. 6).

Los electrones involucrados son el electrón de 1 s del átomo de hidrógeno y el\(3 p_{z}\) electrón desapareado del átomo de cloro. Después del apareamiento por espín, resulta un\(\sigma\) enlace típico en el que cada átomo alcanza una estructura de gas noble: en\(\mathrm{HCl}\) el átomo de hidrógeno está “involucrado” con dos electrones, como en helio, y el átomo de cloro con 18 electrones, como en argón. Los otros electrones (internos) de cloro no participan en el enlace; se denominan no enlazantes.
De acuerdo con las consideraciones anteriores, la vinculación de\(\mathrm{HCl}\) puede tomarse como muy similar a la de\(\mathrm{H}_{2}\). Sin embargo, en la molécula de hidrógeno los electrones que participan en la formación del\(\sigma\) enlace no favorecen la proximidad de ninguno de los núcleos de hidrógeno, sino que son igualmente compartidos. Por otro lado, una preferencia por un núcleo (cloro) se muestra por los electrones del\(\sigma\) enlace en el cloruro de hidrógeno. Esto se debe a que los electrones, por razones energéticas, favorecen el ambiente del átomo más electronegativo; en el cloruro de hidrógeno este es el átomo de cloro y, en consecuencia, los electrones de\(\sigma\) enlace pasan más tiempo en las proximidades del átomo de cloro. Esta situación da como resultado que el extremo de cloro de la molécula esté cargado fraccionalmente negativamente\(\left(\delta^{-}\right)\) y el extremo de hidrógeno esté cargado positivamente de manera fraccionada\(\left(\delta^{+}\right)\). Denotamos tal redistribución de carga interna por el simbolismo\(\mathrm{H}^{\delta+}-\mathrm{Cl}^{\delta-}\), donde el\(\delta\) signo indica una carga electrónica parcial; se dice que el vínculo es polar. (La molécula de hidrógeno no presenta a priori tal “distribución asimétrica de carga”; sin embargo, puede adquirir una polarización temporal). Las moléculas con distribución de carga electrónica asimétrica tienen un momento dipolo permanente, cuyo valor viene dado por el producto de la carga fraccional (\(\delta^{+}\)debe ser igual a\(\delta^{-}\)) y la distancia de separación de carga\((\mathrm{L})\). Si bien se pueden medir los momentos dipolares, sus valores no permiten calcular directamente la polaridad de los enlaces entre átomos ya que se desconoce la distribución detallada de la carga interna. La dirección de la deriva electrónica y, hasta cierto punto, la magnitud de su efecto se puede estimar a partir de la magnitud de la diferencia en la afinidad electrónica entre los compañeros de reacción. Debido a una base de datos limitada sobre la afinidad electrónica, L. Pauling introdujo un término relacionado, la electronegatividad relativa (ver más adelante). De las consideraciones anteriores debe quedar claro que no existe una línea divisoria aguda entre la unión iónica y covalente. Podríamos considerar un enlace completamente iónico para dar como resultado casos en los que la deriva de electrones es tal que un átomo (el catión) se vuelve completamente deficiente en uno o más electrones, y el otro átomo (el anión) se vuelve correspondientemente rico en electrones, estando los electrones de enlace completamente bajo la influencia de este último . Los halogenuros de hidrógeno están unidos a $\ sigma$ y tienen momentos dipolares; los enlaces se denominan covalencia polar. Las moléculas diatómicas homonucleares formadas por los halógenos, a saber\(\mathrm{I}_{2}\),\(\mathrm{F}_{2}, \mathrm{Cl}_{2}, \mathrm{Br}_{2}\) y, son todos sistemas\(\sigma\) unidos que implican el apareamiento de espín de los diversos\(p_{z}\) electrones\(\left(2 p_{z}, 3 p_{z}\right.\),\(4 p_{z}\) y\(5 p_{z}\) respectivamente). No tienen momentos dipolares permanentes.
Energética de Enlace Covalente
Pauling trató extensamente la energía de las covalencias polares, encontradas en todos los sistemas heteronucleares (como\(\mathrm{H}-\mathrm{Cl}\)) que tienen momentos dipolares permanentes\(\left(\mathrm{H}^{\delta+}-\mathrm{Cl}^{\delta-}\right)\). Su enfoque visualiza la unión en dos componentes: una covalencia pura y un componente de enlace iónico con atracción resultante de la interacción de las cargas fraccionarias en los núcleos involucrados.
Pauling determina el componente básico de enlace covalente, por ejemplo en la formación de\(\mathrm{HCl}\), a partir de las energías de enlace obtenidas experimentalmente asociadas con las especies moleculares de los componentes,\(\mathrm{H}_{2}\) y\(\mathrm{Cl}_{2}\). Para ello hizo la suposición básica de que el componente de enlace covalente entre los átomos disímiles viene dado por la media geométrica de las energías de enlace covalente puro asociadas a estas especies moleculares. Así:
Energía de enlace covalente pura de\(\mathrm{HCl}\):
\ begin {alineado}
\ mathrm {BE} _ {\ mathrm {HCl}} &=\ sqrt {\ mathrm {BE} _ {\ mathrm {H} _ {2}}\ veces\ mathrm {BE} _ {\ mathrm {Cl} _ {2}}}\
&\ mathrm {H} _ {2}:\ mathrm {H} -\ mathrm {H}\ text {(Energía de enlace} =\ mathrm {BE} _ {\ mathrm {H} _ {2}} =430\ mathrm {~kJ}/\ mathrm {mole}\ text {)}\\
&\ mathrm {Cl} _ {2}:\ mathrm {Cl} -\ mathrm {Cl}\ text {(Energía de bonos} =\ mathrm {BE} _ {\ mathrm {Cl}} =238\ mathrm {~kJ}/\ mathrm {mole}\ text {)}\\
&\ mathrm {BE} _ {\ mathrm {HCl}} =\ sqrt {430\ times 238} =320\ mathrm {~kJ}/\ texto {mole}
\ end {alineado}
La contribución iónica\((\Delta)\) al enlace covalente polar se obtiene entonces de la diferencia entre la energía de enlace determinada experimentalmente (por\(\mathrm{HCl}\) ejemplo), que obviamente debe contener ambos componentes, y la energía de enlace covalente pura calculada:
\(\left.\Delta=\left[\mathrm{BE}_{\mathrm{HCl}} \text { (experimental }\right)\right]-\left[\mathrm{BE}_{\mathrm{HCl}} \text { (theoretical - covalent) }\right]\)
\(\text{(The experimentally determined} \mathrm{BE}_{\mathrm{HCl}}=426 \mathrm{~kJ} / \mathrm{mole}.)\)
\(\Delta=426-320=106 \mathrm{~kJ} / \text { mole }\)
En relación con el trabajo actualmente discutido, Linus Pauling estableció la escala de electronegatividad actualmente utilizada, o mejor, la escala de electronegatividades relativas. Esta escala, incluida en la Tabla Periódica de los Elementos, es extremadamente útil ya que los valores de la afinidad electrónica son conocidos hasta ahora por muy pocos elementos.
La\((\mathrm{x})\) escala de electronegatividad enumera la tendencia relativa de los elementos neutros a atraer un electrón adicional. (Los valores de\(x\) se enumeran convencionalmente en electrón Voltios.) La escala listada se obtuvo fijando arbitrariamente el valor de\(x_{H}=2.2\). Pauling obtuvo los valores para los otros elementos relacionando las diferencias en la electronegatividad de los compañeros de reacción con el carácter iónico fraccional (componente de enlace iónico) del enlace establecido entre ellos:
\ begin {alineado}
&\ text {experimental}\ mathrm {BE} _ {\ mathrm {AB}} =\ sqrt {\ mathrm {BE} _ {\ mathrm {AA}}\ veces\ mathrm {BE} _ {\ mathrm {BB}}} +\ mathrm {k}\ left (\ mathrm {x} _ {\ mathrm {A}} -\ mathrm {x} _ {\ mathrm {B}}\ derecha) ^ {2}\\
&\ texto {o}\\
&\ Delta=96.3\ left (\ mathrm {x} _ { \ mathrm {A}} -\ mathrm {x} _ {\ mathrm {B}}\ derecha) ^ {2}\ mathrm {~kJ}
\ end {alineado}
Según Pauling, el carácter de unión entre dos elementos diferentes puede definirse como:
enlace iónico para:\(\Delta x>1.7\); enlace covalente para:\(\Delta x<1.7\)
La ionicidad fraccionada del enlace covalente polar como se enumera en la P/T se obtiene por la relación:
\(\%\)unión iónica\(=\left(1-\mathrm{e}^{-0.25\left(\mathrm{x}_{\mathrm{A}}-\mathrm{x}_{\mathrm{B}}\right)^{2}}\right) \times 100\)
Unión en moléculas poliatómicas
En la formación de enlaces covalentes entre átomos en moléculas poliatómicas, las condiciones que distorsionan los orbitales atómicos para que se logre una superposición máxima cuando se produce la unión produce cambios de geometría orbital más extensos que en el caso de las moléculas diatómicas. Se recordará que los cambios que resultan en una formación de\(\sigma\) enlaces en moléculas diatómicas son una distorsión de los orbitales o\(p\) lóbulos de manera que la formación de enlaces más fuertes resulta del solapamiento máximo entre los dos núcleos unidos. Para las moléculas poliatómicas se producen alteraciones extensas en la disposición espacial de los orbitales atómicos, y muy a menudo la geometría orbital única de los orbitales atómicos originales se pierde por completo (fig. 7). A veces es conveniente considerar que estas alteraciones ocurren en cada átomo antes de unirse por un proceso que implica la mezcla, o hibridación, de orbitales atómicos.

Vinculación que involucra carbono
En\(\left(\mathrm{CH}_{4}\right)\) el metano los cuatro electrones exteriores, o valencia, de carbono se comparten con los electrones de hidrógeno; hay espin-emparejamiento (dando como resultado la formación de enlaces) entre cada electrón de hidrógeno individual y uno de los electrones de valencia de carbono. La estructura del gas noble es así alcanzada por cada núcleo: el núcleo de carbono “ve” ocho electrones externos y cada\(\mathrm{H}\) núcleo “ve” dos electrones. Consideremos ahora los orbitales que están involucrados con más detalle. Cada hidrógeno tiene un orbital de valencia esférica (el orbital 1s) que contiene un electrón, y la formación de enlaces covalentes es el resultado de su distorsión, superposición con los orbitales de valencia de carbono y apareamiento de espinas.
Según el principio de Aufbau y la regla de Hund, en su estado fundamental el carbono tiene dos electrones en la\(\mathrm{K}\) cubierta llena y cuatro electrones en la\(\mathrm{L}\) concha: dos electrones de 2 s y dos\(2 p\) electrones en orbitales ocupados individualmente que son capaces de formar enlaces covalentes. Esta configuración proporciona, en principio, solo dos orbitales\(\left(2 p_{x}, 2 p_{y}\right)\) para la formación de enlaces covalentes. Sin embargo, con dos covalencias el carbono no dará la configuración de octeto deseable. Tal configuración se puede obtener si uno de los dos electrones 2s es “promovido” al\(2 p_{z}\) orbital vacío ya que este proceso da como resultado cuatro orbitales ocupados individualmente, todos los cuales, al estar ocupados individualmente, son capaces de formar enlaces. Los orbitales diferentes ocupados individualmente pueden asumir (y por lo tanto asumirán) tras la formación del enlace una configuración de menor energía que implica un proceso llamado hibridación mediante el cual los cuatro orbitales (de dos tipos diferentes) se hibridan en cuatro orbitales idénticos de espaciamiento máximo igual entre sí (fig. 8). Así los orbitales hibridados (\(sp^3\)híbridos) son lóbulos que emanan del átomo de carbono hacia las esquinas de un tetraedro, formar ángulos de enlace de\(109^{\circ} 28^{\prime} . \mathrm{sp}^{3}\) hibridación es característico para el carbono; sin embargo, otros tipos de hibridación,\(\mathrm{sp}^{2}\) y\(\mathrm{sp}\), se encuentran en otros elementos como bien. El boro, por ejemplo, tenderá a promover uno de sus dos electrones 2s a un\(2 p\) estado y, por hibridación, formará tres\(s p^{3}\) orbitales equivalentes que asumen orientación plana con ángulos de banda de\(120^{\circ}\). El berilio forma orbitales híbridos sp de orientación lineal (el ángulo de unión es\(\left.180^{\circ}\right)\). Todos los orbitales híbridos son capaces de formar\(\sigma\) enlaces.
La gran diversidad de compuestos de carbono (forma más compuestos que todos los demás elementos de la Tabla Periódica) se puede atribuir a la capacidad de hibridación de los orbitales de carbono\(\left(\mathrm{sp}^{3}, \mathrm{sp}^{2}\right.\) y\(\left.\mathrm{sp}\right)\). Como consecuencia, el carbono forma no solo\(\sigma\) enlaces axisimétricos (a través de superposición orbital axial), sino también\(\pi\) enlaces (a través de superposición orbital lateral). En el etano compuesto\(\left(\mathrm{H}_{2} \mathrm{C}=\mathrm{CH}_{2}\right)\), los átomos de carbono interactivos se someten a\(\mathrm{sp}^{2}\) hibridación para un\(\sigma\) enlace por superposición de dos orbitales\(\mathrm{sp}^{2}\) híbridos y forman, además, un\(\pi\) enlace por solapamiento lateral de los\(p\) orbitales restantes no hibridados. (Los dobles enlaces implican uno\(\sigma\) y uno\(\pi\).) En el acetileno\((\mathrm{HC} \equiv \mathrm{CH})\) encontramos hibridación sp y, por solapamiento axial, formación de\(\sigma\) enlaces así como solapamiento lateral de los restantes no hibridados\(p_{x}\) y\(p_{y}\) orbitales que forman dos\(\pi\) enlaces (fig. 9).


UNIÓN METÁLICA
Se puede considerar que la estabilidad de los enlaces covalentes y metálicos surge de la disminución de energía potencial experimentada por los electrones de valencia bajo la influencia de más de un núcleo. En los metales, donde los electrones de valencia no están tan estrechamente unidos a sus núcleos iónicos, no podemos esperar la formación de fuertes enlaces de pares de electrones. Las energías de enlace de moléculas diatómicas conocidas de elementos metálicos son, de hecho, menores que las que consisten en elementos no metálicos:\(104 \mathrm{~kJ} /\) mol para\(\mathrm{Hg}_{2}\). Solo las moléculas diatómicas de los semimetales tienen energías de unión relativamente altas\(\left(385 \mathrm{~kJ} / \mathrm{mole}\right.\)\(293 \mathrm{~kJ} / \mathrm{mole}\) para\(\mathrm{As}_{2}\), para\(\mathrm{Sb}_{2}\) y\(163 \mathrm{~kJ} /\) mol para\(\mathrm{Bi}_{2}\)). Estos valores reflejan la unión múltiple. Es posible una estabilidad mucho mayor en agregados más grandes de átomos como metales a granel.
Las propiedades conocidas de los metales, como la baja resistencia eléctrica y maleabilidad, apoyan la visión conceptual de que los electrones de valencia en los metales nunca permanecen cerca de ningún átomo en
particular por mucho tiempo, sino que se desplazan de manera aleatoria a través de la red de núcleos iónicos. Por lo tanto, podemos visualizar los metales como una red de núcleos iónicos que se mantienen unidos por un gas de electrones libres.
(La unión en sistemas metálicos se discute con más detalle en LN-3.)
UNIÓN SECUNDARIA (van der WAALS
La unión primaria (iónica, covalente y metálica) es fuerte y las energías involucradas varían de aproximadamente 100 a 1000 kJ/mol. Por el contrario, la unión secundaria es débil, involucrando energías que van desde aproximadamente 0.1 a 10 kJ/mol. Si bien este tipo de vinculación, también referida como “residual”, es débil, es esencial en el funcionamiento de nuestro entorno. El coque probablemente sería gaseoso y no un brebaje burbujeante y refrescante si no fuera por unión secundaria, ni funcionarían convertidores catalíticos.
La diferencia de energía entre los estados líquido y vapor de un sistema dado viene dada por el calor de vaporización, es decir, el calor requerido para convertir un líquido dado en vapor (normalmente) a la temperatura del punto de ebullición a 1 atm de presión. La diferencia de energía se debe a la atracción intermolecular entre moléculas a corta distancia de separación. Este fenómeno de atracción a través de la unión secundaria se puede considerar mejor entre un solo par de moléculas, pero reconociendo que las fuerzas son de mayor alcance. Se pueden identificar cuatro tipos de fuerzas intermoleculares.
1. Interacción dipolo-dipolo: Las moléculas con dipolos permanentes (como agua, alcohol y otros compuestos orgánicos con grupos funcionales) ejercen una fuerza neta atractiva entre sí como resultado de diversos grados de alineación de porciones de las moléculas con carga opuesta (fig. 10). Para dos moléculas polares con un momento dipolar de\((\mu)\) separadas por una distancia de (r), la energía de atracción se puede cuantificar como:

donde\(\mu\) está el momento dipolo,\(r\) es la distancia de aproximación de las porciones moleculares cargadas opositivamente,\(k\) es la constante de Boltzmann (ver\(P / T)\) y\(T\) es la temperatura absoluta en\(\mathrm{K}\).
Las energías molares de atracción asociadas con la interacción dipolo-dipolo varían de 0 a aproximadamente\(10 \mathrm{~kJ} /\) mol. Estas fuerzas son las principales responsables del estado líquido (a temperatura ambiente) de la mayoría de las moléculas orgánicas polares; son un factor que contribuye para ser líquidas\(\mathrm{H}_{2} \mathrm{O}\) a temperatura ambiente, y son responsables de que el alcohol sea un líquido.
2. Interacción dipolo inducida por dipolo: Un dipolo en una molécula puede interactuar y polarizar los electrones de una molécula no polar vecina, generando así un dipolo inducido que experimentará una fuerza atractiva con el dipolo polarizador polar (fig. 11). P. Debye demostró que en una molécula con una “polarizabilidad”\((\alpha)\) del potencial atractivo derivado de la interacción dipolo inducida por dipolo se da como:
\(\mathrm{E}_{\text {Dipole-Induceddipole }}=-\dfrac{2 \alpha \mu^{2}}{\mathrm{Dr}^{6}}\)

La interacción dipolo inducida es importante en soluciones acuosas y muy efectiva durante la adsorción de moléculas inertes sobre sustratos sólidos activos.
3. London Dispersion Forces: Es un hecho bien conocido que todas las sustancias, incluidos los gases raros y el hidrógeno, asumen el estado líquido a temperatura finita, una indicación de la existencia de atractivas fuerzas interatómicas e intermoleculares, incluso en ausencia de sistemas dipolares permanentes. El origen de esta fuerza ha sido propuesto por F. London en 1930. En consecuencia, los electrones orbitantes generarán en cualquier caso un “dipolo temporal”, cuya configuración cambia a medida que los electrones se mueven. Dado que todos los átomos de un sistema dado experimentan de manera similar momentos dipolares instantáneos temporales, se espera que su efecto sea cancelado debido a la orientación estadísticamente aleatoria de los dipolos. Es evidente que, si los dipolos se sincronizan en un conjunto dado de átomos, entonces se produciría una fuerza neta de atracción (fig. 12). Pero como una fuerza tan atractiva constituye una disminución de la energía de un sistema dado, la sincronización puede y tendrá lugar porque todos los sistemas intentarán asumir una configuración de energía mínima. La fuerza de dispersión de Londres se puede formular como:
\(\mathrm{E}_{\text {London }}=-\mathrm{K} \dfrac{\alpha^{2}}{\mathrm{r}^{6}}\)
Las atractivas fuerzas londinenses son pequeñas, como se manifiesta por los muy bajos puntos de ebullición de los gases raros más pequeños, de hidrógeno y nitrógeno.
4. Enlace de hidrógeno: Las interacciones dipolares de corto y largo alcance calculadas a partir de momentos dipolares moleculares son inadecuadas para explicar una multitud de fenómenos tanto en sistemas orgánicos como en algunos inorgánicos. L. Pauling estudió tales

y concluyó la existencia de interacción atractiva altamente específica entre el hidrógeno que es ácido (lleva una carga positiva fraccional) y los elementos O, F, N y, en menor medida, S en moléculas tanto orgánicas como inorgánicas. Esta interacción, que aún no puede formularse, se conoce como enlace de hidrógeno; su magnitud, que oscila hasta 40 kJ/mol, es significativamente mayor que la de cualquier otro tipo de enlace secundario. El enlace de hidrógeno se considera instrumental en el control de la mayoría de las propiedades del agua, es un elemento clave en la estructura del ácido nucleico y se cree que es un componente esencial en las funciones de memoria del cerebro humano.


