1.3: Unión en Metales, Semiconductores y Aislantes — Estructura de Banda
- Page ID
- 80102
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
INTRODUCCIÓN
Las propiedades características de los metales incluyen: (1) conductividad eléctrica, (2) opacidad y (3) maleabilidad. Un modelo muy simple en el que el cristal metálico es visto como una red de iones positivos rodeados por un “gas” de electrones libres proporciona una comprensión cruda de las propiedades primera y tercera. Si el cristal tiene un gas de electrones libres, es fácil ver por qué la aplicación de un campo eléctrico dará como resultado el movimiento de estos electrones y por lo tanto para la alta conductividad eléctrica. Este modelo también permite explicar la maleabilidad de los metales, como se muestra en la fig. 1b. Cuando un cristal metálico está sujeto a fuerzas que desplazan un plano de átomos con respecto a otro, el ambiente de la especie cargada se deja sin cambios. En contraste, el desplazamiento de planos vecinos en un cristal iónico como resultado de una fuerza distorsionadora conducirá a la escisión, en gran parte debido a cambios en la interacción de las especies cargadas (Figura\(\PageIndex{1, left}\)).

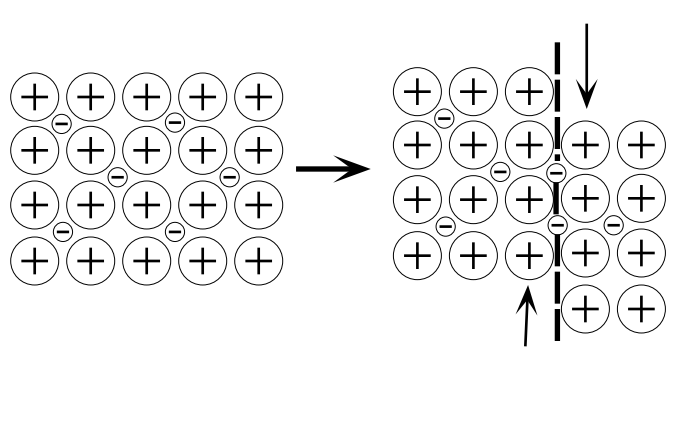
La teoría del gas de electrones libres o teoría de Drude-Lorentz (D-L) también explica en principio la naturaleza de las fuerzas de unión atractivas que mantienen unidos los iones metálicos (el metal): el cristal se mantiene unido por fuerzas electrostáticas de atracción entre los iones metálicos cargados positivamente y el electrones no localizados, cargados negativamente - el gas de electrones. La teoría en su forma original asume que la teoría cinética clásica de los gases es aplicable al gas electrónico; se ignoró la repulsión mutua entre electrones y se esperaba que los electrones tuvieran velocidades que dependieran de la temperatura de acuerdo con una ley de distribución Maxwell-Boltzmann.
Si bien la teoría de la unión metálica Drude-Lorentz se consideró un modelo útil, pronto se hicieron evidentes varias deficiencias. La falla más notable consistió en la discrepancia inexplicable entre las calores específicas observadas y predichas de metales (energía en forma de calor, requerida para aumentar la temperatura\(1 \mathrm{~g}\) de un metal dado por\(1^{\circ} \mathrm{C}\)). La teoría D-L predijo calores específicos mucho mayores que los observados (porque la distribución de energía Maxwell-Boltzmann no tiene restricciones en cuanto al número de especies permitidas para tener exactamente la misma energía). [Si hay restricciones en cuanto al número de electrones con energía idéntica (¡principio de exclusión de Pauli!) , tenemos que aplicar una forma diferente de estadística (estadística Fermi-Dirac).]
TEORÍA DE BANDAS DE ENERGÍA BASADA EN LA FORMACIÓN DE ORBITALES MOLECULARES
Un modelo diferente, y uno que está más estrechamente relacionado con los modelos del enlace químico discutidos anteriormente, es el modelo de banda. Este modelo, propuesto por Bloch antes del desarrollo del enfoque molecular-orbital para la unión química, es en realidad un modelo molecular-orbital de cristales metálicos. Los orbitales característicos de todo el cristal se obtienen como combinaciones lineales de los orbitales atómicos de los átomos individuales.
De la gran conductividad eléctrica de los metales, parece que al menos algunos de los electrones pueden moverse libremente a través del grueso del metal. Dado que incluso el litio con un solo electrón de valencia tiene ocho vecinos más cercanos (cristaliza en una red cúbica centrada en el cuerpo), es claro que los átomos no pueden unirse entre sí por enlaces localizados de pares de electrones (porque en ese caso el átomo de litio, que en conjunto tiene solo tres electrones, tendría que suministrar ocho o incluso catorce electrones de valencia para establecer la unión con los átomos vecinos más cercanos y próximos). El hecho de que en una red metálica un átomo pueda interactuar simultáneamente con un gran número de otros puede explicarse considerando que los metales constituyen un ejemplo extremo de unión deslocalizada.
Las condiciones en los metales no se evalúan tan fácilmente como en las cadenas de hidrocarburos orgánicos porque las celosías metálicas son estructuras tridimensionales. Sin embargo, varios resultados importantes de la teoría de la unión metálica se pueden entender en un modelo altamente simplificado en el que la celosía tridimensional es reemplazada por un sistema unidimensional. Considere la formación de una matriz lineal de átomos de litio a partir de átomos de litio individuales:
\[\mathrm{Li} \rightarrow \mathrm{Li}-\mathrm{Li} \rightarrow \mathrm{Li}-\mathrm{Li}-\mathrm{Li} \rightarrow \mathrm{Li}-\mathrm{Li}-\mathrm{Li}-\mathrm{Li} \rightarrow \ldots\]
La primera etapa es la formación de una molécula de litio,\(\mathrm{Li}_{2}\), que es comparable a la molécula de hidrógeno,\(\mathrm{H}_{2}\). Los dos átomos de litio están unidos entre sí por un par de electrones de valencia; cada átomo de litio suministra su electrón 2s-que, a través del solapamiento orbital, forma un enlace molecular covalente (fig. 2). La molécula formada ocurre en vapor de litio y difiere de la\(\mathrm{H}_{2}\) molécula solo por su mayor distancia interatómica (\(\mathrm{Li}-\mathrm{Li}= 2.67 \times 10^{-10} \mathrm{~m}, \mathrm{H}-\mathrm{H}=0.75 \times 10^{-10} \mathrm{~m}\)) y menor energía de formación. La mayor separación y la consiguiente reducción en la energía de enlace se pueden atribuir al tamaño del núcleo\(\mathrm{Li}^{+}\) atómico.

En la determinación de estados orbitales moleculares por combinación lineal de orbitales atómicos (LCAO) obtenemos más de una solución a partir de la ecuación de Schrödinger. Hasta ahora nos hemos concentrado principalmente en los estados de baja energía, conduciendo a\(\sigma\) o\(\pi\) bonos. Hemos ignorado en gran medida los llamados estados antienlace que en las moléculas covalentes tienen energías superiores a los estados energéticos originales de los compañeros de reacción aislados (actualmente Li) y, por lo tanto, permanecen desocupados (o vacíos) en moléculas de dos átomos. En cualquier sistema multiatómico (como una pieza de metal), el número total de estados orbitales moleculares (estados electrónicos) es siempre el mismo que el número total de estados atómicos originales (conservación de estados electrónicos). Sin embargo, no todos estos estados están necesariamente ocupados por electrones.
Considerar la hipotética molécula lineal\(\mathrm{Li}_{3}\). Dado que la nube de electrones de valencia es esférica, el átomo central de litio no puede dar preferencia a ninguno de sus vecinos. Las tres nubes de electrones de valencia atómica se superponen para formar una distribución continua y otras dos con nodos (estados antienlace), es decir, tres orbitales moleculares en total (Fig. 3).
A medida que aumenta la longitud de la cadena, también aumenta el número de estados electrónicos en los que se divide el\(2 s\) estado atómico, igualando siempre el número de estados al número de átomos. Lo mismo ocurre cuando las cadenas de litio se colocan una al lado de la otra o se apilan una encima de la otra, de manera que finalmente se obtiene la red espacial del cristal de litio. Es de gran importancia que estos estados electrónicos tengan energías que están delimitadas por un valor límite superior e inferior (ver fig. 4). Dentro de estos límites los estados forman una banda de energía de valores muy espaciados (un gramo de litio contiene casi\(10^{23}\) átomos). De manera similar, las bandas de energía también pueden resultar de la superposición de orbitales $p$ y $d$. Los estados electrónicos (orbitales) dentro de una banda de energía son llenados progresivamente por pares de electrones de la misma manera que los orbitales de un átomo fueron llenados de acuerdo con el principio Pauli. Esto significa que para el litio los estados electrónicos de la banda 2s estarán exactamente medio llenos.

Es de interés considerar por qué los átomos o\(\mathrm{Li}_{2}\) moléculas de litio se combinan para formar una red metálica. En la red de litio es la menor distancia entre los átomos vecinos\(3.03 \times 10^{-10} \mathrm{~m}\), que es mayor que en la\(\mathrm{Li}_{2}\) molécula. Esto refleja el hecho de que los enlaces entre pares de átomos en el metal son más débiles que en la molécula. Sin embargo, la forma metálica del litio es más estable que la forma molecular porque en el metal un átomo tiene muchos más vecinos que en la\(\mathrm{Li}_{2}\) molécula. Como resultado, la energía de unión por átomo-gramo de litio (es decir, por\(6.92 \mathrm{~g}\) de litio) es\(163 \mathrm{~kJ}\) para la red metálica, pero solo\(56 \mathrm{~kJ}\) para un mol de molécula.
La posibilidad de hibridación (avanzada por primera vez por L. Pauling para explicar la unión metálica) también es un factor probable para la formación de enlaces metálicos. Por lo tanto, se pueden formar enlaces fuertes cuando las nubes de electrones de valencia se concentran a lo largo de la dirección en la que se encuentran los socios de unión. Según Pauling la situación puede describirse mediante fórmulas limitantes mesoméricas, al igual que en la teoría de los compuestos de carbono insaturados. Una razón dada para que el hidrógeno no forme un metal es su incapacidad para hibridarse.

La aparición de bandas de energías electrónicas permitidas se relaciona con el solapamiento de\(\psi\) las funciones electrónicas. El ancho de cada banda de energía es una función de la estructura cristalina porque determina el número de vecinos más cercanos en el cristal. Diferentes átomos metálicos con la misma valencia, particularmente los elementos del mismo grupo de la tabla periódica, a menudo pueden reemplazarse entre sí en proporciones arbitrarias sin alterar ni el tipo de celosía ni la estructura de las bandas de energía. Esto explica por qué tales metales tienden a formar una serie completa de soluciones sólidas. Las aleaciones metálicas consisten en tales soluciones sólidas o en mezclas heterogéneas de tales soluciones. Dentro de ciertos límites, incluso los átomos metálicos de diferente valencia pueden intercambiarse en una celosía.
Estructura de Metales
De acuerdo con las consideraciones anteriores, la estructura de banda del metal Li se puede representar como se muestra en la figura 5. Según razonamientos previos, la\(2 \mathrm{~s}\) banda tiene\(\mathrm{N}\) estados (\(\mathrm{N}=\)número de átomos) y acomoda\(n 2 s\) electrones (donde\(n\) está el número de electrones por átomo en el\(2 \mathrm{~s}\) estado por N). Así, esta banda solo tiene la mitad de los estados llenos ya que cada estado puede acomodar dos electrones de espín opuesto (principio de exclusión Pauli). De acuerdo con el principio de Aufbau, los estados de energía más bajos de la banda se llenan primero y los estados superiores permanecen vacíos, pero pueden ser ocupados fácilmente por electrones tras la excitación térmica o la aplicación de un campo eléctrico. Dado que el ancho de la banda de energía es del orden de unos pocos voltios, los espaciamientos de los estados dentro de la banda son del orden de\(\sim 10^{-20} \mathrm{eV}\left(1 \mathrm{eV}=1.6 \times 10^{-19} \mathrm{~J}\right)\), los electrones pueden adquirir fácilmente la energía necesaria para moverse a estados excitados, acelerarse y moverse a través del metal como electrones conductores. Por lo tanto, las bandas parcialmente llenas constituyen bandas de conducción.

Fig. 5 Configuración esquemática de la banda de energía para Li.
El mecanismo de conducción en Mg, por ejemplo, parece complicado por el hecho de que cada\(3 s\) estado de la capa de valencia en los átomos está doblemente ocupado\(\left(3 s^{2}\right)\). Por lo tanto, la\(3 s\) banda debe llenarse completamente y no se esperaría en principio ninguna conducción electrónica. La conducción electrónica, sin embargo, se observa debido a un solapamiento parcial de las bandas vacías\(3 s\) y las\(3 p\) bandas vacías. Con este solapamiento, los electrones pueden activarse en\(3 p\) estados vacíos y exhibir conducción, como en la\(s\) banda parcialmente llena en Li.
Estructura de Aisladores y Semiconductores (Cristales Moleculares)
El mismo modelo de banda también puede explicar la falta de conductividad en los cristales covalentes, como el diamante. En el cristal de diamante, con un enlace de dos electrones entre cada átomo y cada uno de sus vecinos, los orbitales moleculares enlazantes forman una banda a energías mucho más bajas que la energía de los orbitales\(\mathrm{sp}^{3}\) híbridos atómicos, y los orbitales antienlace forman una banda a energías mucho más altas que la energía del atómico orbitales. Además, dado que cada átomo aporta cuatro orbitales y cuatro electrones, solo hay suficientes electrones para llenar los orbitales de unión (correspondientes a un enlace de par de electrones que une cada átomo a cada uno de sus vecinos) y los únicos orbitales vacíos son los de la banda de alta energía de los orbitales antienlace (ver fig. 6).

Fig. 6 Estructura de bandas de aislantes y semiconductores (cristales moleculares); las condiciones representadas reflejan un cristal molar de carbono (diamante).
Tanto los aisladores como los semiconductores tienen la misma estructura de banda básica,\(-\) la diferencia principal es el ancho de la brecha de energía prohibida\(\left(\mathrm{E}_{\mathrm{g}}\right)\) entre la valencia y la banda de conducción.
Los aislantes, genéricamente, son materiales con resistividad muy alta (ver Tabla I), que comprenden vidrios, polímeros, refractarios, compuestos, líquidos y gases. En el presente contexto, un aislante es un cristal molecular, como el diamante (C) o el zafiro, con una banda prohibida\(\left(E_{g}\right)\) superior a\(4 \mathrm{eV}\) (valor arbitrario). Generalmente tales materiales no conducirán electricidad ya que su banda de valencia está llena y la energía requerida para transferir electrones desde la banda de valencia a la banda de conducción vacía es muy superior tanto a las energías térmicas a temperatura ambiente como a la energía proporcionada por la radiación del espectro visible ( \(2 \mathrm{eV})\). Por lo tanto, los aislantes (en forma monocristalina) son normalmente transparentes (incoloros); sin embargo, si la luz está excesiva o totalmente dispersa en heterogeneidades internas (como los límites de grano), pueden ser translúcidos e incluso opacos. También se debe reconocer que las impurezas\(\left(\mathrm{Cr}^{3+}\right.\) en\(\left.\mathrm{Al}_{2} \mathrm{O}_{3}\right)\) o defectos puntuales particulares (centros de color) pueden impartir un color a los cristales aislantes transparentes. El color surge por la absorción parcial de la luz blanca y la transmisión selectiva de las otras partes del espectro visible.
Semiconductores: Los semiconductores convencionales, silicio (Si) y germanio (Ge), tienen una banda prohibida\(\left(\mathrm{E}_{\mathrm{g}}\right)\) de\(1.1\) y\(0.7 \mathrm{eV}\) respectivamente y por lo tanto absorben radiación visible; son opacos (fig. 7). Considerando la naturaleza estadística de la distribución de energía térmica en la matriz sólida (Maxwell-Boltzmann), un número significativo de electrones en la banda de valencia adquirirá, a temperatura ambiente, energía suficiente para cruzar la brecha de energía existente y así proporcionar semiconductividad. Por lo tanto, la conductividad aumentará con la temperatura, contrariamente a los sistemas metálicos, hasta que los efectos de dispersión de electrones, debido al aumento de las vibraciones de la red (que disminuyen la movilidad de los electrones), comiencen a dominar.
El valor de los semiconductores para la fabricación de dispositivos de estado sólido radica en el hecho de que el número y tipo de portadores de carga eléctrica conductores [los electrones son de\(n\) tipo (negativos), los agujeros son de tipo p (positivos)] se pueden controlar mediante la incorporación de elementos dopantes apropiados. Así, la incorporación sustitutiva de los elementos del Grupo V (Sb, As, P) proporciona niveles superficiales de donantes en la banda prohibida aproximadamente a\(0.01 \mathrm{eV}\) partir de la banda de conducción. La incorporación sustitutiva de los elementos del Grupo III (B, Al) genera niveles de aceptor en la banda prohibida aproximadamente a\(0.01 \mathrm{eV}\) partir de la banda de valencia. Los dos tipos de impurezas están casi completamente ionizados a temperatura ambiente y dan lugar a conductividad extrínseca tipo n y tipo p, base para la formación de dispositivos de unión como diodos y transistores (fig. 8).
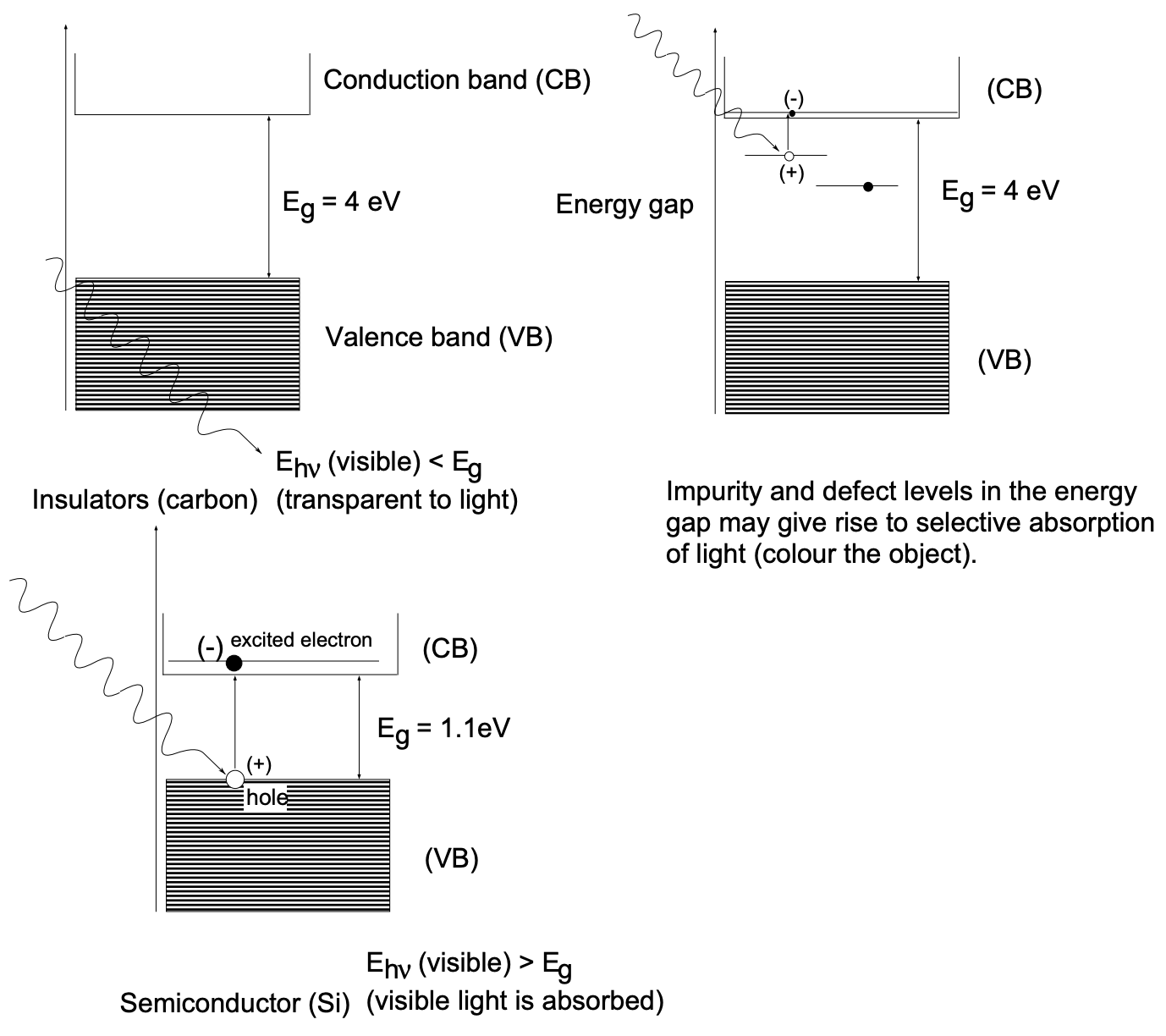
Fig. 7 Comportamiento óptico de aisladores y semiconductores
De creciente importancia son los semiconductores compuestos III-V (adamantina), tales como GaAs, InSb, InP y GaP (compuestos de los elementos del Grupo III y del Grupo V). Juntos, estos compuestos proporcionan ocho electrones de valencia y, por\(\mathrm{sp}^{3}\) hibridación, son capaces de formar una estructura cristalina covalente similar a un diamante con propiedades semiconductoras. Estos

Fig. 8 Semiconductores extrínsecos de tipo p y n.
Los compuestos (GaAs, por ejemplo) exhiben movilidades electrónicas que son mayores que las del silicio y, por lo tanto, son de considerable interés para la tecnología avanzada de dispositivos.
Cuadro I. RESISTIVIDADES ELECTRICAS DE METALES Y NO METALES\(20^{\circ} C^{*}\)

*Del Manual del Instituto Americano de Física, Dwight E. Gray, ed. McGraw-Hill, Nueva York (1963), pp. 4—90; 9—38.
**Tenga en cuenta las diferentes unidades en las dos columnas
APENDICE
Valores aproximados de energía para algunos eventos y reacciones
\ (\ begin {array} {ll}
\ text {Emisión de Energía Solar} &\ sim 10^ {30}\ mathrm {~kJ}/\ text {día}\\
\ text {Energía Solar Convertible en la Tierra} &\ sim 10^ {18}\ mathrm {~kJ}/\ text {año}\\
\ text {Consumo de Energía en la Tierra} &\ sim 8\ veces 10^ {17}\ mathrm {~kJ}/\ text {año}\\
\ text {Explosión de Super-Nova} &\ sim 10^ {39}\ mathrm {~kJ}\\
100\ text {Explosión de bomba H Mega-Ton} &\ sim 10^ {15}\ mathrm {~kJ}\
\ text {Atlas Blast-Off} &\ sim 10^ {8}\ mathrm {~kJ}\
\ text {Rayos X letales Dosis} &\ sim 1\ mathrm {~kJ}\\
\ text {25Pieza cayendo del bolsillo} &\ sim 10^ {-4}\ mathrm {~kJ}\\\ text {Bee's Wing Beat} &
\ sim 10^ {-6}\ mathrm {~kJ}\\ text {Luz de luna/Cara/Segundo} &\ sim 10^ {-8}
\ mathrm {~kJ}\ kKj {Luz de luna/Cara/Segundo} &\ sim 10^ {-8}\ mathrm {J}
\ end {array}\)


