1.4: La naturaleza de los sólidos cristalinos
- Page ID
- 80087
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
En un ensamblaje de átomos o moléculas se forma una fase sólida siempre que las fuerzas de atracción interatómicas (intermoleculares) exceden significativamente las fuerzas térmicas disruptivas y restringen así la movilidad de los átomos, obligándolos a posiciones más o menos fijas. A partir de consideraciones energéticas es evidente (como se discute en LN-2) que en tales sólidos los átomos o moléculas siempre intentarán asumir estructuras altamente ordenadas que se caracterizan por la simetría. Dependiendo de la naturaleza de las fuerzas interatómicas actuantes, todos los sólidos pueden subdividirse en:
- Sólidos iónicos (NaCl)
- Sólidos covalentes (Diamante)
- Sólidos metálicos (Fe, Ni, etc.)
- Sólidos de Van der Waals (hielo, sólidos He)
Los sólidos tal como los encontramos en la naturaleza pueden reflejar o no el arreglo ordenado internamente en su apariencia. Encontramos, por ejemplo, cristales de cuarzo bien formados, granates, diamantes y copos de nieve que se caracterizan por planos limítrofes planos que se cruzan en ángulos característicos. Por otro lado, también observamos piedras redondeadas y objetos sólidos fundidos hechos por el hombre sin evidencia externa de orden interno (fig. 1).

Para entender la apariencia externa del estado sólido es necesario considerar la formación de sólidos de diferentes fases. Los sólidos, por ejemplo, se forman al enfriar líquidos (fundidos) -por congelación o solidificación; este proceso de solidificación normalmente procede en confinamiento total y la estructura “" colada "” resultante tendrá una apariencia externa que refleja en detalle la geometría de confinamiento (y no el orden interno).” Además, dependiendo de las condiciones de solidificación, el cuerpo sólido puede ser un solo cristal o policristalino. Los sólidos policristalinos (más del 95% del estado sólido encontrado) pueden considerarse como un conjunto de cristales simples microscópicos con orientación aleatoria mantenidos juntos como una estructura de laberinto por las formas irregulares entrelazadas de los cristales individuales.
Un ejemplo típico de una transformación de fase “no confinada” es la formación de copos de nieve donde los límites externos del sólido han asumido una apariencia cristalina, reflejando en detalle el\(\left(\mathrm{H}_{2} \mathrm{O}\right)\) arreglo molecular ordenado internamente. Otra formación no confinada de un sólido es la precipitación de la solución (cristales de azúcar,\(\mathrm{CuSO}_{4}\) y similares). De igual manera, la formación de cristales a partir de la fase de vapor conduce a cuerpos que reflejan externamente elementos de orden interno.
ESTRUCTURA CRISTALINA
De la discusión anterior debería ser evidente que, cuando existen fuertes fuerzas interatómicas, los átomos tienden a empaquetarse estrechamente entre sí, siendo la cercanía del empaque particularmente pronunciada en estado sólido. En este caso, los átomos pueden considerarse como esferas duras y el problema del empaquetamiento cercano puede tratarse como uno en el que todo el conjunto tiene una tendencia hacia un empaque eficiente. Un poco de pensamiento o unos simples experimentos con pelotas de ping-pong nos convencen rápidamente de que los arreglos regulares de las esferas generalmente conducen a conjuntos más compactos que a arreglos irregulares (fig. 2). El mismo principio se aplica a la disposición de los átomos en estado sólido. Donde se ejercen fuertes fuerzas atractivas encontramos que los átomos o moléculas en cuestión se disponen en un patrón tridimensional regular. Es esta regularidad la que es la base de la cristalinidad en los materiales: es decir, una estructura cristalina no es más que una ordenada matriz de átomos o moléculas. Esta definición de cristal es distinta del concepto popular basado en la observación de la simetría externa de los cristales, a menudo observada durante el estudio de la química elemental, en la que algunos cristales aparecen cúbicos, otros en forma de aguja y así sucesivamente. La forma externa regular se obtiene sólo cuando las condiciones de cristalización son favorables al desarrollo de caras planas y geométricas. En la mayoría de los casos, particularmente con los metales, estas condiciones están ausentes, y los cristales tienen superficies irregulares a pesar de que la disposición interna es perfectamente geométrica.

Las matrices atómicas en cristales se describen convenientemente con respecto a una red tridimensional de líneas rectas. Considera una celosía de líneas, como en la figura 3, dividiendo el espacio en prismas de igual tamaño que se paran lado a lado con todas las caras en contacto, llenando así todo el espacio y sin dejar huecos. Las intersecciones de estas líneas son puntos de una celosía espacial, es decir, una abstracción geométrica que es útil como referencia para describir y correlacionar la simetría de cristales reales. Estos puntos de retícula son de fundamental importancia en la descripción de los cristales ya que pueden ser las posiciones ocupadas por átomos individuales en los cristales o pueden ser puntos alrededor de los cuales se agrupan varios átomos. Dado que prismas de muchas formas diferentes se pueden dibujar a través de los puntos de una celosía espacial para dividirla en celdas, la manera en que se dibuja la red de líneas de referencia es arbitraria. No es necesario que las líneas se dibujen para que los átomos se encuentren solo en las esquinas de los prismas unitarios. De hecho, es más conveniente describir algunos cristales con respecto a prismas en los que los átomos se encuentran en los centros prismáticos o en los centros de las caras del prisma así como en las esquinas del prisma.

Una característica importante de una celosía espacial es que cada punto tiene un entorno idéntico: la agrupación de puntos de celosía alrededor de cualquier punto dado es idéntica a la agrupación alrededor de cualquier otro punto de la celosía. Es decir, si pudiéramos movernos en la celosía, no podríamos distinguir un punto de otro porque las filas y planos cercanos a cada punto serían idénticos. Si tuviéramos que vagar entre los átomos de un metal sólido o compuesto químico, encontraríamos la vista desde cualquier punto de celosía exactamente igual a la de cualquier otro.
Hay catorce celosías espaciales (fig. 4). Es decir, no se pueden encontrar más de catorce formas en las que los puntos se pueden disponer en el espacio para que cada punto tenga un entorno idéntico. Por supuesto, hay muchas más de catorce formas en las que los átomos pueden disponerse en cristales reales; así hay un gran número de estructuras cristalinas. Con demasiada frecuencia, el término “celosía” se usa vagamente como sinónimo de “estructura”, una práctica incorrecta que a menudo es confusa. La distinción se puede ver claramente si recordamos que una celosía espacial es una matriz de puntos en el espacio. Se trata de una abstracción geométrica que solo es útil como referencia para describir y correlacionar la simetría de cristales reales. Una estructura cristalina, sin embargo, es la disposición de átomos o moléculas que realmente existe en un cristal. Es un arreglo dinámico, más que estático, y está sujeto a muchas imperfecciones. Aunque cualquier estructura cristalina tiene una simetría inherente que corresponde a una de las catorce celosías espaciales, uno, dos o varios átomos o moléculas en la estructura cristalina pueden estar asociados con cada punto de la red espacial. Esta simetría se puede mantener con un número infinito de diferentes disposiciones reales de átomos, haciendo posible un sinfín de estructuras cristalinas.

Para especificar una disposición dada de puntos en una celosía espacial, se acostumbra identificar una celda unitaria con un conjunto de ejes de coordenadas, elegidos para tener un origen en uno de los puntos de celosía (fig. 5). En una celosía cúbica, por ejemplo, elegimos tres ejes de igual longitud que son mutuamente perpendiculares y forman tres bordes de un cubo. Cada celosía espacial tiene algún conjunto conveniente de ejes, pero no son necesariamente iguales en longitud u ortogonales. En cristalografía se utilizan siete sistemas diferentes de ejes, cada uno de los cuales posee ciertas características en cuanto a la igualdad de ángulos y la igualdad de longitudes. Estos siete sistemas cristalinos se tabulan en la Tabla I (a considerar conjuntamente con la fig. 4).

Cuadro I. Los siete sistemas cristalinos
\ (\ begin {array} {lll}
\ hline
\ text {Sistema} &\ text {Parámetros} &\ text {Ángulos interaxiales}\
\\ hline
& a\ neq b\ neq c &\ alpha\ neq\ beta\ neq\ gamma\
\ texto {triclínica} & a\ neq b\ neq c &\ alpha=\ gamma =90^ {\ circ}\ neq\ beta\
\ text {Monocinic} & a\ neq b\ neq c &\ alpha=\ beta=\ gamma\
\ text {Ortorrómbico} & a=b\ neq c &\ alpha=\ beta=\ gamma\
\ texto {Tetragonal} & a=b=c &\ alpha=\ beta =\ ma=90^ {\ circ}\\
\ text {Cúbico } & a=b\ neq c &\ alpha=\ beta=90^ {\ circ},\ gamma=120^ {\ circ}\
\\ text {Hexagonal} & a=b=c &\ alpha=\ beta=\ gamma\ neq 90^ {\ circ}
\\ text {romboédrico} & a=c h\
\ hline
\ end {array}\)
La red de líneas a través de los puntos de una celosía espacial (fig. 3) la divide en celdas unitarias (ver también fig. 4). Cada celda unitaria en una celosía espacial es idéntica en tamaño, forma y orientación a cualquier otra celda unitaria. Es el bloque de construcción a partir del cual se construye el cristal por repetición en tres dimensiones. Las celdas unitarias de las catorce celosías espaciales se muestran en la figura 4. Todas las estructuras cristalinas se basan en estos catorce arreglos.
Las celosías cúbicas centradas en el cuerpo, cúbicas y hexagonales centradas en la cara son comunes y de primordial importancia en Algunos de los metales asociados con aplicaciones nucleares, como el uranio y el plutonio, tienen estructuras cristalinas que son más complicadas que estos tres tipos relativamente simples. En general, las cerámicas cristalinas también son más complejas.
CÉLULAS VS CÉLULAS PRIMITIVAS
En la literatura a menudo encontramos referencias a células unitarias y a células primitivas. La celda primitiva puede definirse como una forma geométrica que, cuando se repite indefinidamente en tres dimensiones, llenará todo el espacio y es el equivalente de un átomo. La célula unitaria difiere de la célula primitiva en que no se restringe a ser el equivalente de un átomo. En algunos casos los dos coinciden. Por ejemplo, en la fig. 4 todas las catorce celosías espaciales se muestran por sus celdas unitarias. De estos catorce, sólo siete (¿cuáles son esos?) son también células primitivas.
Las celdas primitivas se dibujan con puntos de celosía en todas las esquinas, y cada celda primitiva contiene el equivalente de un átomo. Por ejemplo, una celda unitaria cúbica simple tiene un átomo en cada esquina. Sin embargo, en cualquiera de estas esquinas dadas, este átomo debe ser compartido con otros siete cubos idénticos que llenan el volumen que rodea este punto. Por lo tanto, efectivamente solo hay 1/8 del átomo que puede asignarse a esa celda unitaria en particular. Dado que hay ocho esquinas en un cubo, existe el equivalente a un átomo, y así coinciden la célula primitiva y la celda unitaria.
Continuando, considere la celosía cúbica centrada en el cuerpo (BCC). En este caso hay un átomo en el centro del cubo y un átomo aportado por las ocho esquinas. Esta celda, entonces, tiene dos átomos y, para evitar confusiones, debe denominarse celda unitaria. En la red cúbica centrada en la cara hay seis átomos faciales, pero cada átomo facial es compartido por dos celdas. En consecuencia, cada cara aporta 1/2 átomo. Las caras aportan así tres átomos y las esquinas uno, para un total de cuatro átomos en la celda unitaria. La estructura cúbica centrada en la cara (FCC) también se puede considerar como cuatro celdas cúbicas simples interpenetrantes.
En el estudio de los cristales la célula primitiva tiene un uso limitado debido a que la celda unitaria demuestra con mayor claridad las características simétricas de una celosía. En otras palabras, la celda unitaria generalmente se puede visualizar fácilmente mientras que la celda primitiva no puede. Por ejemplo, la naturaleza cúbica de la celosía cúbica centrada en la cara es inmediatamente evidente en la celda unitaria, pero no es tan obvia en la celda primitiva romboédrica.
EMPAQUE DE ÁTOMOS
Una estructura cristalina es una matriz regular de átomos dispuestos en una de las catorce celosías espaciales. Las estructuras cristalinas menos complicadas son aquellas que tienen un solo átomo en cada punto de la red. El polonio tiene la estructura más simple, siendo simple cúbico. En los metales normales, los átomos (o iones positivos) se mantienen unidos por una nube de electrones libres de manera que cada átomo tiende a ser atraído igual e indiscriminadamente a todos sus vecinos geométricamente más cercanos por los electrones libres que pasan entre ellos. Esta condición fomenta la formación de estructuras estrechamente empaquetadas de los tipos que se pueden demostrar empaquetando eficientemente esferas de tamaño uniforme en un volumen dado.
Puede obtener una mejor comprensión del empaque realizando un experimento de la siguiente manera. Supongamos que tenemos una cantidad de pequeñas esferas que se nos requiere empacar eficientemente en una caja (un enfoque 'bidimensional' se puede hacer usando un puñado de centavos). Después de algunos barajados, es obvio que el empaquetamiento más cercano posible se obtiene cuando las esferas están en contacto y sus centros ocupan posiciones que corresponden a los ápices de triángulos equiláteros (fig. 6). También es evidente que hay dos conjuntos de triángulos: uno con vértices apuntando lejos del observador (apunta hacia arriba) y el otro conjunto con vértices apuntando hacia el observador (apunta hacia abajo).
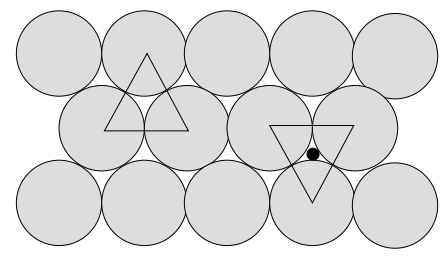
Cuando se agrega una segunda capa, hay un empaquetamiento más cercano si las esferas de esta nueva capa descansan en los huecos formados por las esferas de la primera capa. Los centros de las esferas en la segunda capa estarán por encima de los centros de los triángulos puntiformes hacia arriba o por encima de los centros de los triángulos de puntos hacia abajo, pero no ambos simultáneamente. Qué conjunto se utiliza es inmaterial. Para nuestra discusión, sin embargo, supongamos que la segunda capa está centrada en los triángulos puntiagudos.
Cuando comencemos a agregar una tercera capa, las esferas volverán a descansar en los huecos formados por las esferas de la segunda capa. Y nuevamente tenemos la opción de colocar la tercera capa sobre los triángulos punto-arriba o en los triángulos punto-abajo. Si centramos la tercera capa en los triángulos de puntos hacia abajo, encontramos que la tercera capa está directamente por encima de la primera capa. Si se agregan capas adicionales usando una secuencia de apilamiento alternativa (es decir, centrando alternativamente las capas en los triángulos de puntos hacia arriba y puntos hacia abajo), la secuencia se puede escribir como ABABABAB. Esta disposición de esferas, traducida a una disposición de átomos, es la estructura hexagonal de empaquetamiento cerrado (HCP) -muy importante, pero no se discute en detalle aquí.
Muchos elementos que tienen enlaces covalentes forman arreglos en los que el número de coordinación es (8—N), donde N es el número de electrones de valencia. ¿Cuál, entonces, se acaba de demostrar el número de coordinación de la estructura de HCP? La geometría de la estructura muestra que cualquier átomo tiene doce vecinos equidistantes. Es evidente que si, en cualquier capa, se coloca una esfera dada en la capa contigua, cabe en el hueco formado por tres esferas y consecuentemente es tangente a tres esferas en la capa contigua. Así, cualquier átomo dado en la estructura del HCP es tangente a otros doce átomos, seis en su propia capa y tres cada uno en dos capas contiguas.
Cuando se agregó la tercera capa de esferas en la discusión anterior, asumimos que esta capa estaba centrada en los triángulos de puntos hacia abajo de la segunda capa. ¿Qué sucede si en su lugar se utilizan los centros de los triángulos puntiagudos de la segunda capa? La distribución de esferas en la tercera capa es la misma que en las dos primeras capas, pero no se encuentra directamente por encima de ninguna de estas dos capas. Si se agrega una cuarta capa, centrada en los triángulos punteados hacia arriba de la tercera capa, encontramos que la cuarta capa está directamente por encima de la primera capa y la duplica por completo. La secuencia de apilamiento para esta estructura se puede escribir como ABCABCABC. Esta disposición tiene la misma densidad de empaque y el mismo número de coordinación que la estructura HCP. Sin embargo, es la estructura cúbica centrada en la cara (FCC).
Las estructuras cristalinas HCP y FCC tienen la misma densidad de empaquetamiento y el mismo número de coordinación. Por lo tanto, podríamos esperar que el comportamiento de las dos estructuras HCP y FCC sea muy similar con respecto a las propiedades físicas y mecánicas. Esto, sin embargo, en la mayoría de los casos no es el caso.
La densidad máxima de empaquetamiento se encuentra únicamente en las estructuras cristalinas HCP y FCC. Por qué el enlace metálico no siempre produce uno u otro de estos dos arreglos de átomos más densos es todavía objeto de estudios intensivos. La celda unitaria BCC contiene dos átomos, y el número de coordinación es ocho. Hay una compensación parcial por esto en el hecho de que hay seis vecinos próximos más cercanos a distancias sólo ligeramente mayores que la de los ocho vecinos más cercanos. Algunas características de las estructuras cúbicas se dan en el Cuadro II.
Un ejemplo interesante del tipo de estructura cristalina obtenida en elementos unidos covalentemente que obedecen a la regla del número de coordinación (8—N) (donde N es el número de electrones de valencia) es la estructura diamantada. Esta estructura se encuentra en carbono, germanio, silicio y estaño a bajas temperaturas y en ciertos compuestos. Cada átomo tiene cuatro vecinos más cercanos, una configuración que se denomina de diversas maneras cúbico de diamante, tetraédrico centrado en el cuerpo o cúbico tetraédrico.
CUADRO II. Características de las Celosías Cúbicas
\ (\ begin {array} {lcccc}
&\ subrayado {\ text {Simple}} &\ subrayado {\ texto {Centrada en el cuerpo}} &\ subrayado {\ text {Face-Centered}}
\\ text {Unidad de volumen de celda} &\ mathrm {a} ^ {3} &\ mathrm {a} ^ {3} &\ mathrm {a} ^ {3}\
\ texto Puntos de celosía por Cell} & 1 & 2 & 4\
\ text {Distancia del vecino más cercano} & a &\ frac {a\ sqrt {3}} {2} &\ frac {a} {\ sqrt {2}}\\
\ text {Número de vecinos más cercanos} & 6 & 8 y 12\
\ text {Distancia del segundo vecino más cercano} y a\ sqrt {2} y a & amp; a\\
\ text {Número de segundos vecinos} & 12 & 6 & 6\\
\ end {array}\)
Muchos compuestos cristalizan en variaciones de formas cúbicas. La sal de roca (NaCl), por ejemplo, es típica de muchos óxidos, fluoruros, cloruros, hidruros y carburos. A veces se considera como cúbico simple con átomos alternos de Na y Cl en las esquinas del cubo. En realidad la estructura es de dos celosías FCC interpenetrantes —una de Na y otra de Cl— y la esquina de una se ubica en el punto 1/2, 0, 0 del otro.
Muchos otros óxidos, fluoruros y algunos compuestos intermetálicos tienen la\(\left(\mathrm{CaF}_{2}\right)\) estructura de fluorita. Esto es\(\mathrm{FCC}\) con\(\mathrm{Ca}\) en las esquinas del cubo y los centros de la cara y\(\mathrm{F}\) en todos los puntos de cuarto a lo largo de las diagonales del cubo.
PLANOS DE CELOSÍA Y DIRECCIONES
Es deseable tener un sistema de notación para planos dentro de una celosía cristalina o espacial de tal manera que el sistema especifique la orientación sin dar posición en el espacio. Para ello se utilizan índices Miller. Estos índices se basan en las intercepciones de un plano con los tres ejes cristalinos, es decir, los tres bordes de la celda unitaria. Las intercepciones se miden en términos de las longitudes de borde o dimensiones de la celda unitaria que son las distancias unitarias desde el origen a lo largo de los tres ejes. Por ejemplo, se dice que el plano que corta el\(x\) eje -eje a una distancia del origen igual a la mitad de la\(x\) -dimensión de la celda tiene una\(x\) -intercepción igual a\(1 / 2\), y si corta el\(y\) -eje en\(1 / 2\) la\(y\) -dimensión de la celda, el\(y\) - intercepción es\(1 / 2\), independientemente de las magnitudes relativas de las dimensiones\(x\) - y\(y\) -dimensiones. Si un plano es paralelo a un eje, intercepta el eje en el infinito.
Para determinar los índices Miller (hkl) de un avión, tomamos los siguientes pasos:
- Encuentra las intercepciones en los tres ejes en múltiplos o fracciones de las longitudes de borde a lo largo de cada eje.
- Determinar los recíprocos de estos números.
- Reducir los recíprocos a los tres enteros más pequeños que tengan la misma proporción que los recíprocos.
- Encierra estos tres números integrales entre paréntesis, p. ej., (hkl).
Un cubo tiene seis caras equivalentes. Si tenemos una orientación definida y deseamos discutir un plano específico de estos seis, es posible especificar este plano utilizando los índices propios de Miller. Se utilizan paréntesis alrededor de los índices de Miller para significar un plano específico. Por otro lado, muchas veces resulta ventajoso hablar de planos de una “forma” —es decir, una familia de planos equivalentes como las seis caras de un cubo. Para ello se acostumbra usar los índices Miller, pero encerrarlos entre llaves (llaves). Así, el conjunto de caras de cubo se puede representar como {100} en el que
\(\{100\}=(100)+(010)+(001)+(\overline{100})+(0 \overline{1} 0)+(00 \overline{1})\)
Esta notación proporciona así un esquema abreviado para evitar escribir los índices para las seis caras cúbicas.
La utilidad del esquema es aún más evidente en el caso de los (110) planos, es decir, los planos dodecaédricos (en un sistema cúbico), donde
\ begin {alineado}
\ {110\} =& (110) + (101) + (011) + (\ overline {1} 10) + (\ overline {1} 01) + (0\ overline {1} 1)\\
&+ (1\ overline {1} 0) + (10\ overline {1}) + (01\ overline {1}) + (\ overline {110}) + (\ overline {1} 0\ overline {1}) + (0\ overline {11})
\ end {alineado}
La forma equivalente para el sistema ortorrómbico es
\ begin {alineado}
&\ {110\} =( 110) + (\ overline {110}) + (1\ overline {1} 0) + (\ overline {110})\\
&\ {101\} =( 101) + (\ overline {1} 01) + (10\ overline {1}) + (\ overline {1} 0\ overline {1})\
&\ {011\} =( 011) + (0\ overline {1} 1) + (01\ overline {1}) + (0\ overline {11})
\ fin {alineado}
Los planos octaédricos para el cubo son
\ begin {aligned}
\ {111\} =& (111) + (\ overline {1111}) + (1\ overline {1} 1) + (11\ overline {1})\\
&+ (\ overline {111}) + (\ overline {111\ overline {1}}) + (1\ overline {11}) + (\ overline {111})
\ end {alineado}
Los índices de dirección se definen de una manera diferente. Se construye una línea a través del origen del eje del cristal en la dirección en consideración y las coordenadas de un punto en la línea se determinan en múltiplos de parámetros de celosía de la celda unitaria. Los índices de la dirección se toman como los números enteros más pequeños proporcionales a estas coordenadas y se cierran entre corchetes. Por ejemplo, supongamos que las coordenadas son\(x=3 a, y=b\) y\(z=c / 2\), entonces los números enteros más pequeños proporcionales a estos tres números son 6, 2 y 1 y la línea tiene una dirección [621]. Como ejemplos adicionales, el\(x\) eje -tiene índices de dirección [100], el\(y\) -eje [010] y el\(z\) -eje [001]. Una diagonal de cara de la\(x y\) cara de la celda unitaria tiene índices de dirección [110], y una diagonal de cuerpo de la celda tiene índices de dirección [111]. Los índices negativos ocurren si alguna de las coordenadas es negativa. Por ejemplo, el\(-y\) eje tiene índices [010]. Un conjunto completo de direcciones equivalentes, es decir, direcciones de una forma, se indican mediante caretas:\(\langle u v w\rangle\).


