2.8: Autoevaluación- Reacciones y Cinética + Respuesta
- Page ID
- 80054
1. El urbio (Ur) es un elemento exclusivo que se encuentra en las grandes ciudades. Su óxido no\(\left(\mathrm{UrO}_2\right)\) es muy estable y se descompone fácilmente a temperaturas superiores\(666^{\circ} \mathrm{C}\). La siguiente figura muestra cómo varía la velocidad de reacción con la concentración de\(\mathrm{UrO}_2\) at\(777^{\circ} \mathrm{C}\). La tasa,\(r\), está en unidades de\(\mathrm{M} / \mathrm{s}\) y la concentración de\(\mathrm{UrO}_2, c\), está en unidades de\(\mathrm{M}(\mathrm{mole} / \mathrm{L})\). La pendiente tiene un valor de\(1.77\) y la intercepción tiene un valor de\(1.46\).
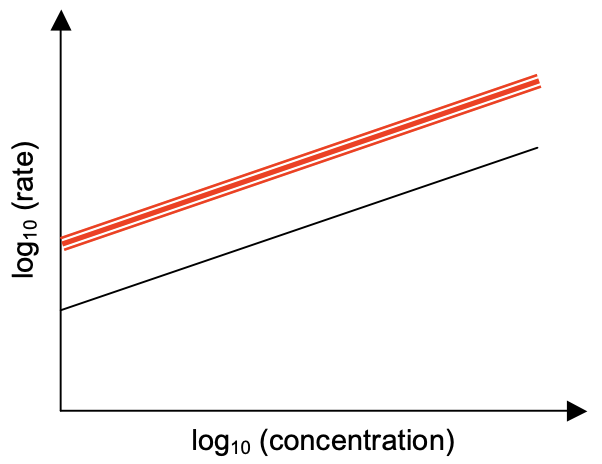
a) ¿Cuál es el orden de reacción?
- Contestar
-
El orden es la pendiente: 1.77
b) Calcular el valor de la constante de tasa. Preste estricta atención a las unidades.
- Contestar
-
\(r=k c^n \rightarrow \log r=\log k+n \log c ; \text{when } c=1, r=k=10^{1.46}=28.8\)
\(\text{Units of } k=r / c^{\mathrm{n}}=(\mathrm{M} / \mathrm{s}) /\left(\mathrm{M}^{1.77}\right)=\mathrm{M}^{-0.77} / \mathrm{s} \rightarrow k=28.8 \mathrm{M}^{-0.77} / \mathrm{s}\)
(c) En la gráfica anterior, dibuje la línea que muestre cómo varía la velocidad de reacción con la concentración de\(\mathrm{UrO}_2\) at\(888^{\circ} \mathrm{C}\). No es necesario realizar cálculos. Presta atención a los valores relativos y pendientes.
- Contestar
-
La línea superior de la gráfica representa la isoterma en\(888^{\circ} \mathrm{C}\). Anote la misma pendiente que\(777^{\circ} \mathrm{C}\) pero mayor valor de\(r\) -intercepción.
2. Mostrar mediante un cálculo que la longitud de difusión del boro (B) en germanio (Ge) es menor que\(1.0 \mu \mathrm{m}\) a una temperatura de\(1200 \mathrm{~K}\) para un tiempo de difusión de 30 minutos. El coeficiente de difusión de B en Ge at\(1200 \mathrm{~K}, D_{\mathrm{B}}\), tiene el valor de\(2.0 \times 10^{-17} \mathrm{~m}^2 / \mathrm{s}\).
- Contestar
-
La longitud de difusión se aproxima por la relación\(x=\sqrt{D t}\) o\(x=2 \sqrt{D t}\)
\(\therefore \sqrt{D t}=\sqrt{2.0 \times 10^{-17} \frac{\mathrm{m}^2}{\mathrm{~s}} \cdot 30 \mathrm{~min} \cdot 60 \frac{\mathrm{s}}{\mathrm{min}}}=1.90 \times 10^{-7} \mathrm{~m}<1.0 \mu \mathrm{m}\)


