3.2: Quiz 2
- Page ID
- 79943
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
1) A continuación se muestra el diagrama de nivel de energía que muestra las transiciones realizadas por un electrón en un átomo de hidrógeno según el modelo de Bohr.
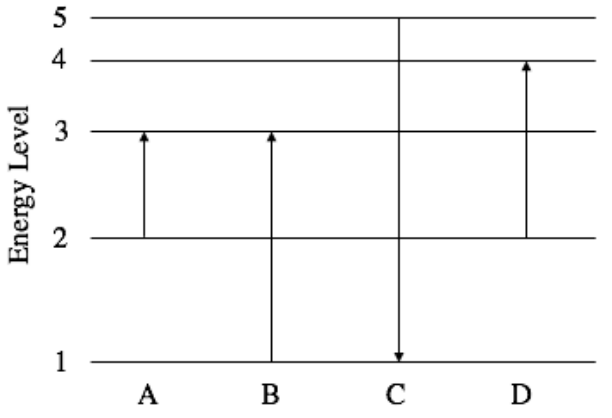
a) Identificar la mayor absorción de energía indicada entre las cuatro transiciones de electrones indicadas anteriormente y calcular la energía del fotón requerida para provocar la transición en eV. (2 pts)
b) ¿Una transición a partir de n=3 a n=2 emitirá un fotón en el rango de luz visible (390nm-700nm)? ¿Puede este fotón ionizar un electrón en el nivel n=3? (2pts)
c) Usa tu espectroscopio para ver las luces que están encima de ti. ¿Cuál es el número mínimo de niveles de energía en un átomo de Bohr necesarios para producir estas líneas? (1 pt)
2) Cuando los humanos están expuestos a la luz solar, la luz Ultravioleta-B (UVB) de longitud de onda\(\sim \mathbf{2 9 5} \mathbf{n m}\) reacciona en nuestra piel para producir vitamina\(D\left(C_{28} \mathrm{H}_{44} \mathrm{O}\right)\). La dosis diaria recomendada de vitamina\(D\) para adultos es la\(\mathbf{0.1 \mathrm{mg}}\) que equivale a\(1.52 * 10^{17}\) moléculas.
a) Se necesita un fotón para crear una molécula de vitamina D. ¿Cuántos Julios de energía UVB absorbe nuestro cuerpo al día para crear la cantidad necesaria de vitamina\(D\)? (3 ptos)
b) Acerca\(2.5 \mathrm{~mW}\left(2.5 \times 10^{-3} \mathrm{~J} / \mathrm{s}\right)\) de la luz UVB productora de vitamina\(D\) golpea nuestra piel expuesta cuando estamos afuera (con una camiseta y pantalones cortos puestos).
Si\(5 \%\) de incidente la luz UVB es utilizada por nuestra piel, ¿cuánto tiempo deben pasar las personas afuera para asegurarse de obtener la dosis requerida de vitamina\(D\)? (2 ptos)


