5.1: CHEM ATLAS_1
- Page ID
- 80081
¿Qué es esto?
El propósito de este documento es servir de guía y recurso que le brinde una rápida visión general de cada conferencia. Para cada conferencia, hay un resumen de los principales temas tratados, el momento Por qué esto importa y la nueva sección Por qué esto emplea, además de algunos problemas de ejemplo. Estos folletos serán dados por “Unidad”, que es el contenido que entra en cada examen. También hay un Mapa Conceptual al inicio de cada Unidad, para mostrar cómo los diversos materiales están conectados entre sí.
Entonces, ¿por qué hicimos esto? Esperamos que sea útil obtener una buena instantánea de cualquier conferencia dada. Ya sea que no pudieras asistir a una conferencia o no podías dejar de pensar en una conferencia, esta es una forma de tener rápidamente una idea del contenido. También me da la oportunidad de proporcionar detalles adicionales para los que quizás no tenga tiempo en el ejemplo Por qué esto importa, y también me permite probar la sección Por qué esto emplea, que desde luego no tendré tiempo de discutir mucho en la conferencia. Ojalá te resulte útil, y como con cualquier otra cosa en esta clase, ¡todos y cada uno de los comentarios son bienvenidos!
Un punto sobre estos resúmenes de conferencias. Tenga en cuenta que los resúmenes de las conferencias no están destinados a ser un sustituto de las notas de la conferencia. Si solo leyeras estos resúmenes y no fueras a dar una conferencia, sí, obtendrías una buena idea de la conferencia desde una vista de muy alto nivel, pero no, ¡no sacarías lo suficiente de ella para que sea tu único recurso para aprender el material!
Cómo se conecta esto: Unidad 1, Conferencias 1-9
En esta clase contamos con 36 conferencias, 20 recitaciones, 9 bolsas de regalos y 12 conjuntos de problemas, todos estrechamente integrados y cada uno diseñado para contribuir a tu experiencia de aprendizaje general de 3.091. Estos diferentes recursos se unen en las Celebraciones de Aprendizajes a lo largo del semestre, incluyendo 9 cuestionarios, 3 exámenes parciales y un examen final. Para cada unidad, definida como el contenido que entra en un medio plazo, hemos creado un Mapa Conceptual para dilucidar las conexiones entre los diferentes componentes de clase para que se pueda ver claramente el contexto de cada uno.
A continuación se muestra una imagen del Mapa Conceptual del Examen 1. Esto demuestra cómo encajan cada uno de los aspectos del curso: ¡tienes muchos recursos! Los problemas de práctica, recitaciones, bolsas de regalo y conferencias son recursos sin clasificar para ayudarte a prepararte para los cuestionarios y exámenes. Todo el material listado en este mapa conceptual es juego limpio para el Examen 1.
Conferencia 1: Introducción y química de la tabla periódica
Resumen
“Nunca confíes en un átomo, ellos lo componen todo”, es una broma clásica de química que también resulta ser tan cierta, pero si queremos saber qué elementos comprenden nuestros materiales de interés, entonces necesitamos saber cómo estos elementos interactúan entre sí, cómo están estructurados y cómo se procesó el material para lograr esta estructura. Para responder verdaderamente a estas preguntas, los investigadores de los últimos siglos han hecho uso del método científico. Esto implica hacer preguntas, reunir y examinar pruebas, identificar explicaciones y volver a probar.
Una de las preguntas más emocionantes en la historia de la química fue la del átomo —Demócrito y Leucipo plantearon la hipótesis de bloques de construcción indivisibles del universo (aunque ahora sabemos que los átomos se pueden descomponer en “partículas subatómicas” aún más pequeñas). Robert Boyle, en su búsqueda por identificar diferentes átomos, estudió minerales metálicos (rocas naturales que contienen impurezas metálicas) y logró separar una gran cantidad de elementos, entre ellos muchos metales. A medida que crecía la lista de átomos descubiertos, los científicos también comenzaron a estudiar su categorización. Por ejemplo, Antoine Lavoisier nombró cuatro categorías basadas en propiedades para los 33 elementos que identificó: Gases, No Metales, Metales y Tierras. John Dalton identificó 36 elementos diferentes y diseñó un símbolo gráfico para representar cada uno de ellos.
En esta conferencia se introdujo el concepto de equilibrio de reacción química, que implica agregar coeficientes a los reactivos y/o productos en la reacción para asegurar que hay números iguales de cada tipo de átomo en los lados izquierdo y derecho de la flecha. Esto es necesario por la ley de conservación de la masa, que establece que nada se crea o destruye a nivel atómico, por lo que la masa de los reactivos es igual a la masa de los productos. Más bien, los átomos pueden reorganizarse para formar diferentes moléculas. La primera reacción química que equilibramos fue una reacción de combustión, que es una reacción en la que un material carbonoso se quema en presencia de oxígeno. Encontramos el reactivo limitante para esta reacción, que es la especie reaccionante (átomo o molécula) que se agota primero. El rendimiento de la reacción es la cantidad de producto formado.
Dalton afirmó que los átomos de un elemento dado tienen un peso particular y otras características distintivas. Propuso la ley de proporciones múltiples, que dice que cuando dos elementos reaccionan para formar una serie de compuestos, las relaciones de masas del 2do elemento por gramo al 1º pueden expresarse como proporciones de enteros.
Por qué esto importa
En esta primera conferencia, empezamos a hablar del descubrimiento de los elementos. Bueno, no me refiero a regalar nada, pero no van a haber tantos al final. De hecho, a la fecha tenemos 118 en el roster oficial, pero si consideramos cuáles podemos usar para hacer cosas para humanos ese número es menor, más como 80 o 90. ¿Cuántos elementos crees que hay en tu celular? Depende del teléfono, ¡pero en el mío hay 64 elementos diferentes!
Eso es más de dos tercios de todos los que incluso podríamos haber usado y es increíble pensar en ello. Debido a este enorme potencial de diseño, el mundo en el que vivimos ha cambiado por completo.
Como Científico de Materiales, me encanta que tengamos esta tradición (gritar al erudito danés Christian J. Thomsen) de nombrar la edad en la que vivimos por el material que más importaba durante esa edad. Pero como Científico de Materiales, también me encanta que nunca más podamos volver a hacer eso. La razón es que realmente vivimos en una nueva era, una en la que podemos realizar el sueño de Richard Feynman, quien en su famoso discurso “Hay mucho espacio en la parte inferior” expuso la visión del diseño a escala atómica y la nanotecnología 30 años antes de su tiempo. Hoy en día, controlamos rutinariamente tanto la elección de los elementos como su estructura, ya que se unen para hacer que los materiales hagan cosas que nunca creímos posibles ¡ni hace solo 10 años! En otras palabras, controlamos su química a escala atómica.

Imágenes de flechas de piedra, maceta de bronce, era industrial, botellas de plástico, chip de silicio © fuentes desconocidas. Este contenido está excluido de nuestra licencia Creative Commons. Para más información, consulte https://ocw.mit.edu/fairuse. La imagen del diseño atómico es de dominio público.
Esto llega a por qué esto es tan genial (y, lo adivinaste, por qué importa). Ya ves, muchos de nuestros desafíos globales actuales —ya sea en la energía, la salud o el medio ambiente— tienen un cuello de botella que se produce por el material que constituye una parte central de la tecnología (en algunos dispositivos se llama la “capa activa”). Eso significa que por “simplemente” elegir o hacer un material diferente, uno tiene el potencial de cambiar completamente las propiedades, el costo y la capacidad de fabricación de la tecnología. Esto es a diferencia de una revolución anterior en torno al silicio donde pasamos de un costo de $1 por transistor en 1965 a $0.00000001 por transistor en 2015. ¡Habla de una curva de aprendizaje! Eso se debió principalmente a los avances en el procesamiento del mismo elemento, el silicio, para llegar a componentes cada vez más pequeños. Más de mil millones de transistores ahora encajan muy bien en un solo chip. A diferencia de esta dramática era del silicio, muchas de las próximas revoluciones tecnológicas dependerán de cambiar el material en sí: en algunos casos, completamente. Ahora vivimos en la Era del Diseño de Materiales, que ha llegado justo a tiempo ya que converge con desafíos muy apremiantes a escala global que dependerán de nuevos materiales a resolver. Y es por ello que el descubrimiento de estos elementos importa tanto. Ellos son nuestro patio de recreo y la base a partir de la cual haremos el próximo conjunto de tecnologías para cambiar el mundo para mejor.
Por qué esto emplea
En esta sección, discutiremos cómo el material de cada conferencia se conecta con trabajos reales. Lo estoy probando este año por primera vez, y como probablemente no tendré tiempo para dedicarme a ello en conferencia, este documento es el único lugar donde lo encontrarás. En Why This Matters, creo apasionadamente que cada conferencia puede y debe estar conectada con algún desafío a mayor escala, o innovación, o inspiración. En Por qué esto emplea, mi objetivo es conectar cada conferencia con un posible campo de empleo. Similar a Why This Matters, esto no pretende ser exhaustivo sino más bien ilustrativo, para darte otra forma en la que el material que estás aprendiendo tenga valor más allá del aula y se conecte con algo, en este caso un trabajo.
Pasamos la mitad de esta primera conferencia hablando de la estructura de clases, no solo administrativamente (lo que se califica, lo que no, etc.) sino también pedagógicamente (los diferentes componentes, cómo se unen para brindar una experiencia de aprendizaje, etc.). Pensar en cómo enseñar mejor, y cómo aprenden los estudiantes, y cómo las nuevas tecnologías deberían o no ser parte de esto, es un área de empleo maravillosamente rica. Si estás interesado en aprender más, consulta el Laboratorio de Enseñanza y Aprendizaje del MIT o algunas de las iniciativas geniales en educación como EdX, NEET o los programas “SuperUROP”.
Otra dirección laboral relacionada con esta conferencia es el descubrimiento de nuevos elementos. Aquí, examinamos cómo los primeros químicos intentaron identificar elementos. Esto se redujo a aplastar, quemar, hervir, reaccionar, etc. Resulta que eso sigue siendo una cosa, solo que en los tiempos modernos toda esta reacción ocurre con piezas de equipo mucho más grandes y equipos de personas mucho más grandes. El siguiente elemento aún por descubrir (al momento de escribir, eso significaría el 119º elemento conocido) probablemente no tendrá una vida útil muy larga, y será muy difícil de hacer en grandes cantidades. Pero empujando los límites entre lo que hemos encontrado naturalmente y lo que podemos hacer sintéticamente en lo que se refiere a los bloques fundamentales del universo. bueno, eso es algo bastante emocionante de hacer. Y dada la predicción de algunos de que existe una “isla de estabilidad” para elementos más pesados que aún no se han hecho, es posible que una era completamente nueva de la química espere tales descubrimientos.
El último ejemplo que voy a dar para el empleo se relaciona con la idea de los minerales metálicos que mencioné anteriormente en esta conferencia. Recuerden que aquí es donde Dalton y muchos otros estaban descubriendo esos nuevos elementos. Básicamente, tomas una roca y la rompes con cuidado y viola, sacas a Fe de ella (ok, es un poco más complicado que eso, pero esa es la idea). Resulta que muy a menudo el átomo metálico está encerrado bastante apretadamente en forma de un “óxido” (sí, eso significa unido al oxígeno, pero llegaremos a eso en algunas conferencias). El punto es que extraer metales como el aluminio de las rocas requiere una enorme cantidad de energía, lo que significa que requiere mucha quema de combustibles fósiles. ¿Y si pudieras llegar a una nueva forma mucho más “verde” de sacar metales o minerales en su forma pura de las rocas de las que se originan? Esto sería un gran problema. La minería de metales y minerales involucra equipos masivos de ingenieros que cubren una amplia gama de trabajos, desde averiguar dónde extraer, hasta caracterizar los materiales de partida, optimizar la química de extracción, hasta trabajar en nuevas formas de hacerlo de manera más eficiente.
Problemas de ejemplo
1. En esta conferencia, fuiste testigo de mi pasión por la pirotecnia.
a) Escribir y equilibrar la reacción química para un proceso similar, la combustión de propano (\(\mathrm{C}_3 \mathrm{H}_8\)).
- Contestar
-
\(\mathrm{C}_3 \mathrm{H}_8+5 \mathrm{O}_2 \rightarrow 3 \mathrm{CO}_2+4 \mathrm{H}_2 \mathrm{O}\)
b) Si tienes\(500 \mathrm{g}\) propano, ¿cuántos moles tienes? ¿Cuántas moléculas?
- Contestar
-
Primero, encontrar la masa molar del propano.
\[3 * 12 \mathrm{~g} / \mathrm{mol}+8 * 1 \mathrm{~g} / \mathrm{mol}=44 \mathrm{~g} / \mathrm{mol} \nonumber\]
Utilice los gramos dados y la masa molar para convertir a moles:
\[500 / 44=11.36 \mathrm{~mol} \nonumber\]
Conferencia 2: Contar átomos y organizar los elementos
Resumen
En este capítulo, presentamos el concepto del topo. Se trata de un número constante, también denominado número de Avogadro, igual a\(6.0221409 \times 10^{23}\). Las unidades de masa atómica (UMA) asignadas a un elemento son iguales a la masa en gramos de un mol de átomos de ese elemento. Así como el número de Avogadro es solo un número, el\(\mathrm{AMU}\) es solo una masa, y\(1 \mathrm{AMU}\) es igual a\(1.67377 \times 10^{-24}\) gramos. Al igual que el topo, una AMU es otra unidad especial que los químicos utilizan para conectar el mundo muy pequeño de los átomos con el mundo comparativamente grande de las cosas con las que trabajamos. Este vínculo entre los mundos macro y atómico significa que simplemente midiendo la masa de una sustancia, podemos saber cuántos átomos de ese material tenemos.
En clase se utilizó el ejemplo de la combustión de una vela, también conocida como la reacción bien equilibrada\(\mathrm{C}_{25} \mathrm{H}_{52}+38 \mathrm{O}_2 \rightarrow 25 \mathrm{CO}_2+26 \mathrm{H}_2 \mathrm{O}\). Utilizamos este ejemplo para enfatizar cómo el concepto del topo nos da un vínculo entre los mundos atómico y macroscópico, entre gramos y átomos. También se utilizó este ejemplo para volver a enfatizar los conceptos de reactivo limitante y rendimiento.
A continuación, nos enfocamos en organizar la tabla periódica. A diferencia del último capítulo, aquí organización significa más que idear un esquema de nomenclatura o una simple categorización de los elementos, como ya lo habían hecho Dalton, Lavoisier y muchos otros. En esta conferencia lo que queremos decir con organización es realmente el reconocimiento de patrones. Los científicos estaban empezando a ver patrones emergiendo entre los elementos, y cuantos más elementos se descubrían, más esfuerzo se ponía en entender estos patrones.
Dmitri Mendeleev desarrolló el precursor de la tabla periódica de hoy. Su gran avance fue que arregló los entonces conocidos (63) elementos no solo por su masa, sino también por la repetición (¡periódica!) patrones que observó en sus propiedades. Esto lo llevó a dejar vacíos en la tabla periódica que posteriormente se llenarían con elementos recién descubiertos. Debido a la periodicidad en las propiedades, incluso podría predecir las propiedades de muchos elementos aún no descubiertos. Las filas de tu tabla periódica se llaman periodos, y las columnas se llaman grupos. Los Elementos del Grupo Principal son aquellos en los periodos dos y tres. Existe una tendencia general de elementos metálicos a no metálicos a lo largo de los periodos. Los Elementos de Transición se encuentran en grupos 3-12 y periodos 4 y 5.
Por qué esto importa
La población de humanos en este planeta ha visto un crecimiento dramático y exponencial. Vamos a hacer un acercamiento sobre dónde el crecimiento realmente comenzó a ponerse en marcha. ¿Ves ese repunte, alrededor de principios del siglo XX? Observe el cambio masivo de pendiente. Fue entonces cuando descubrimos cómo hacer nitrógeno de una manera que las plantas puedan usar.
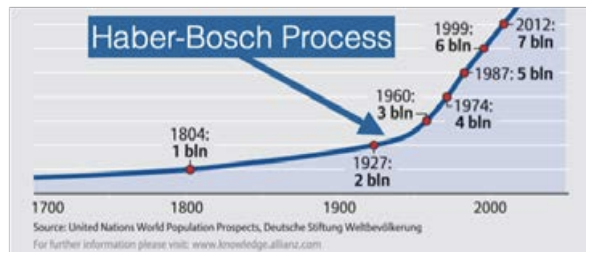
Parcela de personas vs. tiempo © Buró de Referencia de Población. Todos los derechos reservados. Este contenido está excluido de la licencia Creative Commons. Para más información, consulte https://ocw.mit.edu/fairuse.
Es decir, con el descubrimiento que ahora se conoce como el proceso Haber-Bosch (llamado así por los químicos alemanes Fritz Haber y Carl Bosch), el mundo pudo hacer fertilizantes en la abundancia necesaria para alimentar a miles de millones. La clave se reduce a algo llamado “fijar” nitrógeno. Las plantas necesitan nitrógeno para crecer, pero la mayoría de las plantas no pueden usar nada de\(78 \% \mathrm{~N}_2\) esa abundancia que hay en el aire. En cambio, lo necesitan en una forma que sirva\(\mathrm{N}\) átomos individuales, como el amoníaco\(\left(\mathrm{NH}_3\right)\). Entonces, ¿cómo podemos pasar de\(\mathrm{N}_2\) a\(\mathrm{NH}_3\)? Fácilmente, con la siguiente reacción química:
\(\mathrm{N}_2+\mathrm{H}_2 \rightarrow \mathrm{NH}_3\)
Ah, perdón, vamos a equilibrar eso:
\(\mathrm{N}_2+3 \mathrm{H}_2 \rightarrow 2 \mathrm{NH}_3\)
Eso es mejor. Lo que Haber y Bosch realmente hicieron fue desarrollar un catalizador y un proceso que permitiera que esta reacción se llevara a cabo de manera mucho más eficiente que antes. Pero la catálisis se está adelantando un poco a nosotros mismos. Por ahora, centrémonos en la reacción equilibrada y contemos algunos átomos.
En 2019, se producen 500 millones de toneladas de nitrógeno para fertilizantes cada año utilizando el proceso Haber-Bosch. ¡La mitad de la proteína en todos los seres humanos de este planeta proviene del nitrógeno que fue fijado por este proceso! Entonces, aquí está mi pregunta: ¿cuánto tiempo podemos seguir arreglando el nitrógeno de esta manera? Y como la reacción nos dice que necesitamos ambos\(\mathrm{N}_2\) y\(\mathrm{H}_2\), ¿cuál sería el reactivo limitante?
De toda nuestra discusión hasta el momento de esta conferencia sabemos que podemos usar la tabla periódica para determinar que 1 mol de\(\mathrm{NH}_3\) es de 17 gramos. Sólo por simplicidad, supongamos que en el futuro seguimos necesitando hacer la misma cantidad que estamos haciendo hoy, es decir, 500 millones de\(\mathrm{NH}_3\) toneladas al año. Hay aproximadamente un millón de gramos por tonelada, por lo que 500 millones de toneladas anuales\(500 \times 106 \times 106\) gramos por año. Dividiendo por 17 gramos por mol, esto significa que necesitamos hacer aproximadamente\(30 \times 10^{12}\) moles de\(\mathrm{NH}_3\) /año. Dada la reacción equilibrada anterior, esto significa que necesitaremos como insumo a los\(15 \times 10^{12}\) moles de reacción\(N_2\) por año. Ahora, la masa de la atmósfera es de aproximadamente\(5.15 * 10^{21}\) gramos, de los cuales\(78 \%\) es\(\mathrm{N}_2\), así que eso hace aproximadamente\(4 \times 10^{21}\) gramos de\(\mathrm{N}_2\) en el aire. Y como la masa atómica para un átomo de nitrógeno es 7, entonces es 14 para\(\mathrm{N}_2\) lo que significa que hay 14 gramos por mol de\(\mathrm{N}_2\). Por lo que el número de moles disponibles en la atmósfera es de\(4 \times 10^{21}\)\(\mathrm{N}_2 / 14\) gramos de\(=3.5 \times 10^{20}\) moles\(/\) moles de gramos de\(\mathrm{N}_2\) en la atmósfera. Bueno, ¡esa es una buena noticia! Tomando\(3.5 \times 10^{20}\) moles de\(\mathrm{N}_2\) total y dividiendo eso por\(15 \times 10^{12}\) moles de\(\mathrm{N}_2\) necesarios por año, encontramos que podríamos mantenernos en él con el proceso Haber-Bosch de fijar nitrógeno de la atmósfera por más de 20 millones de años más o menos antes de usarlo todo.
Eso es simplemente genial. Piénsalo en esto: acabamos de pasar del átomo al mundo macroscópico y es todo porque tenemos este concepto del topo. Pero nunca respondimos realmente a la pregunta, es decir, ¿cuál es el reactivo limitante en la reacción, el\(\mathrm{N}_2\) o el\(\mathrm{H}_2\)? Ahora sabemos cuánto tiempo nos\(\mathrm{N}_2\) va a durar si fuéramos a usarlo todo para arriba en esta reacción, así que lo que queda es hacer lo mismo por\(\mathrm{H}_2\). Hablando de eso, ¿de dónde sacaremos siquiera\(\mathrm{H}_2\)? Desde luego no desde el aire. Voy a dejar que todos ustedes trabajen a través de esto pero aquí hay una pista: los océanos contienen mucha agua, como más de\(10^{18}\) toneladas. ¡Quizás ni siquiera necesitas hacer ningún cálculo para resolverlo!
Por qué esto emplea
¿Cómo lleva a un trabajo contar u organizar átomos? Bueno, por una cosa estamos hablando de orden, precisión y medición. Después de todo, el éxito de Mendeleev se basó en combinar la medición cuidadosa de las propiedades con un orden preciso. Esta habilidad es necesaria para muchos trabajos diferentes. Un lugar con la medición como misión es el Instituto Nacional de Estándares y Tecnología (NIST). Echa un vistazo a la línea de etiqueta en su Laboratorio de Medición de Materiales: “MML sirve como laboratorio nacional de referencia para mediciones en las ciencias químicas, biológicas y materiales. Las actividades van desde la investigación fundamental y aplicada hasta el desarrollo y difusión de materiales y datos de referencia certificados para asegurar la calidad de los resultados de las mediciones”. Y esa es sólo una de sus muchas divisiones.
Otro trabajo que me viene a la mente es uno relacionado con el fertilizante discutido en nuestro Por qué esto importa. Los tres componentes fundamentales de los fertilizantes comerciales utilizados en todo el mundo son el nitrógeno, el fósforo y el potasio. Como sabemos, el nitrógeno requiere de fijación. El potasio debe obtenerse de otras formas. Por ejemplo, viene muy bien con cloro como cloruro de potasio (\(\mathrm{KCl}\)), pero preferiríamos no tener cloro en el suelo ya que puede provocar toxicidad en los cultivos y alta acidez y salinidad en el suelo. Sin embargo, obtener potasio en otras formas es costoso y requiere, como se puede adivinar, química. Para complicar las cosas, tanto las fuentes naturales de potasio como las necesidades específicas del suelo dependen en gran medida de la geografía. Para los agricultores de las regiones tropicales de Brasil y algunos países de África, las composiciones de suelos y rocas requieren fertilizantes que se ajusten mejor a las necesidades químicas de las plantas de los que están disponibles actualmente. Como solución, se agrega más fertilizante para lograr tanto rendimiento de cultivo como sus homólogos en el norte, pero muchos de los ingredientes básicos, especialmente el potasio, se producen en regiones más septentrionales y por lo tanto son mucho más caros en el hemisferio sur. ¡Es urgente la necesidad de soluciones de fertilización locales y sustentables para aumentar los rendimientos! Pero esto empieza a sonar más como una segunda edición de Why This Matters y menos como un Why This Emploads. Mi punto es que el desarrollo de fertilizantes es un problema de química, y el mundo necesita desesperadamente nuevas soluciones. En términos de empleos, esto podría significar convertirse en algo llamado “Químico Analítico”, lo que significa aplicar los principios de la química para averiguar de qué cosas están hechas, cuáles son las composiciones precisas, cómo monitorearlo, modificarlo, etc. Esto también podría significar trabajar en una empresa o laboratorio de investigación que desarrolle ideas de vanguardia (como el trabajo reciente sobre el uso de la electroquímica para hacer potasio).
Práctica extra
1. Las células solares a veces contienen un recubrimiento de titanio (\(\mathrm{Ti}\)) que impide que la célula se cortocircuite. El Proceso Kroll para la fabricación de metal de titanio a partir de óxido de titanio es:
\(\mathrm{TiCl}_4+\mathrm{Mg} \rightarrow \mathrm{MgCl}_2+\mathrm{Ti}\)
a) Equilibrar la reacción.
- Contestar
-
\[\mathrm{TiCl} _4+2 \mathrm{Mg}->2 \mathrm{MgCl}_2+\mathrm{Ti} \nonumber\]
b) Si tienes\(50 \mathrm{~g}\) de ambos\(\mathrm{TiCl} 4\) y\(\mathrm{Mg}\), ¿cuál es el reactivo limitante en la reacción?
- Contestar
-
Masa molar de Mg: Masa\(24.3 \mathrm{~g} / \mathrm{mol}\)
molar de\(\mathrm{TiCl}_4: 189.9 \mathrm{~g} / \mathrm{mol}\)Encuentra los moles de cada reactivo dividiendo\(50 \mathrm{~g}\) por las masas molares individuales:
\[50 \mathrm{~g} / 24.3=2 \mathrm{~mol} \mathrm{Mg} \quad \quad 50 \mathrm{~g} / 189.9=0.3 \mathrm{~mol} \mathrm{TiCl}_4 \nonumber\]
Use la relación molar de la reacción balanceada\(\left(1 \mathrm{~mol} \mathrm{TiCl}_4 / 2 \mathrm{~mol} \mathrm{Mg}\right)\) para ver cuánto\(\mathrm{TiCl}_4\) podría agotarse con la cantidad de\(\mathrm{Mg}\) que tiene disponible:
\[(2 \mathrm{~mol} \mathrm{Mg} \text { available }) /\left(2 \mathrm{~mol} \mathrm{Mg} / 1 \mathrm{~mol} \mathrm{TiCl}_4\right)=1 \mathrm{~mol} \mathrm{TiCl}_4 \nonumber\]
\(1 \mathrm{~mol} \mathrm{TiCl}_4\)se agotaría si tuviéramos un suministro interminable de la misma con la cantidad de Mg que tenemos. Esta cantidad de\(\mathrm{TiCl}_4\) es mayor que la cantidad que realmente tenemos disponible, lo que significa que la\(\mathrm{TiCl}_4\) se agotará antes de que\(\mathrm{Mg} . \mathrm{TiCl}_4\) sea por lo tanto el reactivo limitante.
c) ¿Cuál es el rendimiento de la reacción en gramos?
- Contestar
-
Para calcular el\(\mathrm{Ti}\) rendimiento de la reacción, utilizamos la relación de\(\mathrm{Ti}\) a\(\mathrm{TiCl}_4\) (porque estos dos tienen una relación molar 1:1) y luego convertimos de moles a gramos de\(\mathrm{Ti}\):
\(0.3\)Se\(\mathrm{TiCl}_4\) están utilizando moles de (es el reactivo limitante, por lo que se utilizará en su totalidad) y debido a la relación molar 1:1 sabemos que se\(\mathrm{Ti}\) producirán\(0.3\) moles de. Multiplique este número por la masa molar de\(\mathrm{Ti}\):
\[0.3 * 47.9 \mathrm{~g} / \mathrm{mol}=14.37 \mathrm{g ~Ti} \nonumber\]
d) Trazar el rendimiento de\(\mathrm{Ti}\) (g) en función del incremento\(\mathrm{Mg}\) disponible para la reacción.
- Contestar
-
La gráfica de\(\mathrm{Ti}\) gramos (en el\(\mathrm{y}\) eje) vs\(\mathrm{Mg}\) gramos (en el\(\mathrm{x}\) eje) comienza en 0 y aumenta linealmente hasta que alcanzan los\(\mathrm{Ti}\) gramos\(14.37 \mathrm{~g}\), momento en el que nos quedamos sin\(\mathrm{TiCl}_4\) y la reacción se detendrá.
Conferencia 3: El descubrimiento del electrón y la estructura del átomo
Resumen
Esta conferencia comenzó con la discusión de experimentos innovadores que acercaron a la comunidad científica a comprender la estructura del átomo. Estos incluyeron los experimentos de J.J. Thomson con el tubo de rayos catódicos (CRT), lo que le permitió encontrar la relación carga-masa de los electrones, que se dio cuenta de que eran partículas cargadas negativamente que se encuentran en todos los átomos. Robert Millikan pudo determinar la masa y la carga del electrón usando su experimento de gotas de petróleo. El átomo no era la partícula más fundamental después de todo, más bien estaba hecho de partículas más pequeñas como electrones, y a medida que aprendemos a continuación esas cosas más pequeñas que componen los átomos tienen una estructura para ellas. La estructura electrónica.
A partir de los estudios de radiación de Marie y Pierre Curie, Ernest Rutherford pudo identificar tres tipos de partículas que se encuentran en la radiación: partículas alfa, que eran grandes y cargadas positivamente, partículas beta, que eran pequeñas y cargadas negativamente, y rayos gamma , que no desviaba ni interactuaba con la placa fotográfica en el experimento de Rutherford en absoluto. Rutherford luego realizó el experimento de lámina de oro, que mostró que los átomos tienen carga positiva que se localiza en el núcleo del átomo en lugar de dispersarse entre la carga negativa, como Thomson había propuesto. Este centro cargado positivamente del átomo se llama núcleo. Las partículas cargadas positivamente en el núcleo se llaman protones. Para cualquier átomo neutro, el número de protones presentes debe ser igual al número de electrones presentes. A este número se le llama el número atómico del elemento, que se denota con la letra\(\mathrm{Z}\). Salvo el caso de un átomo de hidrógeno neutro compuesto por un solo protón en su núcleo y un electrón, todos los átomos también contienen neutrones en sus núcleos, que son, como su nombre podría sugerir, partículas con carga neutra. Para obtener el número de masa de un átomo dado, se suma el número de protones y neutrones en ese núcleo específico. Los átomos del mismo elemento pueden tener diferentes números de neutrones. Esto los hace diferentes isótopos del mismo elemento. Para obtener la masa dada para cada elemento en su tabla periódica, se toma un promedio ponderado de los números de masa de los isótopos estables naturales de ese elemento. El peso se asigna de acuerdo con el porcentaje de abundancia de isótopos en la naturaleza.
Después de los experimentos de Rutherford, quedó la cuestión de cómo un átomo estructurado de esta manera podría ser estable. Niels Bohr fue quien postuló que se debía cuantificar el momento angular de los electrones en átomos, lo que significa que toma valores discretos. Esto significó que también se cuantificaron la energía del electrón y la distancia desde el núcleo; el electrón solo puede ocupar ciertas órbitas.
Por qué esto importa
El descubrimiento del electrón condujo a una nueva comprensión profunda del átomo, lo que a su vez condujo a una teoría completamente nueva (mecánica cuántica), que a su vez condujo a orbitales, enlaces, y los bloques de construcción para toda la química moderna, como veremos pronto. Pero el descubrimiento del electrón también llevó a una nueva capacidad que revolucionó el mundo: la capacidad de pintar con electricidad. La pantalla de fósforo que estaba al final del tubo de rayos catódicos de Thomson fue la precursora de la televisión, y el comienzo de una revolución tecnológica que cambió casi todos los aspectos de nuestras vidas. La televisión no fue inventada por el propio Thomson, pero el descubrimiento de Thomson de este nuevo pincel fundamental —el electrón mismo— fue crucial para que el concepto despegara. Mira lo que sostiene el hombre de la izquierda en esta imagen: ¡es una versión temprana de un televisor, que ahora puedes reconocer como un tubo gigante de rayos catódicos! John Logie Baird fue uno de los primeros en comercializar televisores, vendiendo su primero en 1925. Se puede ver el interior de un televisor temprano en la imagen central: tenga en cuenta que estaba compuesto por un CRT más una bobina para inducir un campo magnético, esencialmente la misma configuración que Thomson utilizó en sus innovadores experimentos.

Hombre con CRT e imágenes de TV abierta © fuentes desconocidas. Este contenido está excluido de nuestra licencia Creative Commons. Para más información, consulte https://ocw.mit.edu/fairuse.
Si los electrones fueran escaneados a través de la pantalla de fósforo lo suficientemente rápido, una imagen podría pintarse tantas veces por segundo que pareciera movimiento para el ojo humano. Esto fue fácil de hacer, porque cambiar un campo magnético de forma rápida y precisa (para posicionar electrones en la pantalla) se puede lograr con circuitos electrónicos simples. Durante la siguiente generación, los electrones se convirtieron en una forma dominante de intercambiar información visual. La química de la propia pantalla también es esencial. Una 'pantalla' es en realidad un recubrimiento de fósforo que a menudo se ponía sobre un trozo de vidrio y era el objetivo del haz de electrones. El fósforo es un término amplio para los materiales que emiten luz en respuesta a un estímulo. Este acto de emisión de luz se llama luminiscencia. Puede resultar confuso ya que el término “fosforescente” significa que el material emite luz lentamente a lo largo del tiempo después de ser estimulado. Un buen ejemplo de un material fosforescente serían los juguetes que brillan en la oscuridad, donde el estímulo es la luz, y el fósforo puede seguir brillando durante muchas horas. Por otro lado, un material “fluorescente” también emite luz en respuesta a un estímulo, pero como un flash rápido que dura nanosegundos. El término fósforo puede referirse a cualquiera de estos, pero el recubrimiento en la pantalla CRT y en esos primeros televisores es del tipo fluorescente. Te puedes imaginar por qué: si no emitiera luz rápidamente,, la imagen tendría resplandores que duraban horas, lo que no sería exactamente una buena experiencia de ver películas.
Para hacer las cosas aún más confusas, el término fósforo (que como acabamos de establecer puede referirse a materiales que son fosforescentes o materiales que son fluorescentes), no debe confundirse con el elemento fósforo. El fósforo también emite luz, pero de una naturaleza completamente diferente, ya que su brillo proviene de una reacción química (un proceso llamado “quimioluminiscencia”). Entonces, para resumir: la pantalla de la que estamos hablando usa un fósforo que es fluorescente, no fosforescente, y no tiene fósforo en él. Genial.
Químicamente hablando, ¿qué son estos fósforos? Hay tantos materiales diferentes que son fósforos que se necesitaría un libro completamente separado para recorrerlos todos. Pueden ser moléculas pequeñas, sólidos complejos o líquidos. Pueden emitir luz en respuesta a muchos estímulos diferentes, desde la luz al calor hasta los campos eléctricos y los electrones que estamos discutiendo aquí en nuestros CRT. Las primeras pantallas de televisión eran en blanco y negro, por lo que el objetivo era simplemente usar fósforos que brillaban en blanco cuando eran golpeados por electrones. Los polvos hechos de zinc, cadmio y azufre y un poco de plata fueron ingredientes tempranos. Para lograr la TV en color, se necesitaron fósforos azules, verdes y rojos. El haz de electrones podría apuntarse a cualquiera que fuera necesario para hacer un color dado, nuevamente utilizando el campo magnético para guiar los electrones con una precisión fantástica. Resultó que los fósforos verdes y azules eran bastante sencillos de hacer, sulfuro de zinc con un toque de cobre para verde y plata para azul. Pero el rojo era una historia diferente: para los fósforos rojos se necesitaron décadas adicionales de investigación para encontrar cualquier cosa que funcionara. Esta es la razón por la que la televisión en color no entró en escena hasta mediados de la década de 1960, ¡40 años completos después de que se introdujera la televisión en blanco y negro! El desafío de fósforo rojo finalmente se resolvió usando una mezcla compleja de itrio, oxígeno, azufre y un poco de europio para una buena medida.
Como hemos enumerado el itrio, tengo que mencionar que es uno de cuatro — ¡sí cuatro! — elementos que fueron descubiertos en la misma cueva en el mismo pueblo, Ytterby, Suecia. El itrio, el terbio, el erbio y el iterbio llevan el nombre de esta ciudad. Seguimos esperando cambrium o bostonio.
Ahora, son solo tus padres o abuelos quienes recordarán cómo era ver televisión en un CRT. Eso es porque los televisores hoy en día funcionan según un principio diferente, a saber, los diodos emisores de luz (LED). Pero al final, ¡sigue pintando con electrones! Un LED emite luz usando la cascada de electrones de alta energía a baja energía en un material sólido. Aprenderemos todo sobre ese material (se llama semiconductor) y por qué los electrones pueden hacer luz de esta manera un poco más tarde en el semestre. La luz que sale de un LED en tu televisor (o teléfono o tablet) todavía suele pasar a través de un fósforo, ya que el fósforo se puede utilizar para afinar el color de la luz que vemos. En este caso el fósforo es estimulado por la luz en lugar de los electrones, pero el resultado es el mismo: la luz y el color se producen utilizando electrones y química.
Por qué esto emplea
¿Cómo podemos conseguir un trabajo basado en el descubrimiento del electrón? Eso es como preguntar cómo podemos conseguir un trabajo relacionado con el conocimiento de los átomos —es decir, los electrones y los átomos lo conforman todo para que cualquier cosa califique, al menos si tiene alguna referencia a la materia en la descripción del empleo. Pero, ¿qué tal si volvemos, específicamente, a ese primer haz de electrones que hizo Thompson para descubrir su propia existencia.. qué empleos podrían involucrar haces de electrones. Ya hablamos de pintar con electrones en el tema de las exhibiciones en Why This Matters, pero resulta que hay mucho más que puedes hacer con un haz de electrones que solo hacer fotos. Para hacerlo, sin embargo, necesitaremos más poder. Mucho poder.
Si aumentas la potencia de ese haz de electrones lo suficiente, y lo mantienes en el vacío (tal como lo hizo Thompson) para asegurarte de que no se dispersen de nada, entonces puedes usar el haz de electrones para crear calor muy localizado, suficiente para derretir cualquier material. Si se hace para unir dos materiales juntos de manera precisa, lo llamamos soldadura. Los electrones tienen muchas ventajas en la soldadura porque pueden enfocarse a áreas muy pequeñas usando campos magnéticos, y la potencia se puede marcar a lo que requiera el trabajo (y casi no hay límite en lo poderoso que se puede hacer un haz de electrones). En el extremo superior, para la soldadura industrial, los haces de electrones pueden llegar hasta 10.000.000 Watts por\(\mathrm{mm}^3\) lo que pueden calentar un metal a una velocidad de 1,000,000,000 Kelvin por segundo.
La soldadura por haz de electrones es una gran industria, y hay muchos trabajos asociados con ella. Se podían soldar piezas metálicas juntas en GE para su negocio de aviación, y menciono a esa compañía específicamente porque fue James Russel quien inventó la soldadura por haz de electrones mientras estaba en GE, allá por la década de 1950 (como nota al margen divertida, también inventó el primer CD). Si haces una búsqueda de soldadura por haz de electrones encontrarás un gran número de anuncios para empresas que la brindan como servicio a otras empresas. Bodycote, por ejemplo, afirma que son, “el proveedor líder mundial de tratamientos térmicos y servicios especializados en procesamiento térmico”, y con 5,700 empleados en 26 países tienen muchos empleos. Pero hay muchas operaciones a menor escala que contratan a personas a las que les gusta disparar electrones masivamente de alta energía en partes metálicas, como el Roark familiar en Brownsburg, IN, que cuenta con una de las cámaras de soldadura por haz de electrones más grandes de Estados Unidos, o Precision Technologies, Inc., que tiene un sonido frío de 5- soldador de haz de electrones de eje que va hasta 150 kV, “capaz de soldar piezas tan pequeñas como unos pocos gramos hasta unas que pesen varias toneladas”, o qué tal Fraunhofer FEP que desarrolla tecnologías de haz de electrones personalizadas y afirma, “¡Usando electrones mejoramos tus materiales y productos!” Fresco.
Práctica extra
1. Tu amiga Wonder Woman te dice que sus brazaletes están hechos de un metal, Feminum (esto es legítimo, fue en el 'programa de\(70 \mathrm{~s}\) televisión), solo se encuentran en su isla natal. Feminum (símbolo Fm) tiene número atómico 120 y masa atómica\(285.47\). El elemento tiene 2 isótopos,\({ }^{285} \mathrm{Fm}\) y\({ }^X \mathrm{Fm}\). La abundancia natural de\({ }^{285} \mathrm{Fm}\) en la isla es\(77 \%\).
a. ¿Cuál es el otro isótopo y cuál es su abundancia natural?
b. ¿Cuántos protones y neutrones tiene cada isótopo?
- Contestar
-
\(77 \%\)la abundancia de un isótopo implica 23 por ciento de abundancia del otro, ya que sabemos que solo hay dos isótopos. La masa atómica es la media ponderada de los dos isótopos. Resuelve la ecuación promedio ponderada para obtener el número de masa faltante:
\[(0.77)(285)+(0.23)(x)=285.47 \quad \quad x=287.04, \text { rounds to } 287 \nonumber\]
2. El número sobre el\(\mathrm{Li}\) símbolo en la tabla periódica (a la derecha) es el número de protones en un núcleo de litio. ¿Cuál es el número debajo del símbolo? ¿Cómo lo calculas?
- Contestar
-
El número debajo del símbolo atómico es la masa atómica. No es específico del átomo, es un promedio ponderado de los isótopos estables (no radiactivos) del elemento, con pesos dados de acuerdo con la abundancia de isótopos en la naturaleza.
Por ejemplo, la masa atómica del litio es\(6.94\), y sus dos isótopos estables son\(7 (92.4\%\) abundancia) y\(6(7.6 \%\) abundancia)
3. Suponiendo que todos los protones (rojo) y neutrones (azul) son visibles, usa la notación adecuada para escribir el átomo que corresponde a cada uno de los siguientes núcleos:
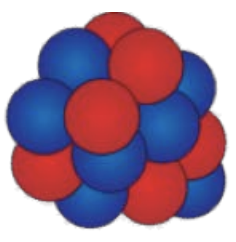
Imagen cortesía de Fundación CK-12, Licencia: CC BY-NC.
- Contestar
-
a) masa: 13, atómico: 6, símbolo atómico:\(\mathrm{C}\)
b) masa: 7, atómico: 3, símbolo atómico:\(\mathrm{Li}\)
Conferencia 4: El modelo Bohr y las transiciones electrónicas
Resumen
El modelo de Bohr es un marco utilizado para describir la naturaleza cuantificada de los átomos. Al asumir que los electrones orbitaban alrededor de planetas similares a núcleos atómicos alrededor del Sol, Bohr demostró que los electrones unidos a núcleos atómicos solo pueden existir en niveles de energía discretos. Al igualar la fuerza de atracción de la interacción de Coulomb entre el electrón cargado negativamente y el núcleo positivo\(F_{C o u l o m b}=-Z e^2 / r^2\), y la fuerza repulsiva debida a la rotación\(F=m v^2 / r\), y sustituyendo el momento angular cuantificado\(L=m v r=n h / 2\), encontramos fórmulas para el radio cuantificado y el cuantificado energía. La energía de un electrón en el enésimo nivel de energía de un átomo que tiene\(\mathrm{Z}\) protones es
\[E=-13.6 Z^2 / n^2 \quad[e V] \nonumber\]
El entero\(\mathrm{n}\), que puede tener cualquier valor positivo\(\geq 1\), se llama número cuántico porque lo hace para que la energía sólo pueda tomar ciertos valores discretos en contraposición a un continuo de posibilidades. El estado\(n=1\) es el estado base, y los niveles de energía más altos se llaman estados excitados. Cuando un electrón pasa de un estado con un número cuántico menor a uno con un número cuántico mayor, la energía del electrón se vuelve menos negativa: gana energía. Sabemos que la energía debe conservarse, por lo que la energía ganada en tal transición debe provenir de alguna parte. De hecho, un fotón con exactamente los dos estados energéticos\(\Delta \mathrm{E}\) entre los dos estados de energía en el átomo puede ser absorbido, excitando al electrón. De igual manera, si la transición ocurre en sentido contrario, el exceso\(\Delta \mathrm{E}\) puede emitirse en forma de fotón.
Los tipos de fotones capaces de ser absorbidos o emitidos por un átomo o molécula modelo de Bohr pueden caracterizarse de manera equivalente por su energía, frecuencia o longitud de onda. Einstein nos enseñó que la luz también puede cuantificarse en su trabajo sobre el efecto fotoeléctrico: la energía del fotón puede tomar valores discretos:
\[E=h f=h c / \lambda \nonumber\]
Dónde\(\mathrm{f}\) está la frecuencia,\(\lambda\) es la longitud de onda,\(\mathrm{h}\) es la constante de Planck,\(\mathrm{c}\) es la velocidad de la luz, y la segunda igualdad es verdad porque\(\mathrm{c}=\mathrm{f} \lambda\). La longitud de onda de la luz que puede interactuar con una transición energética particular se puede encontrar igualando las dos expresiones anteriores. Con esto en mente, vemos que la luz puede ser utilizada para sondear qué transiciones electrónicas están sucediendo en un átomo o molécula, y por lo tanto qué niveles de energía están presentes en un material. El modelo Bohr se ajusta a las líneas espectrales de estrellas observadas previamente por los astrónomos; en particular, las longitudes de onda discretas emitidas por el gas hidrógeno que habían sido observadas por el espectrómetro finalmente tuvieron una explicación.
Existen algunas limitaciones para el modelo de Bohr. Ahora sabemos que los electrones no están realmente orbitando el núcleo (aunque su momento angular se cuantifica como se predijo). Además, el modelo Bohr solo puede usarse para describir transiciones electrónicas con un solo electrón, como\(\mathrm{H}_{\mathrm{He}} \mathrm{He}^{+}\), o\(\mathrm{Li}^{2+}\). Sin embargo, las conclusiones clave sostienen: si se conocen los estados energéticos en un átomo o molécula, también se determinan las longitudes de onda de la luz que puede ser emitida o absorbida por el material. Asimismo, si se observan las longitudes de onda discretas emitidas o absorbidas por un átomo o molécula, también se conocen los niveles de energía disponibles para un electrón.
Por qué esto importa
¿Cómo importa la absorción de fotones por electrones que están en transición de un nivel de energía a otro? Una aplicación a la que está conectado este principio es el refrigerador (!) Eso puede no parecer obvio al principio, pero veamos por qué. Eche un vistazo a la energía promedio que usa una nevera en Estados Unidos durante un período de 55 años. Es interesante señalar que el tamaño promedio de un refrigerador creció de manera constante durante 35 años y luego se estabilizó en la década de 1980.
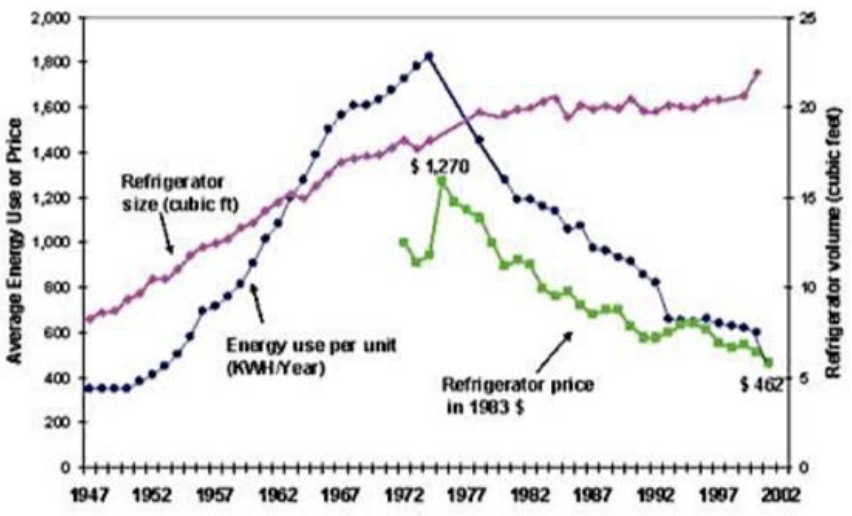
Uso promedio de energía vs. tiempo © fuente desconocida.
Esto, resulta, no fue porque la gente no quisiera más nevera, sino porque no cabía nada más grande a través de la puerta de la cocina. Más al punto, señalar que el uso de energía por unidad aumentó junto con el tamaño durante 30 años, hasta que de pronto comenzó a disminuir rápidamente en la década de 1970, a pesar de que el tamaño continuó aumentando. Esto se debe a que durante ese tiempo también hubo escasez de petróleo y la gente comenzaba a preocuparse por el uso de energía. Algunas de estas personas tenían títulos importantes como Presidente de Estados Unidos (Nixon, Ford y Carter), y por ellos sucedió mucha legislación encaminada a la conservación de energía. Por ejemplo, el presidente Ford firmó la primera ley sobre este tema en 1975, la Ley de Política y Conservación Energética, que llevó al establecimiento de estándares de economía de combustible para automóviles y estándares de eficiencia para electrodomésticos. Después de eso, se firmaron más leyes que crearon incentivos para reducir el consumo de energía (hacia el objetivo de convertir a Estados Unidos en una nación independiente de la energía para 1985), con Carter presentando un plan al congreso afirmando que, “la conservación es la fuente de energía más rápida, barata y práctica”, requiriendo agencias para desarrollar planes de conservación de energía, y crear el Departamento de Energía (DOE).
En este Por Qué Importa Esto Quiero recalcar la importancia de la política gubernamental. Fue el paso del gobierno lo que llevó a la innovación tecnológica lo que llevó a una mayor eficiencia y menores costos. En 1992, se introdujo el programa Energy Star que condujo a una reducción aún mayor en el consumo de energía de los electrodomésticos y a un aumento crítico de la conciencia del consumidor. No sólo los refrigeradores mismos se volvieron más baratos debido a esta innovación, sino que la energía que utilizaron siguió disminuyendo. En 2019 en Estados Unidos, ahorramos alrededor de $20 mil millones anuales solo en consumo de energía para nuestros refrigeradores en comparación con los años 70. Lamentablemente, desde 2017, la administración Trump ha estado tratando de eliminar el programa Energy Star, que muchos consideran uno de los más exitosos de eficiencia energética voluntaria programas en el mundo. Ha ahorrado a los estadounidenses 430 mil millones de dólares en costos de energía en cientos de electrodomésticos, sin mencionar las menores emisiones de CO2 que han resultado.
Ahora todavía no nos hemos conectado de nuevo a nuestra lección de química, y si bien podría hacerlo solo por el ahorro de energía, hay otro ejemplo que involucra una decisión de política relacionada con el refrigerador que muy claramente trae a Bohr de vuelta a la mesa. Ese es el Protocolo de Montreal, que se firmó en 1987 y fue el primer tratado en ser ratificado por todos los países del mundo. Representaba un acuerdo universal para proteger la capa de ozono estratosférico mediante la eliminación gradual tanto de la producción como del consumo de productos químicos que agotan el ozono, como los clorofluorocarbonos (CFC). Tomar esta acción condujo a la recuperación de la capa de ozono de la tierra que protege la vida de la dañina radiación UV. Como resultado se han salvado millones de vidas. Pero, ¿qué tienen los CFC que los hace agotar el ozono? ¿Y por qué es tan importante el ozono para bloquear la radiación UV? La respuesta, por supuesto, viene de la química.
El ozono es una molécula que consta de tres átomos de oxígeno\(O_3\),, y una molécula común de CFC consiste en un átomo de carbono, tres átomos de cloro, y un átomo de flúor,\(\mathrm{CCl}_3 \mathrm{~F}\). Ocasionalmente, la molécula de CFC se descompone y renuncia a uno de sus\(\mathrm{Cl}\) átomos, así:
\[\mathrm{CCl}_3 \mathrm{~F}(\mathrm{~g}) \rightarrow \mathrm{CCl}_2 \mathrm{~F}(\mathrm{~g})+\mathrm{Cl}(\mathrm{g}) \nonumber\]
Tenga en cuenta que se incluyen los subíndices “(g)” para mostrar que todo esto está sucediendo en la fase gaseosa. Una vez que se libera un átomo de cloro, puede reaccionar con el ozono, así:
\[\mathrm{O}_3(g)+\mathrm{Cl}(g) \rightarrow \mathrm{ClO}(g)+\mathrm{O}_2(g) \nonumber\]
Y así cada molécula de CFC puede agotar una molécula de ozono. Pero ahí no se detiene. Se produce una tercera reacción, ya que también hay átomos de oxígeno en la estratosfera. Cuando un átomo de oxígeno interactúa con la\(\mathrm{ClO}\) molécula, reacciona con ella para hacer\(O_2\), así:
\[\mathrm{ClO}(g)+\mathrm{O}(g) \rightarrow \mathrm{Cl}(g)+\mathrm{O}_2(g) \nonumber\]
Y ahí radica el verdadero problema: el átomo de Cl está ahora libre de nuevo y listo para atacar otra molécula de ozono. Debido a este ciclo catalítico, ¡una sola molécula de CFC puede conducir a la destrucción de 100,000 moléculas de ozono!
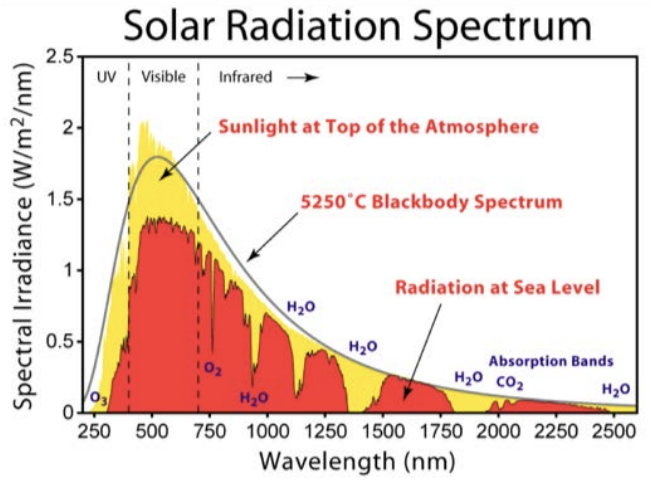
Espectro de radiación solar de Robert A. Rohde como parte del proyecto Global Warming Art. Licencia: CC BY-SA. Fuente: Wikimedia Commons.
Eso nos lleva a la segunda pregunta desde arriba: ¿por qué perder ozono conduce a más radiación UV? Aquí es donde entran las transiciones de electrones. Consulta la trama en esta figura del espectro solar. El eje x es la longitud de onda de la luz proveniente del sol, cubriendo solo los rayos UV, visibles e infrarrojos (por lo que es solo una astilla del espectro EM completo que mostramos algunas páginas atrás). El eje y es la intensidad de la luz a una longitud de onda dada, en vatios por área. Un vatio es una medida de potencia, que es energía por tiempo, o Julios/s. En palabras simples, esta es una trama que muestra el poder de la luz solar en función de su color.
Lo primero que hay que señalar en la gráfica es esa curva negra sólida, que corresponde a una predicción teórica de la radiación del cuerpo negro emitida por un objeto a la temperatura del sol. Esta temperatura varía mucho dependiendo de donde en el sol se mida, pero cerca de la superficie,\(\mathrm{T}=5250^{\circ} \mathrm{C}\) es una aproximación decente. Tenga en cuenta que es un espectro continuo agradable, y tiene una forma típica de la radiación del cuerpo negro (recuerde, ese es el tipo de radiación que mencionamos anteriormente -el tipo que Planck introdujo el concepto de cuantificación para explicar).
A continuación, están las partes sombreadas amarillas que corresponden a la potencia medida real del sol antes de que interactúe con nuestra atmósfera. Sigue bastante bien la radiación del cuerpo negro, lo que valida la predicción. Y luego, está la región sombreada en rojo. Este es el poder del sol medido en la tierra, por lo que la única diferencia entre el rojo y el amarillo es que el rojo es una medida de fotones del sol que han pasado por la atmósfera. Sigue bastante bien el amarillo en general, excepto que ahora hay huecos en el espectro: ¡longitudes de onda discretas donde no hay luz observada en la tierra en absoluto! La trama muestra la razón por la cual: junto a algunas de las brechas más grandes, hay una molécula. \(\mathrm{H}_2 \mathrm{O}\)aparece en varios puntos. Una brecha se atribuye a\(\mathrm{O}_2\) y otra a\(\mathrm{CO}_2\), y una de esas brechas se debe a nuestra agradable, amigable, molécula de ozono que ya no se agota,\(\mathrm{O}_3\). Es la brecha todo el camino sobre el lado izquierdo de la parcela, y es justo donde la luz UV habría estado brillando sobre nosotros. Podemos ver que efectivamente resplandece sobre nosotros fuera de la atmósfera (la amarilla), pero no en la superficie terrestre (la roja).
Esta pequeña astilla de ausencia de luz UV debido a la\(O_3\) molécula es absolutamente esencial para la vida en la tierra tal como la conocemos, y todo es gracias a que los electrones son bombeados en energía de un estado a otro. En este caso sucede en una molécula, no en un átomo, pero se aplica el mismo principio que aprendimos en esta conferencia para las transiciones electrónicas según el modelo de Bohr. Hay estados discretos de energía donde se permite que los electrones estén en la\(\mathrm{O}_3\) molécula, y las transiciones entre estos niveles de energía pueden ocurrir cuando un electrón absorbe o emite un fotón. Al igual que el modelo de Bohr para el átomo de hidrógeno, la naturaleza discreta de las transiciones electrónicas en las moléculas significa que la absorción de la luz ocurre solo en distintos puntos del espectro. Para el ozono, simplemente sucede que hay una diferencia de energía entre dos estados de electrones que tiene la energía de un fotón UV, razón por la cual esta molécula en particular absorbe bien en la UV.
Por qué esto emplea
Estaba pensando en mencionar trabajos en astronomía espectral, ya que el modelo Bohr explicaba la observación de líneas espectrales a partir del hidrógeno y otros elementos luminosos afuera en el espacio. El mismo tipo de análisis, usando básicamente solo una versión (mucho) más elegante del espectroscopio que tienes en tu Bolsa de Goodie, se usa hoy en día para entender las cosas que componen estrellas distantes, nebulosas, galaxias, cuásares, todo tipo de otra materia intergaláctica, incluyendo si los exoplanetas tienen enlaces terrestres atmosféricos composiciones.
Pero en lugar de ir por esa ruta del espacio exterior, me gustaría retomar aquí el punto que hice en Why This Matters, respecto a cómo resolver el problema del agotamiento del ozono es un hermoso ejemplo de lo importante que puede ser la política científica para hacer del mundo un lugar mejor. ¿Qué oportunidades de empleo hay en ese sentido? “Política científica” es un término amplio que puede aplicarse a una amplia gama de empleos y actividades, desde decidir cómo se financia la ciencia hasta cómo puede (o no) traducirse en productos comerciales, hasta cómo la ciencia impacta la salud humana hasta proteger la salud del medio ambiente. Los empleos que resultan de esta dirección suelen implicar una conexión con la política y Washington (si en Estados Unidos) pero no necesariamente tienen que hacerlo. Una forma de involucrarse es a través de becas, donde los estudiantes pueden interactuar con los formuladores de políticas en DC durante un verano o un semestre.
Hay una serie de opciones en este sentido, como el becario de Diplomacia AAAS (consulte https://www.aaas.org/programs/scienc...cy-fellowships), o becas en el Instituto de Política de Ciencia y Tecnología, o la Oficina de Política Científica y Tecnológica de la Casa Blanca (OSTP). Y luego, más allá de esas generales, hay muchas becas especializadas en política científica que van por el subcampo, como la American Geophysical Union Congressional Science Fellowship, o las diversas Subvenciones Marinas de la NOAA para políticas relacionadas con los océanos, o la Beca John Bahcall Public Policy para astronomía. Y muchos más.
Más allá de las becas hay toneladas de empleos por ahí, como en centros de políticas científicas, think tanks u otras organizaciones, desde la Unión de Científicos Preocupados, a la Corporación RAND, a la UNESCO, a la Federación de Científicos Americanos, al Centro para la Ciencia de Interés Público, a la Universidad centros como el Consorcio del Estado de Arizona para la política científica y los resultados. Estos son sólo unos pocos ejemplos —hay tantos más. Podrías involucrarte directamente con las agencias de financiamiento científico como la NSF, DOE o NIH (si te conviertes en gerente de programa en alguna de esas, llámame). La política científica es una parte increíblemente importante de lo que es la ciencia, en lo que puede llegar a ser y cómo se puede usar de la manera más efectiva, sabia y para el bien del mundo.
Práctica extra
1. ¿Cuál es la energía asociada con el estado fundamental en un ion litio?
- Contestar
-
\[E_n=-R_y \dfrac{Z^2}{n^2}=-13.6 \dfrac{3^2}{1^2}=-122.4 \mathrm{eV} \nonumber\]
2. Si una onda de luz tiene la misma magnitud de energía que el estado fundamental del litio, ¿cuáles son la frecuencia y longitud de onda de esta luz?
- Contestar
-
\ begin {reunió}
e=h\ nu=\ dfrac {h c} {\ lambda}\\
122.4 [\ mathrm {eV}] =\ dfrac {\ left (4.14 x 10^ {-15} [\ mathrm {eV}]\ right)\ left (3\ times 10^8 [\ mathrm {~m}/\ mathrm {s}]\ right)} (\ lambda [\ mathrm {m}])}\\
\ lambda=9.9\ times 10^ {-7} [\ mathrm {~m}]
\ fin {reunidos}
Conferencia 5: Dualidad Onda-Partículas y Mecánica Cuántica
Resumen
En este capítulo, continuamos nuestra discusión sobre la ionización. Restricimos nuestros ejemplos a la ionización de átomos de hidrógeno para utilizar el modelo de Bohr del átomo. Un electrón en el estado fundamental, o estado de energía más baja, de un átomo de hidrógeno tiene una energía de\(-13.6 \mathrm{eV}\). Por lo tanto, la energía de ionización de este electrón, o la energía requerida para liberarlo de la atracción nuclear y efectivamente transitarlo al nivel de energía\(\mathrm{n}=\infty\), es\(13.6 \mathrm{eV}\). La energía de ionización de un electrón en un átomo con número atómico se\(\mathrm{Z}\) puede encontrar con la siguiente fórmula:
\[\left.\Delta E_{\text {ionization }}=-13.6 Z^2 \quad \dfrac{1}{n_f^2}-\dfrac{1}{n_i^2}\right)(e V] \nonumber\]
La energía de ionización se puede pensar en términos del efecto fotoeléctrico de Einstein. En su experimento pionero, Einstein brilló luz (corrientes de fotones) de diferentes energías sobre losas de metal. Los fotones tuvieron que alcanzar un umbral mínimo de energía para ionizar los átomos metálicos. Tiene sentido que los metales con mayores energías de primera ionización puedan aferrarse mejor a sus electrones. En otras palabras, la luz con mayor frecuencia será necesaria para ionizar metales con mayores energías de primera ionización. La espectroscopia fotoelectrónica (PES) es una técnica de caracterización que consiste en ionizar materiales con fotones y medir las energías cinéticas de los electrones eliminados. La energía del estado unido de cada electrón eliminado se puede calcular encontrando la diferencia entre la energía del fotón entrante y la energía cinética resultante del electrón liberado.
El modelo de Bohr no pudo explicar la cuantificación de los niveles de electrones; se impusieron en el modelo, pero no se entendieron. A través de una serie de experimentos a principios del siglo XX, se demostró la dualidad onda-partícula. Esto significó que se demostró que las ondas de luz se comportaban como partículas, y se demostró que las partículas se comportaban como ondas. El más famoso de estos experimentos fue el experimento doubleslit, donde se demostró que los electrones actuaban como ondas y partículas. Louis de Broglie demostró que toda la materia actúa como una onda y tiene una longitud de onda correspondiente\((\lambda)\). Esta longitud de onda se puede encontrar usando la relación de Broglie, donde\(\mathrm{p}\) está el momento del objeto, que es igual a su masa por su velocidad, y\(\mathrm{h}\) es la constante de Planck:
\[\lambda=\dfrac{h}{p} \nonumber\]
Erwin Schrödinger, con La ecuación de Schrödinger, describió la relación entre la distribución espacial de una partícula ondulada y sus energías permitidas. En la ecuación de Schrödinger, la cuantificación es una consecuencia natural de resolver para una onda estacionaria. Esta función de onda\(\psi\) no tiene un significado físico directo, al menos que sepamos, pero su cuadrado\(|\psi|^2\) corresponde a la probabilidad de encontrar la partícula en cualquier ubicación dada. Resolver la ecuación de Schrödinger para un electrón en un átomo da un conjunto de funciones de onda que corresponden a los niveles de energía del electrón y las distribuciones de probabilidad espacial. Observe la diferencia dramática con respecto a la imagen de Bohr: ahora el electrón puede estar en cualquier lugar hay un distinto de cero\(|\psi|^2\) que está casi en todas partes. El concepto de posición exacta no se aplica en el mundo cuántico, ya que las partículas no pueden tener su posición e impulso especificados exactamente, de acuerdo con el Principio de Incertidumbre de Heisenberg.
Por qué esto importa
Apliquemos la ecuación de longitud de onda de Broglie a un electrón. Sabemos que la masa de un electrón es\(9 \times 10^{-31} \mathrm{~kg}\). Ahora pon el electrón en un campo eléctrico provocado por un voltaje de\(100 \mathrm{~V}\). Sabemos que esto hará que el electrón se acelere y gane algo de impulso. Específicamente, la energía del electrón es: carga* voltaje\(=\mathrm{e}^* \mathrm{~V}=100\) voltios\(* 1.6 \times 10^{-19}\) Coulombs\(=1.6 \times 10^{-17}\) Julios. Esto se debe a que la unidad voltios es igual a unidades de\(\mathrm{J} / \mathrm{C}\). Entonces ahora tenemos una energía del electrón acelerada a través\(100 \mathrm{~V}\), y de eso podemos obtener su velocidad,\(v 6 \times 10^6 \mathrm{~m} / \mathrm{s}\). A continuación podemos obtener su longitud de onda:\(\lambda=h / m v=6.6 \times 10^{-34} J^* s /\left(9 \times 10^{-31} \mathrm{~kg} * 6 \times 10^6 \mathrm{~m} / \mathrm{s}\right)\), que cuando nos damos cuenta de las unidades de\(J=[\mathrm{kg}]\left[\mathrm{m}^2\right] /\left[\mathrm{s}^2\right]\) vemos nos da\(\lambda=1.2 \times 10^{-10} \mathrm{~m}=0.12 \mathrm{~nm}\) para este electrón.
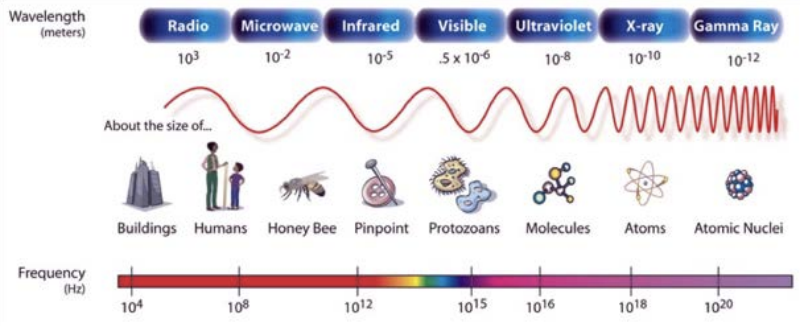
Esta cifra es de dominio público (creada por la NASA).
¿Recuerdas el espectro electromagnético del último capítulo? Eso es luz que cubre órdenes de magnitud de longitud de onda, solo una astilla de la cual se encuentra en el rango visible (400-750 nm). Pero para poder usar esta luz para ver las cosas, debemos usar una longitud de onda de luz que sea igual o menor en tamaño a lo que estamos tratando de ver. De lo contrario la luz simplemente no la recogerá (puedes consultar la física de la difracción para más información sobre esto, pero por ahora, puedes tomar mi palabra al respecto). La correlación entre el límite de lo que podemos ver y la longitud de onda de la luz que usamos para verlo es por lo que me gusta esta otra imagen del espectro electromagnético. En él se superponen ejemplos de objetos del tamaño de la longitud de onda dada. Si queremos usar un tipo de luz para ver, digamos, a un humano, entonces tendríamos que quedarnos en o por debajo de longitudes de onda de 1 m ya que los humanos son de aproximadamente 1 m de tamaño. Eso no significa que podamos ver en la región de microondas, pero eso es solo una limitación de nuestros ojos no de lo que es posible con un tipo de luz. Con mejores ojos que los nuestros, podríamos usar microondas para ver a la gente, pero no podríamos, por ejemplo, usar ondas de radio ya que tienen una longitud de onda más larga que la que estamos tratando de ver.
Ahora pasemos a la escala atómica: en la parte de rayos X del espectro, necesitaríamos usar rayos X o rayos gamma para ver objetos a esa escala. Pero resulta que no sólo nuestros ojos no pueden ver en esa parte del espectro, sino que incluso los dispositivos y detectores que hemos construido no pueden ver tan bien. Podemos tomar radiografías y hacerlo todo el tiempo, pero solo para ver imágenes en la resolución mm a diferencia de nm. Para esto último, necesitaríamos ver una radiografía reflejándose en un objeto del tamaño de nm y poder medirlo con precisión, algo que no somos capaces de hacer. Dicho esto, sí usamos rayos X para obtener información a escala atómica, pero eso es algo diferente todos juntos y tiene que ver con el espaciamiento entre átomos en los sólidos. Aprenderemos todo sobre eso más adelante en el semestre. Pero aquí todavía estamos tratando de “ver” realmente el objeto y el objeto es un átomo. No podemos usar rayos X, aunque estén en la longitud de onda correcta, y olvidarnos de los rayos gamma, porque son aún más difíciles de detectar. Pero, ¿qué más podríamos usar?
Por eso hicimos el cálculo de la longitud de onda del electrón para iniciar esta sección Por qué esto importa —usando el hecho de que un electrón es una onda, y al darle la velocidad correcta, podemos hacer que un electrón tenga exactamente la longitud de onda necesaria para ver en la escala atómica. ¡Los electrones pueden ser nuestra “linterna”! También resulta que son mucho más fáciles de capturar y usar para construir imágenes que las radiografías. Este descubrimiento puso en marcha todo el campo de la microscopía electrónica y cambió la forma en que vemos la materia. Fueron Don Eigler y Erhard Schweizer quienes demostraron en 1989 que al ver\(\mathrm{Xe}\) átomos individuales, podían disponer 35 de ellos para deletrear el logotipo de su compañía. Esta es definitivamente una forma cara de escribir un logotipo, pero el punto es que el logro realizó el sueño de Richard Feynman de poder poner un átomo donde quieras.
Hablando de Feynman, fue un científico increíble y un maestro magistral. Si quieres ver una conferencia increíble totalmente dedicada al experimento de doble hendidura, encuentra y mira el discurso de Feynman de 1959, “Hay mucho espacio en la parte inferior”, y no te arrepentirás. Aquí es donde planteó el sueño de poner átomos donde quieras, y esa fue realmente la primera visión del campo que ahora llamamos nanotecnología. La razón por la que tardó 30 años en realizar el sueño de Feynman es que estábamos trabajando en la oscuridad, literalmente. Si no puedes ver átomos y moléculas, es difícil controlarlos o al menos saber que algo que has hecho te llevó a un control a escala atómica que querías. Este tipo de control condujo a la revolución de la nanotecnología y fue completamente habilitado por la capacidad de los científicos para ver materiales a la escala nm, lo que como ahora sabe fue posible por la naturaleza de onda del electrón.
Por qué esto emplea
Es cierto que ponemos a los humanos en lo humano sin recurrir a la mecánica cuántica, evidencia de lo poderosa y útil que es la visión clásica del mundo. Pero para comprender verdaderamente el mundo, desde el átomo hasta los océanos y las montañas hasta el universo y la vida misma, se debe entender la naturaleza cuántica de todo ello y en algunos casos los efectos cuánticos dominan por completo. Los electrones y su interacción con la luz entran en esta categoría: sin una descripción cuántica no hay esperanza en explicar las interacciones que tienen lugar. Entonces hablemos de trabajos relacionados con los láseres.
La emisión estimulada (discutida por primera vez en un artículo de Einstein en 1917) implica la interacción entre un fotón y un átomo que tiene electrones en estado excitado. Si el fotón tiene justamente la longitud de onda correcta cuando golpea el átomo excitado, entonces el átomo emite un segundo fotón idéntico al primero. El LÁSER es “Amplificación de Luz por Emisión Estimulada de Radiación”, y es completamente y solo descrito por la mecánica cuántica ya que se basa en conocer los niveles de energías discretas de los electrones en el átomo. Y por cierto, cada vez que estás en línea, estás usando un láser ya que así es como la información viaja a través de cables de fibra óptica.
Hay tantas ofertas de trabajo para “ingeniero láser” que ni siquiera sería posible comenzar a enumerar (¡un sitio que acabo de verificar tiene más de 7000 anuncios!). La razón es que los láseres se utilizan hoy en día en todos los ámbitos de la vida. Hay trabajos con láseres en medicina, como en cirugía ocular, a la industria donde los láseres cortan y sueldan, a sistemas de rastreo para todo tipo de aplicaciones, a la investigación en nuevos tipos de espectroscopía, a tantos muchos más. Entonces, si quieres un trabajo que use la dualidad onda-partícula para hacer luz coherente, entonces ese es un primer paso increíble, pero el siguiente paso sería ser más específico.
Tome LIDAR como ejemplo: esto significa Detección y Alcance de Luz, que es un método de detección remota que utiliza pulsos láser para medir distancias. LIDAR ha revolucionado por completo la capacidad de los robots, como los autos autónomos por ejemplo, para ver. Está dentro de esas cajas voluminosas en la parte superior de un automóvil autónomo que gira continuamente, dando 360 grados de visibilidad, así como información de profundidad extremadamente precisa (a\(+/-2 \mathrm{~cm}\)). Todavía es caro (¡\(\$ 75 \mathrm{~K}\)un pop para los sistemas de cochera!) , pero por lo habilitante que es LIDAR, y cuánto crecerá la demanda de esta tecnología, hay muchas oportunidades de empleo. Estos van desde trabajos en empresas de grandes jugadores como Velodyne que ya está vendiendo sistemas a muchos mercados, hasta empresas más pequeñas que intentan innovar la tecnología como Luminar que promete un sistema\(\$ 500\) LIDAR del tamaño de una lata de refresco. Hay toda una gama intermedia, incluidas las propias empresas de automóviles autónomos como Waymo que han decidido construir sus propios sistemas LIDAR. Y este fue solo un pequeño ejemplo de la gran cantidad de oportunidades laborales basadas en láser.
Problemas de ejemplo
1. Se observan electrones de hidrógeno en transición de\(\mathrm{n}=3\) a\(\mathrm{n}=1\).
a) ¿Cuál es el cambio energético en esta transición? ¿Es absorción o emisión?
- Contestar
-
El electrón está cayendo a un estado de menor energía desde un estado de mayor energía, por lo que debe ser emisión.
\[\Delta E=-13.6 Z^2\left(\frac{1}{3^2}-\frac{1}{1^2}\right)=-12.09 \mathrm{eV} \nonumber\]
Podemos verificar nuestra intuición: dado que el valor energético que encontramos es negativo, la transición debe corresponder a la emisión.
b) ¿Qué color de luz observa?
- Contestar
-
\[\lambda=\frac{h c}{10.2[e V]}=1.22 \times 10^{-7} \mathrm{~m}=102.6 \mathrm{~nm} \nonumber\]
Esta transición es en la UV.
c) ¿Cuántas transiciones posibles podría caer un electrón\(=3\) para\(n=1\) completar? ¿Qué transición es responsable del color naranja?
- Contestar
-
Hay dos caminos posibles: directo de\(n=3\) a\(n=1\) o\(n=3\) a\(n=2+n=2\) a\(n=1\).
A continuación, calcule la longitud de onda de las tres posibles emisiones de fotones. Ya sabemos que de\(\mathrm{n}=3\) a\(\mathrm{n}=1\), la longitud de onda del fotón emitido fue\(102.6 \mathrm{~nm}\).
De\(\mathrm{n}=2\) a\(\mathrm{n}=1\):
\ begin {alineado}
&\ Delta E=-13.6 Z^2\ izquierda (\ frac {1} {2^2} -\ frac {1} {1^2}\ derecha) =-10.2\ mathrm {eV}\\
&\ lambda=\ frac {h c} {10.2\ mathrm {eV}} =1.22\ veces 10^ {-7}\ mathrm {~m} =122\ mathrm {~nm}
\ final {alineado}Esta transición también está en la UV.
De\(\mathrm{n}=3\) a\(\mathrm{n}=2\):
\ begin {alineado}
&\ Delta E=-13.6 Z^2\ izquierda (\ frac {1} {3^2} -\ frac {1} {2^2}\ derecha) =-1.89\ mathrm {eV}\\
&\ lambda=\ frac {h c} {1.89\ mathrm {eV}} =6.57\ times 10^ {-7}\ mathrm {~m} =657\ mathrm {~nm}
\ final {alineado}Esta transición corresponde a la luz naranja.
2. Un láser rojo, un láser verde y un láser azul brillan en diferentes piezas del mismo tipo de metal, y se configuran detectores para medir la presencia de electrones emitidos. Para el láser rojo, no se detectan electrones. Para el láser verde y el láser azul, se observan electrones volando del metal. ¿Cuál de las siguientes afirmaciones debe ser cierta?
i) El número de electrones emitidos por el metal usando el láser azul es mayor
ii) La energía cinética de los electrones emitidos por el metal usando el láser azul es la más alta
iii) El láser rojo conduciría a la emisión de electrones si se incrementara la intensidad del láser
- Contestar
-
ii) es cierto, porque la luz azul tiene mayor energía que la luz verde y roja, y la energía de los electrones emitidos es proporcional a la energía de los fotones que golpean la superficie metálica
i) y iii) son incorrectos porque el número de electrones está relacionado con el número de fotones = intensidad de luz, y la intensidad de la luz no afecta la energía de los electrones emitidos.
Conferencia 6: El orbitario atómico y los números cuánticos
Resumen
Una de las principales limitaciones del modelo de Bohr es que solo puede describir un átomo con un solo electrón. Para encontrar las propiedades de múltiples electrones en un átomo, es necesario resolver la ecuación de Schrodinger,\((K+V) \psi=E \psi\), donde\(\mathrm{K}\) está la energía cinética,\(\mathrm{V}\) es energía potencial\((-1 / r\) para un electrón en un átomo),\(\mathrm{E}\) es la magnitud total de la energía, y\(\psi\) es la ondafunción, u orbital del electrón. La solución a la ecuación de Schrodinger para un electrón en un átomo de hidrógeno tiene tres componentes separados:\(\psi=R(r) P(\theta) F(\psi)\). La forma completa de la forma de solución tiene tres grandes implicaciones:
1. Los electrones realmente no orbitan alrededor de los átomos, al menos en el sentido de que los planetas orbitan alrededor del sol. La solución a la ecuación de Schrodinger produce una función de onda, que al ser cuadrada, da una expresión\(|\psi|^2=1\) para la distribución de probabilidad de la ubicación del electrón en relación con el núcleo. Además, aunque cada electrón tiene algún radio es más probable que se encuentre, también existe la posibilidad de que esté mucho más cerca o mucho más lejos del núcleo. Por ejemplo, mientras que Bohr modela electrones con\(n=1\) vivo exactamente\(0.529 \AA\) desde el núcleo, la función de onda para un electrón real en el átomo de hidrógeno tiene una probabilidad ocupacional\(0.529 \AA\) máxima y manchada a ambos lados de ese valor. A medida que aumenta el número cuántico principal, aumenta el número de nodos -regiones prohibidas-, dando bandas distintas alrededor del átomo donde es probable que esté el electrón.
2. Cuatro números cuánticos son necesarios para describir completamente una solución particular. El número cuántico principal,\(n\) es el principal responsable del nivel de energía del electrón. Al igual que en el modelo Bohr,\(n\) puede tomar cualquier valor entero de 1 a infinito. A medida que\(n\) se hace más grande, la energía total se vuelve menos negativa (más grande). Un electrón se denomina equivalentemente como estar en el nivel de\(n^{t h}\) energía y la\(n^{t h}\) concha; los números cuánticos restantes describen subconchas. El número cuántico de momento angular\(l\),, es el principal responsable de la forma de la órbita. Los valores que\(l\) pueden tomar dependen de en qué caparazón se encuentre el electrón: el rango va de 0 a\((n-1)\). El número cuántico magnético,\(m_l\), es responsable de la orientación de la órbita en el espacio. Sus valores dependen de ambos\(n\) y\(l\), y el rango de\(m_l\) va de\((-l)\) a\((l)\). Finalmente, el número cuántico de espín,\(m_s\) puede tener uno de dos valores:\(+1 / 2\) o\(-1 / 2\), que se denomina equivalentemente arriba o abajo.
3. Los electrones que resuelven la ecuación de Schrodinger son distintos de los electrones de Bohr. Si bien solo hay un electrón por caparazón en el modelo de Bohr, la ecuación de Schrodinger da soluciones degeneradas: a medida que\(\mathrm{n}\) aumenta, cada vez hay más niveles orbitales. Además, el modelo de Bohr da un radio permitido fijo para que el electrón viva, mientras que la ecuación de Schrodinger da una distribución de probabilidad de que un electrón esté a una distancia dada del centro (¡y algunas zonas prohibidas!). Finalmente, aunque el modelo de Bohr solo podría describir el comportamiento de los átomos de un electrón, la ecuación de Schrodinger es mucho más amplia: puede describir la estructura electrónica de un átomo con cualquier número de electrones.
También discutimos cómo los valores para el número\(l\) cuántico obtienen los nombres de las letras\(\mathrm{s}, \mathrm{p}, \mathrm{d}\), y\(\mathrm{f}\) correspondientes a\(l=0,1,2,3\), respectivamente. Si decimos que un electrón está en el\(2 s\) orbital, entonces sabemos que corresponde a los números cuánticos\(n=2, l=0, m_l=0\), y el giro podría ser hacia arriba o hacia abajo. Se cubrieron otros ejemplos de conjuntos de números cuánticos y los orbitales correspondientes y estos orbitales de hidrógeno se mostraron como los bloques de construcción de la química. Eso es porque para describir un átomo y sus propiedades, llenamos estos orbitales desde la energía más baja hacia arriba, con el número de electrones\(\mathrm{Z}\) en el átomo. Esta ocupación sigue una tendencia general que es el tema de la siguiente conferencia, pero en esta cubrimos una regla muy importante: el Principio de Exclusión Pauli. Esta regla establece que no hay dos electrones que puedan tener el mismo conjunto de números cuánticos, lo que significa que dos electrones y sólo dos electrones pueden ocupar cualquier orbital dado.
Por qué esto importa
La rareza cuántica es una de las razones más importantes por las que la nanotecnología ha recibido tanta atención recientemente. Ahora bien, ha habido bastante prensa sobre la nanotecnología en las últimas dos décadas, pero uno de mis artículos favoritos de todos los tiempos apareció hace mucho tiempo en el Telegraph del Reino Unido: “Cómo las súper vacas y la nanotecnología harán que los helados sean saludables”. Siempre recuerdo esa pieza por la forma en que definen la nanotecnología: describen a una empresa como “experimentar con la nanotecnología, o la ciencia de cosas invisiblemente diminutas”. Supongo que me gusta esta cita por lo ridícula que es, ya que antes que nada hay muchos reinos diferentes de la ciencia y la ingeniería asociados a cosas diminutas que no podemos ver (la nanotecnología es una de ellas, pero ¿qué tal la física nuclear con sus quarks y gluones, o el viento solar con sus partículas de plasma caliente que llegan a nuestra tierra sólo para ser desviados por el campo magnético de nuestro planeta, ¿o la materia oscura?). En segundo lugar, me gusta esta cita porque pone de relieve —aunque incorrectamente— un atraco en el desarrollo de la nanotecnología, que no era poder observar lo que estaba sucediendo. Esto cambió una vez que pudimos usar los electrones como una forma de iluminar la materia, como se discutió en Why This Matters del capítulo pasado.
El punto principal es que la nanotecnología es muy prometedora. No tanto por las razones que le dieron fama a principios de la década de 2000 (el helado saludable es el menor, ¡ya se suponía que ya teníamos un elevador espacial!) , sino más bien por la química que está “bajo el capó” de la nanotecnología. ¿Qué significa la nanotecnología y por qué tenemos un nombre completo para ello? Respondamos a eso con un ejemplo directamente relacionado con la conferencia de hoy.
Imágenes de semiconductores a granel, pala de helado, punto cuántico © fuentes desconocidas.
Hemos estado hablando de orbitales de electrones en átomos y de cómo el orbital es la nube de probabilidad para el electrón. Bueno, ¿y si tomamos esa nube y la apretamos? O en otras palabras, confinarlo para que no pueda ocupar el mismo volumen que normalmente lo haría. Hay un nombre para eso: confinamiento cuántico. Y cuando confinamos las cosas cuánticas, como en este caso un electrón en un átomo, surgen nuevas propiedades. Toma el color como ejemplo. Para una pieza de material a granel, donde “a granel” aquí solo significa que no es de tamaño nanométrico, podría tener algo que es un poco aburrido ópticamente. Es sólo una pieza de material gris. Pero luego saco mi nano-helado-scooper y hago un pequeño pedazo del material. De pronto, sin cambiar nada excepto el tamaño, ¡puedo afinar el color a prácticamente lo que quiera!
El hecho de que cambiar el tamaño de este material nos permita afinar una determinada propiedad es bastante increíble. Imagínate si tomara una de esas tiras de metal de tu primera Goodie Bag y la rompiera en dos pedazos: no esperarías que cambiara el color del metal. Pero si pudieras romper solo un pequeño trozo de él, como uno con solo 10-20 átomos en él, entonces esa pieza cambiaría de color. ¿Qué tan raro es eso? Es a causa de que esta nube de electrones se quede sin bienes raíces cuando la cantidad de materia es lo suficientemente pequeña. Cuando es nanoescala, la nube de probabilidad confinada cambia la energía del electrón, lo que a su vez cambia el color del material. Hablamos de que los electrones cambian sus niveles de energía en átomos como una forma de absorber o emitir un fotón correspondiente a ese cambio de energía. Bueno aquí tenemos una nueva forma de cambiar los niveles inicial y final ellos mismos, simplemente cambiando el tamaño del material. Ese es un ejemplo de por qué el nano es tan importante.
La capacidad de controlar las propiedades de un material es uno de los fundamentos de nuestra era moderna. Como ya hemos aprendido, comprender la tabla periódica de los elementos y todas las diferencias entre el comportamiento de estos elementos dio a científicos e ingenieros el conocimiento de los ingredientes básicos que se utilizan para construir nuestro mundo. Ir nano es como agregar una dimensión completamente diferente a la tabla periódica: es como que cada elemento ahora puede hacer cosas nuevas, adquirir nuevas propiedades y ser utilizado en nuevas aplicaciones.
Por qué esto emplea
La computación cuántica ha recibido mucha atención recientemente, y por una buena razón. En la última década, hemos llegado al punto en que los bits cuánticos, o qubits, se pueden hacer y controlar experimentalmente. Las computadoras que usamos hoy manipulan la información en forma de bits individuales, que son los famosos 1 y 0 de los últimos 50 años. Pero en una computadora cuántica, los fenómenos mecánicos cuánticos de los que hemos estado aprendiendo en este capítulo se utilizan para manipular la información.
Son los qubits los que tienen la clave ya que esos son los guardianes de los estados cuánticos, que tienen números cuánticos al igual que los estados de electrones en un átomo. Cuando dos qubits interactúan entre sí obtenemos mucho más que solo 1's y 0's, en cambio obtenemos todas las superposiciones posibles. Es como poder aprovechar la nube de probabilidad como una nube informática donde todas las respuestas posibles se computan a la vez.
La computación cuántica es cada vez más grande y mucho más emocionante, ya que muchas empresas predicen computadoras cuánticas comerciales para 2025. La idea de Por qué esto emplea para esta conferencia es llevar esos estados cuánticos que acabamos de discutir y correr con ellos.. todo el camino al Laboratorio de Inteligencia Artificial de Google, o al equipo de IBM Q, o a D-Wave, o a la gente de Intel que trabaja en sus chips Qubit, o a cualquiera de las 63 empresas que cotizan actualmente en Wikipedia bajo “Empresas de todo el mundo dedicadas al desarrollo de la computación cuántica”. Una lista que está creciendo rápidamente. Y eso ni siquiera incluye investigar sobre este tema en un laboratorio aquí en el MIT:)
Problemas de ejemplo
1. Escribe los números cuánticos para cada electrón en un átomo de carbono neutro.
- Contestar
-
Nota: los signos de giro se seleccionan arbitrariamente, por lo que sería igual de correcto voltearlos todos. Para
\ (\ begin {array} {c|c|c|c}
\ mathrm {n} &\ mathrm {l} &\ mathrm {m} &\ mathrm {m} _s
\\ hline\ hline\ hline 1 & 0 & 0 &
1/2\\ 1 & 0 & 0 & 0 & -1/
2\\
2 & 0 & 0 & 0 & amp; 0 & -1/2\\
2 & 1 & -1 & 1/2\\
2 & 1 & 0 & 1/2
\ end {array}\)los\(2 \mathrm{p}\) electrones, deben tener el mismo giro debido a la regla de Hund.
Conferencia 7: Llenar la Tabla Periódica y Nuestro Primer Vínculo (es Iónico)
Resumen
El principio Aufbau es una herramienta utilizada para recordar el orden (típico) en el que las subconchas se rellenan en un átomo multielectrónico. Las interacciones de electrones complican qué subconchas se llenan primero: el blindaje y la penetración orbital afectan qué combinación de energía electrónica y forma (números cuánticos\(n\) y\(l\), respectivamente), es el siguiente estado más estable. El principio de Aufbau a menudo se representa visualmente. Aunque el principio Aufbau generalmente da el orden de que los electrones llenan las subconchas, no cuenta la historia completa. Anteriormente, aprendimos que cada orbital puede contener dos electrones: un giro hacia arriba y otro giro hacia abajo. También aprendimos que cada valor de\(l\), escrito aquí como\(\mathrm{s}, \mathrm{p}, \mathrm{d}\), y\(\mathrm{f}\), puede tener un número diferente de subshells en función de los valores permitidos de\(m_l\). La configuración electrónica de cualquier átomo se puede escribir usando estas pautas: por ejemplo, el potasio es\(1 s^2 2 s^2 2 p^6 3 s^2 3 p^6 4 s^1\). A menudo, la configuración electrónica se acorta para incluir solo el átomo de gas noble completamente ocupado más cercano y los electrones de valencia: en este caso, el potasio es [Ar]\(n= 4 s^1\).
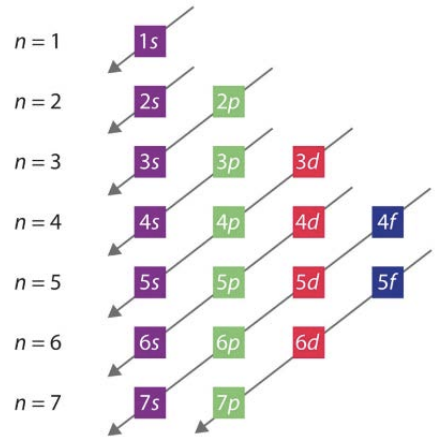
Cuando un átomo tiene sólo un caparazón parcialmente lleno, entra en juego la regla de Hund: todos los orbitales de la subcapa parcialmente llena deben estar ocupados individualmente antes de que alguno esté doblemente ocupado. Porque\(\mathrm{C}\), que tiene 6 electrones y configuración electrónica\(1 s^2 2 s^2 2 p^2\), la regla de Hund nos dice que los electrones se distribuyen como se muestra en el diagrama a continuación.
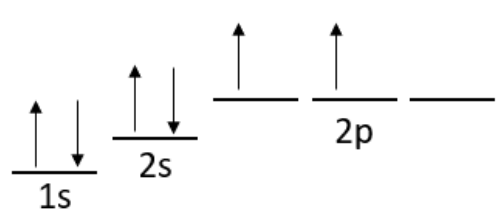
Si los elementos se organizan aumentando el número de electrones (y protones), empiezan a surgir tendencias periódicas, y el relleno de electrones explica la organización de la Tabla Periódica con bloques que corresponden a la subcapa que se está llenando. Los\(\mathrm{p}\) bloques\(\mathrm{s}\) - y -son elementos de “grupo principal” mientras que los del\(\mathrm{d}\) bloque son “elementos de transición” y “bloque f” son “elementos de transición internos”. Un número cuántico principal mayor\(n\) corresponde a orbitales más grandes y, por lo tanto, átomos más grandes: a partir de esto, podemos predecir que el radio atómico debería aumentar un período en la tabla periódica. Por otro lado, tener más protones tira electrones hacia el átomo, por lo que el radio atómico se hace más pequeño yendo de izquierda a derecha a través de una fila. Si un átomo pierde un electrón, su radio disminuye: este tipo de átomo se llama “catión”. Del mismo modo, si un átomo gana un electrón, el “anión” es más grande.
Finalmente, aprendimos que los enlaces iónicos son la atracción electrostática entre dos iones con carga opuesta: se forman por la transferencia de uno o más electrones entre los iones. La fuerza de un enlace iónico se puede aproximar mediante una interacción de Coulomb:\(E=k Q Q / r\). Si la distancia entre dos átomos unidos iónicamente es mayor, ¡el enlace generalmente será más débil! Con sólo observar el tamaño de los iones que componen el enlace, podemos inferir mucha información sobre el sólido iónico correspondiente.
Por qué esto importa
Acabamos de hacer nuestro primer vínculo en\(3.091\), ¡y es fuerte! Echa un vistazo a esta tabla de energías de celosía (in\(\mathrm{kJ} / \mathrm{mol}\)) para un montón de sólidos iónicos. El rango de fuerza de enlace iónico abarca un orden de magnitud en esta tabla, pero incluso el sólido más débil listado (yoduro de potasio,\(\mathrm{KI}\), at\(649 \mathrm{~kJ} / \mathrm{mol}\)) sigue siendo realmente fuerte con una temperatura de fusión de\(681^{\circ} \mathrm{C}\).
El sólido iónico más fuerte listado en esta tabla es el óxido de aluminio, formado al combinar\(2 \mathrm{Al}\) átomos por cada 3\(\mathrm{O}\) átomos (esto equilibra la carga con el\(\mathrm{Al}\) ser\(3^+\) y el\(\mathrm{O}\) ser\(2^-\)). El óxido de aluminio se funde a la friolera\(2,072{}^{\circ} \mathrm{C}\), y es ampliamente utilizado por su dureza y resistencia. Por ejemplo,\(\mathrm{Al}_2\mathrm{O}_3\) se utiliza como abrasivo, incluyendo como un sustituto mucho menos costoso del diamante, y en muchos tipos de papel de lija o herramientas de corte. Debido a su fuerza, se usa como aditivo en muchas aplicaciones, ¡incluida la pasta de dientes! Para este momento de Por qué importa, me gustaría centrarme en una necesidad no satisfecha más que en una solución establecida. Este es un problema donde un material más duro con las propiedades adecuadas y en la estructura correcta podría cambiar millones de vidas.
La hemodiálisis es un proceso para purificar la sangre de una persona que tiene riñones que no funcionan correctamente. Un paciente típico tendrá que ir 3 veces a la semana, sentarse en una silla que se ve así durante aproximadamente 4 horas por sesión, totalizando 600 horas de su tiempo y un costo de\(\$ 80,000\) someterse a hemodiálisis, y este número ha ido creciendo de manera constante en los últimos 30 años. Se espera que, a medida que aumente la incidencia de enfermedades cardiovasculares como la diabetes y la hipertensión, también crezca la población de individuos que necesitan diálisis. Esa máquina a la izquierda de la silla en la imagen es una máquina de hemodiálisis. Durante el proceso, la sangre se extrae del cuerpo a través de un punto de acceso en la vena de un paciente, y se pasa a través de la máquina que elimina toxinas y exceso de líquidos, después de lo cual la sangre filtrada es devuelta al cuerpo a través de otro punto de acceso de nuevo a la circulación. He aquí por qué importa esto.
Si esa máquina pudiera reducirse a un tamaño mucho menor y hacerse portátil, entonces los pacientes podrían hacerlo en casa o mientras viajan o donde quiera que estén, lo que mejoraría seriamente su calidad de vida. Pero los filtros actuales no funcionan lo suficientemente bien como para que el dispositivo sea pequeño y portátil, por lo que las personas que necesitan tratamiento de hemodiálisis están atascadas. Es decir, a menos que se pueda inventar un nuevo filtro, uno que satisfaga tres criterios clave: 1) el material debe ser biocompatible, 2) debe permitir la filtración selectiva para que pueda eliminar algunas cosas pero no otras, y 3) debe proporcionar una filtración eficiente y rápida. Dicho filtro no existe actualmente. Los filtros actuales son membranas porosas a base de celulosa con un tamaño de poro altamente variable, lo que significa que la selectividad molecular es difícil de controlar. Los poros en los filtros actuales también se superponen mucho, haciendo caminos tortuosos que ralentizan el movimiento del fluido, aumentando la cantidad de tiempo que tarda la sangre en fluir. Los filtros actuales se obstruyen fácilmente, son delicados y difíciles de limpiar, así que en el mejor de los casos son de un solo uso y en el peor de los casos se obstruyen tanto tan rápido que incluso lograr un solo uso es difícil.

Imagen de filtro de alúmina por Assaud, L. et al. Revista Beilstein de Nanotecnología 5 (2014): 162-72. Licencia: CC BY.
Aquí podemos considerar los fuertes enlaces iónicos que aprendimos en esta conferencia. Aquí hay una imagen de un nuevo filtro hecho de\(\mathrm{Al}_2 \mathrm{O}_3\). Observe de la barra de escala que los poros son muy pequeños, solo 10 s de nanómetros de diámetro. También están alineados en la misma dirección (por lo que ninguno de ese flujo tortuoso ralentiza las cosas), lo que significa que el flujo a través de ellos será rápido y eficiente. Y tenga en cuenta que los poros son todos aproximadamente del mismo tamaño, lo que le da al filtro la capacidad de rechazar bruscamente las toxinas objetivo. Y claro, ya que es un sólido iónico fuerte, este filtro se puede limpiar de manera muy agresiva con prácticamente cualquier producto químico de limpieza o tratamiento térmico que te importe arrojarle. Todavía queda mucho trabajo por hacer, como reducir el costo de hacer tales filtros, y todavía son un poco frágiles, ¡pero en general los sólidos iónicos tienen un tremendo potencial como filtros de próxima generación!
Por qué esto emplea
Ese ejemplo de un nuevo tipo de filtro ultra resistente es solo uno de los muchos donde se necesitan nuevos materiales de alta resistencia. Y no es solo el material en sí sino también la forma en que se procesa. Y debido a lo mal que se necesitan nuevos materiales resistentes, muchas de las compañías químicas más grandes como Dow, Saint-Gobain, BASF, Sinopec, LG Chem, Arkema o Mitsubishi Chemical, por nombrar solo algunos de los gigantes (todos estos tienen ventas anuales en los\(\$ 10\)'s de miles de millones.
Y todas estas empresas cuentan con grandes equipos que trabajan en la fabricación de materiales de alta resistencia. A veces es acero de alta resistencia, a veces es plástico, y por supuesto otras veces, materiales iónicos. Todas estas empresas tienen ofertas de trabajo, pero una excelente manera de explorar el interés profesional es hacer prácticas, y todas estas empresas también tienen prácticas para estudiantes. Podrías ir directamente al sitio web de la empresa, o también podrías consultar los recursos que tenemos aquí en el MIT. Hay muchos de ellos.
Por ejemplo, echa un vistazo a la página web capd.mit.edu, donde si haces clic en “Empleos y pasantías” obtendrás todo tipo de apoyo y recursos. Definitivamente vale la pena echarle un ojo!
Problemas de ejemplo
1. Clasifique los siguientes átomos en términos de tamaño, energía de ionización y electronegatividad:
\(\mathrm{Ge}\)\(\mathrm{Rb}\)\(\mathrm{Sn}\)\(\mathrm{I}\)
- Contestar
-
A medida que el periodo aumenta por debajo de la tabla periódica, los electrones están cada vez más protegidos del núcleo, por lo que aumenta el tamaño atómico. Adicionalmente, a medida que el número de grupos aumenta a través de la tabla periódica, cada vez hay más protones y por lo tanto aumenta la atracción desde el núcleo, por lo que el tamaño atómico disminuye.
(más pequeño)\(\mathrm{Ge}\)\(\mathrm{I}\)\(\mathrm{Sn}\)\(\mathrm{Rb}\) (más grande)
2. A continuación se muestra un espectro PES para los electrones externos de un elemento misterioso. Etiquetar los ejes y la dirección del aumento de la energía de ionización.
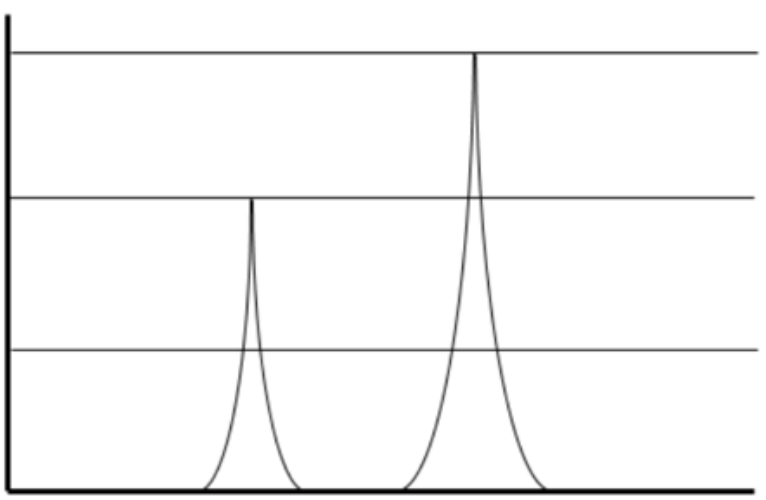
a) Si la configuración de los electrones internos del elemento misterioso es la misma que el neón, identifique el elemento.
- Contestar
-
Fósforo: su configuración electrónica es\([\mathrm{Ne}] 2 \mathrm{~s}^2 3 \mathrm{p}^3\)
b) Por separado, mientras tomaba espectros PES para carbono al vacío, el sello de la máquina de vacío se rompió y dejó entrar un gas desconocido. Se observa lo siguiente en el espectro contaminado:
i. Hay 6 picos totales (incluyendo los picos de carbono)
ii. Cinco picos tienen la misma altura
iii. Un pico es tres veces mayor que los otros
¿Cuál es el elemento contaminante? Explica tu razonamiento.
- Contestar
-
La configuración electrónica del carbono es\(1 \mathrm{~s}^2 2 \mathrm{~s}^2 2 \mathrm{p}^2\). Dado que hay 2 electrones en cada caparazón, estos tres picos deben tener la misma altura. Por lo tanto, los picos adicionales deben pertenecer a\(1 \mathrm{~s}^2 2 \mathrm{~s}^2\)\(2 \mathrm{p}^6\), ya que uno de los picos es tres veces mayor que el resto. El gas contaminante es\(\mathrm{Ne}\).
Conferencia 8: Iones, ionización y valencia
Resumen
En esta conferencia continuamos nuestra discusión sobre la energía de ionización. Vimos que, de manera similar\(\mathrm{Li}\) y\(\mathrm{Be}\) en la última conferencia, la energía de ionización para los elementos a lo largo de los periodos (de izquierda a derecha en la tabla periódica) en el\(\mathrm{d}\) bloque\(\mathrm{p}\) y aumenta debido a un mayor número de protones que conducen a una mayor atracción nuclear. Tiene sentido que se necesite más energía para liberarlos. Por otro lado, al bajar los grupos (de arriba a abajo en la tabla periódica) la energía de ionización disminuye debido a que el aumento de blindaje y distancia desde el núcleo es más significativo que el aumento de la atracción nuclear debido a los protones añadidos.
La razón para aumentar las energías de ionización para los electrones más cercanos al núcleo es que estos electrones están más estrechamente unidos. Por ejemplo, la primera energía de ionización de Li es 5.4\(\mathrm{eV}\), mientras que su segunda energía de ionización es 122\(\mathrm{eV}\). Este segundo electrón experimenta menos blindaje que el primero. Esta información de energía de ionización se puede ver en una gráfica de Espectroscopia Fotoelectrónica (PES). Esta es una gráfica que muestra la energía de ionización versus la intensidad relativa para un elemento dado. PES implica brillar suficiente energía en un átomo para ionizar todos sus electrones, medir su energía cinética, siendo la diferencia igual a cuánta energía estaba ligado el electrón. El PES es una técnica simple y poderosa para medir directamente la ocupación de electrones.
Otra tendencia periódica discutida fue la afinidad electrónica, o el cambio en la energía que acompaña a un electrón adicional. Los halógenos (grupo 17 en la tabla periódica) tienen la mayor afinidad electrónica, debido a que un electrón adicional resultaría en un octeto completo y relleno completo de la subcubierta. La afinidad electrónica aumenta a lo largo de los periodos de la tabla periódica hasta los halógenos.
Esta conferencia también expuso la idea de los electrones de valencia. Estos son los electrones que ocupan orbitales más allá del núcleo de gas noble lleno más alto. Por ejemplo, el carbono y el silicio tienen ambos 4 electrones de valencia. El núcleo de gas noble con mayor llenado de carbono es [\(\mathrm{He}\)], mientras que el de silicio es [\(\mathrm{Ne}\)]. Los electrones de valencia son los que impulsan los enlaces químicos. Los electrones de valencia en los átomos se representan usando diagramas de puntos de Lewis, que son los símbolos químicos de los elementos con puntos que los rodean que representan los electrones de valencia. Las estructuras de punto de Lewis son útiles para visualizar la regla del octeto, que establece que los átomos (ignorando los metales de transición por ahora) están en su estado de energía más bajo y más estable con 8 electrones en su valencia.
En esta conferencia comenzamos a aplicar Lewis Dot Structures a los enlaces iónicos. Los cationes se representan con signos más en su esquina superior derecha, y aniones con signos negativos, como se muestra a continuación.
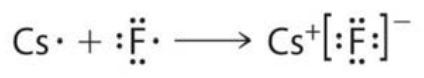
Por qué esto importa
En esta conferencia, nos hemos estado enfocando en átomos que pierden o ganan electrones, también llamados iones. Ahora discutiremos cómo se relaciona este tema con las soluciones de energía renovable.
Echa un vistazo a esta trama de la demanda de electricidad (en azul) vs. suministro de electricidad de un parque eólico (en rojo), registrada en un periodo de dos meses y medio en 2013 en Dinamarca. Observe que por el lado de la demanda, hay cierta variabilidad, pero también hay mucha regularidad. La semana laboral de 5 días consume más energía que los fines de semana, y la cantidad de energía necesaria en realidad no varía mucho de una semana a otra. Ahora contrasta eso con el suministro de electricidad de un parque de turbinas eólicas. Incluso si pones las turbinas en un área de viento conocida, todavía hay una gran cantidad de variabilidad. La energía eólica no es tan cara de producir, pero el mayor desafío no es el costo, es la estabilidad del suministro. Si piensas en cómo construir suficiente de este tipo de oferta poco confiable para satisfacer la demanda constante, ¡necesitarías sobreconstruir la capacidad por un factor de al menos 10 (e incluso eso no sería suficiente en algunos días)! Eso por supuesto no va a ser económicamente factible, así que la solución real, si queremos expandir cuánta energía obtenemos de las energías renovables intermitentes como la eólica y la solar, es poder almacenar la energía para cuando sea necesaria. Si tenemos almacenamiento confiable, entonces el suministro puede ser bastante poco confiable y aún así podríamos satisfacer una demanda constante, siempre y cuando en promedio la oferta pueda satisfacerla.
Una de las formas más fáciles de almacenar energía es empujar algo por una colina y luego dejar que vuelva a bajar. Empuja una pelota por una colina y luego sosténgala ahí, y cuando quieras recuperar la energía potencial almacenada como energía cinética, simplemente déjala ir. Bombeamos agua por colinas, llamadas “hidroeléctricas bombeadas”, que actualmente es una de las únicas tecnologías viables que puede escalar hasta el tamaño (significado, potencia) de las redes eléctricas reales. Una cantidad masiva de agua se bombea cuesta arriba de una colina cuando hay exceso de suministro de energía, y luego retrocede para girar una turbina para generar electricidad cuando hay exceso de demanda. Si bien se trata de una solución de almacenamiento relativamente barata, hay todo tipo de problemas con la ampliación más allá de lo que es hoy, principalmente por la baja energía que obtenemos de la energía gravitacional y, por lo tanto, cuánta tierra se requiere. Hay un gran post que explica por qué será difícil aumentar la hidroeléctrica bombeada como tecnología de almacenamiento de energía en dothemath, que es un sitio genial en general si no lo has visto: https://dothemath.ucsd.edu/2011/11/p...p-the-storage/.
Entonces, ¿qué más podemos bombear una colina para almacenar energía? ¡Aquí es donde entran en escena nuestros iones! Los iones son el ingrediente clave en las baterías. Piense en una batería como una colina electrónica, y cuando la batería está cargada los iones se están bombeando. Los cationes en particular, como\(\mathrm{Li}+\), se empujan hacia arriba por la colina de energía, y el estado de menor energía (abajo en el fondo de la colina) sería uno en el que pueda recuperar ese electrón y volverse neutral nuevamente. Cuando el circuito está cerrado, el catión cae por la colina de energía para encontrarse con el electrón, que recorre el circuito haciendo trabajo en el camino. En este caso en lugar de trabajos mecánicos como el agua, el electrón está haciendo trabajo eléctrico directamente. Esta es una de las grandes ventajas del almacenamiento electroquímico (una buena manera de decir una batería), es decir, que estamos almacenando directamente el tipo de energía que mayormente necesitamos, la energía eléctrica. La energía mecánica o térmica almacenada posteriormente a menudo necesita ser convertida en eléctrica con una gran pérdida de eficiencia.
Pero, ¿qué tan buenas son las baterías hoy, en serio? ¿Podrían utilizarse alguna vez para almacenar las cantidades masivas de energía que se necesitan en “escalas de red”? Como referencia, Estados Unidos usa 3 TW en promedio, o\(3 \times 10^{12}\) Watts\(= 3 \times 10^{12}\) Julios/segundo de energía, por lo que se tiene una idea de lo que significa estar a la escala de la cuadrícula. Asegurémonos de que estamos directamente en energía vs. potencia: un vatio es un julio/segundo que es energía por tiempo, que es potencia. Esa es una métrica importante ya que necesitamos poder acceder a la energía a un ritmo dado. La cantidad total de energía es poder multiplicado por el tiempo, así que para Estados Unidos si nuestro consumo de energía promedio como nación lo es\(3 \mathrm{TW}\), entonces nuestro uso diario de energía es\(72 \mathrm{TW}\) -horas (TWh) y nuestro uso anual de energía lo es\(26,280 \mathrm{TWh}\). Solo para darte una idea de lo grande que es este número, una batería AAA típica almacena aproximadamente un solo Wh de energía. Eso significa que si quisiéramos almacenar las necesidades de energía de Estados Unidos, ¡todo lo que necesitaríamos hacer es construir una instalación de almacenamiento que contenga baterías\(26,280,000,000,000,000\) AAA! Por si te lo estás preguntando, eso es aproximadamente un millón de veces el número de baterías AAA que se venden en Estados Unidos cada año.
Y ahí radica el problema con las baterías, es decir, su baja densidad energética. Pero como espero que estés viendo en esta clase, tales problemas suelen ser oportunidades para que la química entre y marque una diferencia que cambia el juego.
Esta figura muestra la energía por peso frente a la energía por volumen para algunos materiales de almacenamiento diferentes. Tenga en cuenta que las baterías están en la parte inferior izquierda, lo cual no es tan bueno. Puedes ver por qué la gasolina es tan única: tiene una densidad energética muy alta tanto en peso como en volumen, y además de eso es segura y fácil de transportar y extremadamente barata. La competencia es dura.
Un litro de gasolina almacena 33 megajuulos (\(\mathrm{MJ}\)) de energía, o alrededor de 9\(\mathrm{kWh}\) si prefieres esas unidades. Ese litro cuesta alrededor de un dólar. Ahora llévate un Profesor del MIT, quien puede sacar alrededor de 60\(\mathrm{W}\) o 60\(\mathrm{J/s}\) en un buen día. Esto significa que el profesor puede generar la misma cantidad de energía que en un litro de gasolina,\(33 \mathrm{MJ}\), en aproximadamente 153 horas. Dado el salario promedio de un profesor del MIT de\(\$ 10 / \mathrm{hr}\), costaría\(\$ 1530\) obtener la energía del profesor. En comparación con\(\$ 1\) a punto de obtener la misma cantidad de energía almacenada de la gasolina. Las baterías necesitan comenzar a parecerse mucho más a la gasolina y mucho menos a un profesor del MIT si van a ser tecnologías competitivas de almacenamiento de energía a escala de red.
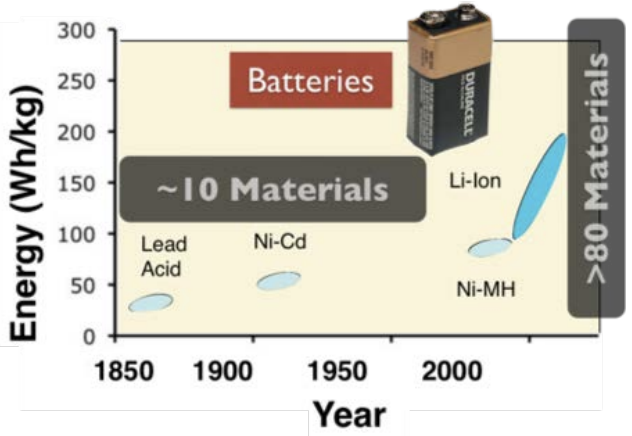
La buena noticia es que ya ha habido un avance tremendo en apenas los últimos 10-20 años. Consulta esta gráfica de densidad energética vs. año para baterías. Observe el avance muy lento durante unos 150 años, con una duplicación de la densidad energética que ocurre aproximadamente cada 60 años. Entonces la pendiente del progreso cambia, y la razón es simple: la química. Específicamente, las rápidas mejoras están sucediendo porque hemos llegado a una era en la que podemos hacer colinas de energía para iones con muchos más tipos de materiales que nunca. He agregado a la trama el número de materiales de los que están hechos los cátodos: históricamente solo se usaron alrededor de 10 materiales catódicos diferentes durante esos primeros 150 años de ritmo lento, pero ahora podemos y hacemos cátodos con más de 80 materiales diferentes, y el número está creciendo a la semana. Esta posibilidad de explosión de materiales se debe a una comprensión más profunda de los iones y a la nueva capacidad de diseñar materiales con paisajes energéticos más eficientes para que los atraviesen. Entonces sí, hay mucho trabajo por hacer para que las baterías sean competitivas en el almacenamiento de energía a escala de red, pero es el momento absolutamente maduro para hacerlo.
Por qué esto emplea
El conocimiento de iones puede conseguirte todo tipo de trabajos. Pero como me enfoqué en el campo de la batería en Why This Matters, centrémonos en ese mismo tema aquí. El mercado global de baterías ya es enorme y su crecimiento proyectado es impresionante. Aquí hay un gráfico de un informe de Deutsche Bank de 2016 que muestra el crecimiento proyectado a corto plazo en la producción de baterías por parte de algunas de las principales empresas que fabrican baterías. Todas estas empresas están contratando a miles y miles de científicos e ingenieros, tecnoeconomistas (¡predecir tendencias tecnológicas no es fácil!) , expertos en empaque y diseño mecánico, y mucho más, todo para trabajar en diversos aspectos de una cosa: el ion. Y hay muchos más trabajos que eso. Las grandes compañías de baterías como las que figuran en la tabla están invirtiendo fuertemente en la contratación de personas para trabajar en baterías, pero también lo son las pequeñas empresas. Y también lo son muchos los equipos de investigación en las universidades, que están sacando empresas a partir de nuevos conceptos.
No solo hay muchas químicas de baterías diferentes que han existido por un tiempo y se están mejorando enormemente, desde iones de litio hasta níquel-metal-hidruro y plomo-ácido, sino que también hay tantas direcciones emocionantes completamente nuevas para las baterías. Todas estas futuras tecnologías de baterías involucran empleos, y aunque es difícil enumerarlos todos debido a lo mucho que ha crecido el campo, aquí hay algunas direcciones interesantes que las empresas están siguiendo:
- Ánodos a base de silicio (reemplazando al grafito actualmente utilizado) que aumentarían la densidad de energía en un factor de 3
- Uso de nanocables metálicos en el electrolito para evitar averías, haciendo que la batería dure 10 o 100\(\mathrm{x}\) más
- Hacer que el electrolito sea sólido en lugar del líquido actual, lo que haría que la batería fuera más estable y permitiría tiempos de carga mucho más rápidos •
- Lanzar grafeno a la batería ya que, de todos modos, ¿qué problema no puede resolver el grafeno? (ok, pero con toda seriedad, se ha demostrado que el grafeno permite una carga/descarga mucho más rápida)
- Fabricación de baterías con metales de espuma
- Hacer que las baterías sean plegables (delgadas como el papel pero que no se rompan) y también se puedan extender
- Baterías de aire de aluminio que han demostrado un alcance de 1,100 millas en un automóvil eléctrico
- Alimentar la carga de baterías con diversos medios, desde señales wi-fi (no inalámbricas inductivas, que es otra cosa), hasta ultrasonidos, hasta aminoácidos, hasta orina. ¡Baterías hechas de sodio, zinc, azufre, magnesio y tantos otros materiales!
- Hacer baterías que nunca se incendiarán
Problemas de ejemplo
1. Elija el átomo más grande entre los siguientes pares:
a)\(\mathrm{Rb}, \quad \mathrm{Rb}^+\)
- Contestar
-
\(\mathrm{Rb}\)es más grande, porque tiene una cáscara adicional\(\left(\mathrm{Rb}^{+}\right.\) pierde su\(5 \mathrm{~s}^1\) electrón)
b)\(\mathrm{Rb}^+, \quad \mathrm{Kr}\)
- Contestar
-
\(\mathrm{Kr}\)es más grande, porque tiene un protón menos que\(\mathrm{Rb}^{+}\), por lo que el núcleo tira menos de los electrones
2) Dibujar las estructuras de punto Lewis de\(\mathrm{FeCl}_3\) y\(\mathrm{MgF}_2\).
- Contestar
-
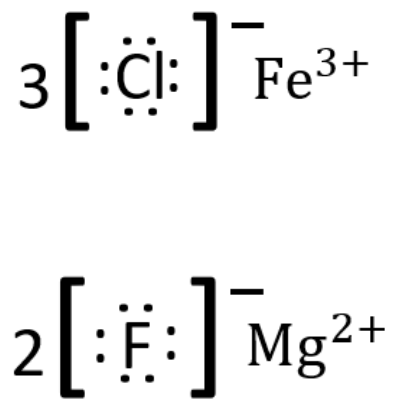
Conferencia 9: Estructuras de Lewis, enlaces covalentes y resonancia
Resumen
Los enlaces covalentes se crean a través del intercambio de electrones en lugar de a través de la atracción electrostática entre cationes y aniones, como enlaces iónicos. Los electrones compartidos en enlaces covalentes logran un estado de energía más bajo y más estable al interactuar con dos núcleos en lugar de uno. Las estructuras de punto de Lewis representan los dos electrones en un enlace covalente con líneas, como se muestra\(\mathrm{H}_2\) a la derecha.
- Conectar átomos, centrales a menudo menos electronegativos
- Determinar el número total de electrones de valencia
- Colocar par de electrones de unión entre átomos adyacentes
- Comenzando con átomos terminales, agregue electrones a cada uno para formar octeto (2 para\(\mathrm{H}\))
- Si sobran electrones, colóquelos en el átomo central
- Si el átomo central no ha alcanzado el octeto, use pares solitarios de los átomos terminales para formar múltiples enlaces al átomo central para lograr el octeto
Es posible tener más de una estructura de Lewis que no valore la regla del octeto. Para estas instancias, calculamos el cargo formal. La suma de la carga formal debe ser igual a la carga global sobre la molécula o ión. Para calcular el cargo formal, siga estos pasos:
- Los electrones no enlazantes se asignan al átomo en el que están ubicados.
- Los electrones de unión se dividen por igual entre los átomos unidos.
- Entonces, la carga formal se puede computar para cada átomo de la siguiente manera:
\[\text { formal charge }=\text { valence } e^{-}-\left(\text {nonbonding } e^{-\prime} s+\frac{\text { bonding } e^{-\prime} s}{2}\right) \nonumber\]
Además de la estabilidad, la carga formal nos habla de la electronegatividad de la estructura: los átomos con carga formal negativa deberían ser más electronegativos y aquellos con carga formal positiva menos electronegativos.
También es posible tener dos estructuras Lewis diferentes con la misma carga formal. Esto indica que la molécula real es una combinación de sus estructuras de resonancia más estables, como ocurre con el ejemplo de ozono en clase, donde tenemos en promedio 1.5 enlaces a cada lado del oxígeno central.
También discutimos el concepto de polaridad, una medida de cómo los electrones desiguales se comparten entre dos átomos en un enlace. En los enlaces covalentes no polares, los electrones se comparten por igual, como en\(\mathrm{H}_2\).
En los enlaces covalentes polares, la compartición es desigual. La electronegatividad\((\chi)\), la tendencia de un átomo a atraer un par compartido de electrones hacia sí mismo, puede ser utilizada como medida de polaridad en un enlace. En un enlace completamente no polar, los dos átomos tendrán electronegatividades idénticas, es decir\(\Delta \chi=0\). En un fuerte enlace iónico, hay una gran diferencia en las electronegatividades. En\(\mathrm{CsF}\), usando la escala de Pauling,\(\Delta \chi=3.98-.79=3.19\).
Por último, nombramos algunas formas en que se puede romper la regla del octeto. Algunos elementos, como el boro, pueden tener menos de 8 electrones. Otros, como el azufre, pueden tener un octeto expandido.
Por qué esto importa
Hablando de la\(\mathrm{CO}_2\) molécula y sus cargas formales y estructura estable, ese es el foco de este Why This Matters. Hagamos esto de antemano: después de un siglo y medio de experimentos y recolección de datos, la comunidad científica ha establecido con enorme consenso que las emisiones de dióxido de carbono son la principal causa del cambio climático. Otras teorías como los ciclos solares o la actividad volcánica no se correlacionan con los cambios de temperatura observados, y ahora solo hay una explicación consistente para el aumento de las temperaturas globales y nuestro clima cambiante: los gases antropogénicos de efecto invernadero, liderados por el dióxido de carbono.
Por cierto, si alguien (digamos, no sé, ¿un político?) iban a decirte algo así como: “Hay tremendo desacuerdo en cuanto a si la tierra es redonda. Se debe fomentar el debate sobre la forma de la tierra -en las aulas, los foros públicos y los salones del Congreso”, llamarías a tal observación ya sea olvido o mentira. Este es el mismo tipo de mentira contada por mucha gente sobre los hechos del cambio climático. Una gran parte de la cobertura mediática se enfoca en cómo definir tales “hechos alternativos”, pero categorizar la observación está fuera del punto. Independientemente de cómo lo llamemos, este tipo de afirmaciones es una amenaza para los fundamentos mismos de la ciencia, para el argumento basado en la razón, y por lo tanto para la sociedad. Los políticos pueden vivir en un mundo “post-hecho”, pero los científicos no, y no pueden. No hay “ciencia post-hechos”.
Ok, volvamos a nuestra molécula. ¿Por qué esta molécula en particular es tan importante para el cambio climático y el calentamiento global? \(\mathrm{CO}_2\)se llama un “gas de efecto invernadero” por su capacidad para absorber la radiación infrarroja, que a su vez calienta el planeta. Echa un vistazo a la trama de intensidad de la radiación solar que golpea el planeta en función de la frecuencia, de Why This Matters en la conferencia 4. El amarillo es lo que golpea la atmósfera superior y el rojo es lo que golpea la superficie terrestre, por lo que la diferencia entre las curvas amarilla y roja es donde se está absorbiendo parte de esa energía solar. Las moléculas pequeñas en la atmósfera, como el ozono, el agua y el dióxido de carbono, son las que absorben esa energía solar entrante. Se puede ver dónde\(\mathrm{CO}_2\) está absorbiendo, hacia la derecha en la parte infrarroja del espectro, mientras que el ozono está sobre a la izquierda en la UV, y el agua está en todas partes. Es la fuerza de absorción de IR lo que hace que un gas de efecto invernadero sea\(\mathrm{CO}_2\) tan efectivo.
Acerca\(25 \%\) de la radiación solar que golpea la tierra (así\(25 \%\) del rojo integrado en la trama) se refleja de nuevo hacia el universo. Pero lo que se refleja no es lo que se absorbe: en cambio, la mayor parte de la energía que se refleja está en la longitud de onda más larga, parte infrarroja del espectro. Ya que\(\mathrm{CO}_2\) absorbe eficientemente en esa parte, actúa como una manta, evitando que se escape parte de esa energía reflejada y redirigiéndola de nuevo a la atmósfera y superficie. Esta manta nos mantiene en un ambiente acogedor\(15^{\circ} \mathrm{C}\) en lugar de\(-18^{\circ} \mathrm{C}\), que es lo que sería la temperatura promedio en la tierra si toda esa energía solar reflejada pudiera escapar.
Como un aparte, el término “gases de efecto invernadero” es un nombre un poco confuso que lamentablemente se ha quedado atascado. El efecto de absorber radiación de longitud de onda larga sobre la temperatura del planeta no tiene nada que ver con los efectos del calentamiento en un invernadero utilizado para cultivar plantas, este último confiando principalmente en evitar que la convección del aire lleve el calor.
Aquí está la conexión de regreso a nuestras estructuras de Lewis y carga formal. Esa absorción eficiente de\(\mathrm{CO}_2\) en el infrarrojo mencioné, que está directamente relacionada con cómo vibran los átomos en la molécula. El fotón es absorbido porque se transfiere a energía vibratoria, por lo que la forma específica en que los átomos se mueven alrededor es extremadamente importante para qué fotones puede absorber y con qué eficiencia lo hace. Si la\(\mathrm{CO}_2\) molécula tuviera un triple enlace y un enlace sencillo, que es una estructura de Lewis válida pero con mayor carga formal, entonces sus patrones de vibraciones cambiarían drásticamente en comparación con el caso de doble enlace más estable (con carga formal\(=0\)), lo que a su vez la haría mucho menos eficiente para absorber toda la energía infrarroja!
Por qué esto emplea
La conferencia de hoy ha sido sobre el enlace covalente, una manera conveniente de representarlo con estructuras de Lewis, y lo que podemos aprender sobre las moléculas de estas estructuras. Es difícil encontrar un trabajo en cualquier campo de la ingeniería o ciencia que no requiera al menos algo de comprensión del enlace covalente ya que es tan omnipresente. Esto también hace que sea difícil concentrarse en un mercado laboral específico para Por qué esto emplea. Por eso voy a enfocarme mucho hacia un solo material —el carbono— y los trabajos que podrías encontrar relacionados con sus enlaces covalentes.
En algunas conferencias estaremos aprendiendo sobre orbitales moleculares y como ejemplo verás cuán flexible puede ser el carbono en su entorno de unión. Es uno de los elementos más flexibles en todo el PT ya que le gustan los enlaces simples, dobles y triples, así como cualquier cosa intermedia (léase: estructuras de resonancia y deslocalización). Escojamos una de las muchas formas en las que el carbono toma para enfocarnos aquí: el anillo aromático. El término aromático sí tiene su origen en el hecho de que las moléculas aromáticas pueden tener una fragancia dulce para ellas, pero de hecho el benceno —la molécula aromática clásica— no tiene ese olor. En cambio, la forma en que se usa el término en química es que los electrones en un anillo de carbono han bajado su energía deslocalizando (¡sí, estructuras de resonancia!). La mayoría de las veces esto ocurre para un anillo que tiene enlaces simples y dobles alternantes, que luego forman un promedio sobre sus estructuras de resonancia. El benceno es el ejemplo clásico de esto, ya que es el anillo aromático más simple que uno puede hacer.
Y probablemente hayas oído hablar del benceno antes, pero lo que quizás no sepas es cuántas formas se puede modificar el benceno para hacer o hacer algo útil. Consulte esta tabla de solo una fracción muy pequeña de derivados de benceno, donde el anillo tiene alguna adición (s) para darle una propiedad o funcionalidad específica. Esta variación masiva de la química de una sola molécula es posible en gran parte debido a ese enlace covalente que hace el carbono.
Muchos materiales que encontramos a diario son fabricados a partir de derivados del benceno. El poliestireno, por ejemplo, es un polímero formado al conectar moléculas de estireno entre sí, y cada año se producen miles de millones de kilogramos de poliestireno. Entonces, ciertamente los trabajos en empresas que involucran la fabricación, el reciclaje o la utilización de plásticos como el poliestireno están relacionados (estoy pensando en un puesto de químico senior en BASF, una empresa de fabricación química, por ejemplo). Pero los usos de los derivados del benceno van mucho más allá de los plásticos. Por ejemplo, las industrias utilizan benceno para fabricar resinas, nylon y muchas fibras sintéticas diferentes, así como lubricantes, cauchos, tintes, detergentes, medicamentos y pesticidas. Toma la medicina como otro ejemplo: aquí está la molécula de acetaminofén (Tylenol), ¡es un derivado del benceno!
Por lo que la industria farmacéutica también es un gran lugar para tomar su conocimiento del benceno (estoy pensando en Johnson y Johnson, Pfizer, Novartis, etc.). Estas empresas invierten miles de millones y miles de millones de dólares cada año para financiar investigaciones sobre el desarrollo y las pruebas de nuevos medicamentos, muchos de los cuales tienen en su núcleo una estructura resonante de Lewis.
Problemas de ejemplo
1. Dibujar la resonancia\(\mathrm{CHO}_2^{~-}\) y asignar cargas formales a cada átomo.
- Contestar
-
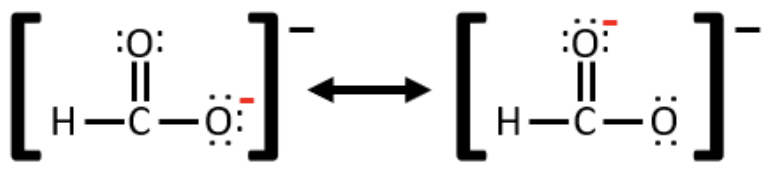
2. Verdadero o falso: La siguiente imagen muestra dos estructuras de resonancia de una molécula
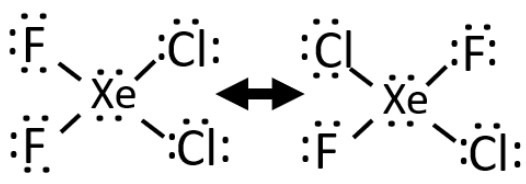
- Contestar
-
Falso. Las dos estructuras no son estructuras resonantes porque los átomos se mueven alrededor.
Lectura adicional
Conferencia 1: Introducción y química de la tabla periódica
• Historia de los átomos (no probados):
https://courses.lumenlearning.com/trident-boundless-chemistry/chapter/history-of-atomic-structure/
• Reacciones de equilibrio y reactivo limitante:
Conferencia 2: Contar átomos y organizar los elementos
• El peso molecular y molar:
https://opentextbc.ca/chemistry/chapter/3-1-formula-mass-and-the-mole-concept/
• Más información sobre carreras en ciencias de los alimentos y química agrícola:
Conferencia 3: El descubrimiento del electrón y la estructura del átomo
• Revisión de isótopos:
• Receta de pudín de ciruela (no probada):
https://www.epicurious.com/recipes/food/views/superb-english-plum-pudding-20010
Conferencia 4: El modelo Bohr y las transiciones electrónicas
• Más sobre la Radiación del Cuerpo Negro, cuantificación y un video genial sobre el efecto fotoeléctrico:
• Resumen de los espectros de emisión y absorción:
• Ciencia en contexto: Einstein y otros científicos destacados huyeron de la Alemania nazi (no probados):
https://physicstoday.scitation.org/do/10.1063/PT.6.4.20180926a/full/
Conferencia 5: Dualidad Onda-Partículas y Mecánica Cuántica
• Más sobre la dualidad onda-partícula y el átomo cuántico:
• Espectroscopia fotoelectrónica:
Conferencia 6: El orbitario atómico y los números cuánticos
• Números cuánticos:
https://courses.lumenlearning.com/cheminter/chapter/quantum-numbers/
• La Ecuación de Schrodinger y la Partícula en una Caja (no probada):
http://hyperphysics.phy-astr.gsu.edu/hbase/quantum/schr.html
• Curso de mecánica cuántica:
https://www.youtube.com/watch?v=qO_W70VegbQ&list=PL8dPuuaLjXtN0ge7yDk_UA0ldZJdhwkoV e index=45
• Introducción a la Mecánica Cuántica por David J. Griffiths, disponible aquí o en su biblioteca local del MIT:
Conferencia 7: Llenar la Tabla Periódica y Nuestro Primer Vínculo (es Iónico)
• Configuraciones electrónicas:
• Tendencias periódicas:
https://opentextbc.ca/introductorychemistry/chapter/periodic-trends-2/
• Vínculos iónicos:
https://www.youtube.com/watch?v=zpaHPXVR8WU
Conferencia 8: Iones, ionización y valencia
Espectroscopia Fotoelectrónica (PES):
Conferencia 9: Lewis Structures
• Dibujo de Diagramas de Punto Lewis: Práctica extra:
http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html
• Tutorial en video:


