5.2: CHEM ATLAS_2
- Page ID
- 80082
Cómo Conecta Esto: Unidad 2, Conferencias 10-20
Conferencia 10: Formas de Moléculas
Resumen
Esta conferencia se centró en el modelo Valence Shell Electron Pair Repulsion (VSEPR). Este modelo nos permite predecir las formas de las moléculas, un precursor para comprender mejor sus propiedades. VSEPR se basa en la repulsión de electrones, y da las estructuras más estables como las que minimizan estas repulsiones. Para encontrar la representación VSEPR de una molécula, siga estos pasos:
- Escribir estructura de Lewis
- Clasificar cada par de electrones como de unión o no unión
- Maximizar la separación entre dominios
- Dar más espacio a los dominios no enlazantes y a los dominios de unión con un orden de enlace más alto
Un par de unión (BP) de electrones es cualquiera de dos electrones que participan en un enlace. Un doble enlace está compuesto por 2 BP, y un triple enlace está compuesto por 3 BP. Un par solitario (LP) de electrones es cualquiera de dos electrones que no forman parte de un enlace. La fuerza de repulsión entre pares de electrones, en orden ascendente, va de la siguiente manera: BP-BP, BP-LP, LP-LP. Además, la repulsión de una sola PA es menor que la de 2 BP o 3 BP.
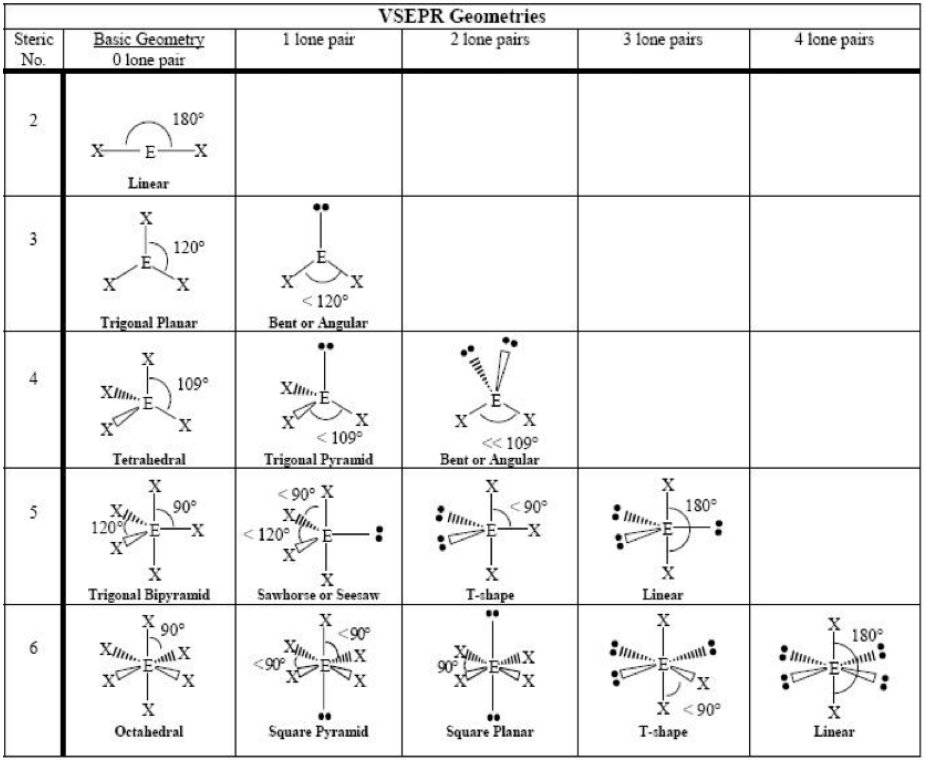
Geometrías VSEPR por Química Boundless. Licencia: CC BY-SA. Este contenido está excluido de nuestra licencia Creative Commons. Para más información, consulte https://ocw.mit.edu/fairuse.
Por qué esto importa
El humano promedio puede discriminar entre 4,000 y 10,000 olores diferentes. (Antes de que nos entusiasmemos con lo increíble que es eso, ¡considera que un perro puede oler entre 10 y 100 mil veces mejor que un humano!). Pero, ¿qué es el olor, desde una perspectiva química? El gusto y el olfato están relacionados, y pensar en lo que hay detrás de ellos se remonta a los antiguos griegos. Nada menos que nuestro amigo Demócrito (¡atomismo!) especuló que el sabor de una sustancia se debía a la forma de sus partículas componentes. Pensó que las partículas ácidas serían afiladas, ya que sentían que atacaban tu boca, mientras que las cosas dulces estaban hechas de bonitas formas tiernas y suaves. Si bien su razonamiento era bastante sencillo, la idea de que el gusto y el olfato se regían por la forma era asombrosamente profusa.
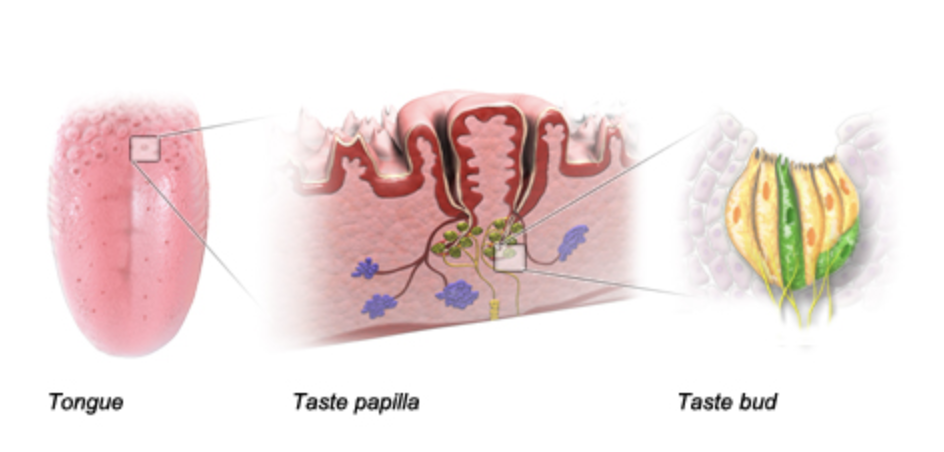
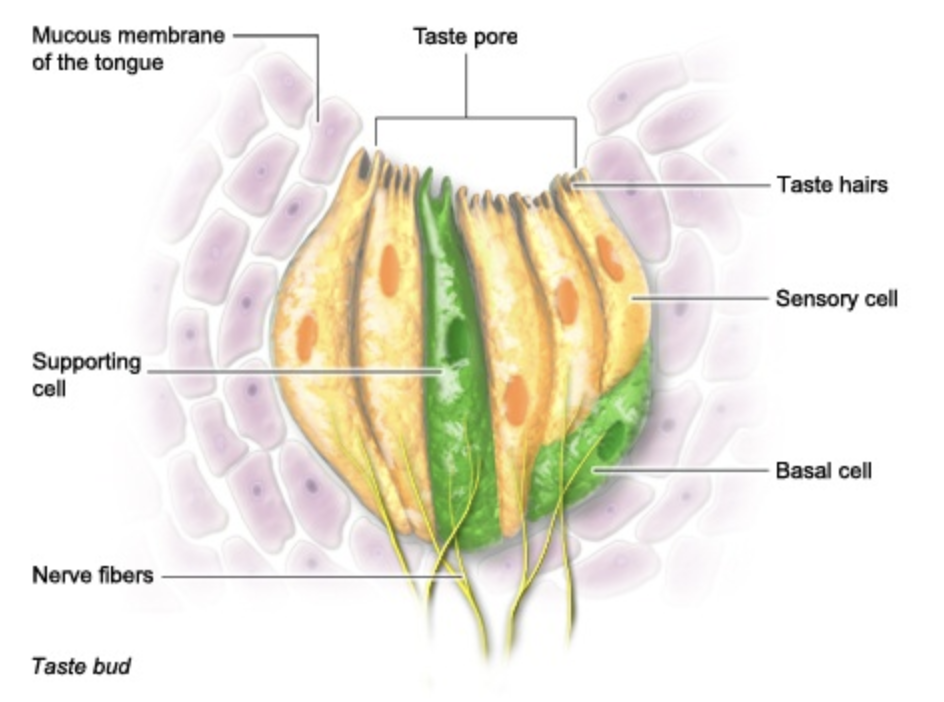
Avance rápido 2500 años y ahora sabemos que la capacidad de saborear y oler funciona a través de “sitios receptores” en la lengua y la nariz. Aquí está la lengua descompuesta, mostrando el sitio receptor a la derecha, y debajo de eso hay una vista más amplia del sitio receptor con varias partes etiquetadas. Tenga en cuenta que el sitio receptor también es lo que llamamos una papilla gustativa. Las señales que se envían desde este sitio receptor al cerebro a través de las fibras nerviosas determinan lo que se sabe, y la señal depende profundamente no sólo de la composición de la molécula en sí, sino también de su forma.
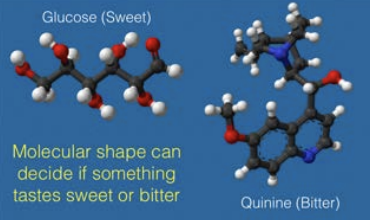
Echa un vistazo a las dos moléculas a continuación, glucosa que sabe dulce y quinina que sabe amarga. Sus químicas son diferentes y la forma en que la química de la molécula se une a la célula sensorial es crucial, pero la forma en que la forma encaja en el poro mismo e impacta la orientación de la molécula en la célula sensorial puede ser igualmente importante. Si no conociéramos las formas de estas moléculas, las escribiríamos como simples estructuras 2D de Lewis, ¡pero son esas formas 3D que ves en la figura las que distinguen sus gustos!
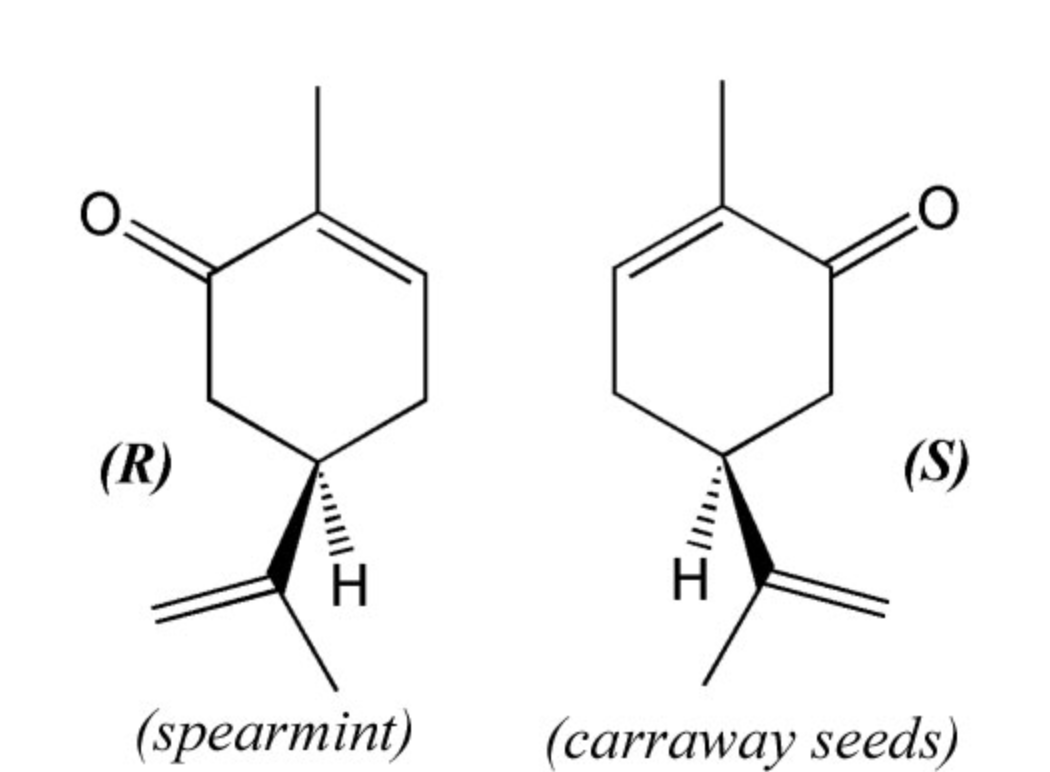
En el caso de la molécula de carvona, o\(\mathrm{C}_{10}\mathrm{H}_{14}\mathrm{O}\), tenemos un ejemplo aún más llamativo del papel de la forma en el olfato. Esta molécula forma dos imágenes especulares, denotadas\(\mathrm{R}\) y\(\mathrm{S}\) en la siguiente figura. La\(\mathrm{R}\) forma huele a menta verde mientras que la\(\mathrm{S}\) forma huele a semillas de alquitrán. Misma química exacta, forma diferente, olor diferente. Muchas moléculas pueden tomar dos formas como esta con simetría especular pero que no son lo mismo, y tales pares se llaman enantiómeros. En realidad, más allá de las moléculas, los enantiómeros pueden ser cualquier cosa. Tus manos, por ejemplo, son enantiómeros. Si los sostienes uno frente al otro verás que tienen simetría de espejo, y si intentas rotar uno alrededor del otro verás que no puedes superponerlos. Por esta razón, la propiedad de tener simetría especular pero no superponible se llama mano, o quiralidad. El hecho de que los dos enantiómeros sean percibidos como de olor diferente muestra que esas células receptoras deben contener grupos quirales, lo que les permite responder más fuertemente a un enantiómero que al otro. Así, tanto para la molécula que se olía como para las moléculas utilizadas para hacer el olfato, ¡la forma molecular es la clave!
Por qué esto emplea
Ya es hora de que hablemos de enzimas. Estas son moléculas, a menudo proteínas, plegadas en una específica (¡y complicada!) forma, que aceleran las reacciones químicas en tu cuerpo. Las enzimas son absolutamente esenciales para tantas funciones cruciales de nuestro cuerpo, incluyendo la respiración, la digestión, la función muscular y nerviosa, y muchas más. En la digestión, ¡el papel de una molécula enzimática puede acelerar una reacción necesaria en un factor de un millón de veces! Eso te permite digerir tu cena en horas en lugar de, bueno, mil años.
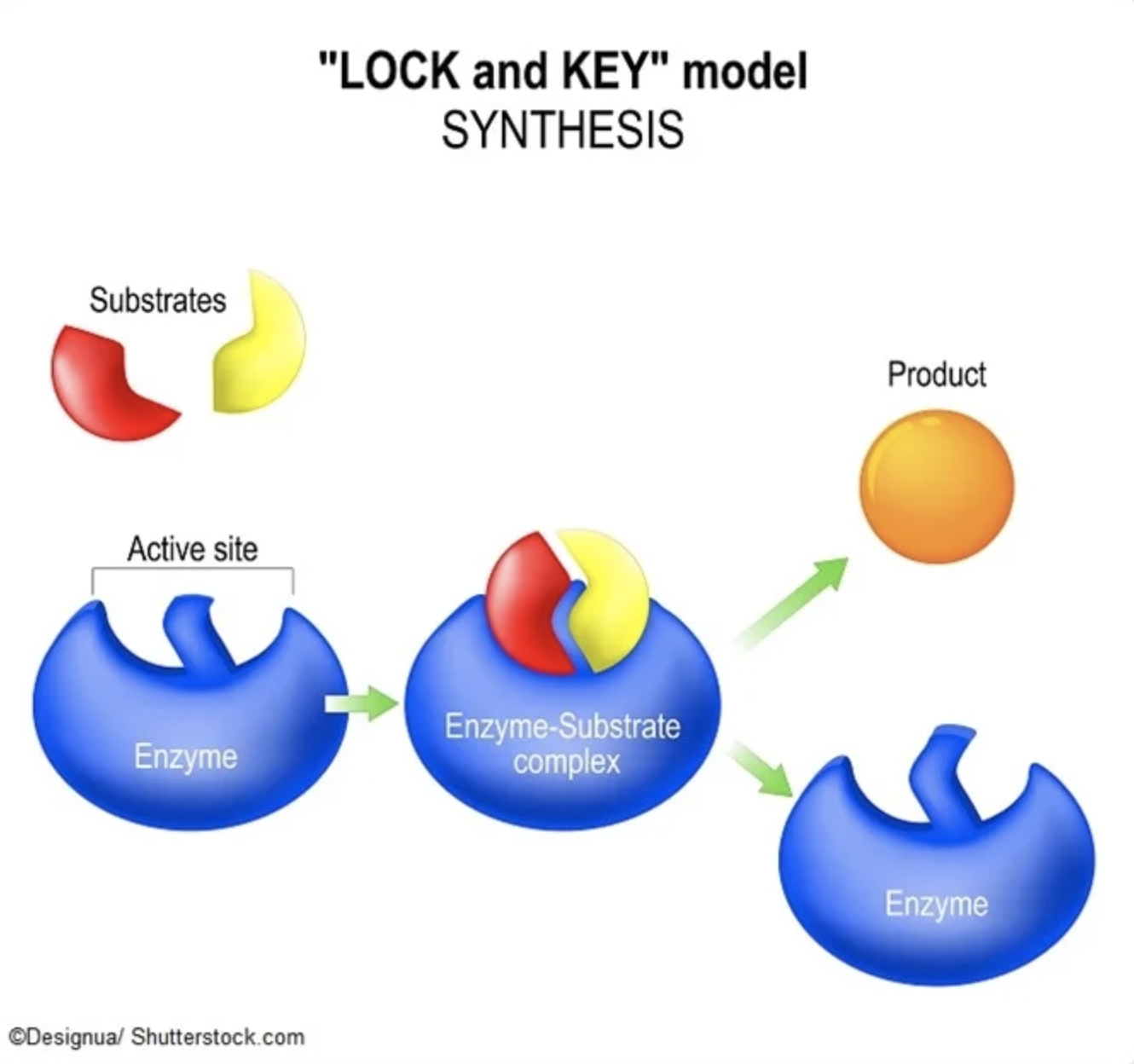
Las enzimas funcionan uniéndose a las moléculas de una manera específica, y es posible que ya hayas adivinado que la forma es crucial. De hecho, ya en 1894 fue el premio Nobel Emil Fischer quien ideó el modelo de “cerradura y llave” para explicar cómo funcionan las enzimas. La idea en este modelo es más o menos cómo suena: el sitio activo de una enzima es una forma específica, y solo el sustrato encajará en él, como una cerradura y una llave. Aquí hay una caricatura para ilustrar cómo la enzima encaja perfectamente, por su forma, en un sustrato, dándole al sustrato el poder de hacer que las reacciones sucedan más rápido (también llamada catálisis). El modelo se ha actualizado en los últimos 100 años, por ejemplo para incluir el hecho de que el sustrato y la enzima en sí son dinámicos y pueden cambiar de forma cuando interactúan, o que los efectos del solvente circundante son importantes, pero la característica clave de que la forma es crucial sigue siendo el principio fundamental sobre el cual operan las enzimas.
Como habrás notado con solo ir a la tienda de abarrotes, hay un gran mercado para nuevos alimentos con nuevas enzimas. Hay tantas enzimas involucradas en la digestión, como las lipasas que ayudan a digerir las grasas en las tripas. La amilasa ayuda a convertir los almidones en azúcares. La maltasa rompe la maltosa de azúcar en glucosa (está en papas, pasta y cerveza, por ejemplo). La tripsina descompone las proteínas en aminoácidos. La lactasa descompone la lactosa, el azúcar en la leche, en glucosa y galactosa, y así sucesivamente. Lo que me lleva al mercado laboral: aquí, específicamente a la industria alimentaria. La síntesis y el uso de nuevas enzimas en la preparación de los alimentos han visto un tremendo crecimiento no sólo en la digestión sino también en el sabor y textura de los alimentos, así como posibles beneficios económicos. Hay muchos trabajos relacionados con la ciencia de los alimentos (consulta este artículo en las páginas de NatureJobs, que es un sitio genial por si no lo has visto: https: //www.nature.com/naturejobs/ciencia/articles/10.1038/nj7422 - 149a? wt.ecid = NatureJobs - 20121106). Pero los trabajos relacionados con las enzimas que tienen que ver con la comida también se relacionan con el futuro de la humanidad misma. ¿Cómo alimentaremos a nuestra población en el futuro? ¿Será necesario que todas las proteínas sean de origen vegetal? ¿O comeremos carne de insectos? ¿O carne cultivada en un laboratorio? ¿Los alimentos serán impresos en 3D y serán servidos por robots? Todos estos temas han recibido recientemente una gran cantidad de atención, financiamiento para la investigación, llevado a nuevas empresas y mucho interés de empresas más grandes, y todo eso significa empleos. Específicamente, trabajos que involucran conocimiento sobre enzimas, que al final solo funcionan por su forma (¡VSEPR!).
Problemas de ejemplo
1. Dibuje la estructura de Lewis\(\mathrm{H}_2 \mathrm{~N}-\mathrm{SH}\) y determine la geometría de VSEPR alrededor de (a) el átomo de nitrógeno y (b) el átomo de azufre.
- Contestar
-
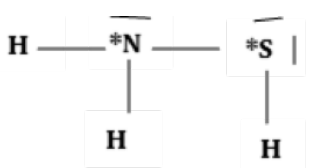
a) Geometría alrededor del átomo de nitrógeno: piramidal trigonal
b) Geometría alrededor del átomo de azufre: doblado
2. Determine la geometría VSPER para cada una de las siguientes opciones y prediga si cada una será polar o no polar
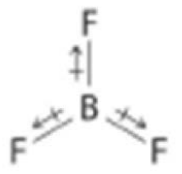
a)\(B F_3\)
- Contestar
-
\(B F_3\): Diferencia en electronegatividad N-F: enlaces polares. Planar trigonal: ¡cancelan los dipolos! No polar
b)\(F O F\)
- Contestar
-
\(FOF\): Diferencia en\(\mathrm{O}-\mathrm{F}\) electronegatividad: momento dipolo: polar
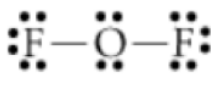
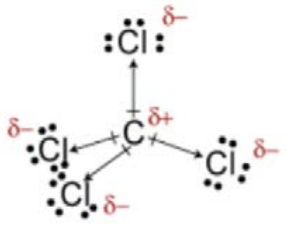
c)\(\mathrm{CCl}_4\)
- Contestar
-
\(\mathrm{CCl}_4\): Diferencia en\(\mathrm{C}-\mathrm{Cl}\) electronegatividad: momentos dipolares; estructura tetraédrica: cancelar, ¡así que no polar!
Conferencia 11: Orbitales Moleculares
Resumen
La teoría orbital molecular es una herramienta utilizada para predecir la forma y el comportamiento de los electrones que se comparten entre átomos. Se suman dos o más orbitales atómicos para hacer una combinación lineal de orbitales atómicos, el método LCAO, lo que permite caracterizar rápidamente los tipos de enlaces formados entre dos átomos.
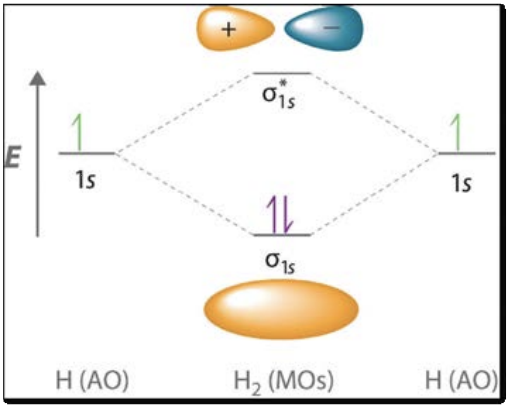
Cuando se agregan orbitales atómicos, pueden interferir constructivamente, formando un enlace, o pueden interferir destructivamente, formando un estado antiunión. En una molécula, el estado de unión es siempre menor en energía que el orbital atómico correspondiente, mientras que el estado antiunión es siempre mayor. Los diagramas orbitales moleculares, o\(\mathrm{MO}\) diagramas, son una herramienta de visualización conveniente para ver cómo se distribuyen los electrones entre dos átomos: el hidrógeno se muestra a la derecha como ejemplo.
Los dos\(1 \mathrm{~s}\) orbitales de hidrógeno se combinan para formar un\(\sigma_{1 s}\) enlace, que es menor en energía y por lo tanto más estable. Si hubiéramos comenzado con helio, habría habido cuatro electrones para distribuir: dos formarían un\(\sigma_{1 s}\) enlace, pero los otros dos irían en el estado\(\sigma_{1 s} *\) antiunión, cancelando efectivamente el enlace.
Después de colocar electrones en el\(\mathrm{MO}\) diagrama, se puede calcular el orden de enlace:
\(B O=\dfrac{1}{2} \text { ( of } \mathrm{e}^{\prime} \text { in bonding orbitals }-\mathrm{e}^{\prime} \text { in anti-bonding orbitals) }\)
Los bonos más fuertes tienen órdenes de bonos más altas, y la orden de fianza debe ser\(>0\) para que exista un bono en absoluto. Para nuestro ejemplo anterior, un dímero de hidrógeno tiene\(\mathrm{BO}=1\), pero un dímero de helio tiene\(\mathrm{BO}=0\). Esto explica por qué el gas hidrógeno existe como\(\mathrm{H}_2\), ¡pero el gas helio consiste en átomos individuales!
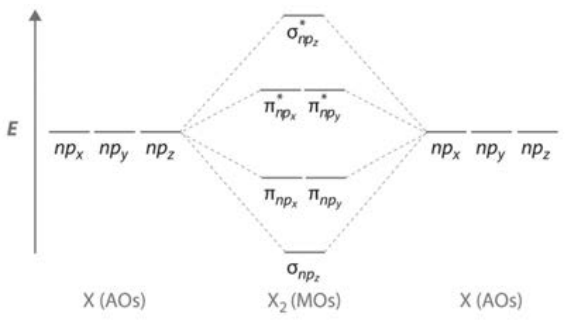
Si un átomo tiene orbitales p así como orbitales s, se pueden formar enlaces adicionales llamados enlaces. Los tres dominios orbitales p producen tres tipos de enlaces, uno\(\sigma\) y dos:\(\sigma_{n p z}, \pi_{n p x}\), y\(\pi_{n p y}\), donde\(\mathrm{n}\) se refiere al nivel de energía particular que se está considerando. Tenga en cuenta que el\(\sigma\) enlace se forma tanto para el solapamiento\(\mathrm{s}\)\(\mathrm{p}\) orbital como para uno de los solapamientos orbitales: el término\(\sigma\) enlace significa que el enlace tiene simetría cilíndrica alrededor del eje del enlace, algo que no es el caso para los enlaces. Antiadhesión\(\sigma^*\) y\(\pi^*\) estados también forman desde\(\mathrm{p}\) -orbitales\(\mathrm{MO}\) s. Un\(\mathrm{MO}\) diagrama genérico para\(\mathrm{p}\) -orbitales se muestra a la izquierda.
\(\mathrm{MO}\)s también se pueden formar a partir de dímeros heterogéneos: se aplican las mismas reglas. Dado que cada uno de los átomos tiene distintos niveles de energía asociados con sus\(\mathrm{s}\) - y\(\mathrm{p}\) -orbitales, el\(\mathrm{MO}\) diagrama formado usando dos átomos diferentes suele estar sesgado, y los enlaces que resultan son enlaces covalentes polares. El átomo que es más electronegativo es menor en energía. Puede ser útil contar el número de electrones en los orbitales atómicos iniciales y asegurarse de que todos se utilicen al llenar el\(\mathrm{MO}\) s. Recuerde que si un dímero está cargado positivamente, ha perdido un electrón, y si está cargado negativamente, ha ganado un electrón: estos tienen que ser contabilizados para también! Si uno de los átomos tiene más electrones que el otro, como un enlace entre\(\mathrm{H}\) y\(\mathrm{Cl}\), los electrones en exceso forman pares no enlazantes, al igual que los pares solitarios en los diagramas de Lewis que dibujamos antes. Si todos los electrones del\(\mathrm{MO}\) diagrama están emparejados, entonces el dímero es diamagnético, pero si quedan electrones desapareados, es paramagnético. Para los dímeros de bajo peso molecular, los orbitales\(2 \mathrm{~s}\) y los orbitales\(2 \mathrm{p}\) atómicos son muy cercanos en energía, y pueden interactuar entre sí. Para los dímeros con\(\mathrm{MW}\) menor que\(\mathrm{O}_2\), los\(\sigma_{2 p z}\) orbitales\(\pi_{2 p x, y}\) y cambian, y los\(\pi_{2 p x, y}\) estados se llenan primero.
Por qué esto importa
Hay dos formas de separar la pasta del agua hirviendo una vez que está cocida. Una forma es verter la mezcla a través de un colador, o un filtro, para retener la pasta por un lado mientras se deja pasar el agua hirviendo. Otra es dejarla en la estufa y dejar que toda el agua hierva. Cada una de estas técnicas de separación lleva al mismo desenlace, pero como puedes imaginar son muy diferentes. No estoy hablando de cómo sabría la pasta (ignoremos esa parte), sino de cuánta energía se necesita para llevar a cabo esta tarea de separación. Verter a través de un filtro es fácil, rápido y eficiente, mientras que dejar la olla en la estufa llevaría más tiempo y requeriría mucha más energía.
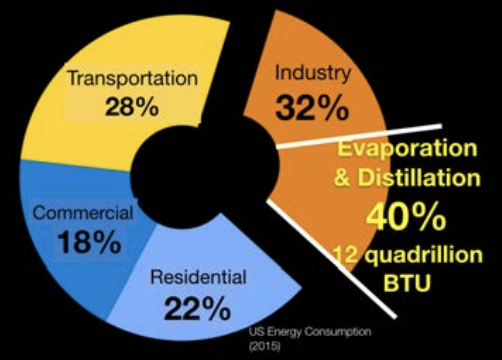
Ahora encoja de pasta a nano-pasta. En otras palabras, la escala de tamaño de las moléculas. Separamos moléculas entre sí todo el tiempo para una amplia variedad de procesos industriales. De hecho, si nos fijamos en el consumo de energía de Estados Unidos, alrededor de 1/3 de él va a lo que vagamente se denomina “Industria”. Pero, ¿sabías que el 40 por ciento de esta energía para la industria sirve solo a un proceso, separando moléculas? La razón por la que el número es tan grande es que solo utilizamos el enfoque térmico lento e ineficiente, no el enfoque de filtro mucho más eficiente, para realizar las separaciones. Eso es la friolera del 12 por ciento de toda la energía utilizada en Estados Unidos que se destina a hervir un químico de otro.
Entonces, ¿por qué no solo vertimos estos químicos a través de un nano-filtro, igual que hacemos con la pasta y los coladores? Si cambiáramos de la separación térmica a un filtro, ¡podríamos ahorrar hasta el 90 por ciento de esa energía! La razón por la que no lo hacemos, es el filtro en sí. Los filtros actuales aún no están a la altura del estándar. Por un lado, tenemos filtros hechos de polímeros (materiales que conoceremos más adelante en el semestre) que pueden separar muy bien las moléculas más pequeñas, pero son tan delicadas que no se pueden usar en los entornos químicos y térmicos duros de la mayoría de los procesos industriales. Por otro lado, tenemos filtros hechos de cerámica (materiales con fuertes enlaces iónicos y/o covalentes) que son súper resistentes y pueden manejar las condiciones, pero no pueden bajar a los tamaños de las moléculas pequeñas que necesitan ser separadas.
Entonces es que llegamos a nuestros orbitales moleculares, llenado orbital, y el ejemplo específico de\(\mathrm{N}_2\) vs.\(\mathrm{O}_2\) cubiertos en clase. Porque una de las grandes separaciones que necesitamos hacer a escala masiva involucra exactamente a estas dos moléculas. \(\mathrm{O}_2\)es abundante en el aire (¡a menos que entres a una habitación cerrada, enciendas una vela y esperes 12 horas como aprendimos en la conferencia 2!) , pero para muchas aplicaciones necesitamos\(\mathrm{O}_2\) concentraciones mucho más altas que su 21 por ciento natural en el aire. Tomemos como ejemplo la combustión: el 78 por ciento\(\mathrm{N}_2\) en el aire tiene un impacto negativo en los procesos de combustión ya que las moléculas de nitrógeno se calientan durante la reacción a temperaturas muy altas, lo que no sólo es ineficiente, sino que se descompone en gases tóxicos de óxido de nitrógeno (\(\mathrm{NOx}\)). Aumentar la cantidad de oxígeno y disminuir la cantidad de nitrógeno conduce a eficiencias de combustión mucho más altas, menores emisiones dañinas y temperaturas de procesamiento más altas. Ahora bien, puede estar pensando que solo estoy hablando de procesamiento de combustibles fósiles, y sí eso es sin duda un excelente ejemplo de nuestro uso de la combustión como sociedad, pero obtener\(\mathrm{O} 2\) moléculas purificadas va mucho más allá, a aplicaciones en la industria médica al tratamiento de aguas residuales a la fabricación de metales, por nombrar sólo unos pocos.
La separación de\(\mathrm{O}_2\) de\(\mathrm{N}_2\) es de tanta demanda a nivel mundial que se realiza en una cantidad de 31 mil millones de kilogramos al año. Debido a que la separación se realiza de manera ineficiente utilizando procesos térmicos, en este caso yendo criogénico, que es enfriamiento en lugar de hervir pero para el mismo propósito, se utilizan 47 TeraBtu (unidades térmicas británicas, o la cantidad de energía térmica necesaria para elevar una libra de agua en un grado Fahrenheit) de energía por año solo para hacer la separación! Solo para ser claros, eso es\(47,000,000,000,000\) Btu de energía, o si prefieres\(13,774,340,298,094\) Watt-hora. Un hogar típico en Estados Unidos usa alrededor de 900,000 vatios-hora de energía por polilla, solo como referencia.
¿Cómo ahorramos hasta el 90 por ciento de la energía masiva utilizada para\(\mathrm{O}_2\) separar\(\mathrm{N}_2\) al cambiar de la separación térmica a un enfoque basado en filtros? ¡La respuesta está en esos orbitales moleculares! Nos hablan de la unión de cada molécula y las interacciones de las moléculas con materiales filtrantes aún por inventar que podrían combinar lo mejor de ambos mundos, desde polímeros hasta materiales cerámicos. Los\(\mathrm{MO}\) s de\(\mathrm{N}_2\) y\(\mathrm{O}_2\) también nos dicen que estas moléculas responden de manera diferente a los campos magnéticos aplicados externamente, lo que a su vez puede ser útil para impulsar la eficiencia de separación. Existe una tremenda oportunidad para que nuevos filtros tomen estas dos moléculas más abundantes en el aire y las pongan en compartimentos separados, pero todo tiene que empezar por saber cómo se comportan los electrones en las moléculas. Y eso, por supuesto, obtenemos de la teoría orbital molecular.
Por qué esto emplea
El problema con la energía de fusión es que es incontrolada. Ya en la década de 1950, Disney estaba haciendo películas para sentirse bien (toma unas palomitas de maíz y echa un vistazo, “Nuestro amigo el átomo”), sobre lo pronto que iba a ser la energía, “demasiado barata para medir”. 70 años después, ¿por qué no es este el caso? La fusión es tan atractiva en tantos niveles: a diferencia de la fisión, que es materia de los reactores nucleares actuales, la fusión no tiene residuos radiactivos ni subproductos, siendo el único resultado de una reacción de fusión cantidades ridículas de energía y helio. La fusión es el motor de las estrellas, así que sabes que esta energía es seria. Vamos a descomponerlo: ¿recuerdas la comparación batería vs. gasolina que hice en la Conferencia 8? Aproximadamente, las mejores baterías de iones de litio de hoy en día pueden almacenar aproximadamente\(1 \mathrm{MJ}\) de energía por\(\mathrm{kg}\). La gasolina, por otro lado, puede almacenar\(45 \mathrm{MJ}\) por kg. Pero sigamos adelante. El explosivo TNT almacena alrededor\(4160 \mathrm{MJ} / \mathrm{kg}\). ¡El uranio cuando se usa en la fisión nuclear almacena la friolera\(3,456,000 \mathrm{MJ}\)\(/ \mathrm{kg}\)! Esta increíble densidad de energía es un argumento fuerte para la generación de energía nuclear y a menudo se invoca. Pero cuando pasamos a la fusión, cuando nos movemos a las cosas de las estrellas, todos estos números se sienten pequeños. La densidad de energía del combustible para fusión, que es una combinación de tritio y deuterio, es increíble\(576,000,000\)\(\mathrm{MJ} / \mathrm{kg}\). Y ese combustible es muy abundante y barato. Por eso el sueño de la fusión sigue vivo incluso después de 70 años de intentarlo, y de hecho hoy en día hay un enorme resurgimiento en la energía de fusión. Para más información no necesitas ir muy lejos, consulta el PSFC (Plasma Science and Fusion Center) aquí mismo en el MIT. O el nuevo spin-out del MIT llamado Commonwealth Fusion Systems.
Si la fusión nuclear va a hacerse realidad (en solo 10 años según algunos, pero también hemos estado escuchando que desde la película de Disney por lo que necesitamos acercarnos con un optimismo cuidadoso), uno de los ingredientes más importantes para que funcione serán los imanes. Muchos y muchos imanes y muy potentes. Eso se debe a que una de las formas más probables de lograr que la fusión funcione es contener la energía masiva liberada (que, por cierto, llega a temperaturas de hasta 100 millones de grados), es confinar la energía utilizando campos magnéticos. Ahora, en los diseños de reactores de fusión los campos magnéticos a menudo se generan con bobinas superconductoras, por lo que es diferente de nuestros electrones desapareados en el\(\mathrm{MO}\) diagrama de\(\mathrm{O}_2\). Pero la idea general de que un material puede responder a un campo magnético externo proviene de su relleno de electrones, y cuantos más electrones estén desapareados como en la\(\mathrm{O}_2\) molécula, más sensible puede ser.
Entonces, ¿cuáles son los trabajos relacionados con el desarrollo de nuevos imanes? Podrías ir a trabajar en una startup de fusión nuclear como Commonwealth Fusion, o a las grandes operaciones de fusión lideradas por el gobierno como el programa ITER en Francia. Pero tantas otras industrias necesitan imanes más fuertes, más baratos y ligeros que el mercado laboral se extiende mucho más allá de la fusión. Podrías buscar trabajos en empresas que fabrican imanes (hay muchos), o empresas que buscan nuevas ideas para reciclar imanes (como Urban Mining Company), o como científico en un laboratorio estadounidense que empuja las fronteras de los imanes (como el Laboratorio Nacional de Alto Campo Magnético de Florida, o el de Los Álamos), o en empresas que intentan fabricar imanes que no dependen de elementos de tierras raras (como Toyota por ejemplo, entre muchos).
Práctica extra
1. Considerar\(O_1 512\) y\(O_2^{+}\)
a) Dibujar el\(\mathrm{MO}\) diagrama de cada molécula.
b) Encontrar el orden de fianza de cada uno.
c) Etiquetar cada uno como paramagnético o diamagnético.
- Contestar
-
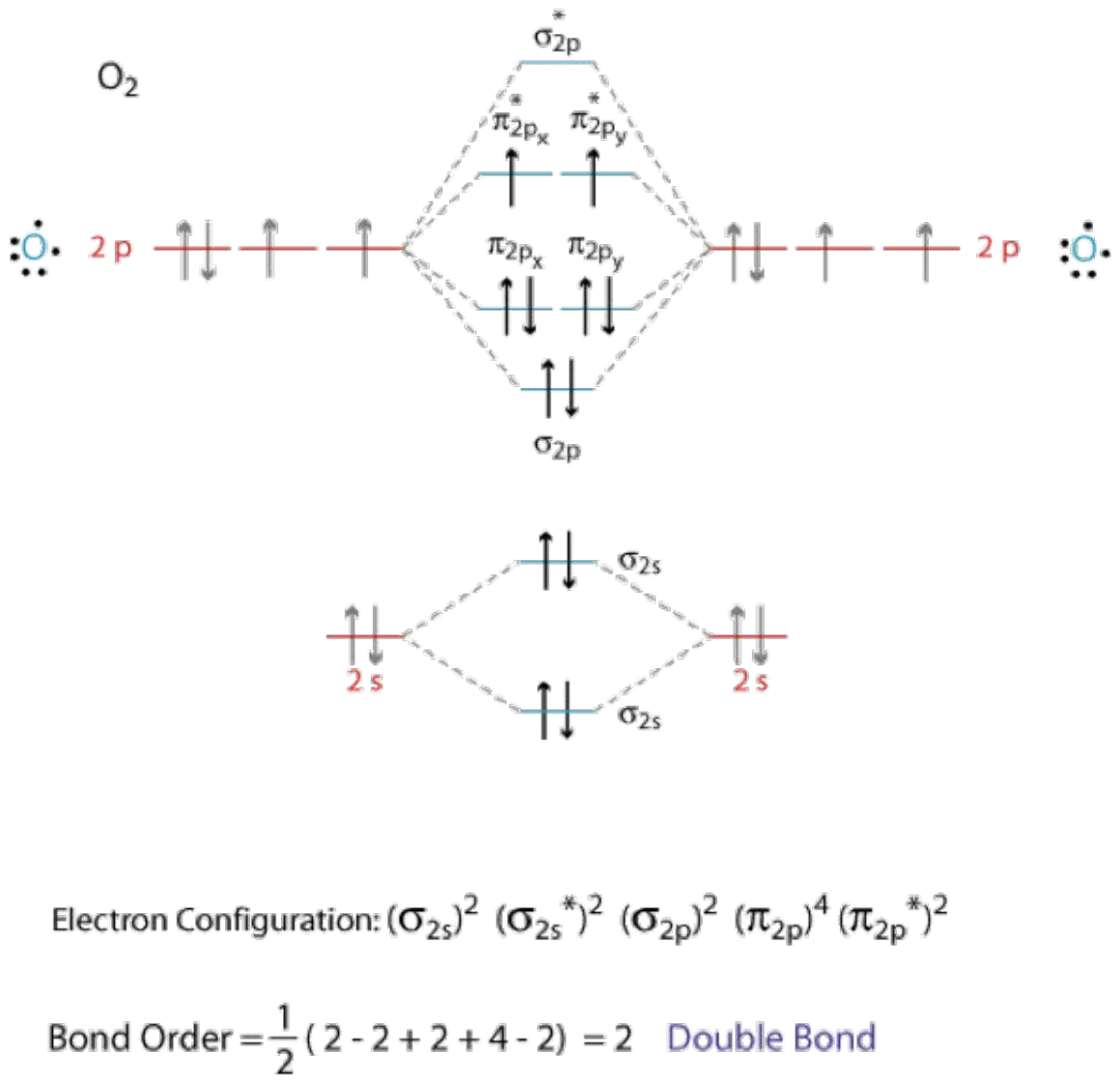
\(\mathrm{O}_2\)es paramagnético porque tiene electrones desapareados.
\(\mathrm{O}_2^{+}\)también es paramagnético, porque tiene un electrón desapareado. Su orden de fianza es\(2.5\)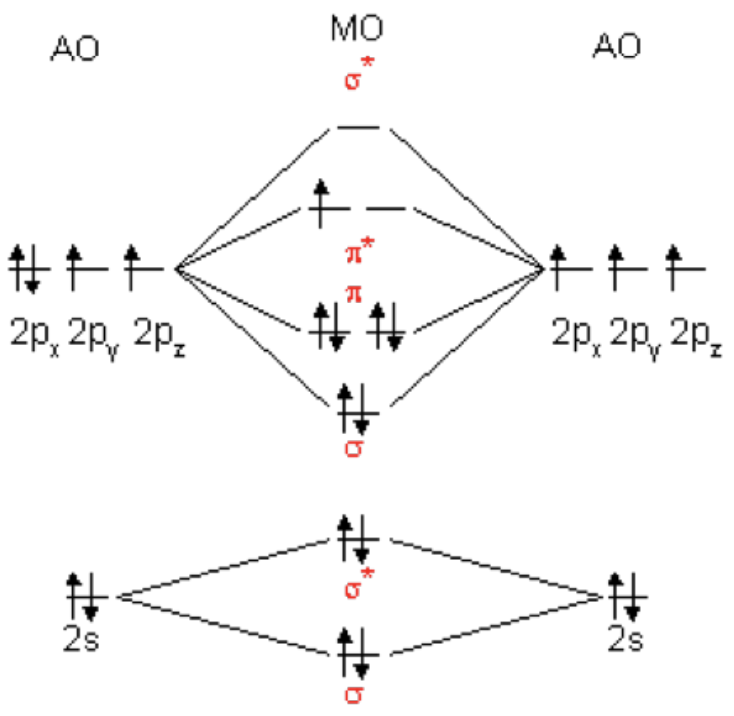
2. Dibuja el\(\mathrm{MO}\) diagrama de\(\mathrm{HCl}\).
- Contestar
-
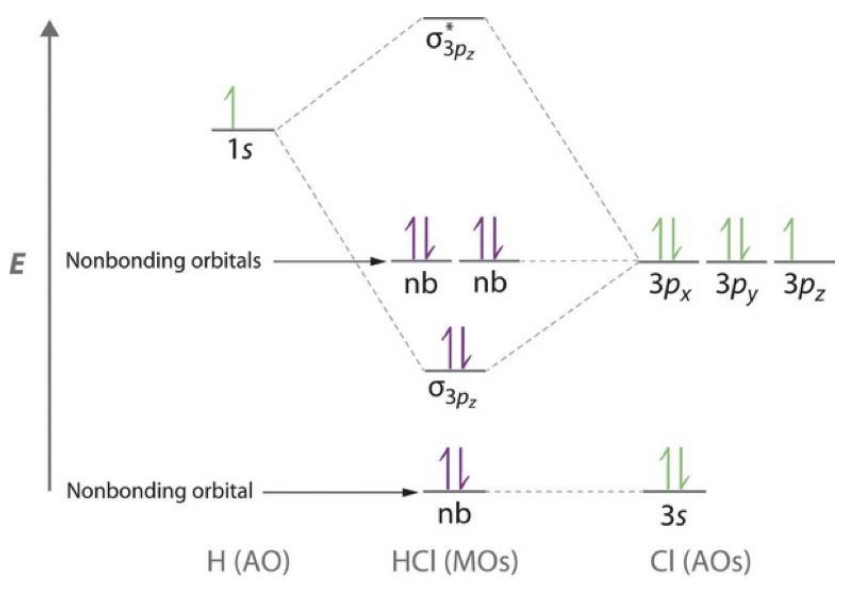
Conferencia 12: Hibridación en Orbitales Moleculares
Resumen
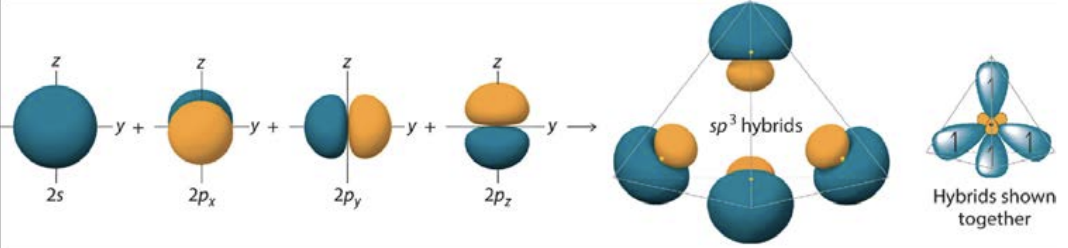
Si múltiples orbitales atómicos dentro de un átomo tienen niveles de energía similares, pueden hibridarse, combinándose para formar orbitales iguales que tienen una energía promedio menor. Considera el metano\(\mathrm{CH} 4\),, como ejemplo: el átomo de carbono tiene dos\(2\mathrm{s}\) electrones y dos\(2\mathrm{p}\) electrones. Los\(2\mathrm{p}\) estados\(2\mathrm{s}\) y se hibridan, produciendo cuatro electrones desapareados de igual energía que están listos para unirse con átomos de hidrógeno. A medida que ocurre la hibridación, los cuatro electrones del carbono se redistribuyen de manera que se espacien al máximo, disminuyendo la energía del sistema y produciendo el estado más estable: una molécula de metano tetraédrico. A este tipo de hibridación se le llama\(\mathrm{sp}^3\), porque un nivel\(\mathrm{s}\) de energía orbital combinado con tres niveles\(\mathrm{p}\) de energía orbitales.
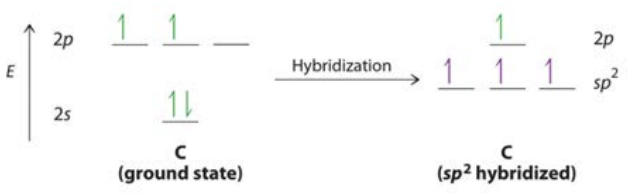
Para el caso del etano\(\mathrm{C}_2\mathrm{H}_4\), el proceso de hibridación es ligeramente diferente, como se muestra aquí (esta vez como diagrama de nivel de energía). Cada carbono forma solo tres enlaces: dos con átomos de hidrógeno y uno con el otro carbono. El nivel de energía\(\mathrm{s}\) -orbital se combina con dos niveles de energía\(\mathrm{p}\) orbitales para formar tres\(mathrm{sp}^2\) enlaces iguales; los\(2\mathrm{p}\) electrones restantes forman un\(\pi\) enlace de mayor energía entre los dos átomos de carbono y producen un doble enlace entre los átomos de carbono.
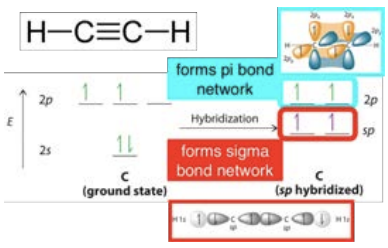
La siguiente molécula lógica molécula lógica a considerar es el acetileno,\(\mathrm{C}_2\mathrm{H}_2\). En este caso, cada carbono solo está unido a un hidrógeno, por lo que solo un nivel de\(2 \mathrm{p}\) energía se hibrida con el nivel de\(2\mathrm{s}\) energía para formar un enlace\(\mathrm{sp}\) hibridado. Los\(2\mathrm{p}\) orbitales restantes forman dos enlaces, lo que produce un triple enlace entre los átomos de carbono.
En resumen, la hibridación ocurre para disminuir la energía general del sistema: los orbitales atómicos se combinan entre sí para formar estados mixtos con una energía promedio menor. Conocer la hibridación de la molécula equivale a conocer la forma molecular: VSEPR da el nombre geométrico correspondiente a la combinación específica de ángulos de enlace que minimizan la energía general del sistema.
Por qué esto importa
Más de 3 mil millones de personas en este planeta viven en regiones estresadas por el agua. 1.8 mil millones de personas beben agua contaminada fecalmente. 600 millones de personas hierven su agua para limpiarla. En lugares donde la escasez de agua es un problema grave, según algunas estimaciones el 70% de todas las enfermedades y el 30% de todas las muertes pueden atribuirse a la falta de agua o calidad del agua. El agua dulce constituye apenas 2.5% de toda el agua en la tierra, pero más de 2/3 de esa está amarrada en glaciares. Esto significa que solo el 1% de toda el agua del planeta es potable, y el saldo de este preciado recurso está muy fuera de escala.
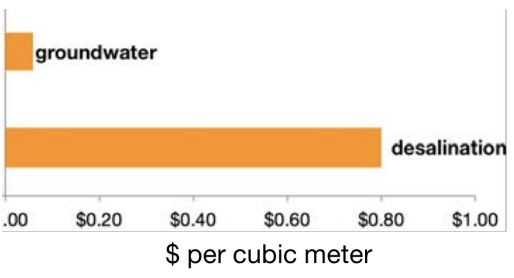
Dado el nivel de crisis global en el que se ha convertido el acceso al agua dulce, tiene mucho sentido dirigir nuestra atención hacia el otro 97% del agua del planeta, el agua salada en los océanos. El problema, por supuesto, es que no es potable (o útil en la mayoría de la agricultura), a menos que se elimine la sal. La buena noticia es que la desalinización está creciendo en términos de uso y capacidad instalada, pero la mala noticia es que todavía cuesta demasiado convertirse en un sustituto ubicuo de las aguas subterráneas.

¿Cómo podemos trabajar para reducir el costo y aumentar la eficiencia en la desalinización? En primer lugar, necesitamos saber cuál es el desglose de costos actuales, y como puede ver en el gráfico circular de esta imagen, el mayor costo de la desalinización está en la energía que se necesita para bombear agua a través del sistema. Por “sistema” me refiero a una instalación de pretratamiento donde el agua de mar se corre a través de la arena para filtrar grandes impurezas (conchas, rocas, algas marinas, etc.), seguido de la parte real “desal” de la desalinización, donde el agua corre a través de un conjunto de membranas (40,000 de ellas en la planta que se muestra en la imagen) que eliminan el sal y dejar pasar el agua dulce. Bombear el agua salada a través de estas membranas requiere de lejos la mayor parte del consumo de energía de la planta, por lo que mejorar las membranas y hacerlas más eficientes energéticamente es crucial. De hecho, no es solo que las membranas utilizadas hoy en día son ineficientes energéticamente, sino que también se ensucian (las bacterias y otra materia orgánica crecen en sus poros) y son extremadamente delicadas por lo que no se pueden limpiar muy bien. Esto significa que la mayor parte del tiempo la planta está pagando costos de energía más altos de lo que necesita (¡en un factor de 2 o 3 a veces!) porque tiene que bombear agua a través de membranas que están sucias y bloqueadas y que no se pueden limpiar. ¡Ahora eso es lo que yo llamo una oportunidad de diseño de materiales! Hacer una mejor membrana para la etapa de eliminación de sal de la desalinización, y hacer que el proceso sea más barato. Así es como llegamos a nuestro Why This Matters y conexión con la conferencia de hoy.
Aprendimos sobre los enlaces sigma y pi que se pueden formar cuando se hibridan los\(\mathrm{AO}\) s de los átomos de carbono.
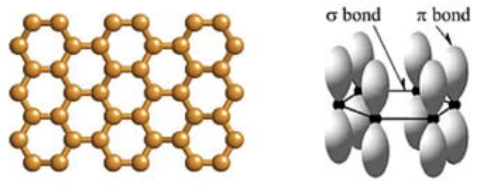
En los ejemplos en clase teníamos carbono unido al hidrógeno y a veces también a sí mismo. Si solo tenemos\(\mathrm{sp2}\) hibridación y solo tenemos\(\mathrm{C}\) átomos y no\(\mathrm{H}\) átomos, entonces llegamos a un material muy, muy fresco: el grafeno. Está unido en una hoja de celosía de nido de abeja (una hoja 2D) con\(\mathrm{sp}^2\) enlaces, y esos\(\mathrm{p}\) electrones adicionales forman enlaces pi a través del plano para darle un gran impulso de estabilidad. Es un material muy fresco y su aislamiento del grafito (que son solo pilas de grafeno) ganó el Premio Nobel en 2010. (¡Los científicos que descubrieron el grafeno pudieron separarlo de un trozo de grafito usando solo cinta corriente! Así que recuerda, a veces todo lo que necesitas para un Premio Nobel es lápiz, cinta adhesiva y determinación). No puedo entrar en todos los detalles de por qué el grafeno es genial, pero si buscas en línea lo verás de inmediato. Otra consecuencia del grafeno es que lanzó todo un campo de "\(2 \mathrm{D}\)materiales” donde los investigadores se han dado cuenta de que se pueden convertir tantos otros materiales en estas láminas que tienen solo uno o unos pocos átomos de espesor. Ahora incluso es posible hacer pilas completamente nuevas de materiales 3D mezclando y haciendo coincidir\(2 \mathrm{D}\) hojas (consulte por ejemplo el papel de Geim y Grigorieva, “Heteroestructuras de Van der Waals”, volumen Nature 499, páginas 419-425 (25 de julio de 2013). Por cierto, Geim fue uno de los dos científicos que ganaron el premio Nobel por el descubrimiento del grafeno. El otro es Novoselov, pero Geim es un poco especial ya que es la única persona que alguna vez ha ganado tanto los premios Nobel como los IgNobel, este último por levitar ranas. Pero yo digrego.
El punto es que el grafeno puede ser simplemente la membrana definitiva. Solo tiene un grosor de 1 átomo, por lo que en términos de pérdida viscosa es difícil de superar. Además, es mucho más resistente que las membranas de polímero actuales, por lo que se puede limpiar fácilmente. No es de extrañar que el grafeno haya sido considerado como un potencial de desalinización desde 2012, incluso por personas que quizás ya conozcas, por ejemplo, “Desalinización de agua a través del grafeno nanoporoso”, de Cohen-Tanugi y Grossman, Nanoletters volumen 12, páginas 3602- 3608 (2012). Debido a su enorme potencial en la desalinización del agua y también en el tratamiento y purificación del agua en general, hay muchos grupos de investigación e incluso ya una serie de empresas que trabajan para comercializar membranas a base de grafeno (Vía Separaciones, por ejemplo). Todo esto es extremadamente emocionante, pero también solo es posible debido a la hibridación que se produce en los átomos de carbono, lo que combinado con esos enlaces pi les permite tomar la forma de grafeno.
Por qué esto emplea
Esto es difícil ya que la hibridación en química es lo que permite que existan tantas moléculas, y esto impacta en casi todos los sectores laborales, sin mencionar la vida misma. Pero como cubrimos el grafeno en Why This Matters, apegémonos al grafeno aquí en la categoría Empleo también. Hay empresas que fabrican grafeno directamente e invierten mucho $$ en hacerlo barato, a gran escala y de alta calidad (es decir, muy pocos defectos si es posible), o con químicas funcionales a medida. También hay diferentes versiones de grafeno, desde grafeno puro hasta óxido de grafeno y óxido de grafeno reducido, etc. El supermercado de grafeno, el material ACS o el grafeno son ejemplos de empresas que fabrican productos de grafeno y todas ellas tienen vacantes laborales para estudiantes que conocen la hibridación.
Pero la producción de grafeno también ha sido abrazada a lo grande por las grandes empresas. Toshiba ha invertido más de 50 millones de dólares en plantas de fabricación de nuevos materiales de carbono, desde grafeno hasta otras nanoestructuras de carbono sp como nanotubos de carbono y fullerenos. Otros grandes productores químicos se han incorporado al club, como Cemtrex, Mitsubishi Chemical, Cabot o Aixtron, por citar sólo algunos ejemplos. Y todas estas son solo empresas que están pensando en hacer grafeno, pero luego si nos expandimos a aquellas que lo están utilizando para mejorar su tecnología, la lista sigue y sigue. Esto es especialmente cierto en las compañías de baterías, tanto grandes como pequeñas, donde el uso de nanoestructuras de carbono sp2 como el grafeno tiene un tremendo potencial. Las aplicaciones que involucran catálisis y electrónica también son candidatos fantásticos para el uso del grafeno.
Práctica extra
1. Observe un solo carbono en la porción de una celosía de diamante debajo. Convénzase de que la estructura podría seguir creciendo hacia afuera infinitamente en todas las direcciones.
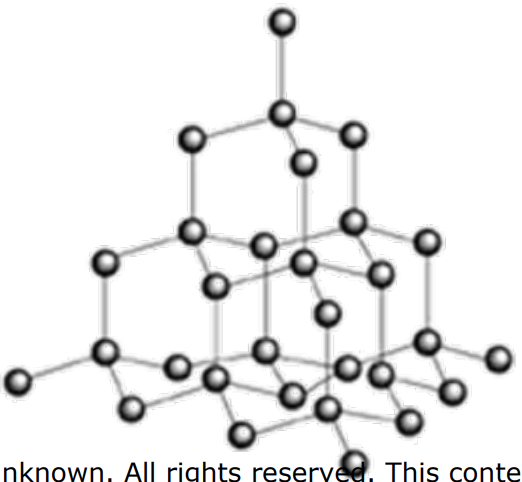
a) ¿Cuál es la carga formal sobre cualquier átomo de carbono?
- Contestar
-
0, está formando 4 bonos
b) ¿Cuál es la hibridación de cualquier enlace? ¿Cómo lo sabes?
- Contestar
-
\(\mathrm{C}\)está formando 4 enlaces sigma, por lo que debe tener 4 orbitales hibridados equivalentes: debe haber utilizado los tres orbitales p y su\(\mathrm{s}\) -orbital:\(\mathrm{sp3}\)
c) ¿Es esta una estructura resonante? ¿Cómo lo sabes?
- Contestar
-
No, todos los electrones están formando enlaces sigma, así que no hay otra configuración de electrones permitida
2. Mira un solo átomo de carbono en la porción de una molécula de buckminsterfullereno a continuación (¡sí, es el logo de nuestra clase!)
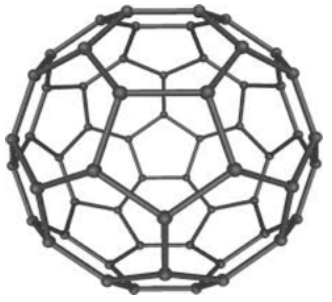
a) La carga formal sobre cualquier\(\mathrm{C}\) átomo es 0. ¿Cuántos enlaces sigma y pi debe estar formando cada carbono?
- Contestar
-
Tiene que haber un doble enlace asociado a cada carbono para que esté formando 4 enlaces y tenga 0 carga formal, por lo que cada carbono está formando 3 enlaces sigma y 1 enlace pi
b) ¿VSEPR está satisfecho? ¿Está casi satisfecho?
- Contestar
-
Cada enlace sigma tiene que\(\mathrm{sp2}\) hibridarse, ya que se están formando tres enlaces totales y todos se encuentran en un plano
c) ¿Cuál es la hibridación de cualquier enlace sigma? ¿Cómo lo sabes?
d) ¿Es esta una estructura resonante? ¿Cómo lo sabes?
- Respuesta a c y d
-
Sí - Hay diferentes configuraciones en las que los enlaces p se pueden hacer sobre toda la molécula de fullereno, por lo que hay resonancias. Además, inferimos que los\(\mathrm{p}\) orbitales que forman los enlaces pi pueden sumar o restar dando orbitales moleculares de electrones deslocalizados, apuntando a la resonancia
Conferencia 13: Interacciones intermoleculares
Resumen
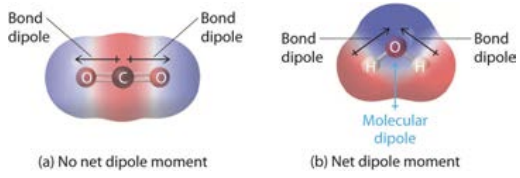
Esta conferencia se centró en las fuerzas intermoleculares (IMF), que son interacciones entre moléculas más débiles que los enlaces iónicos o covalentes, pero que a mayor escala adquieren un papel enorme en dar a los materiales sus propiedades. Primero, definimos un dipolo: un par de cargas, una positiva y otra negativa, separadas por una distancia. Ya hemos visto dipolos en esta clase, un enlace covalente que implica una diferencia en las electronegatividades, por ejemplo si un átomo es electropositivo y el otro electronegativo, forma un dipolo. La\(\mathrm{H} - \mathrm{Cl}\) molécula es un ejemplo sencillo que se muestra aquí, donde la flecha en el diagrama apunta hacia el cloro más electronegativo, y el\(\delta^+ / \delta^-\) indica un exceso de carga positiva/negativa. La flecha es la dirección del dipolo. Es posible que una molécula con enlaces covalentes polares no tenga dipolo neto, como se muestra\(\mathrm{CO}_2\) a continuación. Esto se debe a que sus dos dipolos cancelan. El agua tiene un dipolo neto solo en la dirección y.
La presencia de un dipolo neto significa que los dipolos de la molécula sentirán atracción por cargas opuestas. Esta otra carga podría ser un ion, u otro dipolo. La primera se llama interacción ión-dipolo, y la segunda interacción dipolo-dipolo. Estas son atracciones entre moléculas más que enlaces dentro de ellas.
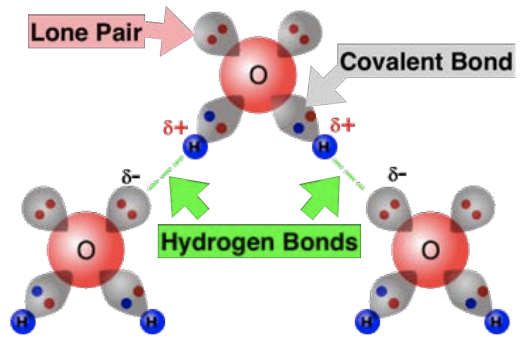
Todavía es posible que las moléculas sin dipolo neto participen en el enlace intermolecular, ya que incluso las moléculas no polares pueden experimentar dipolos temporales debido a las fluctuaciones en la nube de electrones. Estos dipolos temporales pueden ocurrir debido a interacciones con cargas circundantes, en cuyo caso se denominan dipolos inducidos. Estos pueden interactuar con iones o dipolos permanentes u otros dipolos inducidos. Estas fluctuaciones en la nube de electrones también pueden ser resultado de la temperatura. Cuando estos dipolos temporales interactúan entre sí, las fuerzas atractivas se llaman fuerzas de dispersión de Londres (LDF). Es más fácil deformar temporalmente las nubes de electrones de algunas moléculas en comparación con otras. Tienen diferencias en polarizabilidad. Por ejemplo, los átomos más grandes son más polarizables que los átomos más pequeños debido a que sus electrones externos se ven menos afectados por la tracción nuclear. Cuanto más polarizable es una molécula, más fuerte es su LDF. El LDF también depende de la superficie de la molécula, ya que mayor área superficial significa más nube de electrones que puede ser inducida temporalmente al desplazamiento, lo que a su vez significa una LDF más alta. Finalmente, discutimos los enlaces de hidrógeno, que ocurren cuando un átomo de hidrógeno unido a un elemento altamente electronegativo en una molécula (como nitrógeno, oxígeno o flúor) es atraído a una región cargada negativamente, como un par solitario de electrones.
Por qué esto importa
https://www.americanscientist.org/article/how-gecko-toes-stick
Los lazos débiles en realidad no son tan débiles, sobre todo cuando hay muchos de ellos. El gecko es un ejemplo perfecto de ello. ¡Es un animal notable que puede caminar arriba y abajo de paredes e incluso cruzar el techo sin sudar! El motivo es que sus dedos de los pies están acolchados con pelos microscópicos (llamados “setas”), y cada uno de estos a su vez tiene cientos de ramas a nanoescala. ¡Un dedo de gecko puede tener hasta mil millones de pelos pequeños! Estos pelos tienen la clave de sus habilidades adhesivas aparentemente mágicas y la razón por la que hay tantos de ellos es precisamente por lo que aprendimos en esta conferencia: interacciones débiles como van der Waals se hacen más fuertes con más superficie. Mil millones de pequeñas nano-hebras en cada dedo del pie le dan al pie del gecko una gran cantidad de superficie, especialmente cuando esas hebras se encuentran casi planas contra cualquier superficie a la que el gecko esté trepando o pegando. Cuando la hebra corre paralela a una superficie, maximiza la cantidad de hebra que puede enganchar en la atracción de van der Waals con esa superficie. Cuando el hilo es más perpendicular, la fuerza se reduce drásticamente.
Aquí radica el secreto del Gecko, porque no es suficiente que tenga una puntera súper adhesiva, sino que también necesita poder alternar entre súper adhesivo y no adhesivo en absoluto. De lo contrario, ¡se pegaría a la pared y no podría moverse! Entonces, el Gecko sabe claramente todo sobre la dependencia de la atracción de van der Waals en el contacto con la superficie, y cada vez que da un paso ajusta la adhesión de los dedos cambiando el ángulo de sus miles de millones de pelos de los dedos.
Esto importa no solo porque es una ilustración genial de lo increíble que puede ser la naturaleza, sino también por lo relevantes que serían los adhesivos reversibles mejorados para una amplia gama de aplicaciones. Sí, esto incluye escalar edificios como Tom Cruise en Mission Impossible 4, pero también afectaría áreas que van desde la fabricación avanzada hasta el tratamiento de heridas. Solo piensa en lo que podría significar tener una cinta que sea 1000 veces más fuerte que la cinta actual, y que se pueda aplicar y quitar miles de veces sin pérdida de pegajosidad. Tanto investigadores como empresas han estado tratando de imitar las habilidades adhesivas del Gecko durante décadas, y aún así no estamos en un lugar donde podamos hacerlo, aunque un mejor control sobre la química y la nanoestructura de los materiales nos está acercando más que nunca. Todo se reduce a la ingeniería de la atracción de van der Waals.
Por qué esto emplea
La última interacción débil que discutimos en este capítulo fue la del enlace de hidrógeno. Este vínculo es increíble en muchos sentidos, entre los cuales no menos importantes son las oportunidades de empleo que brinda. Los enlaces de hidrógeno son prevalentes (y a menudo dominantes) para determinar la forma en que las proteínas se pliegan y se despliegan, y en la forma en que las hélices del ADN se mantienen unidas. Es la razón por la que el papel es posible, y la razón por la que los peces no se congelan en invierno en un estanque, por nombrar solo algunos ejemplos. Pero el ejemplo en el que quiero enfocarme para esto Por Qué Esto Emplea es el de los recubrimientos superficiales. La forma en que una superficie interactúa con el agua se puede diseñar modificando la forma en que el hidrógeno del agua se une a la superficie, la forma en que el hidrógeno del agua se une a sí misma, o ambas.
Se necesitan recubrimientos que repelan el agua en todo el lugar, desde mantener los parabrisas de los automóviles despejados, hasta hacer ropa que se mantenga seca en una tormenta, hasta evitar la condensación en las turbinas de las centrales eléctricas. La química que entra en estos recubrimientos es la clave para controlar los enlaces de hidrógeno, y hay muchas empresas interesadas en contratar gente para trabajar con dicha química. Esto va desde empresas de materiales de tamaño mediano como NEI Corporation, que fabrica un recubrimiento “superhidrofóbico” llamado Nanomyte, o UltraTech, que fabrica recubrimientos de contención de derrames, o Aculon, que afirma en su página web, “Donde hay una superficie que tiene un problema, nos gusta pensar que podemos ayudar a resolver eso problema”, a empresas más grandes como DuPont que fabrica recubrimientos especializados para la industria de Petróleo y Gas, a pequeñas start-ups como DrogoTa, fundada por nuestro propio Curso 2 Profesor Kripa Varanasi. Estos son solo un puñado de ejemplos de las muchas empresas que construyen productos alrededor del control de los enlaces de hidrógeno.
Práctica extra
1. En\(\mathrm{T}=25^{\circ} \mathrm{C}, \mathrm{F}_2\) y\(\mathrm{Cl}_2\) son gases,\(\mathrm{Br}_2\) es un líquido, y\(\mathrm{I}_2\) es un sólido. Esto se debe a que (elija uno):
A. Las interacciones de Londres aumentan con el tamaño molecular.
B. Las interacciones dipolares inducidas por dipolo aumentan con el tamaño molecular.
C. Las interacciones dipolo-dipolo aumentan con el tamaño molecular.
D. La polarizabilidad aumenta con el tamaño molecular.
E. Las interacciones de Londres aumentan con el tamaño molecular y la polarizabilidad aumenta con el tamaño molecular
- Contestar
-
E
2. Con base en la siguiente información:
\(\mathrm{CF}_4\), Peso molecular\(87.99\), Punto de ebullición normal\(-182^{\circ} \mathrm{C}\)
\(\mathrm{CCl}_4\), Peso molecular\(153.8\), Punto de ebullición normal\(-123^{\circ} \mathrm{C}\)
Las fuerzas intermoleculares de atracción en las sustancias anteriores se describen por cuál de las siguientes (elija una):
A. fuerzas gravitacionales
B. Fuerzas de Londres
C. fuerzas ion-dipolo
D. Fuerzas dipolo-dipolo (dipolos permanentes)
E. fuerzas repulsivas
- Contestar
-
B
3. El ácido acrílico se muestra a continuación.
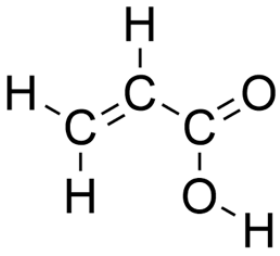
¿Cuál es la fuerza intermolecular dominante en una solución de ácido acrílico? (también, ¿cuál es la hibridación alrededor de cada átomo?)
- Contestar
-
\(\mathrm{H}\)-enlace (todos los átomos son\(\mathrm{sp2}\) excepto el\(\mathrm{O} - \mathrm{H}\), que es\(\mathrm{sp3}\))
Conferencia 14: Fases
Resumen
La presión atmosférica es la fuerza por unidad de área ejercida por la masa de la atmósfera sobre todo lo que envuelve, y otros gases, líquidos y sólidos pueden ejercer presión de manera similar. En un sistema cerrado, se desarrolla un equilibrio a medida que las moléculas se convierten de una fase a otra (como líquido a gas), y viceversa (gas de nuevo a líquido). La presión que una fase ejerce sobre otra depende fuertemente de qué fuerzas intermoleculares estén presentes en el sistema. Los IMF fuertes conducen a bajas presiones de vapor, mientras que los IMF débiles conducen a altas presiones de vapor.
La presión de vapor de un material es diferente al peso de un gas; más bien, está relacionada con la probabilidad de que un líquido o sólido pierda moléculas a la fase gaseosa. Si la presión de vapor es mayor que la presión atmosférica, el peso de la atmósfera no es suficiente para atrapar el gas que se libera, y el material comienza a hervir.
Hasta el momento, la ebullición se ha descrito completamente con respecto a la presión, ¡pero la temperatura también marca la diferencia! La presión de vapor también depende fuertemente de la temperatura: a medida que la temperatura aumenta, la presión de vapor aumenta exponencialmente. Entonces a medida que se calienta un material, su presión de vapor aumenta hasta que supera la presión atmosférica y comienza a hervir. Por ejemplo, si empezamos con agua en\(25 \mathrm{C}\), su presión de vapor es de aproximadamente\(0.02\) atm. Para cuando alcanza\(100^{\circ} \mathrm{C}\), la presión de vapor se ha incrementado 50 veces para alcanzar\(1 \mathrm{~atm}\), momento en el que comienza a hervir.
Anteriormente aprendimos que una temperatura más alta produce mayor energía cinética y más movimiento molecular. Sin embargo, cuando un material está “a” una temperatura determinada, no todas las moléculas se mueven alrededor de la misma. La distribución de las energías cinéticas asociadas a una temperatura dada puede ser muy amplia, con colas largas. Entonces la temperatura se usa para describir la energía cinética promedio, pero algunas moléculas tendrán más y otras tendrán menos. La ecuación Clausius-Clapeyron da la relación exponencial entre la presión de vapor y la temperatura:
\(\ln (P)=-\Delta H_{v a p} / R T+C\)
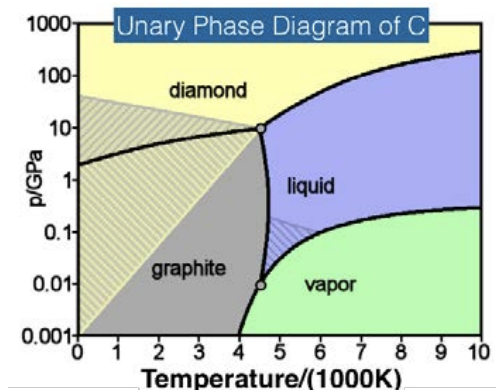
El diagrama es de dominio público. Fuente: Wikimedia Commons.
donde\(\Delta H_{\text {vap is }}\) es la entalpía de vaporización, o la energía por mol requerida para convertir una molécula líquida en una molécula de gas. Hay un calor latente o entalpía involucrada en todo tipo de cambio de fase:\(\Delta H_{v a p}\) para vaporización,\(\Delta H_{f u s}\) fusión y\(\Delta H_{\text {sub for }}\) sublimación. La entalpía de la sublimación es siempre mayor que la entalpía de fusión, ya que los átomos/moléculas de estado sólido están más fuertemente unidos que los átomos/moléculas líquidas. La ley de Hess nos dice que cualquier camino de un estado a otro es un camino válido, porque la energía total requerida para cambiar de estado será la suma de las diferencias de energía a lo largo del camino.
Los diagramas de fase son útiles para saber cuál es la fase de equilibrio de un material a una temperatura y presión dadas. Los límites de fase se denominan curvas de coexistencia: en estos puntos, existen dos fases simultáneamente. Si se cruza un límite de fase, se producirá un cambio de fase. Los diagramas de fase son como “mapas” de un material.
Por qué esto importa

El calor es una forma esencial de transferencia de energía para los seres humanos, no sólo para mantener la temperatura corporal sino también para una gama de actividades primarias y avanzadas, desde cocinar y esterilizar, hasta operar motores y generar electricidad. El control de la energía térmica para beneficiar a la humanidad se remonta a tiempos prehistóricos y el calor sigue siendo la moneda energética más valiosa de nuestra existencia. Como se ilustra en esta cifra, casi el 90% de toda la energía consumida globalmente es generada o consumida como energía térmica en algún momento durante el ciclo de oferta/demanda. Por lo tanto, es sorprendente, incluso llamativo, que a la fecha no tengamos medios viables para almacenar energía térmica. A diferencia de la energía mecánica, donde el material puede ser simplemente bombeado por una colina de energía potencial y mantenido allí hasta que sea necesario como en el caso de la hidroeléctrica bombeada, o energía eléctrica donde los electrones pueden ser empujados hacia arriba por una colina electroquímica y retenidos allí como en una batería, para el caso de los fonones — los portadores de energía térmica energía — no existe tal estabilidad. En cambio, la energía térmica retrocede por la colina energética y no se puede detener. El calor siempre se disipa. Tiene fugas y no podemos contenerlo por mucho que trabajemos para aislar un reservorio térmico.
La lenta fuga de energía térmica de un material que es más caliente que su entorno se llama “calor sensible”. Eventualmente, se transferirá suficiente energía al ambiente para que tenga la misma temperatura que el entorno. De hecho, si tomas una clase de termodinámica aprenderás que la definición misma de temperatura es, “la que es igual cuando el calor deja de fluir entre sistemas en contacto térmico”. Entonces, una forma de almacenar energía térmica es calentar algo, entonces ese algo filtrará su calor a cierta velocidad hacia algún ambiente hasta que su temperatura sea la misma que la del ambiente. El almacenamiento y liberación de calor sensible se utiliza todo el tiempo, desde un paquete de calefacción que se pone en el microondas y se pone en el cuello dolorido hasta enfocar la luz solar en una losa de concreto como en una planta de energía solar térmica, hasta la vieja idea de calentar una montaña entera para la generación de energía a largo plazo a medida que se enfría lentamente. (ese último aún no ha sido probado por si te lo estás preguntando... ¡pero es un concepto pulcro!). Pero ya sea un paquete de calor o una montaña, el problema con el calor sensible es que obtienes lo que obtienes casi sin control. Aparte de la cantidad de aislamiento con el que empaques tu material, no hay muchas buenas maneras de ralentizar y ninguna manera de detener el flujo de calor. Porque en este modo de almacenamiento térmico, calentamos algo hasta cierta temperatura y comienza a enfriarse de inmediato, tampoco hay control sobre la temperatura que obtienes de la energía almacenada: cambia constantemente a medida que se enfría.
Ah, pero de hecho hay una manera de “aferrarse” a la energía térmica, y luego liberarla como calor cuando sea necesario, al igual que la electricidad en las baterías. Y te da un control completo y total sobre la temperatura de liberación. De hecho, un simple cubo de cera es un sistema de almacenamiento térmico. Funciona aprovechando su cambio de fase: cuando la cera se funde cambia de sólido a líquido, y la energía requerida para que ocurra este cambio de fase es grande (esa sería la entalpía de fusión,\(\Delta H_{f u s}\), como se discutió en la conferencia). Cuando la cera vuelve a enfriarse, se vuelve sólida nuevamente, y toda esa energía de cambio de fase se devuelve al solidificarse. Los materiales que se utilizan así, donde se utiliza la entalpía de uno de sus cambios de fase como forma de almacenar y liberar energía térmica, se denominan “materiales de cambio de fase” (PCM). Es un nombre un poco extraño ya que todos los materiales son materiales de cambio de fase, pero la etiqueta PCM se ha pegado como una forma de referirnos a aquellos en los que tratamos de hacer algo útil tecnológica o científicamente con la energía almacenada/liberada por el cambio de fase.
Los PCM se utilizan en muchas aplicaciones, incluido el paquete de calentamiento simple (al que llegaré en un momento), pero también en aplicaciones de alta temperatura. Tomemos como ejemplo las sales fundidas utilizadas en las centrales termosolares. La luz solar se enfoca en una sal o mezcla de sales (como el nitrato de sodio y potasio por ejemplo), que funde la sal en un líquido durante el día. Cuando se enfría por la noche, la sal ahora solidificante mantiene una temperatura precisa en su cambio de fase durante un largo periodo de tiempo (lo cual es bueno para una central eléctrica), hasta que se congela completamente de nuevo en un sólido. Hay muchos otros materiales PCM y muchos otros usos de los materiales PCM, y conocer el diagrama de fases para que uno pueda marcar exactamente la temperatura correcta de liberación de calor rojo sto es el primer paso para hacerlo posible!
Y permítanme concluir esto Por qué esto importa con un hecho más llamativo. Empecé explicando que el 90% de toda la energía se genera/consume como energía térmica. ¡Pero un masivo 60% del calor generado para alimentar nuestro mundo se desperdicia! Podríamos capturar y reciclar gran parte de esa energía. Hay mucho interés e investigación en el desarrollo de nuevos PCM con mayores densidades de almacenamiento (mayores entalpías de fusión), lo que significa nuevas químicas. La capacidad de hacer un nuevo PCM que posea todas las métricas clave deseables para una aplicación dada requiere un profundo conocimiento de las interacciones intermoleculares en el PCM que a su vez conducen a su diagrama de fases.
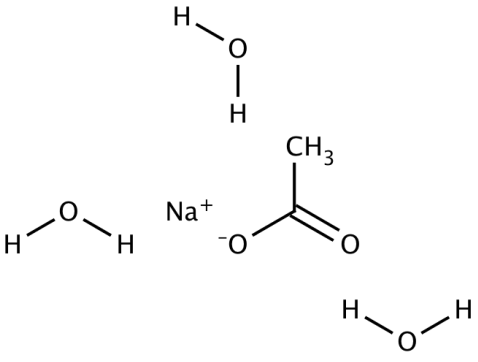
También hay un nuevo y emocionante trabajo para hacer que los PCMs sean “activables”, de modo que permanezcan atascados en estado líquido hasta que se aplique algún disparador externo. Entonces, cuando se activa, se solidificaría y liberaría toda su energía de cambio de fase, lista para ser “cargada” nuevamente como un sólido. Esto ya sucede en algunos casos, y aprovecha el fenómeno de sobreenfriamiento que discutimos en la conferencia. En un paquete de acetato de sodio trihidrato (la química se muestra aquí), por ejemplo, es bastante fácil de superenfriar, por lo que cuando el material se calienta más allá de su punto de fusión de 58C se convierte en líquido pero se puede enfriar de nuevo a temperatura ambiente sin solidificarse de inmediato. Permanece metaestable en estado sobreenfriado, hasta que se aplica algún gatillo como un poco de fuerza mecánica externa (o un cubito de hielo también lo haría). Ese disparador recuerda al material que en realidad quiere ser un sólido a esta temperatura, es decir, proporciona un sitio de nucleación para la fase sólida, y luego como está a un buen 30°C por debajo del punto de fusión, todo termina solidificándose y emitiendo toda su energía de cambio de fase (entalpía de fusión). Hay mucho interés y trabajo para desarrollar nuevas formas de mantener los PCMs sobreenfriados, lo que a su vez podría hacer que el almacenamiento de energía térmica se parezca mucho más al almacenamiento de energía eléctrica: energía activable y distribuible bajo demanda. ¡Eso, a su vez, revolucionaría el panorama del consumo energético!
Por qué esto emplea
¿Cómo puede un diagrama de fases conseguirle un trabajo? ¡Es más fácil de lo que pensaste! Muchas empresas fabrican y utilizan materiales (como, casi todos), y en el uso de materiales muchas empresas tienen necesidades. Esto podría significar el desarrollo de materiales completamente nuevos o podría significar el ligero ajuste de las propiedades de los materiales existentes. Pero de cualquier manera, el punto de partida para cualquier diseño de materiales es el diagrama de fases del material. Y un lugar donde eso comienza es en saber calcular diagramas de fases. Hay empresas en las que podrías trabajar que hacen y venden directamente software sofisticado para calcular diagramas de fase (echa un vistazo a thermo-calc o factsage por ejemplo), y luego están las miles de empresas que publican trabajos donde se requiere conocimiento de cómo usar dicho software.
¿Quieres diseñar nuevos motores de cohetes? Lockheed tiene aberturas donde se requiere un profundo conocimiento de la termodinámica. O qué tal el “ingeniero termodinámico” que publica en United Launch Alliance (que también fabrica motores de cohetes). O si quieres que los edificios sean más eficientes energéticamente podrías unirte a PassiveLogic, que está trabajando en “desarrollar la tecnología de control de próxima generación para el futuro de las ciudades inteligentes”, y actualmente está buscando un “pasante de termodinámica y simulación”. O podrías unirte a uno de los spin-outs del MIT Course 3, Boston Metal, que está trabajando en una producción de metal más verde y tiene una apertura actual que solicita que los solicitantes tengan una “sólida comprensión del equilibrio termodinámico/fase”. Por supuesto, esta lista va entre miles porque en última instancia cualquier forma de ingeniería utiliza materiales, y la forma de los materiales utilizados se basa en su diagrama de fases.
Práctica extra
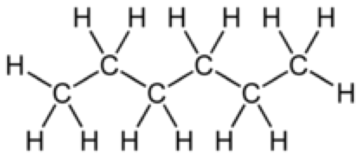
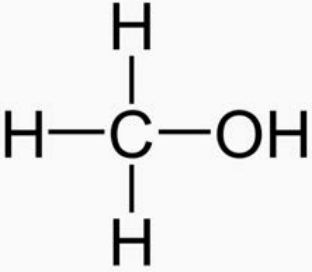
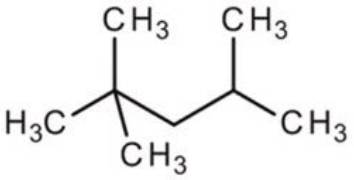
1. Clasifique las siguientes moléculas en orden ascendente de presión de vapor:
| i) Hexano | ii) Metanol | iii) Isooctano |
|---|---|---|
 |
 |
 |
- Contestar
-
El metanol tiene la menor presión de vapor porque su\(\mathrm{OH}\) grupo le permite unir hidrógeno a otras moléculas de metanol. El siguiente es el hexano porque, aunque no tiene capacidades de enlace de hidrógeno, es más lineal que el isooctano, por lo que puede experimentar mayores fuerzas de dispersión en Londres. El isooctano tiene la presión de vapor más alta porque no tiene capacidad de enlace de hidrógeno y es menos apilable que el hexano, por lo que tiene menos fuerzas de dispersión de Londres presentes.
2. Se utilizan tres cubitos de hielo para enfriar un refresco en\(20 \mathrm{C}\). El refresco tiene una masa de\(0.25 \mathrm{~kg}\). El hielo está en\(0 \mathrm{C}\) y cada cubo de hielo tiene masa\(6.0 \mathrm{~g}\). Encuentra la temperatura cuando todo el hielo se haya derretido.
- Contestar
-
Los cubitos de hielo están a la temperatura de fusión de\(0 \mathrm{C}\). El calor se transfiere del refresco al hielo. El derretimiento del hielo ocurre en dos etapas: primero se produce el cambio de fase y el hielo sólido se transforma en agua líquida a la temperatura de fusión, luego la temperatura de esta agua sube. La fusión produce agua en\(0 \mathrm{C}\), por lo que se transfiere más calor del refresco al agua hasta que el sistema de agua más soda alcanza el equilibrio térmico.
\[Q_{\text {ice }}=-Q_{\text {soda }} \nonumber\]
El calor transferido al hielo es:
\[Q_{i c e}=m_{i c e} \times L_f+m_{i c e} \times c_W \times\left(T_f-20 C\right) \nonumber\]
Trayendo todos los términos que involucran\(T_f\) en el lado izquierdo y todos los demás términos en el lado derecho, resuelven para la cantidad desconocida\(T_f\):
\[T_f=\dfrac{m_{\text {soda }} \times c_W \times 20 C-m_{i c e} \times L_f}{\left(m_{\text {soda }}+m_{i c e}\right) \times c_W} \nonumber\]
El valor resultante es\(13 \mathrm{C}\).
3. Imagine una sustancia con los siguientes puntos en el diagrama de fases: un punto triple a\(.5\) atm y\(-5^{\circ} \mathrm{C}\); un punto de fusión normal en\(20^{\circ} \mathrm{C}\); un punto de ebullición normal en\(150^{\circ} \mathrm{C}\); y un punto crítico en\(5 \mathrm{~atm}\) y\(1000^{\circ} \mathrm{C}\). La línea de líquido sólido es “normal” (es decir, pendiente positiva).
a) Esbozar aproximadamente el diagrama de fases, utilizando unidades de atmósfera y Kelvin.
- Contestar
-
1-sólido, 2-líquido, 3-gas, 4-fluido supercrítico, punto\(\mathrm{O}\) -triple punto,\(\mathrm{C}\) -punto crítico\(-78.5{ }^{\circ} \mathrm{C}\) (La fase del hielo seco cambia de sólido a gas en\(-78.5{ }^{\circ} \mathrm{C}\))
b) Describir lo que se vería a presiones y temperaturas superiores a 5 atm y\(1000^{\circ} \mathrm{C}\).
- Contestar
-
Uno vería un fluido supercrítico, al acercarse al punto, uno vería desaparecer el menisco entre el líquido y el gas.
c) Describir lo que sucederá con la sustancia cuando comience en un vacío\(-15^{\circ} \mathrm{C}\) y se presuriza lentamente.
- Contestar
-
La sustancia comenzaría como un gas y a medida que aumenta la presión, se comprimiría y eventualmente solidificaría sin licuarse ya que la temperatura está por debajo de la temperatura del punto triple.
Conferencia 15: Bandas electrónicas en sólidos
Resumen
Cuando dos átomos se unen, sus orbitales atómicos se combinan para formar un conjunto de orbitales moleculares enlazantes y\(\mathrm{MO}\) antiadherentes. Cuando los\(10^{24}\) átomos se unen para formar un sólido, sus orbitales atómicos se combinan para formar una banda continua de estados electrónicos. Las bandas están llenas de electrones: qué tan llenas se ponen depende de cuántos electrones contribuya cada constituyente y cuán estrechamente espaciadas en energía estén las bandas.
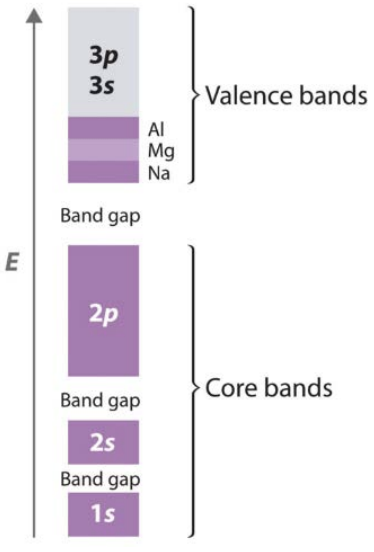
Por ejemplo, aquí está el diagrama de energía de banda para\(\mathrm{Na}\),\(\mathrm{Mg}\), y\(\mathrm{Al}\). Todos estos elementos tienen completo\(1\mathrm{s}\),\(2\mathrm{s}\), y\(2 \mathrm{p}\) bandas: estas “bandas centrales”, por lo tanto, están completamente llenas de electrones. \(\mathrm{Na}\)tiene un electrón de\(3 \mathrm{~s}^1\) valencia adicional, que se llena\(1 / 8\) de la\(3 \mathrm{~s} / 3 \mathrm{p}\) banda combinada. De igual manera,\(\mathrm{Mg}\) tiene valencia ocupación de electrones de\(3 \mathrm{~s}^2\) y\(\mathrm{Al}\) tiene\(3 \mathrm{~s}^2 3 \mathrm{p}^1\), que llenan aún más la\(3 \mathrm{~s} / 3 \mathrm{p}\) banda.
Aquí, las\(3 \mathrm{p}\) bandas\(3 \mathrm{~s}\) y se muestran como una banda combinada: cuando las bandas están muy cerca en energía, pueden superponerse, y esencialmente combinarse para formar un conjunto continuo de estados. Cuando hay una brecha de energía entre los electrones más energéticos que viven en una banda y los electrones menos energéticos que viven en la siguiente banda, se forma una brecha de banda, como los que se muestran aquí entre\(1\mathrm{s}\) y\(2\mathrm{s}\),\(2\mathrm{s}\) y\(2 \mathrm{p}\), y\(2 \mathrm{p}\) y\(3 \mathrm{~s} / 3 \mathrm{p}\) bandas. Obsérvese que el término banda prohibida se reserva para describir solo una de estas brechas de banda, como se discute a continuación.
Conocer el relleno de la banda nos dice mucho sobre las propiedades del sólido. Si la banda de mayor energía está parcialmente llena, el material es un metal. Si la banda más alta llena está completamente llena de electrones, entonces hay un hueco entre ella y la siguiente banda más alta: esta es la banda prohibida del material, y estos sólidos se llaman semiconductores. En los semiconductores, la banda de energía más alta que está completamente llena de electrones se llama banda de valencia, y la siguiente banda desocupada más alta se llama banda de conducción. Si el espacio de banda es muy grande, digamos\(>4\) o\(5 \mathrm{eV}\), entonces el material es eléctricamente aislante.
El intervalo de banda tiene una propiedad similar a la del antienlace\(\mathrm{MO}\) o nodos en\(\mathrm{AO}\) s de mayor energía: es decir, todas las energías dentro de la banda prohibida están prohibidas, por lo que todos los electrones deben estar en una banda, no en el medio. Dentro de una banda, los electrones pueden moverse: si no hay hueco y el material es un metal, es fácil que los electrones se muevan libremente, y la conductividad es alta. Es más difícil que los electrones se muevan en un semiconductor, pero es posible que un electrón obtenga un impulso de energía y la transición de una banda a otra; a menudo, estos refuerzos provienen de la luz o del calor. Por supuesto, se necesita menos energía para cruzar un pequeño espacio entre dos estados que uno grande: es mucho más probable que la energía térmica (aproximadamente\(0.025 \mathrm{eV}\) /átomo a temperatura ambiente\(300\mathrm{K}\)) excita un electrón en la banda de conducción de un semiconductor como\(\mathrm{Si}\) un aislante como el diamante ( \(\mathrm{C}\)).
Los electrones también se pueden excitar en la banda de conducción a través de la luz: los semiconductores con energía en el rango de aproximadamente\(1.5-3 \mathrm{eV}\) pueden ser excitados por la luz visible (aproximadamente\(400-800 \mathrm{~nm}\)). Si la longitud de onda de un fotón corresponde a la energía justa para que coincida con la banda prohibida, ese electrón puede saltar a través de la región de energía prohibida. ¡En este caso, salta a la banda de conducción y se vuelve libre para moverse! Con esto en mente, es posible controlar el flujo de electrones a través del hueco y la conductividad del semiconductor con luz. Si la banda prohibida es mayor que la luz visible de longitud de onda más baja, el material no puede absorber fotones de mayor energía y el material es transparente en el rango de luz visible.
Por qué esto importa
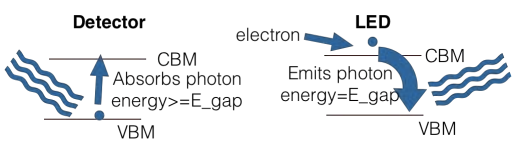
El mundo en el que vivimos usa mucha luz. Y en caso de que no te hayas dado cuenta, cada vez más de esa luz proviene de LEDs, o diodos emisores de luz. Ya sea su teléfono o computadora portátil o televisión o automóvil o refrigerador o casa u oficina o calle, lo más probable es que la forma en que se encienda es con LED. Y esos funcionan porque son semiconductores. Como se discutió en la conferencia, un semiconductor se forma cuando la unión en un material junto con su disposición estructural conduce a la formación de un espacio de banda del tamaño justo (unos pocos\(\mathrm{eV}\)). A partir de esto inmediatamente tenemos dos dispositivos conocidos. Primero, los electrones en la banda de valencia máxima (VBM) pueden ser excitados por la luz hacia el mínimo de banda de conducción (CBM) donde conducen, un dispositivo también conocido como fotodetector. Segundo, podemos tener lo contrario: poner electrones en el CBM y a medida que caen en cascada hacia el VBM, se emiten fotones, un dispositivo también conocido como LED.
En la conferencia 3, utilicé la televisión como tema de Why This Matters y mencioné que la razón por la que la televisión en color tardó tanto en desarrollarse fue que los fósforos rojos estables, económicos, eran un desafío. Para los LEDs resulta que también fue un color particular que retrasó su ubicuidad, pero en este caso era azul, en el extremo superior de la brecha. Para los fósforos fue la química la que tuvo la clave para inventar nuevas moléculas que pudieran absorber electrones y brillar en rojo. Una vez más, 50 años después, fue la química la que tuvo la clave para desbloquear un nuevo material, en este caso un semiconductor que pudiera tomar una corriente de electrones y convertirlos en luz azul. El truco viene en poder diseñar la brecha de banda del sólido.
Echa un vistazo a esta gráfica de banda prohibida vs. la constante de celosía, que es una medida del espaciamiento entre átomos en un cristal que se repite periódicamente. Estaremos cavando en cristales en unas semanas, pero por ahora puedes considerar que el eje x es simplemente cualquier característica estructural del sólido. El punto es que existe una fuerte dependencia, y una vez conocida y entendida esta dependencia, entonces se podrían desarrollar nuevas aleaciones con apenas la química y por lo tanto la estructura adecuadas, para dar justamente la banda prohibida correcta y por lo tanto el color.
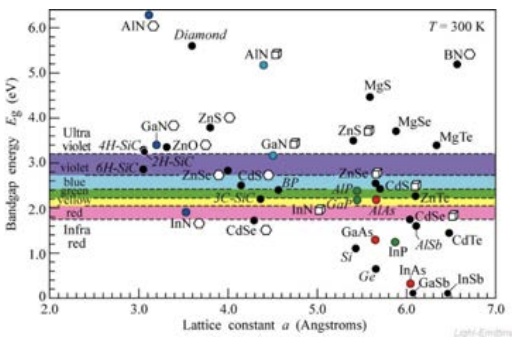
Eche un vistazo a\(\mathrm{GaN}\) la trama y observe que su banda prohibida es un poco demasiado alta si queremos que el azul se emita como electrones en cascada de su CBM a VBM. Por otro lado, otros materiales como INn tienen bandgaps que son mucho más bajos en energía que lo que se necesita para emitir azul. Resulta que alear diferentes materiales juntos es una de las formas más efectivas de “afinar la banda prohibida”, y así es exactamente como los científicos llegaron al azul. Ya tenían rojo y verde, así que una vez que se pusieron azules pudieron combinarlos todos juntos para obtener ledes blancos, que desde entonces se han apoderado por completo del mercado.
La idea de modificar a propósito la banda prohibida de un material se llama ingeniería bandgap, y es la pieza central de la revolución de semiconductores. Llega mucho más allá de los LEDs, ya que la banda prohibida es una propiedad crucial en láseres, transistores, detectores y mucho más de nuestro mundo electrónico.
Por qué esto emplea
¿Cómo puede el conocimiento de la estructura de banda de un sólido conducir a un trabajo? Esto puede, de hecho, ser el más fácil Por qué Esto Emplea sección para escribir de todo el semestre! Los semiconductores son tan ubicuos en nuestro mundo que es casi imposible moverse sin interactuar con ellos. Están en casi todos y cada uno de los dispositivos electrónicos. Son tan importantes que algunos llamarían a esto la era del semiconductor. La ley de Moore depende de fabricarles dispositivos más pequeños cada año. Hacen electricidad del sol. Proporcionan luz de la electricidad. Se comunican por nosotros. Ellos computan para nosotros. Podría continuar.
La industria de semiconductores es masiva y hay muchos empleos en muchas empresas, y muchos estudiantes del MIT pasan a trabajar en esta industria. Hay tantos trabajos en la industria de semiconductores que hay un sitio web llamado semiconductorjobs.com. Y muchos otros sitios web similares. Aún más interesante, la industria ya no se trata solo de hacer chips más rápidos o chips especializados como para la comunicación inalámbrica. Se ha vuelto mucho más grande debido a todas las diversas necesidades de estos materiales y dispositivos, desde electrónica de consumo hasta autos inteligentes, Hollywood, exploración espacial e inteligencia artificial. Hay trabajos relacionados con todas estas áreas, tanto en la industria tradicional de semiconductores (piensa, Intel, AMD, Semtech, TI, y decenas más), sino también en las empresas que trabajan en estas aplicaciones (piensa, Bosch, Toyota, Dreamworks, Microsoft, Google, y cientos, tal vez miles más), así como empresas haciendo ambas cosas, como Samsung.
Problemas de ejemplo
1. Supongamos que su LED está hecho de silicio y desea que absorba luz de mayor longitud de onda. ¿Se debe alear con germanio o carbono? Explica tu respuesta.
- Contestar
-
Absorber mayor longitud de onda = banda prohibida más pequeña. Por lo tanto, alear con\(\mathrm{Ge}\) un átomo mayor = menor banda prohibida.
2. A continuación se muestra una gráfica de la intensidad de la luz solar en la superficie terrestre en función de la longitud de onda
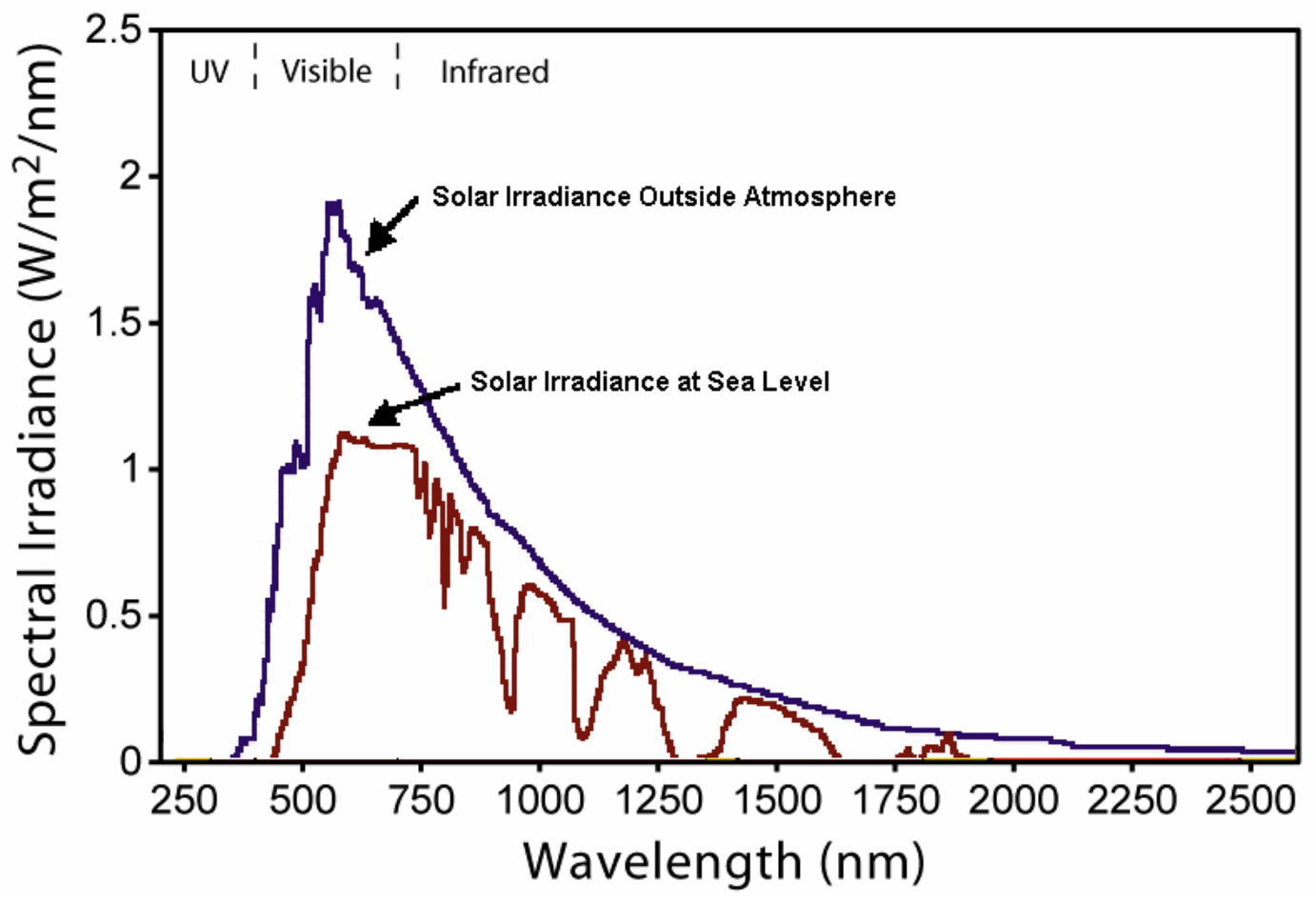
Calcule la longitud de onda de banda prohibida de cada uno de estos semiconductores conocidos y marque el rango de longitudes de onda de luz que cada semiconductor podría absorber. ¿Cuál crees que sería la peor célula solar? Elige uno:
- Contestar
-
Utilice el viejo truco de conversión de energía a longitud de onda:
\[E(e V)=\dfrac{1240}{\lambda(n m)} \nonumber\]
A.\(\mathrm{Si}\) (\(1.14 \mathrm{eV})=1088 \mathrm{~nm}=1.088\)micrones de banda prohibida
B.\(\mathrm{Ge}\) (\(0.67 \mathrm{eV})=1851 \mathrm{~nm}=1.851\)micrones de banda prohibida
C.\(\mathrm{GaAs}\) (\(1.39 \mathrm{eV})=892 \mathrm{~nm}=0.892\)micrones de banda prohibida
D.\(\mathrm{InSb}\) (\(0.16 \mathrm{eV})=7750 \mathrm{~nm}=7.750\)micrones de banda prohibida
Cada material absorberá la luz con longitudes de onda más cortas que esta longitud de onda de banda prohibida (así que todo a la izquierda de esa longitud de onda en la gráfica).
El espectro de absorción de InsB se extenderá bien fuera del lado de la gráfica (absorbe TODO) - pero debido a que la banda prohibida de InSb es tan pequeña, los electrones que excita no llevan mucha energía (pierden el exceso al calor) así que sería una célula solar horrible.
A.\(\mathrm{Si}\) (banda gap\(1.14 \mathrm{eV}\))
B.\(\mathrm{Ge}\) (banda gap\(0.67 \mathrm{eV})\)
C.\(\mathrm{GaAs}\) (banda gap\(1.39 \mathrm{eV}\))
D.\(\mathrm{InSb}\) (banda gap\(0.16 \mathrm{eV}\))
3. Tienes tres materiales diferentes:\(\mathrm{AlP}\) (banda gap\(2.45 \mathrm{eV}\)),\(\mathrm{SiC}\) (banda gap\(3.0 \mathrm{eV}\)) y\(\mathrm{CdSe}\) (banda gap\(1.74 \mathrm{eV}\)). ¿Cuál de los siguientes tres arreglos geométricos probablemente sea el más eficiente para convertir la luz solar en electricidad? Explica tu respuesta.
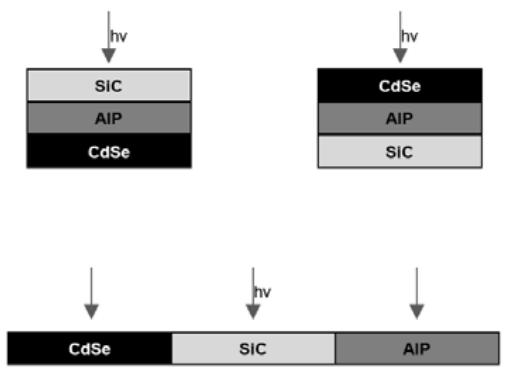
- Contestar
-
Arriba a la izquierda: todas las longitudes de onda absorbidas y menor energía térmica liberada.
Conferencia 16: Semiconductores y Dopaje
Resumen
Los semiconductores tienen este nombre porque su conductividad de electrones se encuentra en algún lugar entre la de los aisladores y los metales. La brecha de banda de un semiconductor, es decir, el espacio entre su banda de conducción y la banda de valencia, es mayor que la de un metal pero menor que la de un aislante. Inicialmente, los electrones están unidos a la red (la disposición de los átomos en el sólido) y no pueden conducir. Sus estados energéticos están dentro de la banda de valencia. Para que los electrones conduzcan, deben obtener suficiente energía para salir de la banda de valencia y entrar en la banda de conducción, lo que implica pasar la banda gap (estados de energía prohibidos).
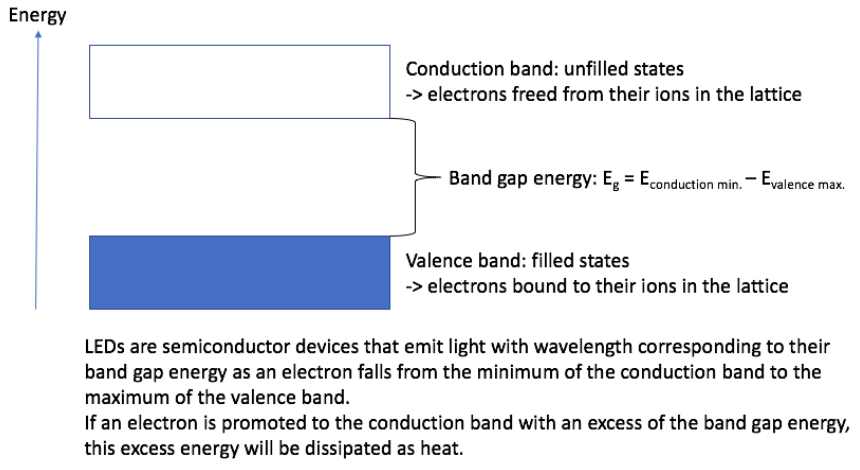
Dos formas en que estos electrones inicialmente unidos pueden lograr la conducción son a través de una transferencia de energía térmica y a través del dopaje, lo que implica introducir impurezas (un número relativamente pequeño de átomos extraños en comparación con el número de átomos en la red) para aumentar la densidad de portadores de carga (electrones o agujeros, la ausencia de un electrón que esencialmente actúa como una carga positiva). (Nota: hay una tercera manera que discutimos en la última conferencia, pateando electrones por encima de la brecha usando fotones). Existen dos tipos de dopaje,\(\mathrm{p}\) tipo y\(\mathrm{n}\) tipo. \(\mathrm{P}\)el dopaje de tipo implica agregar impurezas con menos electrones que los átomos en la red no dopada (es decir, aluminio dopado en silicio). \(\mathrm{P}\)tipo dopaje crea agujeros. La presencia de estos agujeros permite la conducción en la celosía y la creación de un nivel de energía aceptor.
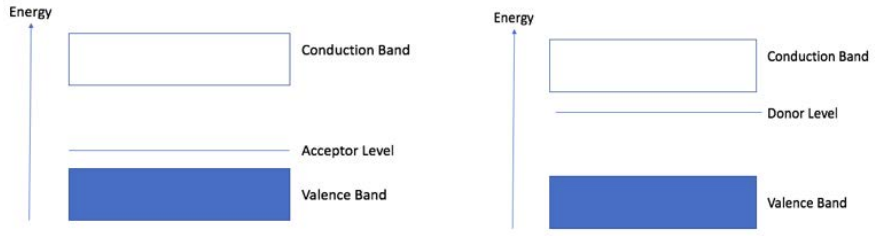
\(\mathrm{N}\)el dopaje de tipo implica agregar impurezas con más electrones que los átomos en la red no dopada (es decir, fósforo dopado en silicio). \(\mathrm{N}\)El dopaje tipo introduce electrones adicionales (portadores de carga negativa). Estos electrones tienen una energía correspondiente al nivel del donante, y son capaces de conducir con una suma mucho menor de energía en comparación con los electrones en la banda de valencia.
Por qué esto importa

Toda la industria de semiconductores se basa en formas de dope\(\mathrm{Si}\)\(\mathrm{Ge}\),\(\mathrm{GaAs}\), y otros semiconductores con cantidades precisas de impurezas deseadas, para hacer semiconductores\(\mathrm{n}\)\(\mathrm{p}\) tipo y tipo que luego se ponen en miles de millones en un solo chip en extremadamente complicado arreglos. Es así como se hizo el primer transistor, al poner en contacto entre sí un semiconductor\(\mathrm{n}\)\(\mathrm{p}\) tipo y tipo. Puedes aprender todo sobre el primer transistor en tantos grandes recursos (como esta breve explicación de video por ejemplo, https://www.youtube.com/watch?v=JBtEckh3L9Q). Aquí hay una foto de ese primer transistor, que no se parece a lo que hoy verías en un chip de computadora, pero es el primer cruce p-n y abrió la puerta a una revolución.
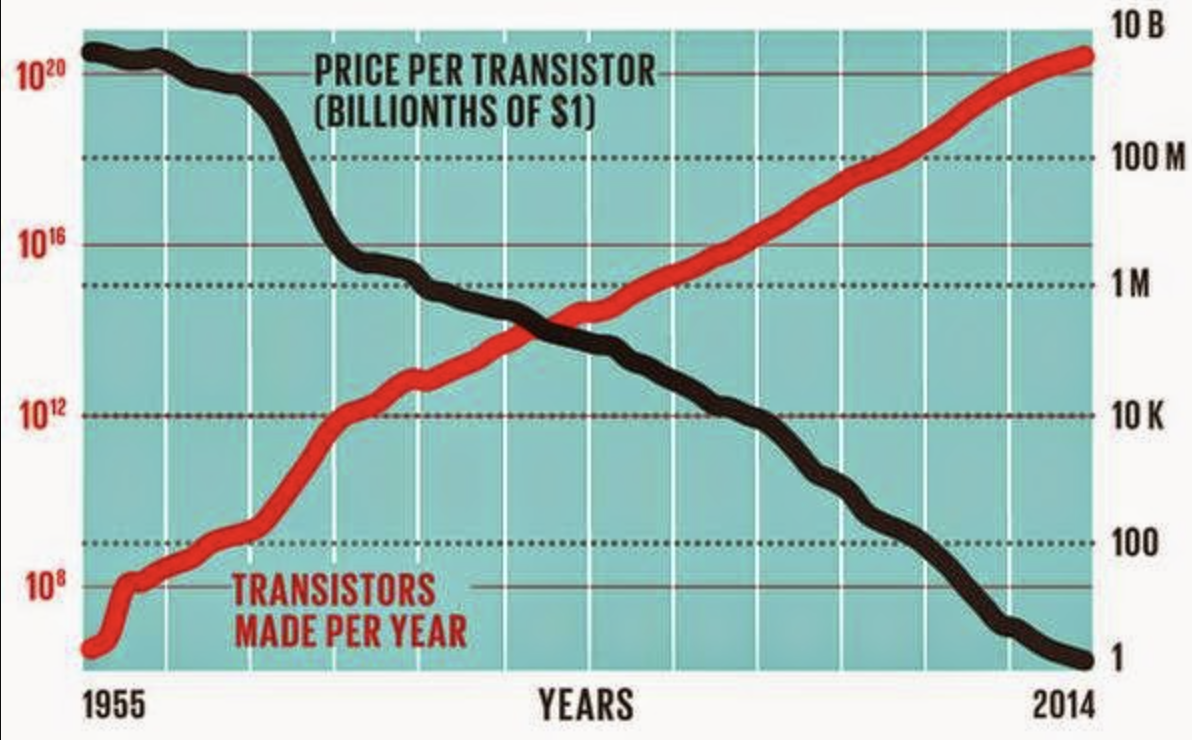
Sólo para tener un poco de perspectiva: En 2014 se fabricaron 250 mil millones de transistores, lo que equivale a un ritmo de 8 billones de transistores por segundo. Aquí hay una tabla de lo que llamamos la ley de Moore, que no es una ley en absoluto sino simplemente lo que sucede cuando muchos científicos e ingenieros increíblemente inteligentes trabajan en algo durante 60 años.
Hablando de inteligente, ¿cómo hacemos nosotros, como humanos, nuestra computación natural? ¿Cómo se apilan las computadoras que hacemos hasta los cerebros que usamos para hacerlos? Verás, la ley de Moore se ve, y es, impresionante, pero es una medida de la potencia informática, no del consumo de energía. Los centros de datos por sí solos actualmente representan el 3% de\(\mathrm{CO}_2\) las emisiones globales y las estimaciones son que dentro de 10 años más del 20% de toda la electricidad será consumida por TI. La mayor parte de esta energía se destina al envío de corriente a través de billones y billones de semiconductores\(\mathrm{p}\)\(\mathrm{n}\) tipo y tipo.
Sólo por diversión, comparemos la potencia consumida por una computadora que tiene el número equivalente de procesadores que el cerebro humano. Un cerebro humano adulto típico tiene alrededor de\(10^{11}\) neuronas, o células nerviosas, cada una conectada a aproximadamente\(10,000\) otras neuronas a través de conectores llamados sinapsis, que son las superautopistas del procesamiento de información en el cerebro. Un cerebro tiene un total de alrededor de\(10^{14}\) sinapsis. Con 1 transistor equivalente a aproximadamente\(10\) sinapsis, podemos construir una computadora tan poderosa como el cerebro, o al menos con tanta capacidad informática, con chips de\(10^6\) computadora (cada chip empacando\(10\) mil millones de transistores). Esto requeriría alrededor\(10\mathrm{MW}\) al poder. Eso es\(10,000,000\) Watts de potencia necesarios para hacer funcionar el cerebro artificial. En comparación, ¡el cerebro humano funciona sobre\(20\) Watts!
La razón por la que estoy haciendo esta comparación en nuestra Why This Matters es que la\(\mathrm{p} - \mathrm{n}\) unión y el transistor provocaron una revolución asombrosa que abarcó muchos órdenes de magnitud. Pero aún nos faltan otros 6 ceros en la reducción del consumo de energía, si alguna vez queremos tratar de igualar el cerebro, para lo cual claramente se necesita otra revolución.
Por qué esto emplea
Desde que mencioné el cerebro humano y lo comparé con chips de computadora, enfoquemos esta sección en la interfaz cerebro-máquina. Este ha sido, por supuesto, el tema de muchas películas de ciencia ficción (sí, The Matrix), pero también ha sido el foco de muchos laboratorios de investigación y programas gubernamentales durante al menos los últimos 30 años. Esto se debe al enorme potencial de permitir que la interfaz humano-cerebro ayude a pacientes con una amplia gama de enfermedades neurodegenerativas. Y todo este trabajo nos ha llevado a un momento bastante emocionante en los esfuerzos por fusionar el cerebro con las máquinas, una en la que se están formando muchas nuevas entidades comerciales.
Elon Musk, por ejemplo, lanzó Neuralink hace unos años. Esta es una compañía bastante emocionante no solo por su concepto inicial, sino también porque han traído equipos altamente talentosos e interdisciplinarios de científicos, médicos e ingenieros. Muchas de las personas involucradas en tal esfuerzo necesitarán saber sobre los semiconductores y el dopaje, y en este caso el serio desafío de crear electrónica que sean “amigables con el cerebro” (echar un vistazo a la obra del profesor John Rogers, como ejemplo). Varias empresas han invertido en esta área, como Boston Scientific, Abbot, Blackrock Microsystems, CorTec, o NeuronExus, por nombrar solo algunas. Y los programas de gobierno también están creciendo esfuerzos, por ejemplo a través de DARPA o la Iniciativa NIH BRAIN.
Problemas de ejemplo
1. Los niveles de dopaje en semiconductores suelen variar de\(10^{13} / \mathrm{cm}^3\) a\(10^{18} / \mathrm{cm}^3\), dependiendo de la aplicación. En algunos dispositivos (como los transistores) se necesitan varios\(\mathrm{n}\) - y materiales de\(\mathrm{p}\) tipo con diferentes concentraciones de dopaje.
\(\mathrm{Si}\)tiene una densidad de\(2.328 \mathrm{~g} / \mathrm{cm}^3\). ¿Cuál es la relación de\(\mathrm{Si}\) átomos a átomos dopantes en el\(10^{13} / \mathrm{cm}^3\) dopaje y el\(10^{18} / \mathrm{cm}^3\) dopaje?
- Contestar
-
Para encontrar la relación entre\(\mathrm{Si}\) átomos y átomos dopantes, necesitamos encontrar el número de\(\mathrm{Si}\) átomos por cúbico\(\mathrm{cm}\). Este es un problema sencillo de estequiometría:
\[\dfrac{2.328 \mathrm{gSi}}{1 \mathrm{~cm}^3 \mathrm{Si}} \times \dfrac{1 \mathrm{molSi}}{28 \mathrm{gSi}} \times \dfrac{6.022 \times 10^{23} \text { atomsSi }}{1 \mathrm{molSi}}=\dfrac{5 \times 10^{22} \text { atomsSi }}{\mathrm{cm}^3} \nonumber\]
Ahora tomamos la relación de\(\mathrm{Si}\) átomos a átomos dopantes, obteniendo:
a)\(5 \times 10^{22}: 10^{13}=5,000,000,000: 1\)
b)\(5 \times 10^{22}: 10^{18}=50,000: 1\)
a)\(10^{13} / \mathrm{cm}^3\)
b)\(10^{18} / \mathrm{cm}^3\)
2. Te drogas\(\mathrm{Ge}\) con\(2.43 \mathrm{mg} \mathrm{Mg}\).
a. ¿Qué tipo de dopaje es este? ¿Qué transportistas de carga se introducen?
- Contestar
-
\(\mathrm{p}\)dopaje tipo; se introducen agujeros
b. ¿Cuántos portadores rinde cada sustitución?
- Contestar
-
cada sustitución produce 2 portadores
c. Calcular el número de transportistas de carga creados por la adición de\(2.43 \mathrm{mg} \mathrm{Mg}\).
- Contestar
-
\ begin {alineado}
2.43\ mathrm {mg}\ veces 10^ {-3}\ frac {\ mathrm {g}} {\ mathrm {mg}}\ veces\ frac {1\ mathrm {~mol}} {24.3\ mathrm {~g}} =10^ {-4}\ mathrm {~mol}\
\ text {2 portadores por sustitución:} 2\ veces 10^ {-4}\ mathrm {~mol}\ texto {agujeros}\\
2\ veces 10^ {-4}\ tiempos 6.602\ veces 10^ {23} =1.32\ veces 10^ {20}\ texto {agujeros}
\ final {alineado}
d. ¿Con qué cantidad\(\mathrm{Ge}\) deberías empezar si quieres una densidad de portador de carga de\(1016 / \mathrm{cm} 3\)?
- Contestar
-
\ begin {alineado}
10^ {16}\ texto {portadores}/\ mathrm {cm} ^3=1.32\ veces\ frac {10^ {20}} {x}\\
x=1.32\ veces 10^4\ mathrm {~cm} ^3\ mathrm {Ge}
\ end {alineado}
3. Para\(13 \mathrm{~cm} 3\) de\(\mathrm{Si}\), calcular el número de miligramos de\(\mathrm{B}\) átomos necesarios para tener\(3.091^* 10\) 17 portadores/\(\mathrm{cm}^3\). Supongamos que el dopante sólo se incorpora sustitucionalmente en el\(\mathrm{Si}\).
- Contestar
-
\(\mathrm{p}\)tipo: los portadores son agujeros
\(13 \mathrm{~cm}^3 \times \dfrac{3.091 \times 10^{17 \text { carriers }}}{1 \mathrm{~cm}^3} \times \dfrac{1 \text { atom }}{1 \text { carrier }} \times \dfrac{1 \mathrm{~mol}}{6.022 \times 10^{23} \text { atoms }} \times \dfrac{10.81 \mathrm{~g}}{1 \mathrm{~mol}} \times \dfrac{1000 \mathrm{mg}}{1 \mathrm{~g}}=0.0721 \mathrm{mg}\)
Conferencia 17: Bonos Metálicos y Propiedades de los Metales
Resumen
Los metales se forman a partir de átomos que tienen bandas electrónicas parcialmente rellenas: los electrones de valencia están unidos libremente, formando un mar de electrones en todo el sólido. Los electrones de valencia liberados son libres de moverse alrededor de los cationes fijos: son compartidos por todos los átomos en el sólido, en lugar de fijarse a un átomo específico. Los enlaces que se forman entre los átomos metálicos se denominan enlaces metálicos. A diferencia de los enlaces iónicos o covalentes, donde los electrones involucrados en el enlace están estrechamente unidos con los iones, los enlaces metálicos no pertenecen a un ion u otro.
Los metales se caracterizan por su alta conductividad eléctrica, alta conductividad térmica, alta capacidad calorífica, ductilidad y brillo. Cada una de estas propiedades puede correlacionarse con la estructura electrónica y la imagen del mar de electrones.
Debido a que las bandas electrónicas en los metales se superponen, no hay espacio de banda, los electrones pueden moverse libremente a través de los estados de energía muy espaciados. Si un electrón en la superficie se perturba, es fácil que la energía se transfiera a través del sólido: el modelo Drude para la conducción relaciona la deriva de electrones con el campo aplicado, produciendo conductividad. Los electrones libres también pueden vibrar, por lo que los metales sólidos pueden transferir eficientemente energía térmica o calor. La conductividad térmica de los metales es directamente proporcional a la conductividad eléctrica a través de la ley Wiedemann-Franz. Las propiedades de los metales también se pueden controlar a través de la aleación. Por ejemplo, el bronce es una aleación metálica con\(\mathrm{Cu}\) y\(\mathrm{Sn}\) en una proporción 4:1. Aunque la presencia de\(\mathrm{Sn}\) disminuye la conductividad general al 10% del cobre puro, el bronce es mucho más resistente a la corrosión. El latón es una aleación metálica con\(\mathrm{Cu}\) y\(\mathrm{Zn}\) en una relación 2:1. Aunque la conductividad es 28% del cobre puro, el latón es mucho más maleable que el cobre puro.
Dos propiedades mecánicas son compartidas por la mayoría de los metales: maleabilidad y ductilidad. Ambos son una medida de cuánto puede deformarse un material sin romperse. Los materiales maleables se pueden comprimir mucho sin romperse, mientras que los metales dúctiles se pueden estirar mucho sin romperse. La alta maleabilidad y ductilidad permiten que los sólidos metálicos se estiren en alambres o se martillen en formas complejas. Por ejemplo, una varilla de platino de 1 cm de diámetro y 10 cm\(\equiv 2777 \mathrm{km}\) de largo se puede introducir en el alambre simplemente tirando. Sorprendentemente, estas propiedades mecánicas pueden correlacionarse directamente con la estructura electrónica. A medida que el sólido se deforma y los iones se mueven, el mar de electrones puede moverse fácilmente, permitiendo que los átomos se reorganicen sin romper suficientes enlaces para provocar la fractura.
Las tendencias periódicas en la fuerza de unión metálica están directamente relacionadas con la estructura electrónica. Los enlaces metálicos suelen ser más débiles para elementos con subconchas de valencia casi vacías (\(\mathrm{Cs}\)\(\mathrm{Hg}\)) o casi completas (), y más fuertes para elementos con conchas de valencia medio llenas (\(\mathrm{W}\)). Cuando la banda de valencia está medio llena de electrones, se maximiza la relación de orbitales de unión: orbitales antiadherentes. En\(\mathrm{MO}\) teoría, los orbitales atómicos se combinaron para formar estados de unión y antiunión. En la imagen de la banda, la parte inferior de la banda de valencia representa el carácter de\(100 \%\) unión y la parte superior de la banda representa el carácter\(100 \%\) antiadhesión. Por lo tanto, los bonos de valencia medio llenos producen los enlaces metálicos más fuertes. Para los metales de transición, los orbitales atómicos son tan cercanos en energía que a menudo se superponen, creando amplias bandas de energía con características compartidas. Los metales en los grupos 6-9 tienen más probabilidades de tener bandas de valencia\(\approx\) medio llenas, por lo que los enlaces metálicos que forman son más fuertes.
Por qué esto importa
La corrosión de los metales es la peor. El costo global de la corrosión se estima en $2.5 billones. ¡Sí, trillón! Esto equivale a 3.4% del PIB global en 2013. No pensamos mucho en la corrosión en nuestro día a día. Pensamos en ello como la oxidación de los radios de una rueda de bicicleta o algunos engranajes de aspecto antiguo. Pero si una tubería se corroe lo suficiente, puede agrietarse. Si un bote se corroe lo suficiente, puede hundirse. Se trata de problemas extremadamente graves que implican no sólo una dramática pérdida de dinero, sino también un grave riesgo de seguridad y una posible pérdida de vidas. Si profundiza en el tema de la corrosión, encontrará que muchas industrias han adoptado lo que llaman, “sistemas de gestión de la corrosión”. Lo que esto realmente significa es que son conscientes de que es un gran problema, y van a intentar hacer algo al respecto. Pero, ¿qué pueden hacer? La respuesta a esa pregunta es, por supuesto, la química. Y debido a la química, se ahorran 500 mil millones de dólares anuales al prevenir, o al menos ralentizar drásticamente, la corrosión. Se necesita mucho más trabajo por hacer.

La industria automotriz es un excelente ejemplo de una industria que ha pasado del control mínimo de la corrosión en la década de 1970, cuando la vida de un automóvil se fijó típicamente por la corrosión de la carrocería y el marco, al control de corrosión de última generación a través de la tecnología avanzada de pintura/recubrimiento y el uso de corrosión- materiales resistentes. En este capítulo mencioné el uso de la aleación como una forma de hacer que los metales sean más resilientes, con el ejemplo del bronce que es el cobre con una pizca de estaño. Así es exactamente como se desarrollan los recubrimientos anticorrosión y pueden venir en forma de pinturas o capas adicionales de aleación metálica o tratamiento de superficies metálicas existentes. Los metales estructurales grandes como los que se usan en puentes o turbinas eólicas a menudo se tratan con recubrimientos a base de zinc y aluminio para proporcionar prevención de corrosión a largo plazo, mientras que muchos sujetadores de acero y hierro están recubiertos con una capa delgada de cadmio para bloquear la absorción de hidrógeno, lo que puede provocar grietas por tensión. Las aleaciones de níquel-cromo y cobalto-cromo se utilizan a menudo como recubrimientos de prevención de corrosión debido a que tienen muy bajos niveles de porosidad lo que las hace extremadamente resistentes a la humedad, lo que a su vez inhibe la oxidación. Cerámicas de óxido como la alúmina (¡que recuerdan que ya discutimos cuando hablamos de enlaces iónicos!) puede hacer recubrimientos excelentes y fuertes.
La química de la corrosión es un área de investigación altamente activa y extremadamente importante, y una comprensión más profunda de la química de cómo ocurre, así como cómo se puede usar la química para prevenirla, representa un desafío masivo continuo y una enorme oportunidad.
Por qué esto emplea
¿Cómo puede el metal hacer un trabajo? Vamos con un ejemplo que es una gran parte de nuestro futuro, y de hecho es realmente genial: la impresión 3D. De metales. En pocos años, la impresión 3D de metales ha pasado de concepto a franja a casi convencional. Muchas empresas ahora pueden imprimir piezas metálicas en 3D y muchas innovaciones siguen sucediendo en estas empresas. ¿Qué tipo de personas contratan estas empresas? ¡Los que saben del mar de electrones, claro!
Hay muchas empresas en este espacio, incluida una de las nuestras, un spin-out basado en MIT llamado Desktop Metal que se formó en 2017. Uno de los aspectos emocionantes de la impresión 3D de metal es que no hay un estándar, al menos aún no. Tantas empresas diferentes están trabajando en empujar las fronteras de diferentes tecnologías, desde Desktop Metal que usa algo que llaman Bound Metal Deposition, hasta Concept Laser que sinters metales con un láser y ahora es propiedad de GE, hasta Arcam (también ahora propiedad de GE) que utiliza un haz de electrones para fundir el metal, a Xact Metal que usa algo llamado Powder Bed Fusion, a ExOne que usa algo llamado chorro de aglutinante, a Vader Systems que utiliza campos magnéticos, a Cytosurge que reclama resolución nanométrica, a muchas más empresas y muchos más enfoques para el proceso de impresión. Todos estos enfoques requieren el desarrollo continuo de nuevas químicas (“tintas”) y nuevas formas de manipularlas en formas personalizadas, complejas y de alta resolución.
Problemas de ejemplo
1. Metales vs. semiconductores
a) ¿Por qué los metales son mejores sonductores eléctricos que semiconductores?
- Contestar
-
Los metales no tienen banda prohibida, por lo que sus electrones pueden conducir libremente, dando lugar al efecto “mar de electrones”
b) ¿Con qué frecuencia los semiconductores dopados alcanzan los niveles de conductividad eléctrica de los metales?
- Contestar
-
El dopaje en semiconductores nunca es suficiente para alcanzar los niveles de conductividad de los metales. Esto se debe a que la concentración de dopantes (las impurezas que aportan electrones o huecos al material a granel) es extremadamente pequeña y no es suficiente para alterar la estructura de bandas del material.
2. ¿Por qué la plata (\(\mathrm{Ag}\)) es más conductora eléctrica que el platino (\(\mathrm{Pt}\))?
- Contestar
-
\(\mathrm{Ag}\)es más eléctricamente conductor que\(\mathrm{Pt}\) debido al radio atómico; el aumento del tamaño de los átomos conduce a un mayor espaciamiento atómico, lo que aumenta el movimiento de los electrones
3. Clasifique los siguientes metales en orden de aumentar la fuerza de unión metálica y explique su razonamiento:
A.\( \mathrm{Co}\)
B.\(\mathrm{Cd}\)
C.\(\mathrm{W}\)
D.\(\mathrm{Ni}\)
- Contestar
-
Los enlaces metálicos tienden a ser más débiles para los elementos que tienen conchas de valencia casi vacías o casi llenas. Son más fuertes para aquellos con conchas de valencia medio llenas. Por lo tanto,
más débil:\(\mathrm{Cd}, \mathrm{Ni}, \mathrm{Co}\), más fuerte:\(\mathrm{W}\)
Conferencia 18: El sólido perfecto: Cristales
Resumen
Los sólidos cristalinos poseen un orden de largo alcance: la disposición de los enlaces juega un papel importante en la determinación de las propiedades de los cristales. Cada cristal tiene una celda unitaria, una unidad repetitiva como un sello que puede ser embaldosado en un patrón. A menudo, hay muchas celdas unitarias que podrían elegirse para un cristal dado; es convencional seleccionar la celda unitaria más pequeña que contenga toda la información necesaria. En la figura, (a), (b) y (c) todos muestran celdas unitarias válidas y cómo se tejan, pero (d) no es válido porque cuando se tejan, no cubre todo el espacio: hay huecos. En el espacio 3D, las celdas unitarias compuestas por diversas disposiciones atómicas dan información sobre los sólidos cristalinos. La celda unitaria también da información sobre cómo se empaquetan los átomos. La fracción de empaquetamiento es una medida de cuánto del área 2D de la celda unitaria se llena con átomos:
Fracción de empaque = (área ocupada por átomos)/(área total disponible)
En el espacio 3D, solo hay 7 celdas unitarias distintas que pueden llenar todo el espacio sin huecos. Bravais descubrió cómo organizar los átomos en celdas unitarias; resulta que solo hay 14 celosías Bravais únicas. En 3.091, nos enfocaremos en celdas unitarias cúbicas, que tienen todos los lados de la misma longitud y todos los ángulos = 90 grados. Hay tres celdas unitarias cúbicas distintas.
La fila superior indica la posición de los centros de átomos para cada una de las celosías cúbicas. A continuación, los átomos se muestran como llenando la cantidad máxima de volumen: esto ayuda a visualizar cuántos átomos hay en cada celda unitaria. Finalmente, cada una de las celdas unitarias se muestran en el contexto de una sección mayor de un cristal. Varias métricas clave ayudan a determinar las propiedades macroscópicas de un cristal, incluyendo la fracción de empaquetamiento atómico (APF) y el número de coordinación. La fracción de empaquetamiento atómico se calcula en el espacio 3D:
APF= (átomos en celda unitaria) * (volumen de átomo)/(volumen de celda unitaria)
El volumen de un átomo puede aproximarse como el volumen de una esfera dura:\(V=4 / 3 * \pi * r^3\). Para cada una de las celosías cúbicas, el radio de la esfera dura apropiada puede relacionarse con la constante de celosía (ancho de la celda unitaria). Por último, el número de coordinación, o el número de vecinos más cercanos, da información sobre cuántos átomos están disponibles para formar enlaces. El número de átomos en la celda unitaria es la suma de las partes de átomos compartidas entre las celdas unitarias vecinas. Por ejemplo, la célula unitaria cúbica centrada en el cuerpo (BCC) tiene un átomo completo en el centro y también un átomo en cada esquina que se comparte equitativamente entre 8 células. Por lo tanto, el número total de átomos en una celda unitaria BCC es de 8*1/8+1=2 átomos/celda unitaria.
Por qué esto importa
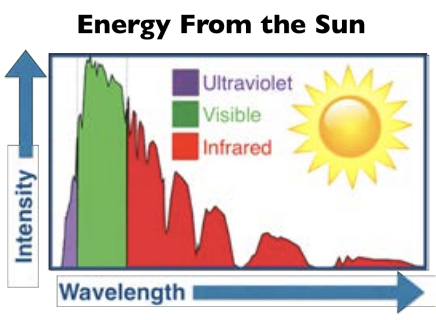
Volvamos a una aplicación de semiconductores que mencioné hace algunas conferencias pero que no profundizé en. Se trata de usar energía luminosa para excitar electrones por encima de la banda prohibida, y el hecho de que esto significa que puedes aprovechar la luz como una forma de electricidad con los materiales adecuados. Eso se llama célula solar, o dispositivo fotovoltaico. Aquí está la energía que recibimos en el planeta tierra del sol. Vimos esta trama cuando dimos el ejemplo de la molécula de ozono como una razón clave por la que no recibimos mucha radiación UV en el planeta (ya que el ozono la absorbe en lo alto de la atmósfera). Esta vez, estoy usando la gráfica para mostrar que no sólo la intensidad depende fuertemente de la longitud de onda de la luz, sino que gran parte de la energía que recibimos viene ya sea en las partes visibles o infrarrojas del espectro. Ingenuamente, se puede pensar que la mejor célula solar simplemente absorbería todo; en el lenguaje de nuestras conferencias bandgap y semiconductores, eso significa que tendría una banda prohibida muy pequeña, ya que cuanto menor sea la brecha, menor será la energía del fotón para excitar un electrón por encima de la brecha. En una célula solar, una vez que un electrón se excita por encima del hueco, esa carga negativa se extrae entonces del dispositivo de la banda de conducción, mientras que el agujero positivo se extrae de la banda de valencia. Esos cargos extraídos pueden funcionar (como cargar su teléfono).
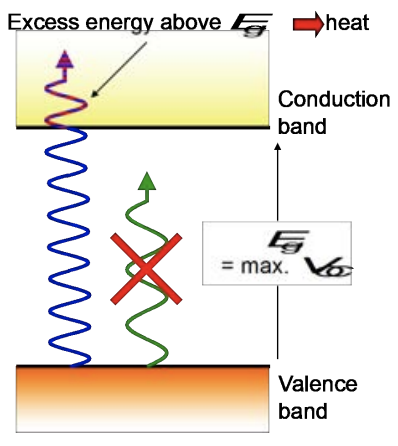
¡Ah, pero fue tan fácil! El reto es que una vez que el electrón se excita muy rápidamente “termaliza” hasta el fondo de la banda de conducción. Es un proceso que ocurre tan rápido que hay muy poco que podamos hacer al respecto (aunque hay un área activa de investigación para extraer “electrones calientes” de los materiales, antes de que puedan termalizarse, pero no hay dispositivos que funcionen en este momento). Esta termalización significa que la cantidad de energía que el electrón puede tener cuando está listo para hacer el trabajo, por muy alta que sea de energía el fotón que lo excitó, es igual a la energía de la banda prohibida. Eso se muestra aquí en este diagrama de energía como la línea squiggly azul. Un fotón de esta energía azul sería absorbido por el material, y el electrón excitado no perdería ninguna energía ya que no iba más alto que la banda prohibida. Pero si se absorbe una luz de mayor frecuencia, como ese garabato púrpura, entonces el fotón aún crea un electrón excitado en el material, aunque se pierde cualquier exceso de energía por encima de la banda prohibida, ya que el electrón cae rápidamente al mínimo de banda de conducción antes de que pueda extraerse.
Por otro lado, si el fotón que entra tiene una energía menor que la banda prohibida, diga ese garabato verde en el diagrama, entonces no será absorbido en absoluto (no hay estados presentes para excitarse). Y he aquí por qué es tan importante entender la química de las células solares, ya que tenemos impulsores competidores: cuanto menor sea la brecha, más se puede absorber ese espectro, pero cuanto menos energía tenga el electrón para trabajar y más energía se pierde por la termalización, mientras que cuanto mayor es la brecha, más energía es el electrón tiene en ese CBM, pero se pueden absorber menos fotones. Esto se debe a que, como aprendimos, el semiconductor sólo puede absorber luz igual o mayor en energía a su banda gap. Esta compensación significa que hay una banda prohibida óptima para una célula solar hecha de un solo material, y esa brecha óptima es de alrededor de 1.3\(\mathrm{eV}\). Eso está bastante cerca de la banda prohibida del silicio, que es 1.1\(\mathrm{eV}\).
Sí, ¡pero eso es solo si tenemos un cristal perfecto! De hecho, el silicio podría tener una banda prohibida mucho menor, dependiendo de lo bueno que sea un cristal. Si tiene defectos (estas son interrupciones en la celosía y estad atentos, ¡ese tema llegará pronto!) , entonces la banda prohibida puede ir muy abajo, con el límite de que el silicio podría incluso llegar a ser metálico si la cristalinidad se estropeaba demasiado. Esto explica parte de la razón por la que el silicio ha sido caro y también tiene que ir sobre el vidrio en lugar de sustratos plásticos: es decir, porque una célula solar de silicio tiene que hacerse muy gruesa (100's de micras).
La verdad del asunto es que el silicio es un terrible absorbedor de luz. Así es, el material de células solares que domina el mercado mundial en\(> 85\%\) es horrible al hacer una de las cosas más importantes que necesita hacer: absorber la luz solar. El silicio sigue siendo capaz de absorber, claro, pero simplemente es ineficiente así que solo tiene que hacerse muy grueso para capturar toda la luz. Compare eso con otros materiales que pueden absorber la luz de manera eficiente como una molécula de tinte, que podría absorber toda la energía del sol en capas 1000x más delgadas. El grosor del silicio es de doble golpe: primero, significa que la célula solar es quebradiza, no puede doblarse y debe ir sobre vidrio lo que hace que todo el dispositivo sea pesado, y 2) significa que las cargas excitadas tienen una distancia mucho mayor para recorrer en el material antes de que puedan alcanzar un electrodo y ser extraídas para el trabajo. Y eso significa alto costo, ya que es mucho material que necesita ser hecho lo más perfectamente cristalino posible. Se puede (casi) hacer, pero es difícil, caro y requiere enormes plantas de fabricación. Pero obteniendo esa calidad, esa cristalinidad a grandes distancias (¡sí, los micrones son distancias muy grandes para un electrón o un átomo!) , vale la pena porque la cristalinidad es la clave de las propiedades semiconductoras. En este caso, es el transporte de electrones del que estamos hablando, y cuanto más ordenada y cristalina sea la celosía, mejor se moverán las cargas.
Por qué esto emplea
Dado que esta conferencia se trata de cristalinidad, echemos un vistazo a las oportunidades de empleo en la fabricación de cristales. Es cierto que se pueden desenterrar rocas del suelo y es posible que ya tengan orden cristalino en ellas, como el interior de esta roca que se muestra aquí. Pero la mayoría de las veces estos cristales son inútiles para la tecnología ya que contienen todo tipo de orientaciones todas mezcladas, a menudo tienen muchos defectos en ellos, y además generalmente no son elementos puros sino minerales que contienen el elemento de interés junto con impurezas (como el oxígeno). Entonces la pregunta es: ¿cómo se hace de un cristal lo más puro posible a partir de un solo elemento? Tomemos el silicio como ejemplo.
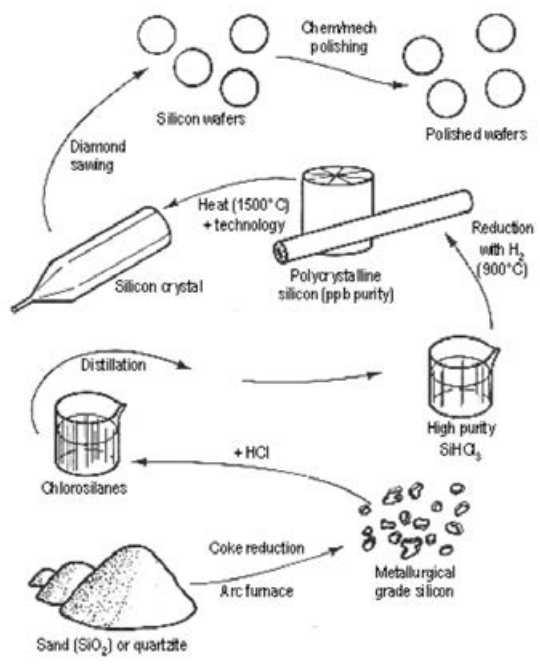
Aquí hay una figura de todos los pasos que toma para convertir la arena en silicio cristalino. Como puede ver, hay muchos de ellos, y muchos implican altas temperaturas o mezcla química. Muchas empresas operan en diferentes etapas de este gráfico. Por ejemplo, pasar de la arena al “silicio de grado metalúrgico” es algo que hacen muchas empresas más pequeñas, como Mississippi Silicon, Elkem o Silicon Materials, Inc., por nombrar solo algunas. A menudo se trata de empresas con unos pocos cientos de empleados por lo que es posible que no tengan una gran cantidad de ofertas de trabajo, pero hay muchas empresas por lo que si te sumerges profundamente en el panorama completo de los productores de silicio probablemente encontrarás algunas buenas oportunidades.
Una vez que una empresa ha hecho silicio de pureza suficientemente alta, entonces pueden moldearlo en un lingote. Esto también requiere una mayor purificación y también nuevamente altas temperaturas. La mayoría de las empresas que fabrican lingotes de alta pureza tienen actualmente su sede en China, aunque hay otras dispersas por todo el mundo incluyendo en lugares como Japón, Alemania y Corea. Y una vez que hay un lingote, se puede cortar en obleas que luego se pueden convertir en dispositivos. Aquí tenemos una gran cantidad de grandes empresas especializadas en este proceso, como Materiales Aplicados o Lam Research, entre muchas otras.
Problemas de ejemplo
1. Calcular la fracción de empaquetamiento atómico (\(\mathrm{APF}\)) de una celda unitaria cúbica simple.
- Contestar
-
Volumen de celda unitaria\(=a^3=8 r^3\) (debido a la constante de celosía,\(\mathrm{a}=2 \mathrm{r}\))
Volumen de un átomo\(=r^3\)
de átomos en celdas unitarias cúbicas simples\(=1\)
Constante de celosía,\(\mathrm{a}=2 \mathrm{r}\)
\(\mathrm{APF}=(\)volumen de un átomo)/(volumen de la celda unitaria)\(\mathrm{x}\) (número de átomos en una celda)
\[\dfrac{\frac{4}{3} \pi r^3}{8 r^3} \times 1=\dfrac{\pi}{6}=52.4 \% \nonumber\]
2. ¿Cuál de las tres estructuras cúbicas cree que es más probable que se forme a alta presión? ¿Por qué?
- Contestar
-
FCC es más probable que BCC, que es más probable que SC. Fracción de empaque más alta significa que los átomos están más cerca
3. \(\mathrm{CsCl}\)forma una red SC interpenetrante, que parece una red BCC pero con 2 tipos diferentes de átomos. Para este problema, usaremos una celosía BCC y asumiremos que los\(\mathrm{Cl}-\) iones están en las esquinas.

a) ¿Cuántos de cada tipo de átomo hay en la celda unitaria?
- Contestar
-
\(1 \mathrm{Cl}-\)iones e\(1 \mathrm{Cs}+\) iones
b) ¿Cuál es la constante de celosía, a (la longitud de un lado de la celda unitaria), en términos de los radios atómicos\(r_{C s}\) y\(r_{C l}\)? ¿Cuál es el valor de un in\(\AA\)?
- Contestar
-
Dirección de empaquetado cerrado = diagonal del cuerpo
\ comenzar {reunido}
\ sqrt {3} a=2 r_ {C s} +2 r_ {C l}\\
\ sqrt {3} a=2 (2.38 A) +2 (1.00 A) =3.90 A
\ end {reunido}
Conferencia 19: Cortando un cristal: los aviones Miller
Resumen
Una celosía cristalina es un mapa que indica cómo se disponen los puntos idénticos en el espacio. En la última conferencia, colocamos un solo átomo en cada sitio de celosía, y a partir de ahí pudimos calcular la fracción de empaquetamiento atómico. Sin embargo, cualquier cosa podría colocarse en los sitios de celosía, siempre y cuando se ponga lo mismo en cada sitio de celosía. La celosía es “cómo” repetir; “qué” repetir se llama la base. La celda unitaria sirve como una forma de pensar en dónde nos encontramos en el cristal.
Para los puntos en la celosía\((\mathrm{h}, \mathrm{k}, \mathrm{l})\) se utilizan coordenadas cartesianas: convencionalmente, son escaladas por la constante de celosía. Una dirección dentro del cristal es descrita por un vector: estos vectores siempre comienzan en el origen, por lo que las direcciones se describen completamente por el punto final del vector, que se encuentra en una cara de la celda unitaria. La notación es ligeramente diferente para los vectores cristalográficos: los puntos finales se escalan para que todos sean enteros, y están encerrados entre paréntesis sin espacios, [\(\mathrm{hkl}\)]. Por ejemplo, el vector de\((0,0,0)\) a\((1 / 2,1,0)\) en el diagrama es la dirección cristalográfica [120]. Esta notación se llama Índices Miller. Una dirección negativa se indica con una barra superior: el vector de\((0,0,0)\) a\((-1,0,0)\) se escribe como\([\overline{1} 00]\). En un sistema cúbico, todas las direcciones con el mismo conjunto de índices Miller son equivalentes, independientemente del orden: estas se pueden agrupar en familias de direcciones: estas se indican con corchetes angulares,\(\langle h k l\rangle .\)
Los índices Miller también se pueden usar para describir planos cristalográficos, los cuales se pueden determinar siguiendo 4 pasos:
1. Lea los puntos en los que el avión intercepta los ejes en términos de fracción de la longitud de celda unitaria
2. Toma recíprocos de las intercepciones
3. Dividir por el mayor factor común para producir valores enteros
4. Encerrar entre paréntesis, sin comas (\(\mathrm{hkl}\))
Por ejemplo, este plano intercepta el\(x\) -eje en\(x=1\), el\(y\) -eje en\(y=1\) y nunca cruza el\(z\) -eje, entonces la\(z\) intercepción es\(z=\infty\). Los recíprocos de estos valores son 1,1, y 0, así es el plano (110).
Una familia de planos en el sistema cúbico contiene todos los planos con el mismo conjunto de índices Miller pero en cualquier orden. Las familias de planos se indican con corchetes,\(\{h k l\}\).
La densidad de empaque en un plano dado se calcula como
Densidad de empaquetamiento planar = (átomos en el plano)/(área del plano) [átomos/área]
Tenga en cuenta que la densidad de empaque plano no es la misma que la fracción de empaque plano, ¡que no tiene unidades! Finalmente, la distancia entre planos descrita por el mismo conjunto de índices Miller,\(\mathrm{d}\), se puede determinar en términos de la constante de celosía, a:
\(d=\dfrac{a}{\sqrt{\left(h^2+k^2+l^2\right)}}\)
Por qué esto importa

Una de las propiedades clave que depende de la densidad en un plano es la energía para escindir un cristal. Esto resulta sumamente importante ya que escindir es justo lo que suena: cortar, o en otras palabras, romper. Si un cristal se puede escindir en una cierta dirección cristalográfica más fácilmente que otra, entonces esa es la dirección en la que el cristal se romperá más fácilmente. De hecho, esta es la razón por la que los cristales suelen ser “facetados”, incluso cuando se acaban de excavar directamente del suelo. El Por qué esto importa para hoy no se trata de cómo se ve un cristal, sino de cómo se rompe. Esa densidad de empaque planar puede decirnos qué plano cede ante una tensión aplicada a un cristal, y por lo tanto cómo el cristal termina deformándose bajo tensión.

Eche un vistazo al cristal que se tira aquí en esta imagen, antes de aplicar una deformación por tracción y después. Observe que cuando se estira, tiene esas formas inclinadas de disclike. Eso se debe a que se rompe a lo largo de los planos Miller que tienen la menor densidad de empaque ya que están más débilmente unidos. Esto no sólo nos informa de cuándo se romperá un material cristalino, sino que nos da la imagen a escala atómica de cómo se rompe y qué forma toma a medida que se rompe. Ahora bien, muchos sólidos pueden no tener grandes diferencias en la energía requerida para romper diferentes planos Miller, por lo que este tipo de fenómeno puede no ocurrir cuando está bajo tensión de tracción. Para muchos metales los enlaces no son tan direccionales y el material simplemente puede deformarse fácilmente debido a ese mar de electrones acomodando el tramo (¿recuerdas ese ejemplo de trefilado de la Conferencia 16?). Luego está el otro extremo del espectro, donde un material es tan anisotrópico que en una dirección la densidad plana y el tipo de unión son completamente diferentes que en las otras direcciones. El grafito (en la foto aquí) es un hermoso ejemplo de esto.
Los alambres largos y delgados también pueden estar hechos de grafito. De hecho, las fibras de carbono, como se les llama, constituyen un mercado de $1.7B hoy en día, y es un mercado que está creciendo fuerte. Si pudiéramos reducir el costo en aproximadamente un factor de 10 más o menos, entonces las fibras de carbono serían capaces de competir con materiales como el acero en cuanto al costo al tiempo que son más fuertes, livianas y más resistentes. Solo para comparar, ¡las fibras de carbono de hoy son 10 veces más fuertes que el acero mientras que son 5 veces más ligeras! Si se pudiera bajar el costo de las fibras de carbono, entonces reemplazaríamos todo lo que pudiéramos por ellas porque simplemente son así de buenas. Las fibras de carbono no son grafito sino que son como grafito, en el sentido de que tienen grandes planos de\(\mathrm{sp}^2\) carbono unidos que están alineados entre sí. Pero para darle mayor fuerza o bien los planos están algo arrugados, o están unidos entre sí a través de enlaces covalentes. De cualquier manera, es la capacidad de diseñar la química de los aviones Miller lo que marca la diferencia.
Por qué esto emplea
Sigamos adelante con el concepto de fibras de carbono de la sección Why This Matter anterior. Como mencioné, las fibras de carbono podrían revolucionar completamente los materiales estructurales y hacer que tantos aspectos de nuestras vidas sean más livianos, fuertes y eficientes. Pero aún queda mucho trabajo por hacer en las propias fibras para bajar su costo, así como para integrarlas en otros productos, desde telas hasta plásticos, concreto y metal. Muchas empresas están haciendo un trabajo sumamente interesante relacionado con estos problemas. Y sí, todo parte de una sólida comprensión de esos planos Miller y direcciones cristalográficas.
Hexcel tiene ingresos anuales superiores a $2B y su producto estrella es la fibra de carbono y los compuestos. ¡Tenga en cuenta que tanto su nombre como su logotipo son todos sobre esos hexágonos en grafito! Hexcel también es genial porque en su sitio web enumeran directamente las oportunidades de pasantías para estudiantes. Otra compañía en este espacio es Solvay que fabrica miles de productos, muchos de los cuales involucran planos cristalinos de grafito. Ahí está Toray, con sus orígenes en los autos de carreras, que enumera las fibras de carbono como uno de sus 5 negocios principales, y está Nippon Steel que tiene una subsidiaria completa dedicada a Granoc, una tela liviana o hilo hecho de fibras de carbono. Su química patentada de fibra de carbono, prometen, es, “dar vueltas al futuro”.
Problemas de ejemplo
1. Dar los índices Miller del plano sombreado:
- Contestar
-
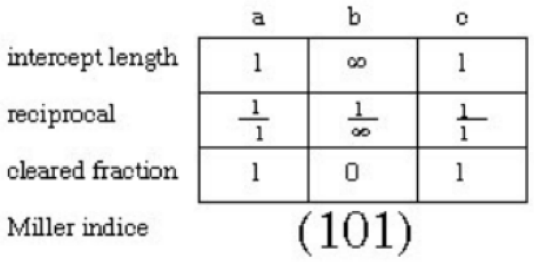
2. Dibuje lo siguiente en una celda de unidad cúbica:
a) (\(\bar{2}10\))
- Contestar
-
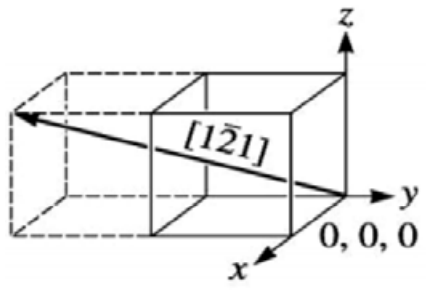
b) [\(1\bar{2}1\)]
- Contestar
-
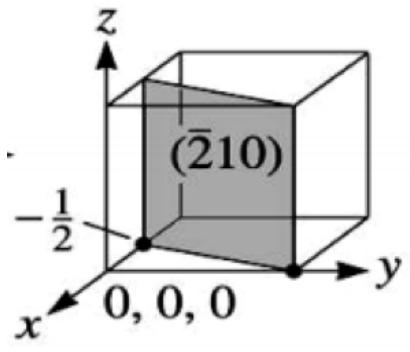
Conferencia 20: Generación de rayos X
Resumen
Los átomos son demasiado pequeños para ver con luz visible, pero los rayos X tienen el rango justo de longitudes de onda para obtener imágenes en la escala atómica. Wilhelm Rontgen descubrió por primera vez los rayos X al observar electrones golpeando un objetivo metálico en un tubo de rayos catódicos. Los electrones fueron emitidos por un filamento calentado y dirigidos por un campo eléctrico dentro del tubo a velocidades muy altas. Cuando los electrones de alta velocidad golpean átomos metálicos, se generan dos tipos de rayos X. La radiación continua de rayos X es causada por la deflexión de un electrón entrante ya que interactúa con un átomo objetivo metálico: como su nombre indica, las longitudes de onda permitidas para el Bremsstrahlung (que se traduce en “radiación de frenado”) son un espectro continuo por encima de un límite inferior. El límite inferior en la longitud de onda (límite superior en la energía) se establece por la energía del electrón entrante, porque la energía de los rayos X emitidos no puede ser mayor.
El segundo tipo de rayos X que se puede generar es un producto de la estructura electrónica de los átomos diana metálicos. Cuando un electrón de alta energía incide sobre un átomo de metal, puede eliminar un electrón en el núcleo interno del átomo objetivo, permitiendo que un electrón central de mayor energía caiga en cascada. Si el electrón cae en cascada desde el\(n=2\) hasta el nivel de\(n=1\) energía, el fotón que se emite se llama fotón alfa. Estos rayos X son discretos: ocurren a una sola longitud de onda que corresponde a la diferencia en los niveles de energía.
Los cristógrafos utilizan una notación ligeramente diferente para los niveles de energía dentro de un átomo: el estado fundamental (\(n=1\)) se llama\(\mathrm{K}\) caparazón,\(n=2\) es el\(\mathrm{L}\) caparazón y\(n=3\) es el\(\mathrm{M}\) caparazón. Usando esta notación, un fotón que se emite a través del proceso de un electrón que cae de\(n=2\) a\(n=1\) se llama fotón\(\mathrm{K}\) -alfa. La diferencia de energía entre los electrones de caparazón interior es enorme, por eso los fotones que se emiten son rayos X.
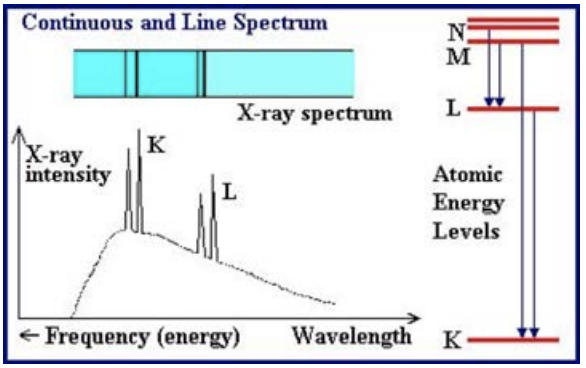
Los elementos más pesados tienen mayores diferencias entre los niveles de energía, por lo que la longitud de onda\(\mathrm{K}\) -alfa es menor. Por lo tanto, es posible determinar de qué tipo de átomo se emitió la radiografía, con solo conocer la longitud de onda: estos rayos X se denominan rayos X característicos.
En esta gráfica, el Brehmsstrahlung y los rayos X característicos se muestran juntos, tal y como se medirían. Los dos primeros picos son las líneas\(\mathrm{K}\) -beta (M a K) y\(\mathrm{K}\) -alfa (L a K), ya que éstas corresponden a las mayores transiciones energéticas dentro del átomo. Luego vienen las líneas\(\mathrm{L}\) -beta (N a L) y\(\mathrm{L}\) -alfa (M a L), que son brechas de energía mucho más pequeñas. La intensidad se puede cambiar cambiando el número de electrones que inciden en el objetivo. La longitud de onda de Brehmsstrahlung de límite inferior se puede cambiar ajustando la energía cinética de los electrones incidentes, aunque esto no cambiaría la ubicación de los picos característicos de rayos X en absoluto. La única manera de desplazar los rayos X característicos es cambiar el metal objetivo utilizado para generar los rayos X. Sin embargo, si la energía de los rayos X incidentes es demasiado baja, no aparecerían rayos X característicos: los electrones incidentes deben tener suficiente energía para noquear un electrón central para dar inicio a la cascada.
Por qué esto importa
El descubrimiento de los rayos X, y la posterior capacidad de controlar completamente qué longitud de onda de los rayos X se genera, ha tenido tanto impacto en la vida moderna que es realmente difícil elegir solo un ejemplo para Why This Matters. Pero supongo que ya que tengo que escoger, también puedo volver a las raíces del propio Rontgen y a una de las primeras formas en que utilizó sus nuevos rayos. ¡Eso sería para sacarle una foto a su esposa! Más precisamente, su mano -es la primera fotografía de rayos X jamás tomada e inició una revolución (El círculo negro en el segundo dedo de la izquierda es su anillo, por cierto).
Lo clave de las radiografías, que Rontgen notó de inmediato, es que son capaces de pasar a través de tejidos blandos del cuerpo como piel y carne, pero son absorbidos por el material más denso como el hueso. Esto significa que si haces brillar rayos X en una parte del cuerpo, los huesos del interior proyectan sombras, las cuales pueden ser capturadas con una placa fotográfica. Este fue un avance increíble para la medicina ya que por primera vez un médico pudo ver dentro de un paciente vivo sin tener que cortar al paciente abierto. Algunos de los primeros usuarios de radiografías en medicina fueron médicos militares, quienes podrían utilizarlos para optimizar la remoción de balas de un soldado herido. A medida que los médicos vieron lo útiles que podían ser, las radiografías se volvieron centrales para el diagnóstico y para la década de 1930 habían llevado al campo especializado de la radiología.

Actualmente no solo los rayos X se utilizan rutinariamente en muchos aspectos de la medicina, sino que la tecnología de las imágenes por rayos X continúa mejorando drásticamente. Más allá de un mejor contraste en las imágenes, un avance muy reciente aplica técnicas desarrolladas originalmente para el Gran Colisionador de Hadrones en Ginebra, que sigue siendo el acelerador de partículas más grande del mundo con 27 km de largo. Con una combinación de obturadores avanzados, cámaras y software, es posible un tipo completamente nuevo de imágenes de rayos X, con imágenes 3D y en color. Echa un vistazo a esta primera radiografía de dientes, tomada en 1896 con un tiempo de exposición de 9 minutos (!). Ahora mira una imagen de rayos X moderna de los dientes junto a ella. Esa es una mejora increíble, y más aún cuando te das cuenta de que la imagen de la derecha es completamente 3D y un dentista puede girarla para ver todos los ángulos.
Por qué esto emplea
Hay mucha generación de rayos X que continúa en el mundo, y el ejemplo de imágenes médicas que di anteriormente en Why This Matters es solo una parte de él. Por ejemplo, los rayos X también se utilizan como escáneres en los aeropuertos, o como formas de hacer el control de calidad para muchas partes industriales, o para analizar la degradación de pinturas valiosas, o en el campo ahora llamado “astronomía de rayos X”, por nombrar solo algunos ejemplos. Las radiografías también se utilizan no solo para ver una enfermedad como el cáncer, sino también para tratarla (“radioterapia”). Solo el mercado médico para las radiografías solo está configurado para superar los 16.5 mil millones de dólares a nivel mundial para 2025. Y todos estos usos para los trabajos de hechizos de rayos X.
Hay muchas empresas por ahí que fabrican equipos de rayos X. Siemens, por ejemplo, vende 6 tipos diferentes de “equipos de rayos X digitales”, pero esa es solo una categoría: también tienen una máquina robótica de rayos X, así como dos tipos de escáneres CT (sí, esos también usan rayos X), y una máquina de fluoroscopia que usa rayos X para examinar el movimiento. ¡Y esa es solo una compañía! Siemens es una empresa muy grande, con la subsidiaria “Siemens Healthineers” fabricando este tipo de equipos. El 41% de su fuerza laboral estadounidense de 13K personas se encuentra en RD, ingeniería, TI o soporte técnico. Y hay muchos otros: Philips, GE Healthcare, Hitachi Healthcare America, Medtronic, Samsung Medical Devices, Eizo, Xoran Technologies y United Imaging, Canon Medical Systems, y todavía estoy empezando. Todas estas empresas están vendiendo amplias gamas de equipos de rayos X y todas compiten entre sí por los clientes, lo que significa que constantemente están tratando de mejorar su tecnología y diferenciar lo que venden de sus competidores. Y más allá de estas grandes empresas, hay muchas empresas de pequeña escala que buscan innovar en el campo. Por ejemplo la compañía MARS Bioimaging, con sede en Nueva Zelanda, está comercializando la tecnología de rayos X en color 3D que salió del Colisionador de Hadrones.
Y ese es solo el lado del equipo. También están todas las empresas trabajando en un nuevo software para analizar las imágenes producidas por todo este equipo de rayos X. Por ejemplo, hay muchas start-ups que aplican IA para analizar los datos de la imagen de rayos X y en algunos casos ¡se ha demostrado que la IA funciona mejor que los médicos humanos!
Problemas de ejemplo
1. Mira el espectro de rayos X a continuación. Se puede ver que\(\lambda_{\kappa \beta}\) es menor que\(\lambda_{\kappa \alpha}\). ¿Y qué pasa\(\lambda_{\Lambda \alpha}\)? Dibuja este pico en el espectro.
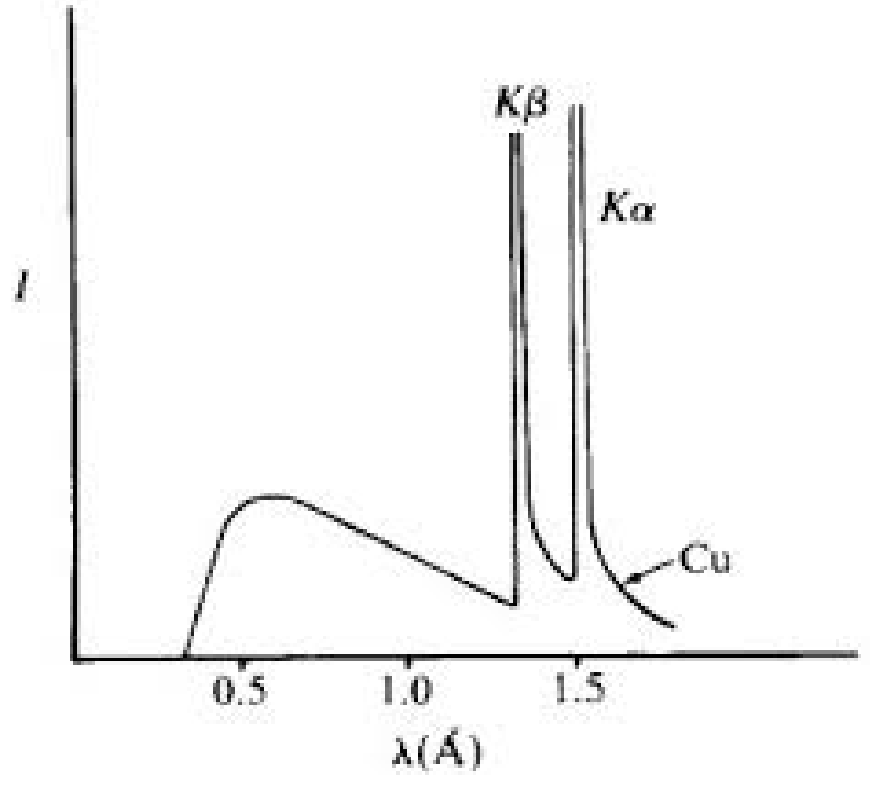
- Contestar
-
\ begin {alineado}
E_ {\ kappa\ alpha} &=13.3 (6-1) ^2\ izquierda (\ dfrac {1} {1^2} -\ dfrac {1} {2^2}\ derecha) =255\ mathrm {eV}\\
&L_\ alpha: n_i=3; n_f=3+1=4\\ &L_\ alpha: n_i=3; n_f=3+1=4\\
&L_\ alpha: n_i=3; n_f=3+1=4\\
E_ {L\ alfa} &=13.6 (6-7.4) ^2\ left (\ dfrac {1} {2^2} -\ dfrac {1} {3^2}\ derecha) =3.7\ mathrm {eV}\\
&\ quad\ quad\ quad E_ {\ kappa\ alfa} >E_ {L\ alfa}\\
&\ quad\ cuádruple\ lambda_ {\ kappa\ alfa} <\ lambda_ {L\ alfa}
\ final {alineado}
2. ¿Cuál es la longitud de onda\(\kappa_\alpha \mathrm{x}\) de los rayos producidos por una fuente de cobre?
- Contestar
-
\ begin {reunidos}
E=\ dfrac {h c} {\ lambda} =-13.6 (Z-1) ^2\ izquierda (\ dfrac {1} {n_f^2} -\ dfrac {1} {n_i^2}\ derecha)\\
Z=29, n_f=1, n_i=2\ lambda=1.54 A
\ end {reunidos}
Lectura adicional
Conferencia 10: Formas de Moléculas
• Lectura y práctica adicionales de VSEPR:
• Más sobre formas moleculares y medicamentos (no probados):
https://www.pearsonhighered.com/ blbmw13einfo/assets/pdf/blbmw-ch09.pdf
Conferencia 11: Orbitales Moleculares
• Video que descompone la Teoría Orbital Molecular:
https://www.youtube.com/watch?v=P21OjJ9lDcs
• Herramienta Cool para visualizar orbitales moleculares de agua:
http://www.bcbp.gu.se/~orjan/qc/h2o/ index.html
Conferencia 12: Hibridación en Orbitales Moleculares
- Lectura más detallada sobre la hibridación:
https://opentextbc.ca/chemistry/chapter/8-2-hybrid-atomic-orbital
Conferencia 13: Interacciones intermoleculares
• Revisión de interacciones intra- vs. intermoleculares:
• Enlaces de hidrógeno: esenciales para la vida:
https://www.cbsnews.com/news/nature-up-close-water-and-life-as-we-know
• Cómo se adhieren los Geckos a Der Waals:
https://www.sciencemag.org/news/2002/08/how-geckos-stick-der-waals
Conferencia 14: Diagramas de fase
• Trazado de un diagrama de fases:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch14/ phase.php
• Más información sobre los cambios de fase, incluyendo ejemplo interactivo del punto de ebullición:
https://courses.lumenlearning. com/química/infinita/capílico/cambios de fases/
• Sobre la termodinámica del chocolate templado:
https://acselementsofchocolate.typepad. com/elements_of_chocolate/TEMPERINGCHOCOLATE.html
Conferencia 15: Bandas electrónicas en sólidos
• Más sobre teoría de bandas:
http://hyperphysics.phy-astr.gsu.edu/hbase/Solids/band.html
• Más sobre materiales semiconductores:
https://www.pveducation.org/pvcdrom/pn-junctions/semiconductor-materia
• Guía de Britney Spears para la Física de Semiconductores (uno de los mejores sitios web de la historia en Internet):
http://britneyspears.ac/lasers.htm
Conferencia 16: Semiconductores y dopaje
• Revisión del dopaje:
• Más allá de 3.091— Juncciones P-N:
https://www.pveducation.org/pvcdrom/welcome-to-pvcdrom/ pn-cruces
• Cómo funcionan los LEDs:
https://electronics.howstuffworks.com/led.htm
Conferencia 17: Los enlaces metálicos y las propiedades de los metales
• Revisión de propiedades metálicas:
https://courses.lumenlearning.com/introchem/chapter/bonding-in-metals-the
• Profundiza en la unión metálica:
• Cómo se extraen los metales de la tierra:
https://www.bbc.co.uk/bitesize/guides/z3v9msg/ revisión/1
Conferencia 18: El sólido perfecto: cristales
• Revisión de cristales SC, BCC y FCC:
https://www.youtube.com/watch?v=_h-Xv9nsJLc
• Más sobre celdas unitarias y celosías de empaque:
Conferencia 19: Cortando un cristal: los Planos Miller
• Paso a paso Miller:
https://www.youtube.com/watch?v=9-us_oENGoM
• Más allá de 3.091—cristalografía y espacio recíproco:
https://www.youtube.com/watch?v=DFFU39A3fPY
Conferencia 20: Generación de rayos X
• Más detalles sobre la generación de rayos X:
http://xrayweb.chem.ou.edu/notes/xray.html
• Rayos X en imágenes médicas:
https://www.hopkinsmedicine.org/health/treatment-tests-and-therapies/ radiografías


