5.3: CHEM ATLAS_3
- Page ID
- 80096
Cómo Conecta Esto: Unidad 3, Conferencias 21-30
El propósito de este documento es servir de guía y recurso que le brinde una rápida visión general de cada conferencia. Para cada conferencia, hay un resumen de los principales temas tratados, el momento Por qué esto importa y la nueva sección Por qué esto emplea, además de algunos problemas de ejemplo. Entonces, ¿por qué hicimos esto? Esperamos que sea útil obtener una buena instantánea de cualquier conferencia dada. Ya sea que no pudieras asistir a una conferencia o no podías dejar de pensar en una conferencia, esta es una forma de tener rápidamente una idea del contenido. También me da la oportunidad de proporcionar detalles adicionales para los que quizás no tenga tiempo en el ejemplo Por qué esto importa, y también me permite probar la sección Por qué esto emplea, que desde luego no tendré tiempo de discutir mucho en la conferencia. ¡Ojalá te resulte útil!
Un punto sobre estos resúmenes de conferencias. Tenga en cuenta que los resúmenes de las conferencias no están destinados a ser un sustituto de las notas de la conferencia. Si solo leyeras estos resúmenes y no fueras a dar una conferencia, sí, obtendrías una buena idea de la conferencia desde una vista de muy alto nivel, pero no, ¡no sacarías lo suficiente de ella para que sea tu único recurso para aprender el material!
A continuación se muestra una imagen del Mapa Conceptual del Examen 3. Esto demuestra cómo encajan cada uno de los aspectos del curso: ¡tienes muchos recursos! Los problemas de práctica, recitaciones, bolsas de regalos y conferencias son recursos sin clasificar para ayudarte a prepararte para los cuestionarios y exámenes. Todo el material listado en este mapa conceptual es juego limpio para el Examen 3.

Conferencia 21: Ley de Bragg y difracción de rayos X
Resumen
La difracción de rayos X (XRD) es un método utilizado para caracterizar sólidos. Se basa en la difracción de rayos X al golpear planos de cristal (¡los planos Miller de los que hemos aprendido!) Al suponer que cada plano de átomos es continuo, y que reflejan los rayos X entrantes de tal manera que el ángulo incidente y el ángulo reflejado son iguales, los Braggs derivaron la ecuación que lleva su nombre y relaciona la distancia entre los planos repetitivos (\(\mathrm{d}\)) y el ángulo de incidencia de rayos X ( \(\theta\)) a la longitud de onda de rayos X:
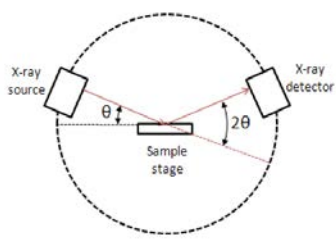
Dos rayos X que golpean planos Miller equivalentes con el mismo ángulo de incidencia interferirán constructivamente si la distancia adicional que uno de los viajes es igual a la longitud de onda de la radiografía. Cuantitativamente, si\(\lambda=2 d \sin \theta\),\(\lambda\) se mejora la intensidad de los rayos X salientes con longitud de onda. La interferencia constructiva ocurrirá siempre que la distancia de longitud de ruta sea un múltiplo entero de la longitud de onda:\(2 d \sin \theta=n \lambda\) para entero\(\mathrm{n}\). Para\(3.091\), vamos a asumir\(n=1\). Cuando se produce una interferencia constructiva, una señal llegará al detector en la máquina XRD y se observará un pico en una gráfica de la intensidad de rayos X. Para la interferencia destructiva, no se observará ningún pico. Conocer el ángulo que da lugar a un pico así como la longitud de onda de los rayos X incidentes nos permite obtener la distancia entre los planos que produjeron la reflexión. Esto se conoce como la condición de Bragg:
\(2 d_{h k l} \sin \theta_{h k l}=\lambda\)
Para un plano Miller dado, denotado por\((h k l)\), la condición de Bragg se satisface por un par\((d, \theta)\) de espaciamiento interplanario y ángulo de incidencia.
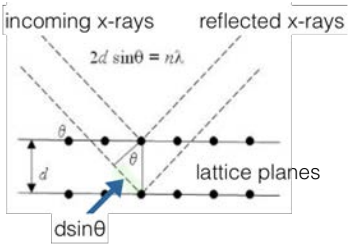
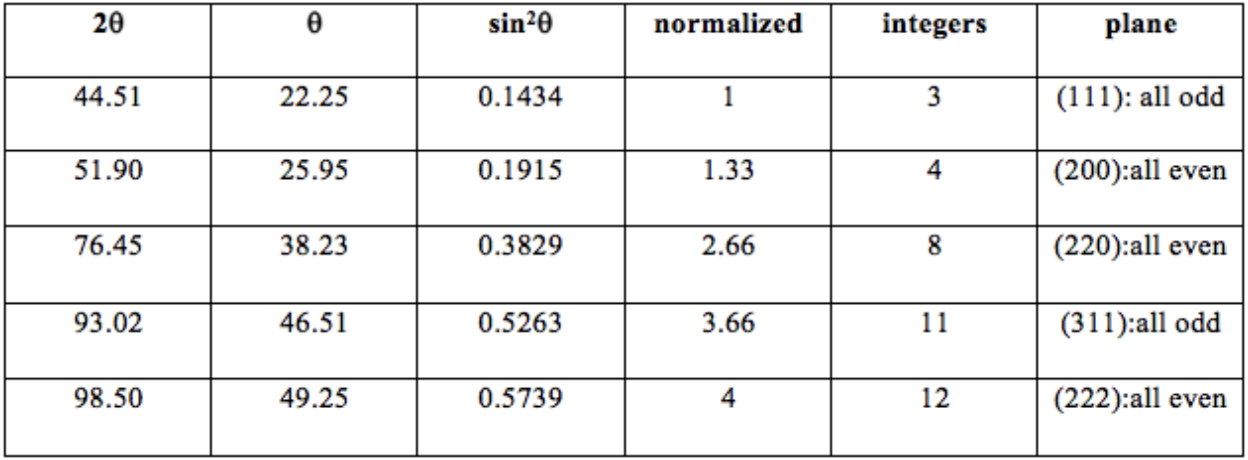
Para cada una de las estructuras cristalinas (SC, BCC o FCC), existen reflexiones que incluso cuando se cumple la Condición de Bragg conducen a interferencia destructiva, debido a la simetría cristalina. El patrón de ausencias máximas se utilizó para derivar un conjunto de reglas llamadas reglas de selección, que permiten conocer, o al menos reducir las posibilidades de, la estructura cristalina de un material basado en sus picos XRD. Para el caso de SC, no hay reglas y cualquier avión está bien. No hay reflexiones prohibidas.
Para el caso de\(\mathrm{BCC}\), las reflexiones permitidas son aquellas donde\(\mathrm{h}+\mathrm{k}+\mathrm{l}\) hay un número par. La reflexión prohibida son aquellas para las que\(\mathrm{h}+\mathrm{k}+\mathrm{l}\) es un número impar. Para el caso de\(\mathrm{FCC}\), las reflexiones permitidas son aquellas en las que todas\(\mathrm{h}, \mathrm{k}, \mathrm{l}\) son impares o todas\(\mathrm{h}, \mathrm{k}, \mathrm{l}\) son pares. Los reflejos prohibidos de FCC son aquellos donde h, k, l se mezcla par/impar.
Por qué esto importa
Para los sólidos, la estructura puede ser tan importante como la química misma, y están profundamente conectados. Cuando miro hacia arriba la estructura cristalina de un elemento en la Tabla Periódica veo lo que es para el estado de tierra o de menor energía de ese elemento. Este es el “lugar feliz” general, enérgicamente hablando, del material. Pero los materiales pueden tomar otras estructuras metaestables y ser muy felices allí, también. Y Why This Matters es porque las propiedades pueden ser completamente diferentes dependiendo de la estructura cristalina que tome el material, y XRD es el método de caracterización más importante que tenemos para determinar la estructura cristalina. Ya hemos visto la diferencia entre grafito y diamante, que contiene el mismo elemento exacto (carbono) pero simplemente dispuesto en una estructura diferente. Lo mismo es cierto para, bueno, prácticamente para todo. Tomemos otro elemento, el hierro, como ejemplo.
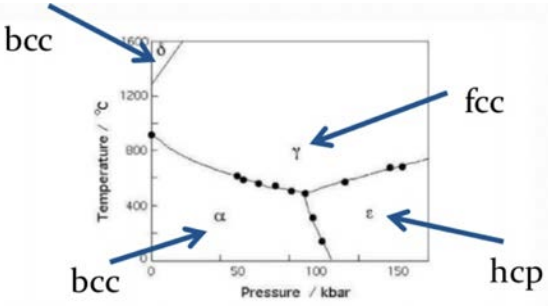
Aquí hay un diagrama de fases para el hierro. Como recordarás de la Conferencia 14, un diagrama de fases es una gráfica de las diferentes fases de un material en función de algunas variables, en este caso presión y temperatura. Observe que en condiciones normales o “ambiente” de temperatura (\(\approx 300\mathrm{K}\)) y presión (\(\approx 1 \mathrm{bar}\)), el hierro es un\(\mathrm{BCC}\) cristal. Esto también es lo que encontrarás si buscas su estructura cristalina en el PT. Pero note al leer el diagrama de fases que si elevamos la temperatura se vuelve\(\mathrm{FCC}\), y si elevamos la presión entra en la fase HCP (no es cúbica así que no la hemos cubierto). Dato curioso: si sigues subiendo la temperatura eventualmente volverá a ser\(\mathrm{BCC}\).
La razón por la que todo esto importa es que la estructura cambia las propiedades. En el caso del hierro, las propiedades magnéticas del elemento se ven afectadas. Si es FCC entonces será 'antiferromagnético' a diferencia del comportamiento 'ferromagnético' BCC. ¡Recomiendo tomar un curso de magnetismo en el futuro para conocer más sobre estos términos! Esto tiene enormes implicaciones en las tecnologías magnéticas. Y sé que probablemente estés pensando: claro, ¡pero no construimos demasiadas tecnologías basadas en hierro que operen a 1000\(\mathrm{K}\)! Tienes razón, pero el truco es que muchas veces podemos persuadir a estos materiales para que se queden atrapados en una de esas fases metaestables y luego usarlos para tecnologías mientras está en esa fase. Nuevamente, el diamante es un gran ejemplo: no es el estado fundamental del carbono por lo que es metaestable como diamante en lugar de grafito, pero sabemos que permanece pegado ahí por mucho tiempo así que para la mayoría de las tecnologías que usan diamante (digamos, una pieza de joyería), no nos preocupamos de que cambie de su fase metaestable.
Volviendo al tema de la conferencia, cuando hacemos algo, ya sea que ese algo sea tan antiguo como el hierro elemental o tan nuevo como una perovskita nanoestructurada, la forma más simple y común que tenemos de decir su estructura cristalina es por\(\mathrm{XRD}\). En algunos casos, el uso de\(\mathrm{XRD}\) puede desentrañar el misterio estructural de un material, como en el caso de la doble hélice para el ADN o las muchas proteínas desde entonces. En otros casos, se utiliza para no desvelar el secreto de una estructura completamente nueva, sino para clasificar un material en una u otra estructuras bien conocidas. A veces la razón es entender un material, a veces es para diseñar las propiedades del material, y muchas veces es ambas cosas. Pero sea cual sea la motivación, esta herramienta de caracterización increíblemente poderosa ha revolucionado lo que sabemos sobre los sólidos.
Por qué esto emplea
Hemos estado haciendo referencia a estos cristógrafos (¡que son muy exigentes con la notación!) para varias conferencias ahora. Pero, ¿quiénes son estas personas? Y más al grano: ¿quién los contrata? Hay muchos trabajos de cristalógrafo de rayos X en la industria biotecnológica, en empresas de todos los tamaños. Blueprint Medicines, que parece un spin-out de Harvard y está justo al final de la calle, tiene una apertura ahora con el título, “Científico sénior/científico principal, Cristalografía de rayos X”, siendo la descripción de la primera función de trabajo, “Proporcionar soporte cristalográfico de rayos X y estructura-función de proteínas, incluyendo el diseño de fármacos basado en la estructura, hasta proyectos de descubrimiento de fármacos en curso y nuevas iniciativas de descubrimiento de objetivos”. Y las empresas farmacéuticas y biotecnológicas más grandes tienen aún más empleos. Toma Novartis, que también tiene una gran sede cerca del MIT, justo abajo de Mass Ave. Están contratando personas para realizar” experimentos de cristalografía, incluido el cribado de cristalización usando manejo automático de líquidos. GlaxoSmithKline tiene una oportunidad para que alguien “permita la cristalografía de rayos X de mayor rendimiento”. Johnson and Johnson está contratando personas con experiencia en cristalografía de rayos X para hacer, “química automatizada”. Y tengo que mencionar un último ejemplo por el título de su apertura actual, Bristol-Myers-Squibb está buscando un, “Investigador de Investigación, Química de Estado Sólido”. ¡Me va a encantar! Quieren, “un científico de nivel de entrada con experiencia en cristalografía de rayos X, difracción de rayos X y caracterización de estado sólido”. ¡Ese es ahora tú!
Y no todo se trata de la industria farmacéutica. Los hospitales también están contratando cristalógrafos de rayos X (estos no son el mismo puesto que un radiólogo), para trabajar en proyectos de investigación por ejemplo con aperturas en Mass General y Dana Farber. Y también hay muchos puestos de investigación en difracción de rayos X, desde puestos en el Howard Hughs Medical Institute hasta laboratorios y centros universitarios en todo el país.
Problemas de ejemplo
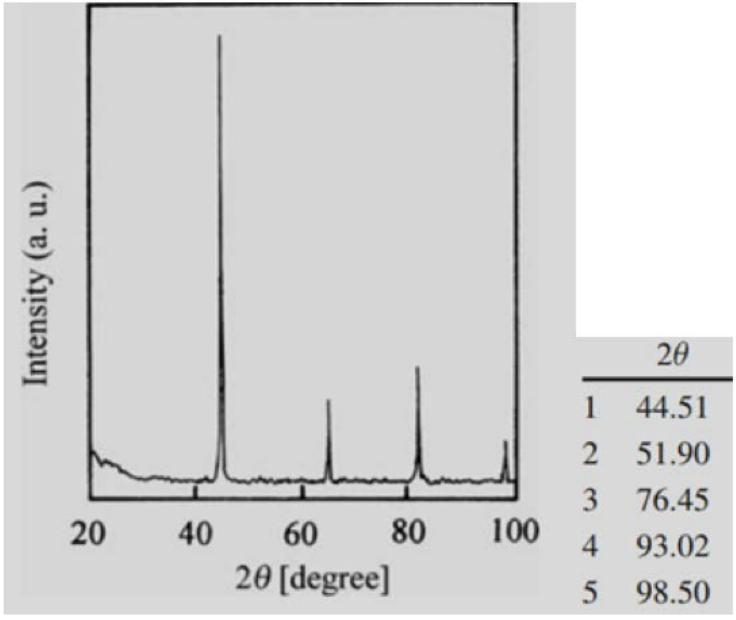
1. Determinar la estructura (cúbico simple, cúbico centrado en el cuerpo o cúbico centrado en la cara) a la que probablemente corresponde este\(\mathrm{XRD}\) patrón (se utilizaron\(\kappa_{\alpha}\) rayos X de cobre).
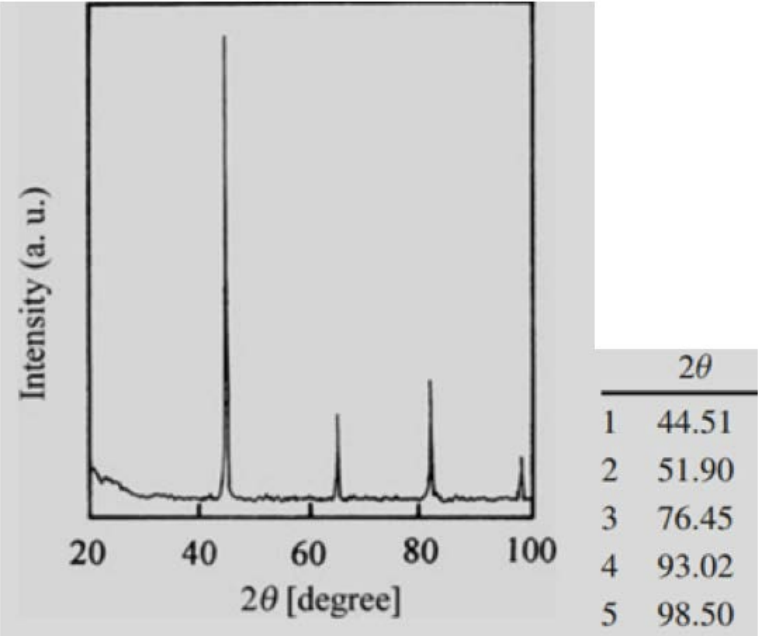
- Contestar
-
Dado que los índices de cada plano son todos impares o todos pares, utilizando las reglas de selección podemos determinar que esta estructura es\(\mathrm{FCC}\).
Conferencia 22: De la difracción de rayos X a la estructura cristalina
Resumen
En esta conferencia terminamos de analizar el\(\mathrm{XRD}\) espectro de una\(\mathrm{Al}\) muestra, que se muestra a continuación.
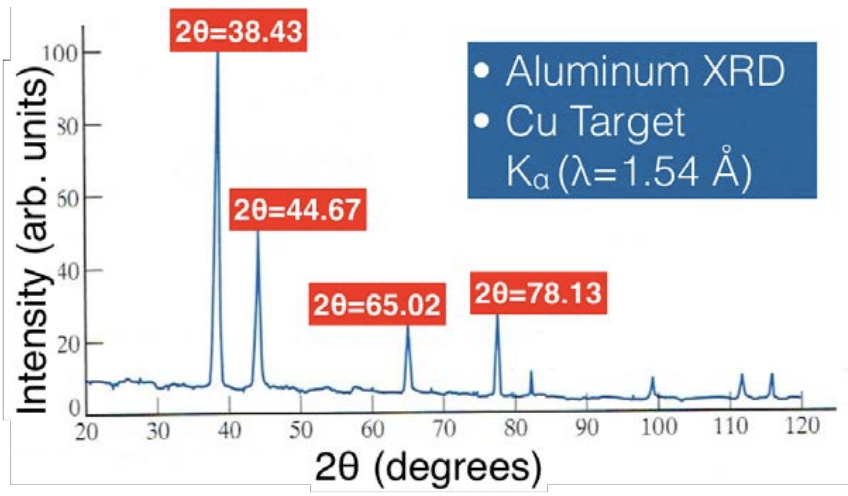
La parcela se obtuvo mediante rayos X\(\mathrm{K}\) alfa brillantes de un\(\mathrm{Cu}\) objetivo en nuestra\(\mathrm{Al}\) muestra. Lo que queremos hacer es averiguar la estructura cristalina y la constante de celosía de\(\mathrm{Al}\). Para responder a estas preguntas, necesitamos nuestra práctica ecuación de distancia de separación de planos Miller (donde '\(\mathrm{d}\)' es la distancia entre dos planos Miller repetitivos con índices\(\mathrm{hkl}\) en un sistema cúbico, y '\(a\)' es la constante de celosía):
\(d_{h k l}=\dfrac{a}{\sqrt{h^2+k^2+{ }^2}}\)
y la condición de Bragg:
\(2 d_{h k l} \sin \theta_{h k l}=\lambda\)
Observe que ambas ecuaciones incluyen\(d_{h k l}\). Podemos usar esto a nuestro favor y sustituir una\(d_{h k l}\) ecuación por otra para obtener lo siguiente:
\(\left(\dfrac{\lambda}{2 a}\right)^2=\dfrac{\left(\sin \theta_{h k l}\right)^2}{h^2+k^2+l^2}\)
Conocemos el valor de la longitud de onda, porque está fijada por los\(K_a\) rayos X de la fuente de cobre. Estos rayos X tienen una longitud de onda de\(1.54 \AA\). Entonces la expresión para nuestro ejemplo se convierte en:
\(\left(\dfrac{1.54 \AA}{2 a}\right)^2=\dfrac{\left(\sin \theta_{h k l}\right)^2}{h^2+k^2+l^2}\)
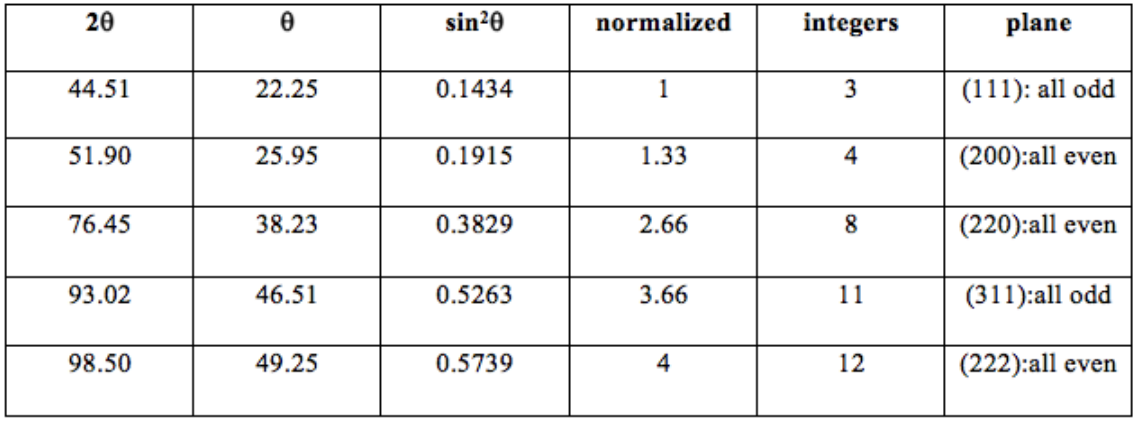
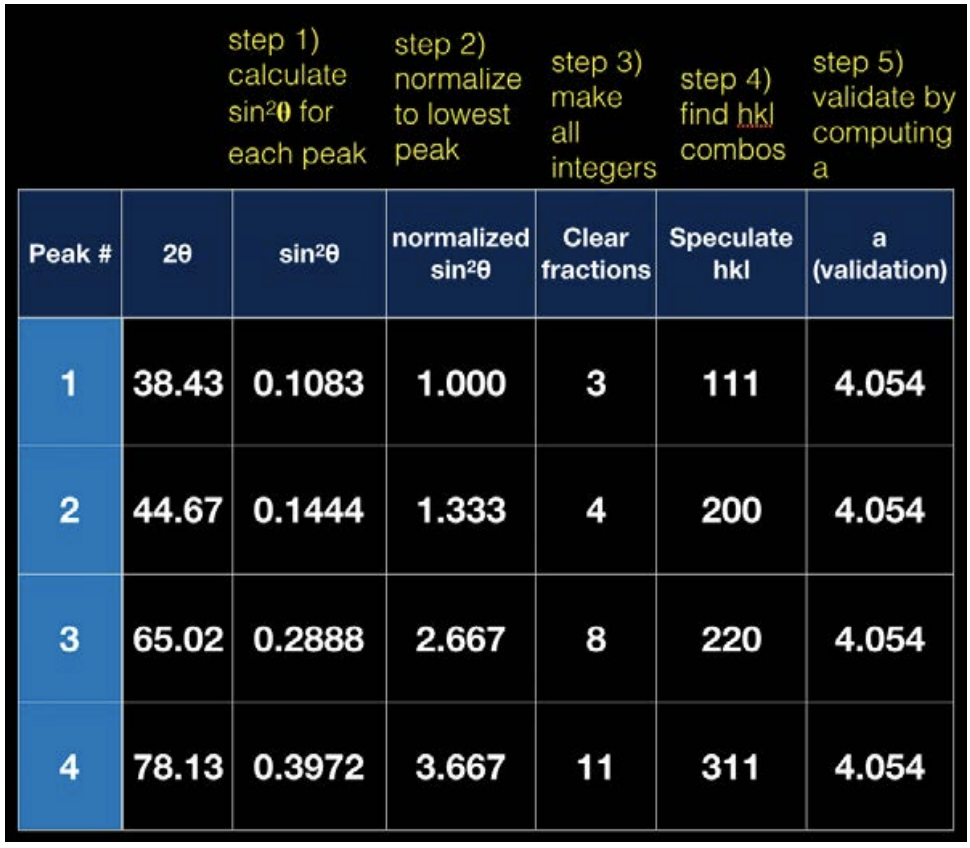
Ahora tenemos constantes en ambos lados del signo igual, porque el parámetro de celosía no cambia. Podemos hacer una conjetura educada del\(\mathrm{hkl}\) valor siguiendo los procedimientos descritos en la tabla de la siguiente página.
De las reglas de selección sabemos que\(\mathrm{Al}\) es un\(\mathrm{FCC}\) metal, ya que las combinaciones (\(\mathrm{hkl}\)) siempre son todas pares o todas impares. También podemos tomar un valor de\(\theta\) y un valor de h, k y l y conectarlos a la ecuación anterior para encontrar el parámetro de celosía, dado en la columna más a la derecha del gráfico.
Por qué esto importa

Foto de Henry Moseley es de dominio público.
Se trata de Henry Moseley (imagen, Real Sociedad de Química). Se le representa ahí en su laboratorio, sosteniendo en sus manos, por supuesto, un tubo de rayos catódicos modificado. Estaba experimentando con radiografías. Pero los intereses de Moseley eran menos sobre las estructuras cristalinas y las condiciones de Bragg y más sobre las propias líneas de rayos X y lo que significaban. Realizó un estudio sistemático de los metales utilizados para generar los rayos X, comparando la emisión de rayos X de 38 elementos químicos diferentes.
Ya se habían realizado algunos trabajos que nos llevaron a comprender las partes características y continuas del espectro de generación de rayos X, como discutimos hace algunas conferencias. Pero no se había llevado a cabo un estudio sistemático completo hasta la obra de Moseley. Eche un vistazo a la diferencia entre los dos espectros de rayos X generados con dos objetivos diferentes:\(\mathrm{Mo}\) y\(\mathrm{Cu}\). Tenga en cuenta las\(\mathrm{K}_{\beta}\) líneas\(\mathrm{K}_{\alpha}\) y para cada una, y que se desplazan a una longitud de onda más baja para\(\mathrm{Mo}\) en comparación con\(\mathrm{Cu}\). Como sabemos, esto se debe a la diferencia de energía entre las conchas de\(n=1\) y\(n=2\) (for\(\mathrm{K}_{\alpha}\)) o\(n=1\) y\(n=3\) (for\(\mathrm{K}_{\beta}\)), y tiene sentido que esta diferencia de energía sea mayor (correspondiente a menor longitud de onda)\(\mathrm{Mo}\) ya que es más pesada que \(\mathrm{Cu}\). Pero, ¿cuál es exactamente la dependencia y por qué está presente? Veamos los datos de una secuencia de objetivos, directamente de un subconjunto de datos de Moseley.
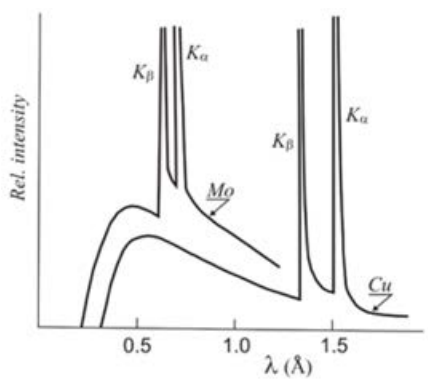
Estas son líneas de rayos X características para\(\mathrm{Ca}\) arriba a través\(\mathrm{Zn}\), por lo que van a través de los elementos\(\mathrm{d}\) -block de la cuarta fila en el PT. Tenga en cuenta que no es en realidad\(\mathrm{Zn}\) sino más bien latón, que ya aprendimos es una mezcla de\(\mathrm{Zn}\) con\(\mathrm{Cu}\) — eso es porque se\(\mathrm{Zn}\) derretiría bajo el bombardeo de electrones de alta energía antes de que pudiera emitir rayos X característicos, por lo que Moseley le dio la fuerza extra que necesitaba haciendo latón, y luego restó la emisión de\(\mathrm{Cu}\). ¡Buen truco!
Lo que Moseley encontró fue que si las líneas de emisión características fueran trazadas como el cuadrado de su energía vs. número atómico, se obtendría una línea recta. Encajó los datos considerando que las líneas provenían de una excitación de núcleo, por lo que una diferencia en los niveles de energía del modelo de Bohr:
\(E_{x-r a y}=13.6[e V](Z-1)^2\left(\dfrac{1}{1^2}-\dfrac{1}{2^2}\right)=\dfrac{3}{4}(13.6[\mathrm{eV}])(Z-1)^2\)
Esto ahora se llama ley de Moseley. ¿Ves por qué es\(\mathrm{Z}-1\) en lugar de\(\mathrm{Z}\) como en el modelo Bohr? Es porque el electrón que cae en cascada para generar los rayos X es “ver” un cribado de 1 electrón del núcleo. Eso se debe a que uno de esos electrones del núcleo 1s fue noqueado, pero ahí queda uno que proyecta una carga positiva, de ahí la\(\mathrm{Z}-1\). Entonces, ¿qué significó esta tendencia en los datos? Esto es lo que dijo Moseley en su ponencia de 1913: “Tenemos aquí una prueba de que hay en el átomo una cantidad fundamental, que aumenta en pasos regulares a medida que uno pasa de un elemento al siguiente. Esta cantidad sólo puede ser la carga sobre el núcleo central positivo, de cuya existencia ya tenemos prueba definitiva”.
La razón por la que esto es tan importante, y por qué lo estoy convirtiendo en el Por qué esto importa para este capítulo, es que incluso a través de la tabla periódica Mendeleev había existido y se estaban descubriendo y agregando más elementos, hubo una falla importante en la tabla periódica: la posición predicha por el peso atómico de un elemento no siempre coincidieron con la posición predicha por sus propiedades químicas. Recuerde que el posicionamiento de Mendeleev se basaba en el peso y las propiedades y cuando la periodicidad lo requería, optó por ordenar los elementos en función de sus propiedades, más que en su peso atómico. Pero, ¿había algo más fundamental que el peso atómico?
Los datos de Moseley solo tenían sentido si la carga positiva en el núcleo aumentaba exactamente en una unidad a medida que se pasa de un elemento al siguiente en el PT. En otras palabras, ¡descubrió que el número atómico de un elemento es idéntico a cuántos protones tiene! Sé que esto nos parece algo obvio ahora, pero en ese entonces “número atómico” era simplemente un número sin sentido, que no fuera el lugar del elemento en la tabla periódica. No se pensó que el número atómico estuviera asociado con ninguna cantidad física medible. Para Mendeleev, la periodicidad fue por masa atómica y propiedades químicas; para Moseley, fue por número atómico. Esto llevó a una comprensión mucho más profunda de la tabla periódica y sus percepciones inmediatamente ayudaron a comprender algunos misterios clave, por ejemplo dónde colocar los lantánidos en el PT\((\mathrm{La}=\# 57, \mathrm{Lu}=\# 71)\), o por qué\(\mathrm{Co}\) viene antes\(\mathrm{Ni}\). Y las brechas que Mendeleev dejó brillantemente abiertas en su PT para crear periodicidad ahora tenían sentido al faltar números atómicos en una secuencia, por ejemplo elementos\(43,61,72\), y ahora\(75\) se entendía que contenían tantos protones (fueron descubiertos más tarde por otros científicos: tecnecio, prometio, hafnio y renio).
Moseley murió trágicamente en 1915 a los 27 años en una batalla en la Primera Guerra Mundial. En 1916 no se otorgaron premios Nobel en física o química, lo que se cree que se hizo para honrar a Moseley, quien seguramente mereció uno.
Por qué esto emplea
Hemos cubierto la generación de rayos X y fabricantes de máquinas hace dos capítulos, y en el último capítulo analizamos trabajos relacionados con la cristalografía de rayos X. Para este último Por qué esto emplea relacionado con los rayos X, es hora de ir a lo grande o irse a casa. Y cuando digo grande, quiero decir muy grande. Cuando los electrones o para el caso cualquier partícula cargada se aceleran a velocidades cercanas a la luz, entonces la aceleración que experimentan simplemente para permanecer en un bucle produce una radiación masivamente energética. La longitud de onda puede variar drásticamente, pero muy a menudo estos enormes aceleradores se utilizan para hacer rayos X de súper alta energía. La intensidad de estos rayos es deslumbrantemente brillante, millones de veces más brillante que la luz solar y miles de veces más intensa que los rayos X producidos de otras maneras. Este nivel de brillo los hace útiles para casi todas y cada una de las áreas de investigación y campos de la ciencia. Algunos tipos de mediciones solo son posibles cuando se usa luz sincrotrón, y para otros tipos se puede obtener información de mejor calidad en menos tiempo que con las fuentes de luz tradicionales. Se ha demostrado que son útiles en tantas áreas que es imposible enumerarlas todas, pero ciertamente en biología, química, física, materiales, medicina, descubrimiento de fármacos y geología, por nombrar solo algunos campos, los sincrotrones han tenido un impacto dramático. Tienen tal demanda que a menudo uno necesita reservar tiempo en ellos con muchos meses de anticipación. Un sincrotrón típico puede tener hasta 50 “líneas de haz” que agarran los rayos X de alta energía del bucle y los enfocan en un haz donde se realizan experimentos. Estas líneas suelen ser reservadas y puestas en uso las 24 horas del día, los 7 días de la semana, durante todo el año. Aquí hay una foto de uno de ellos, la Fuente Avanzada de Fotones en el Laboratorio Nacional Argonne en Illinois. Su declaración general del eslogan dice: “La Fuente Avanzada de Fotones (APS) en el Laboratorio Nacional Argonne del Departamento de Energía de Estados Unidos proporciona haces de rayos X ultrabrillantes y generados por anillo de almacenamiento de alta energía para la investigación en casi todas las disciplinas científicas”.

La parte de Empleo de esto es bastante genial. Estas instalaciones, que se llaman “sincrotrones”, están en todo el mundo, y requieren de miles de personas para construir y luego correr. El carácter internacional de ellos es asombrosa: solo haz una búsqueda de imágenes para sincrotrón y encontrarás fotos de ellos en todo el planeta. Y eso significa trabajos en muchas ubicaciones diferentes. Algunos son viejos, como el del Laboratorio Nacional de Berkeley (¡pero sigue pateando!) , algunos son de tamaño mediano como ese APS que se muestra arriba, y otros son enormes como el Colisionador de Hadrones que mencioné en la última conferencia como un lugar donde se inventaron las imágenes de rayos X en 3D. Los colisionadores también son fuentes de luz de sincrotrón, ya que están construidos para acelerar las partículas a velocidades muy altas. Aunque los colisionadores pueden usarse para aplastar partículas a estas velocidades, a menudo también se usan simplemente como una forma de generar luz de alta intensidad.
No tengo en mente un título de trabajo específico, pero si miras una lista como esta: https://en.wikipedia.org/wiki/List_of_synchrotron_radiation_facilities verás dónde están estos sincrotrones, y para cada uno de ellos hay un enlace de “empleo” en el que puedes hacer clic para explorar posibles empleos.
Práctica extra
1. Determinar el elemento que conformó la muestra de la Conferencia 21 Práctica Extra Problema 1. El patrón XRD se reproduce a continuación (se utilizaron\(k_a\) rayos X de cobre).
- Contestar
-
Para conocer qué elemento se utilizó como muestra, encuentre el parámetro de celosía (a) usando la ecuación para el espaciado interplanar\(\left(d_{h k l}\right)\), la ley de Bragg y la ley de Moseley. Para\(\mathrm{h,k,l}\) y\(\theta_{h k l}\), elija un plano y un ángulo correspondiente del gráfico que desarrollamos el último capítulo, que se muestra a continuación:
\ begin {reunió}
d_ {h k l} =\ dfrac {a} {\ sqrt {h^2+k^2+l^2}}\\
\ lambda=2 d_ {h k l}\ sin\ izquierda (\ theta_ {h k l}\ derecha)
\ final {reunidos}La energía corresponde a la\(\mathrm{Cu}(\mathrm{Z}=29) k_\alpha\) radiación:
\ begin {reunió}
E=\ dfrac {h c} {\ lambda} =13.6 [e V] (Z-1) ^2\ izquierda (\ dfrac {1} {n_f^2} -\ dfrac {1} {n_i^2}\ derecha)\
\ lambda=\ dfrac {h c} {-13.6 (Z-1) ^2\ izquierda (\ frac {1} {n_f^2} -\ frac {1} {n_i^2}\ derecha)}\\
d_ {h k l} =\ dfrac {h c} {-13.6 (Z-1) ^2\ izquierda (\ frac {1} {n_f^2} -\ frac {1} {n_i^2 }\ derecha) 2\ sin\ theta_ {h k l}}\\
a=\ dfrac {h c\ sqrt {h^2+k^2+l^2}} {-13.6 (Z-1) ^2\ izquierda (\ frac {1} {n_f^2} -\ frac {1} {n_i^2}\ derecha) 2\ sin\ theta_ _ {h k l}} =3.53 A
\ fin {reunidos}Este parámetro de celosía corresponde a\(\mathrm{Ni}\).
2. Te gustaría realizar un experimento de XRD, pero no sabes qué objetivo se usa en el difractómetro de tu laboratorio. Se pone en una muestra de calibración de hierro, que es BCC y tiene un parámetro de celosía de\(2.856\) angstroms. Si observa el siguiente patrón de XRD, ¿qué material es el objetivo? Estás bastante seguro de que hay un filtro que evita que cualquier cosa con menor energía que\(k_a\) la radiación golpee tu muestra.
Los picos observados son los siguientes:
| cuenta | 10 | 1000 | 20 | 2200 | 8 | 5 | 1200 | 2500 |
|---|---|---|---|---|---|---|---|---|
| \(2\theta\) | 17.38 | 20.87 | 24.67 | 29.62 | 30.30 | 35.15 | 36.45 | 42.37 |
a) ¿Qué tipo (s) de rayos X están golpeando la muestra?
- Contestar
-
\(k_\alpha \operatorname{AND} k_\beta\)
b) ¿Cuántos planos están representados por los datos? ¿Qué aviones son?
- Contestar
-
Se representan 4 planos:\((110),(200),(211)\), y\((220)\)
c) ¿Cuáles son los espaciamientos interplanares asociados a estos planos?
- Contestar
-
\[\dfrac{2.856}{\sqrt{h^2+k^2+l^2}} \nonumber\]
Al enchufar cada (\(\mathrm{hkl}\)), los espaciamientos son 2.02, 1.43, 1.17 y 1.01 A
d) ¿Qué elemento se utilizó como objetivo?
- Contestar
-
\ begin {reunió}
\ lambda=2 d_ {h k l}\ sin\ izquierda (\ theta_ {h k l}\ derecha)\
\\ lambda_ {k_\ alpha} =0.73 A\
\ lambda_ {k_\ beta} =0.61 A
\ end {reunidos}
- Contestar
-
\[E=\dfrac{h c}{\lambda}=13.6(Z-1)^2\left(\dfrac{1}{n_f^2}-\dfrac{1}{n_i^2}\right) \nonumber\]
Para\(k_\alpha, n_i=2\) y\(n_f=1\). Para\(k_\beta, n_i=3\) y\(n_f=1\).
\ begin {aligned}
&h=4.135\ times 10^ {-15}\ mathrm {eV}. \ mathrm {s}\\
&c=3 x 10^8\ mathrm {~m}/\ mathrm {s}\\
&\ mathrm {Z} =42
\ end {alineado}
Conferencia 23: Defectos puntuales
Resumen
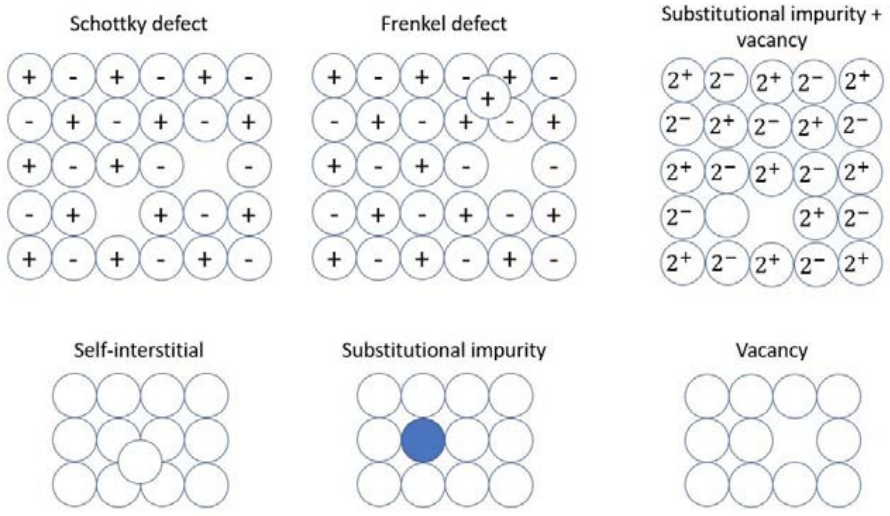
Un defecto puntual es una alteración localizada en la regularidad de la red cristalina. Existen cuatro tipos de defectos puntuales: vacantes, impurezas intersticiales, autointersticiales e impurezas sustitucionales.
Arrhenius determinó una ley para la dependencia de la temperatura de la velocidad a la que ocurren los procesos:
\(k=A e^{-E_a / R T}=A e^{-E_a / k_B T}\)
donde\(\mathrm{R}\) es la constante de gas (o\(k_B\) es la constante de Boltzmann) y\(E_a\) es la energía de activación. El término en el exponente debe ser sin unidades: por lo tanto, si se da la energía de activación\(\mathrm{J} / \mathrm{mol}\), use la versión con\(R\), pero si la energía de activación se da en\(J\), use la\(K_B\) versión. Recordemos que la constante de gas es justa\(R=K_B * N_A\). Las unidades están determinadas por el prefactor\(\mathrm{A}\), que puede considerarse como una energía cinética promedio del sistema.
Las vacantes siempre están presentes en cada sólido porque son el resultado de procesos activados térmicamente. Podemos considerar la tasa de formación de una vacante y la tasa de remoción de esa misma vacante como dos procesos activados térmicamente, cada uno con su propia tasa. A cualquier temperatura dada, cuando la tasa de formación de la vacante es la misma que la tasa de “deformación” de la vacante entonces la concentración de vacantes en el cristal estará en equilibrio. Dado que cada tasa se activa térmicamente podemos usar una ecuación de Arrhenius para describir tanto el proceso hacia adelante como hacia atrás, y establecerlos iguales para el equilibrio uno llega a una fórmula que describe cómo la concentración de vacantes depende de la temperatura:
\(N_v=N e^{-E_a / k_B T}\)
donde\(N_v / N\) está la concentración fraccionaria de vacantes y\(E_a\) es la energía de activación\([\mathrm{J}]\) requerida para eliminar un átomo. Si la vacante ocurre en un sólido iónico, se debe mantener la neutralidad de carga. Por lo tanto, el defecto se forma como defecto de Schottky, donde se elimina un par de cargas (un catión y un anión), o como defecto de Frenkel, donde el átomo vacante se asienta en otra parte de la red en un sitio intersticial. Para un defecto de Schottky en un sólido iónico como\(\mathrm{CaCl}_2\), se\(\left(\mathrm{Cl}^{-}\right)\) deben eliminar dos aniones por cada\(\left(\mathrm{Ca}_2^{+}\right)\) vacante de catión para mantener la neutralidad de carga. Frenkel y un catión más pequeño\(\mathrm{AgCl}, \mathrm{AgBr}\), como, y\(\mathrm{AgI}\), por ejemplo.
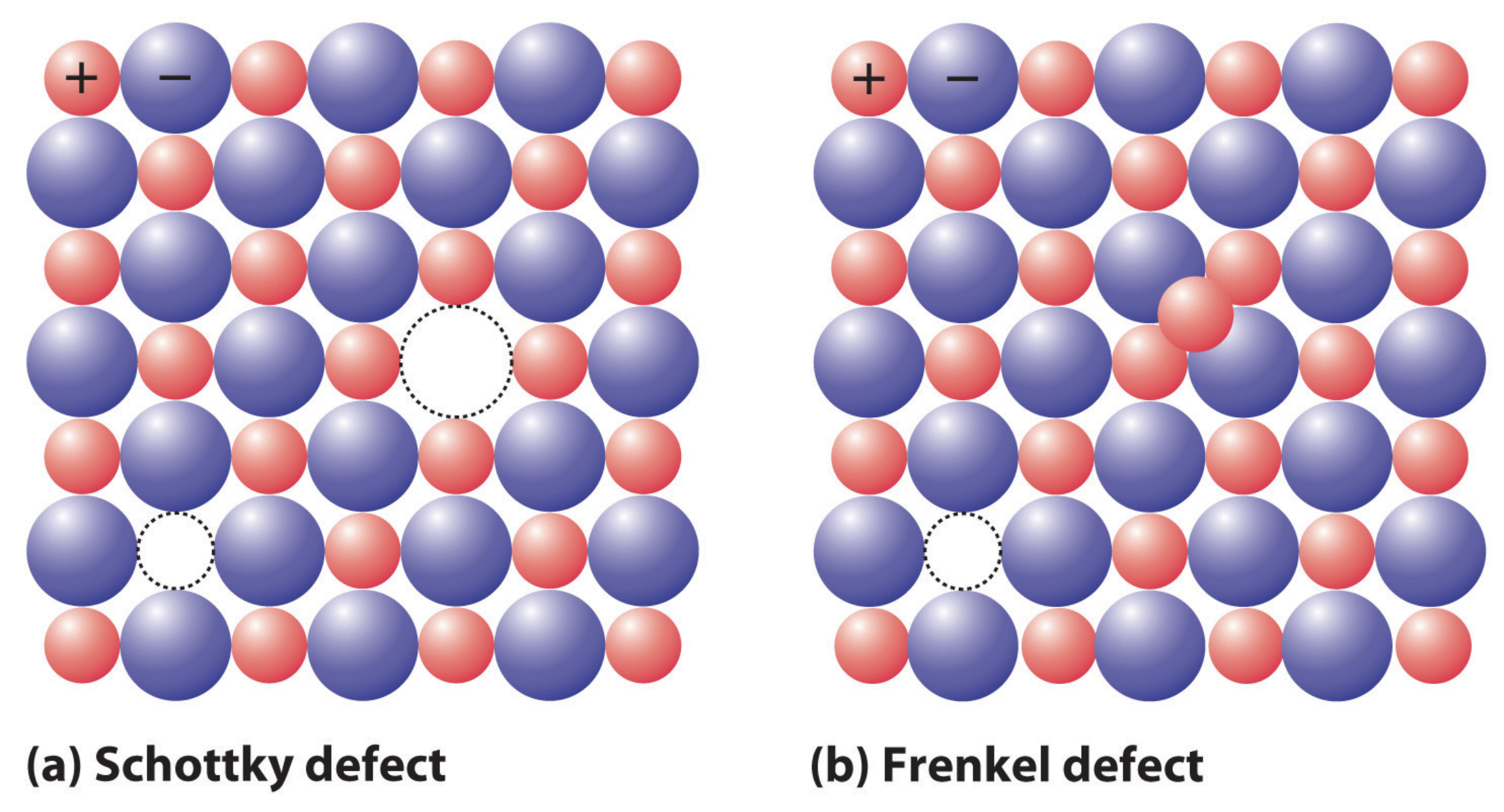
Los defectos intersticiales también pueden ocurrir en los sólidos covalentes: en este caso, un átomo extra ocupa un sitio que no forma parte de la red, pero el requisito de neutralidad de carga no requiere la creación de una vacante siempre que los átomos intersticiales tengan la misma carga que los átomos de la red. Por ejemplo, una entrada\(\mathrm{C}\) intersticial\(\mathrm{Fe}\) es neutra de carga. Si el átomo intersticial es el mismo tipo de átomo que la red, como un\(\mathrm{Si}\) átomo en una\(\mathrm{Si}\) red pero no en un sitio reticular, el defecto se denomina autointersticial. La energía requerida para formar un autointersticial\((2-5 \mathrm{eV})\) es mucho mayor que para una vacante\((0.5-1 \mathrm{eV})\), por lo que estos defectos son mucho menos comunes: esto se puede racionalizar pensando en lo difícil que sería exprimir un átomo entre átomos de tamaño similar dispuestos en una red estrechamente empaquetada.
Los átomos que ocupan el lugar de otro átomo en una red se denominan defectos de sustitución. Generalmente, las reglas Hume-Rothery proporcionan pautas a las que los átomos pueden ser un defecto sustitutivo: el tamaño atómico debe estar dentro\(+/- 15\%\), la estructura cristalina debe ser la misma, la electronegatividad debe ser similar, y la valencia debe ser la misma o superior.
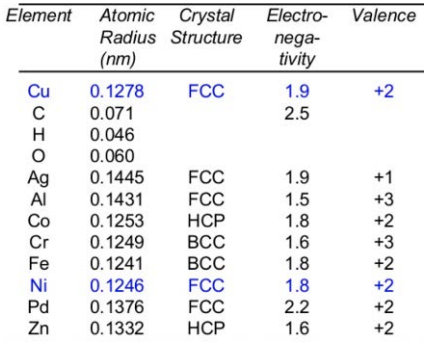
Por qué esto importa
Detengamos el defecto intersticial del carbono en el hierro, también conocido como acero. Este defecto particular es aquel que tiene beneficios positivos si se controla cuidadosamente y la cantidad correcta de carbono (no mucho, resulta) se coloca en las posiciones correctas dentro de la celosía de hierro (los agujeros tetraédricos, por ejemplo, en bcc\(\mathrm{Fe}\)). De hecho, el cambio en las propiedades del hierro es absolutamente tremendo y representan un ejemplo espectacular de cómo los defectos pueden ser utilizados beneficiosamente. Si se elimina la cifra de producción vs. tiempo debido a tomar una pieza de hierro puro y ap- las restricciones de copyright. La capa se deforma lateralmente sobre ella, entonces su tensión de cizallamiento resuelta es bastante baja, alrededor de 10 MPa. Eso significa que si empujas hacia los lados sobre una pieza de hierro puro se deformará bajo 10 MPa de presión. Pero con solo 1%\(\mathrm{C}\) en sitios interstiales, el\(\mathrm{C}\) hierro dopado puede tener un esfuerzo cortante resuelto tan alto como 2000 MPa, ¡200 veces mayor que el caso sin dopar!
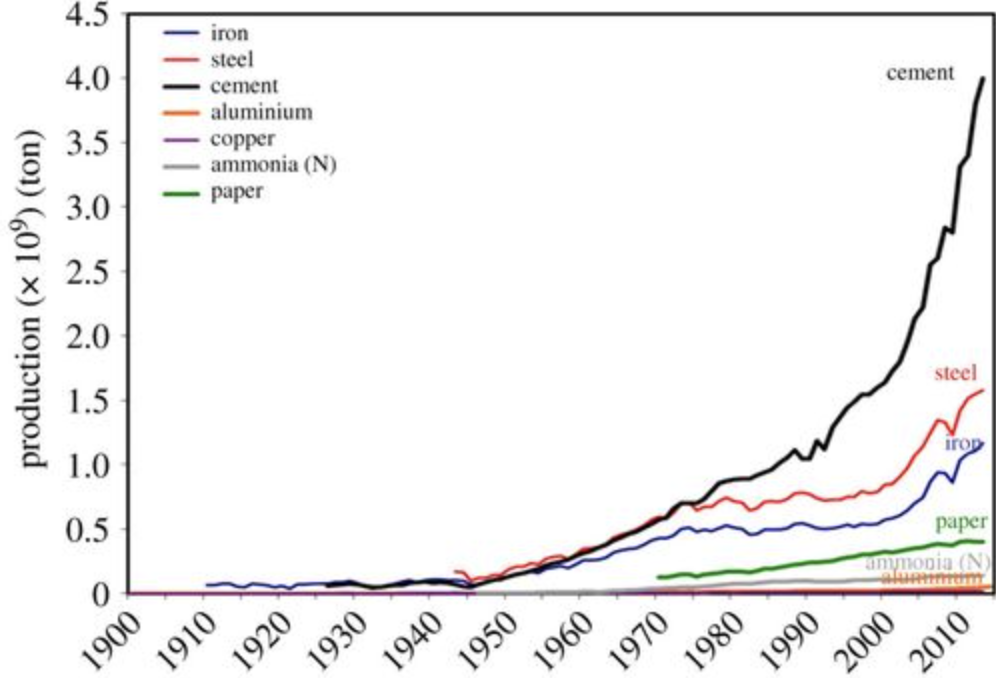
Ahora, este fenómeno se conoce y se practica desde hace más de 2500 años, cuando la gente observó por primera vez la resistencia mecánica impartida sobre el hierro cuando fue calentado por un fuego de carbón (el carbón era la fuente de carbono). Pero eso es solo: hace 2500 años, o hace 1000 años, o incluso hace solo 100 años, no se fabricaba mucho acero cada año. Esto ahora está cambiando, y está cambiando drásticamente, y es por qué esto importa.
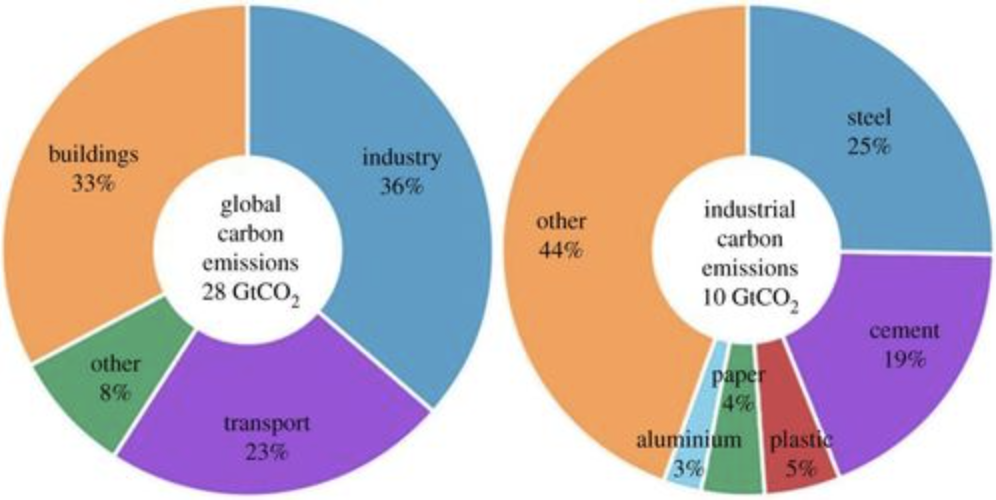
Gráfico de emisiones de carbono industrial
Eche un vistazo a la tabla anterior (del Servicio Geológico de Estados Unidos, la ONU, la FAO, la Asociación Mundial del Aluminio) de la cantidad de producción de algunos de los materiales que los humanos fabrican a una escala lo suficientemente masiva como para requerir enormes trozos del consumo de energía del mundo. El cemento y el acero son los dos primeros, y las estimaciones los sitúan en 10-15% combinados de\(\mathrm{CO}_2\) las emisiones mundiales anuales. Si miramos solo\(\mathrm{CO}_2\) las emisiones de los procesos industriales, el acero tiene la mayor participación al 25% del total. Pero aún más importantes son esas pendientes en las tendencias de producción: tenga en cuenta que el uso de estos productos está creciendo y seguirá creciendo dramáticamente en el futuro. Atrás hace 2500 años no importaba cómo se fabricara el acero. Tampoco tenían idea de por qué el carbón le daba esas propiedades al hierro. Hoy en día, no sólo necesitamos encontrar nuevas formas de hacer acero de manera más eficiente, sino que también sabemos lo que sucede en el material a escala atómica y de unión. En otras palabras, entendemos su química de estado sólido.
¿Cómo podemos hacer acero de una manera más eficiente energéticamente? Responder a esa pregunta se basa en el conocimiento de los defectos puntuales en el material, y específicamente en la energía que se necesita para introducir carbono en la red intersticial. Y no siempre es obvio. Por ejemplo, si comparamos el tamaño atómico de\(\mathrm{C}\) con los tamaños de los volúmenes intersticiales disponibles en\(\mathrm{Fe}\), está claro que no encaja del todo, y algún tipo de distorsión reticular tendrá que tener lugar para acomodar el defecto intersticial, incluso tan pequeño como un\(\mathrm{C}\) átomo. Pero eso significa que no es tan sencillo como ocupar el sitio del defecto con más espacio, ya que necesitamos saber cómo se tensan los átomos en respuesta a que el defecto esté ahí. Tomemos el ejemplo de -hierro: en esa fase pensarías que un\(\mathrm{C}\) átomo ocupa el agujero tetraédrico más grande, pero de hecho prefiere ir al sitio intersticial octaédrico. La razón de esta preferencia es que cuando el\(\mathrm{C}\) átomo -entra en el intersticial, la tensión se alivia para el sitio octaédrico por dos átomos de hierro vecinos más cercanos que se mueven un poco, mientras que para el sitio tetraédrico, cuatro átomos de hierro son los vecinos más cercanos y el desplazamiento de todos estos requiere más energía de tensión. Esta es solo una fase de hierro y dos sitios diferentes. Puede haber formas de mover los\(\mathrm{C}\) átomos a otras fases más fácilmente, eso tomaría menos energía, y daría la misma fuerza. O tal vez hay otras formas más allá del fuego (razón por la cual la fabricación del acero requiere tanta energía) para obtener la química del defecto justo. Este es un problema duro, pero crítico: eche un vistazo a este gráfico de un artículo reciente publicado en Science que desglosa qué sectores serán más difíciles de hacer “verdes”. ¡Tenga en cuenta el protagonismo del acero y el cemento! Para resolver problemas tan duros, necesitaremos avances en la química de defectos.
Por qué esto emplea
Esto es fácil: ¡en realidad hay un puesto de trabajo llamado “Ingeniero de defectos”! En Global Foundries, se preocupan por los defectos para la fabricación básica de materiales semiconductores, mientras que en Intel, hay aberturas para que los ingenieros de defectos trabajen en 3D XPoint, que es una nueva tecnología de memoria no volátil. Intel también tiene una vacante para un “Ingeniero de Reducción de Defectos”. Estas y muchas más aberturas similares son para industrias donde los dispositivos se fabrican en salas limpias, a menudo salas limpias muy limpias. Una sala limpia “Clase 1”, por ejemplo, significa que si tomas un metro cúbico de aire en cualquier lugar dado de la habitación, contarías menos de 10 partículas de tamaño 100 nanómetros, menos de 2 partículas de tamaño inferior a 200 nanómetros y cero partículas mayores que eso. La razón por la que las instalaciones de fabricación necesitan un nivel tan alto de pureza del aire es que están fabricando características del orden de 10 nanómetros y, por lo tanto, cualquier defecto pequeño puede ser un gran problema.
Ahora bien, de nuevo, estos no son necesariamente defectos puntuales (aunque ciertamente partículas de 100 nm que chocan con una capa de silicio mientras se procesa pueden causar defectos puntuales). ¿Qué hay de las tecnologías donde el defecto puntual es la parte clave de la tecnología en sí? En ese caso puede estar hablando de una pila de combustible de óxido sólido (\(\mathrm{SOFC}\)). Estos son típicamente óxidos metálicos y funcionan conduciendo iones de oxígeno a través del material. Pero la única forma en que un ion oxígeno puede moverse es si hay vacantes de oxígeno presentes, y en suficiente densidad a temperaturas razonables. Muchas empresas trabajan en el desarrollo de celdas de combustible de óxido sólido eficientes, de bajo costo y de baja temperatura. Cada fabricante de automóviles, por ejemplo, tiene interés en esto como una posible forma futura de impulsar el transporte (Nissan tiene un auto demo genial). Otras empresas como Precision Combustion, Elcogen o Bloom Energy trabajan para construir\(\mathrm{SOFCs}\), con esa última diciendo, “mejores electrones” *en su página de inicio. Bonito. (aunque pensé que todos los electrones eran idénticos.. pero de todos modos). El punto es que hay un interés creciente\(\mathrm{SOFC}\) y un mercado ya fuerte listo para llegar a mil millones de dólares para 2024. Con un mayor control sobre esas vacantes de oxígeno, la capacidad de abaratar los materiales y la capacidad de controlar defectos a temperaturas más bajas, ¡el uso de\(\mathrm{SOFC}\) podría aumentar incluso mucho más que eso!
Práctica extra
1. Esboce los siguientes defectos:
a) Schottky
b) Frenkel
c) Impureza sustitucional+vacante
d) Auto-intersticial
e) Impureza sustitutiva
f) Vacante
- Contestar
-
2. Las celdas de combustible de óxido sólido dependen de la reacción del combustible con el oxígeno para formar agua. Un óxido cerámico puede ser dopado para introducir vacantes de oxígeno que permiten que la carga conduzca a través del electrolito sólido. La circonita se\((\mathrm{ZrO} 2)\) puede dopar agregando\(\mathrm{Sc}2\mathrm{O}3\). Si\(0.5 \mathrm{~g}\) de se\(\mathrm{Sc}2\mathrm{O}3\) puede incorporar en\(10 \mathrm{~g}\) de\(\mathrm{ZrO} 2\) mientras se mantiene la estructura de zirconia, ¿cuántas vacantes de oxígeno se generan?
- Contestar
-
Estamos dopando\(\mathrm{ZrO}_2\) con\(\mathrm{SC}_2 \mathrm{O}_3\). Los\(\mathrm{Zr}^{4+}\) iones son reemplazados por los\(\mathrm{Sc}^{3+}\) iones, creando un desequilibrio de carga de\(-1\) con cada sustitución. Esto significa que por cada 2 de tales reemplazos, o cada\(2 S c^{3+}\) iones agregados, habrá un\(-2\) desequilibrio, y se\(\left(V_O^{\prime \prime}\right)\) creará una vacante de oxígeno para compensar y lograr la neutralidad de carga.
\[0.5 g \mathrm{Sc}_2 \mathrm{O}_3\left(\dfrac{1 \mathrm{molSc_{2 } \mathrm { O } _ { 3 }}}{137.9 g}\right)=0.0036 \mathrm{molSc}_2 \nonumber\]
\(0.0072 \mathrm{~mol} \mathrm{Sc} c^{3+}\)agregado Número\(=0.0036 \mathrm{~mol} V_O "\)
total de vacantes de oxígeno\(=2.18 \times 10^{21}\)
Conferencia 24: Defectos de línea y curvas de tensión-deformación
Resumen
Los defectos de línea son defectos unidimensionales en un cristal que afectan a muchas propiedades de materiales macroscópicos, incluida la deformación. En 3.091, nos centraremos en dos tipos de deformación: la deformación elástica, que es reversible (la deformación solo ocurre cuando se aplica una tensión, y retrocede una vez que se elimina la tensión), y la deformación plástica, que es permanente.
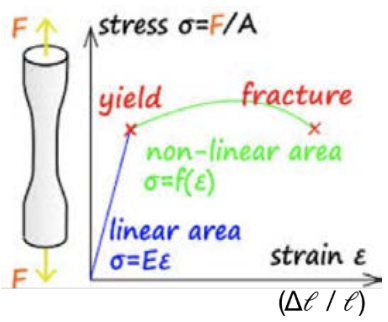
La deformación elástica se puede comparar con conectar todos los átomos con resortes: la ley de Hooke, f=-Kx, nos dice que hay una fuerza restauradora que devuelve el material a su estado inicial. Esto corresponde a la región lineal inicial en una curva tensión-deformación. Si un material es quebradizo, probablemente se romperá en el régimen lineal. Sin embargo, si el material es dúctil, puede sufrir deformación plástica: el material ya no responde linealmente a la tensión aplicada. Un mecanismo de deformación que ocurre durante la deformación plástica se llama deslizamiento: planos individuales de átomos se deslizan entre sí debido a la presencia de un defecto de línea. Una dislocación es un tipo de defecto de línea que se forma cuando los átomos están ligeramente desalineados: existe un plano extra de átomos en el cristal.
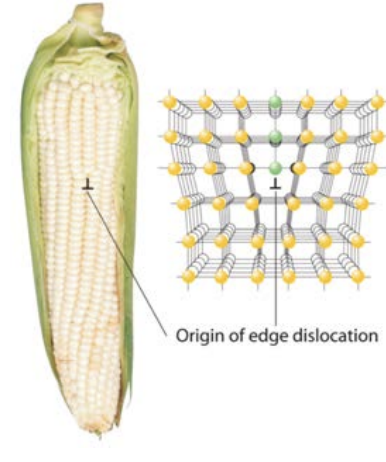
Las dislocaciones pueden moverse a través de un cristal cuando se aplica una fuerza. Los átomos se deslizan sobre otro para aliviar el estrés interno causado por la aplicación de una fuerza. ¿Cómo podemos saber cuáles son los planos de deslizamiento? Para que el material se deslice, dos planos adyacentes de átomos deben deslizarse uno junto al otro. A medida que esto sucede, los vínculos entre los planos deben romperse y reformarse. Por lo tanto, los planos de deslizamiento deben ser planos que tengan la menor densidad de unión interplanar. Se puede verificar que esto significa que los planos más densamente empaquetados serán los planos de deslizamiento, ya que tienen la mayor densidad de unión intraplanar. Esto significa que el deslizamiento ocurre paralelo a los planos estrechamente empaquetados: juntos, los planos de deslizamiento y la dirección de deslizamiento forman un sistema de deslizamiento de cristal. Muchos materiales pueden sufrir deslizamiento mediado por dislocación, pero los metales en particular son conocidos por este mecanismo de deformación. El mar de electrones que aprendimos en los metales permite que los enlaces se muevan (se rompan y se vuelvan a formar en un nuevo punto) con facilidad en comparación con los sólidos iónicos y covalentes, que tienen estructuras electrónicas mucho más rígidas.
Cuando la tensión se aplica por primera vez a un material elástico, las dislocaciones se forman inicialmente a medida que los planos de átomos se separan. Si dos dislocaciones se topan entre sí mientras se mueven, los defectos pueden quedar anclados, por lo que ya no pueden moverse a través del cristal. A medida que se clavan más y más dislocaciones, se enredan y no se produce deslizamiento: el material seguiría deformándose elásticamente pero requeriría mucha más fuerza para deformarlo. En otras palabras, la fijación por dislocación hace que los materiales sean más duros. Este mecanismo de fortalecimiento del material se llama endurecimiento por trabajo. El endurecimiento por trabajo hace que el límite elástico aumente, pero a expensas de la ductilidad.
Por qué esto importa
Hablemos de energía eólica. El viento tiene los mismos desafíos de intermitencia que tiene la energía solar (por lo que en otras palabras, solo puede ser realmente útil a gran escala si podemos almacenar la energía de manera económica y eficiente). Pero el viento también tiene muchas ventajas y es una forma muy atractiva de generar electricidad. Es por eso que la capacidad eólica instalada ha experimentado un tremendo crecimiento a nivel mundial en los últimos 20 años. En Estados Unidos, más del 5% de nuestra electricidad total ahora es generada por el viento.
Gráfico Capacidad Global Acumulada Instalada del Viento 2001-2016 (pg. 3)
Una turbina eólica en realidad se basa en una tecnología bastante simple, que es una de las razones por las que es tan atractiva. Básicamente, el viento gira las palas, lo que proporciona la fuerza para hacer funcionar un motor eléctrico a la inversa para generar electricidad. El reto es que los vientos de alta energía más consistentes ocurren a grandes altitudes, por lo que las palas son más eficientes cuanto más grandes y más arriba se pueden hacer que vayan. Esto significa que las palas tienen que soportar tremendas cargas mecánicas de la alta energía eólica. Y para dificultar las cosas, las palas tienen que poder ir y venir entre viento alto, bajo o sin viento dependiendo de la hora del día. (como un aparte, me encanta mirar mapas y si te interesa ver cómo varía la velocidad del viento en todo el mundo, hay muchos mapas geniales que te muestran esto).
Entonces, en otras palabras, necesitamos palas que sean lo suficientemente fuertes como para que no se rompan bajo la tensión extrema de la fuerza del viento, sino lo suficientemente flexibles como para que puedan doblarse sin deformaciones irreversibles. Y ¿qué es lo que necesitamos entender e diseñar para poder hacer mejores cuchillas? Los defectos de línea por supuesto!!
Echa un vistazo a esta parcela de materiales.
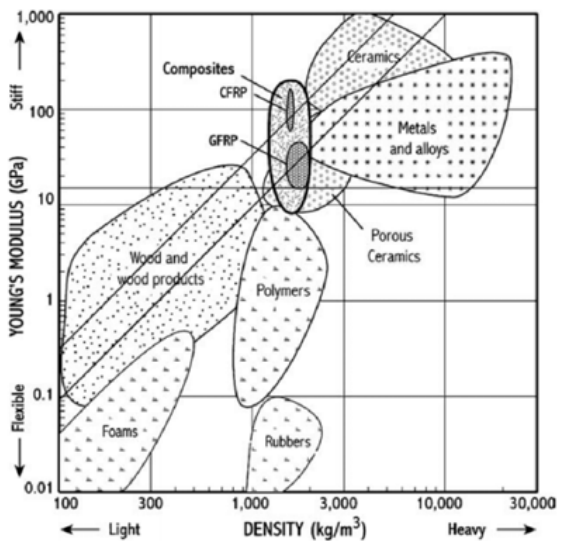
Aquí estamos viendo la densidad del material en el eje x y el módulo de Young en el eje y. El módulo de Young es simplemente una medida de la rigidez elástica del material, por lo que si volvemos a nuestra curva de tensión/deformación al comienzo de este capítulo, se relaciona con la pendiente del régimen elástico lineal. Para una pala de turbina eólica, nos gustaría que fuera ligera y fuerte, pero también flexible. Como aprendimos en esta conferencia, los defectos de línea están relacionados con la plasticidad, que se relaciona con el límite elástico, que se relaciona con cuánto puede deformarse elásticamente un material.
A partir del gráfico, podemos comparar las diferentes clases de materiales (como metales vs. cerámica vs. polímeros, etc) para dos de estas propiedades: densidad y rigidez. Lo interesante de esto es que hay partes enormes del gráfico que actualmente están vacías. En otras palabras, hay mucho trabajo por hacer para encontrar y preparar materiales que sean a la vez pesados y flexibles, o ligeros y fuertes. Y ya sabes lo que esto significa: ¡nueva química combinada con control sobre defectos de línea!
Por qué esto emplea

Vamos a lo grande. Este barco, por ejemplo, se llama SS Schenectady, y tiene un poco de problema. Sobre todo que se agrieta por la mitad. Muchos barcos construidos durante la Segunda Guerra Mundial estaban hechos de acero de baja calidad, que era demasiado fácil de fracturar a las temperaturas del mar. De hecho, sí probaron la resistencia de su acero pero sólo en el dique seco, por lo que la temperatura de prueba fue superior a la temperatura operativa. Una vez que el barco estaba en el agua más fría, el acero se volvió mucho más quebradizo y se hizo mucho más fácil que se formaran defectos, y una vez que se formaron les fue fácil crecer bajo el estrés aplicado. Uno ciertamente no quiere la deformación plástica del metal de un barco, pero tampoco se quiere este tipo de fragilidad. Obtener la fuerza adecuada para la aplicación correcta en las condiciones adecuadas requiere mucho conocimiento de los materiales y sus propiedades de defectos. Y también hay muchos trabajos en este espacio. Piénsalo: prácticamente todo lo que construimos hoy en día tiene que tener algún tipo de condiciones de operación donde se puedan contar las propiedades mecánicas para funcionar como se esperaba. De lo contrario, los barcos se agrietan por la mitad, los puentes colapsan y las carreteras
Desde que acabo de dar el ejemplo del barco, qué tal éste: el Departamento de la Marina de Estados Unidos tiene una apertura para un “Ingeniero de Materiales” donde explícitamente piden experiencia en, “resistencia de los materiales (relaciones tensión-deformación)”. La división de Manufactura, Tecnología e Ingeniería de Corning está contratando a un “Científico/Ingeniero” para modelar la resistencia de los materiales, presumiblemente en su mayoría vidrios. Hay una apertura para un “Ingeniero de Investigación — Comportamiento de Materiales” en GE para diseñar propiedades mecánicas de nuevos materiales estructurales y recubrimientos para propulsión de aviones. Hay tantos trabajos en este espacio que ni siquiera podría categorizarlos a todos: prácticamente cualquier empresa que fabrique o se ocupe de materiales tiene trabajos disponibles relacionados con su resistencia mecánica y fallas. Desde barcos, hasta edificios, dispositivos médicos a ropa, naves espaciales a muebles, los defectos tienen la llave.
Práctica extra
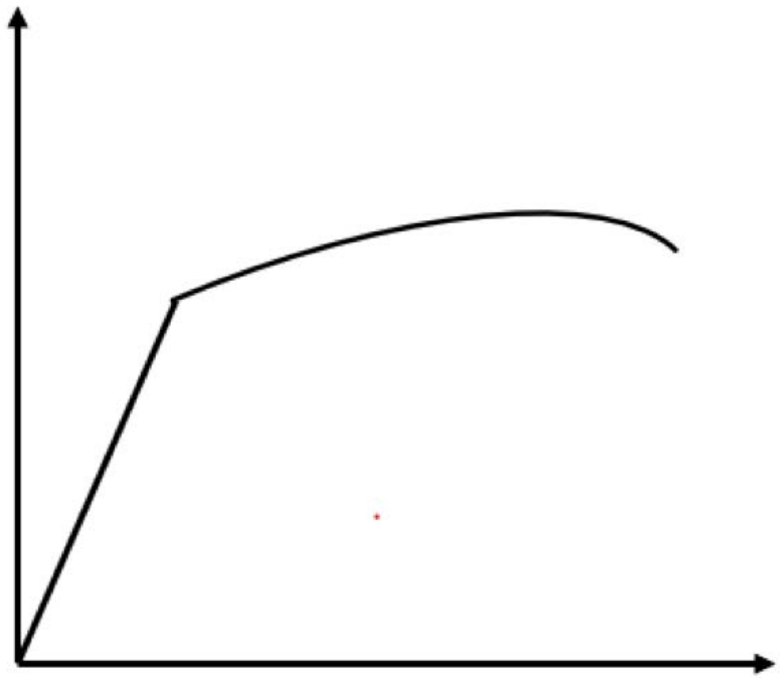
1. Se obtiene la siguiente curva tensión-deformación para una muestra de aluminio (FCC).
a) Etiquetar las siguientes regiones en la parcela (¡y los ejes!) :
Régimen elástico Régimen plástico Punto de fluencia Punto de fractura Módulo elástico
- Contestar
-
Ejes: tensión,\(\sigma\) en el\(y\) eje -eje, tiene unidades de fuerza/área. La tensión, $\ epsilon$ en el eje x, no tiene unidades, pero a menudo se representa como longitud/longitud
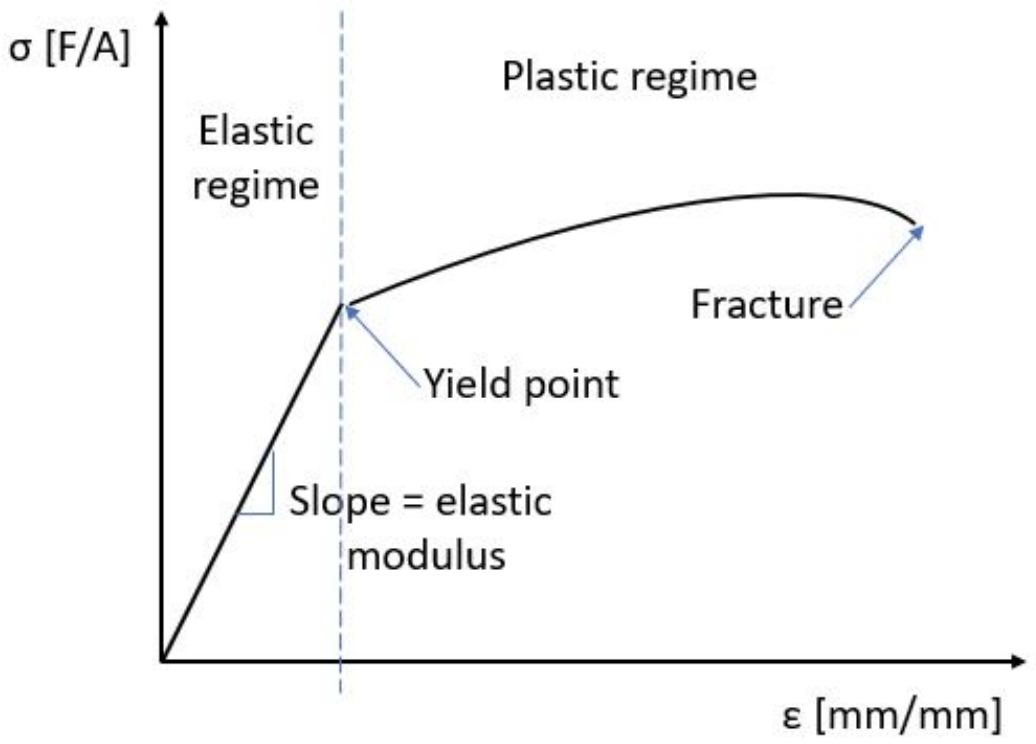
b) ¿Cuál es el sistema de deslizamiento en aluminio?
- Contestar
-
El sistema de deslizamiento para FCC es la dirección empaquetada y el plano cerrado:\(\langle 110\rangle\) y ¡\(\{111\}\)Recordemos que los corchetes angulares se utilizan para denotar familias de direcciones, y las llaves rizadas se utilizan para denotar familias de planos!
Conferencia 25: Materiales amorfos: Sólidos vítreos
Resumen
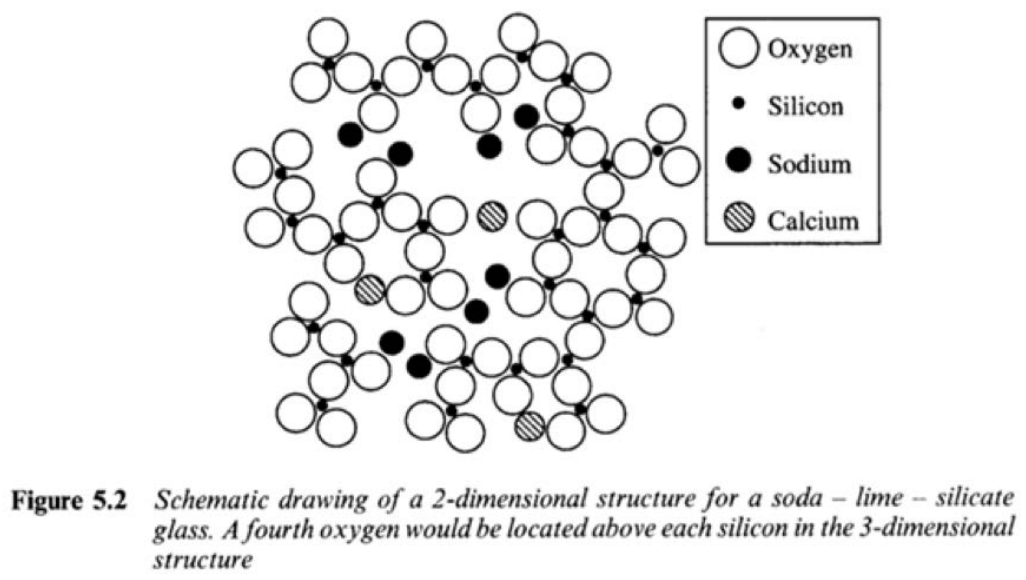
Los vidrios son “materiales amorfos”: todos los átomos están dispuestos aleatoriamente en una estructura no repetitiva. En\(3.091\), nos centraremos en un tipo de vidrio: sílice, o\(\mathrm{SiO}_2\). Cada átomo de silicio tiene cuatro electrones de valencia, por lo que es feliz formar 4 enlaces simples. Si un oxígeno se une a cada uno de estos electrones de valencia, cada uno de los oxígenos queda con un electrón extra, formando una\(\left(\mathrm{SiO}_4\right)^{4-}\) molécula. Sin embargo, cuando se forma un sólido a partir de estas moléculas de silicato, el\(\mathrm{O}\) puede ser compartido entre silicatos vecinos, formando un puente.
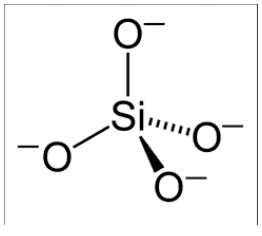
Las moléculas individuales de silicato tetraédrico permanecen intactas, pero pueden rotar libremente en relación con las otras moléculas de silicato en el sólido. Cuando no arreglan de manera ordenada, se forma vidrio de sílice. Si el sólido que se forma es cristalino o vítreo depende fuertemente de las condiciones de procesamiento a las que se somete la sílice.
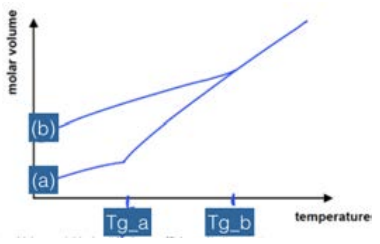
Una métrica para cuantificar las condiciones de procesamiento es observar cómo cambia el volumen molar en función de la temperatura. Para un cristal, la trama se ve así. Hay una línea inclinada que corresponde al material sólido, luego un salto, luego una línea inclinada diferente que corresponde a la fase líquida. El salto se produce a la temperatura de fusión\(T_m\): cuando el material se funde o congela, sufre un enorme cambio de volumen. La pendiente de cada línea se define como el coeficiente de expansión térmica. Sin embargo, a veces cuando un material se enfría, puede permanecer en la fase líquida siguiente\(T_m\): esto se llama sobreenfriamiento. Cuando un líquido se sobreenfría, continúa actuando como un líquido hasta que ocurre una de dos cosas:
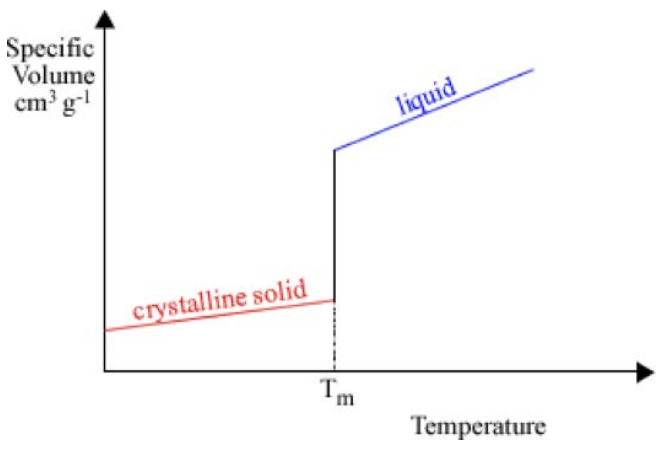
1. Cristaliza, caracterizado por un gran salto hacia abajo a la línea sólida cristalina y luego el comportamiento sólido
2. De pronto se convierte en un sólido, “congelado” en su estado desordenado y convirtiéndose en un vaso. Esta transición se caracteriza por un cambio en la pendiente en\(T_g\), el punto en el que se forma el sólido (llamada temperatura de transición vítrea), pero ninguna discontinuidad en la curva de congelación.
¿Cómo podemos saber qué camino tomará un material? Depende de las propiedades de los materiales: si el líquido tiene una alta movilidad (baja viscosidad), las moléculas pueden moverse fácilmente y acomodarse en la estructura cristalina energéticamente preferencial. Los líquidos altamente viscosos o de baja movilidad tienen muchas más probabilidades de quedar atrapados en un vaso. Además, si la estructura cristalina es muy complicada, o si el líquido se enfría muy rápidamente, es difícil para los átomos encontrar sitios cristalinos antes que las formas sólidas: estos casos también son más propensos a conducir a la formación de vidrio.
El volumen por mol es una buena medida del trastorno en el material: cuanto más lejos es el molar
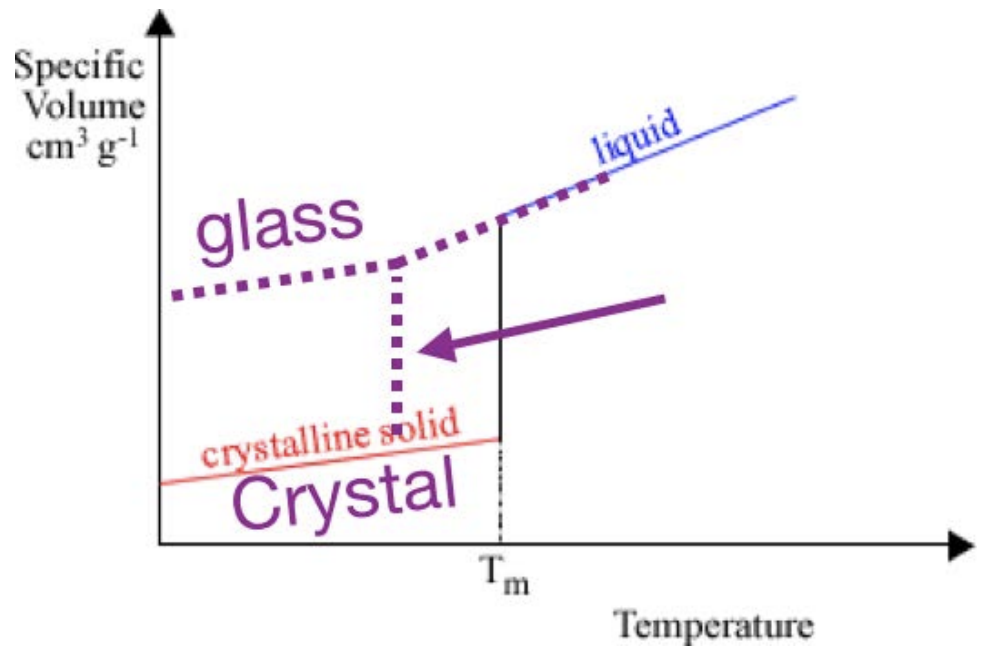
el volumen es de la caja cristalina, cuanto más vítreo es el material. Aunque un material solo tiene un punto de fusión, puede tener múltiples transiciones de vidrio dependiendo de cómo se procese. La XRD es una herramienta que se puede utilizar para determinar si un material es un cristal o un vidrio: a medida que el material se desordena cada vez más, los picos agudos observados en el patrón de XRD desaparecen en un amplio halo amorfo.
Por qué esto importa
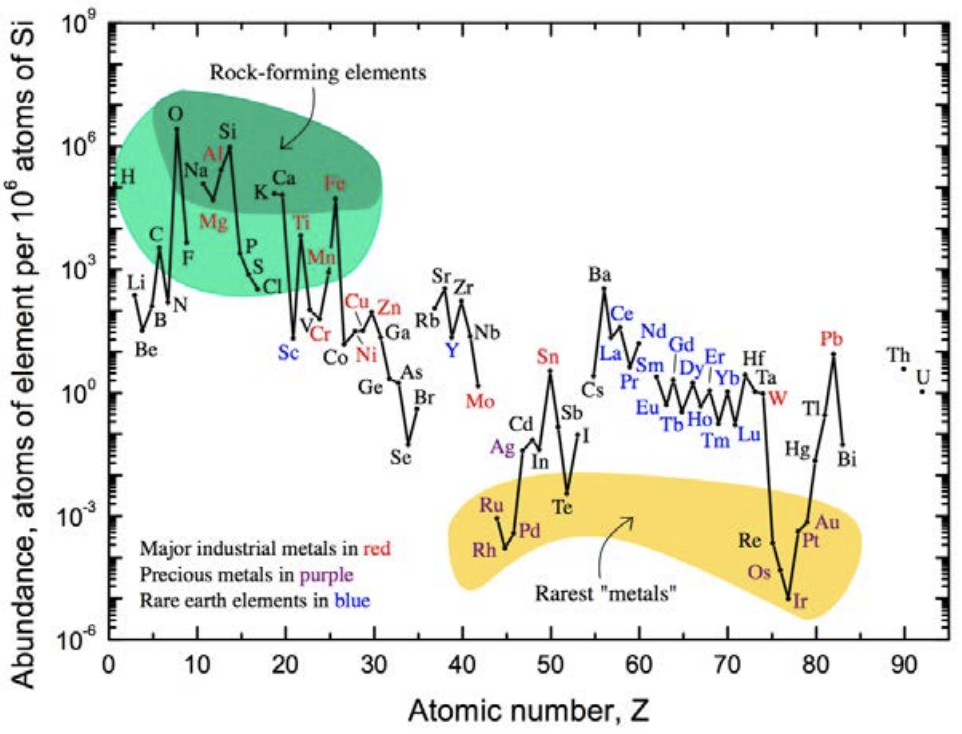
\(\mathrm{SiO}_2\)el vidrio está hecho de arena y hay mucho en el planeta. \(\mathrm{SiO}_2\)destaca como un material base que tiene propiedades realmente impresionantes. Eso es en parte por su tremenda abundancia. Echa un vistazo a esta trama de la abundancia de átomos en la corteza terrestre. Obsérvese que de todos los elementos de la tabla periódica, el oxígeno y el silicio son #1 y #2. Esto quiere decir que la sílice es barata, y no nos vamos a agotar, a diferencia de otros elementos. De hecho, hay muchos “elementos críticos” como\(\mathrm{Li}\)\(\mathrm{Co}\)\(\mathrm{Ga}, \mathrm{Te}\), y por\(\mathrm{Nd}\) nombrar algunos, etiquetados como tales por el Departamento de Energía porque existe la preocupación de que no habrá suficientes de ellos en el futuro para satisfacer la demanda global. Pero\(\mathrm{Si}\) y\(\mathrm{O}\) son lo contrario de crítico: son dramáticamente abundantes. Y esto presenta una tremenda oportunidad de usar\(\mathrm{SiO}_2\) como material base para aplicaciones de amplio alcance.
Y es por eso que importa la química que aprendimos en esta conferencia: porque aprendimos que
las propiedades clave del vidrio, y la forma en que se procesa, todas provienen de la química. Las formas en que seguimos usando el vidrio en este planeta pueden aumentar a medida que la población humana y las necesidades/uso tecnológico sigan aumentando, pero ¿cómo podemos hacer utilizar el vidrio de manera más sostenible dado que el material base es tan abundante? ¿O qué otras aplicaciones puede ser útil el vidrio donde actualmente no se usa hoy en día? ¿Se puede hacer el vidrio “más verde”? Un ejemplo genial de cómo esto podría funcionar es en el trabajo de Markus Keyser, quien inventó el “Sinter Solar”. Esta es una impresora 3D autosuficiente de objetos de vidrio que puedes conducir hacia el postre, alimentar la arena y la luz solar que abundan e imprimir objetos de vidrio. La luz solar se utiliza tanto para alimentar el motor eléctrico de la impresora como para crear la energía térmica suficiente\(T_g\) para llegar arriba de la arena. Ya puedes comprar impresoras comerciales de vidrio 3D, pero me gusta este ejemplo porque es de emisión neutra.
Foto de Marcus Kayser's Solar Sinter
El futuro de hasta qué punto empujemos tecnologías como esta dependerá de hasta qué punto seamos capaces de impulsar las propiedades del vidrio. En la próxima conferencia vamos a discutir algunas formas diferentes de controlar las propiedades del vidrio, pero solo se necesita la conferencia de hoy y una comprensión de esos grupos de silicato para comprender el vínculo clave entre la química y por qué esto importa.
Por qué esto emplea
Corning es uno de los fabricantes de vidrio más grandes y conocidos del mundo. Ese video que mencioné en la conferencia anterior que mostré en clase, sobre la caída del príncipe Rupert, que era de la serie educativa “Corning Museum of Glass”. Están realmente, realmente en el vidrio. Y son grandes: sus ingresos de 2018 fueron\(\$ 11.4 \mathrm{~B}\) y actualmente tienen 51,500 empleados. En su sitio web si haces clic en la sección “ingeniería” de la página de ofertas de empleo encontrarás cientos de anuncios. También tienen un montón de prácticas para estudiantes:, “Una pasantía de Corning ofrece una valiosa experiencia práctica para que las personas en su disciplina elegida incluyan, entre otras, Ciencia de Materiales, Ingeniería, Investigación, Manufactura, TI, Recursos Humanos, Marketing, Finanzas y Cadena de Suministro”. Es un lugar genial que lo ha hecho grande de vidrio y convertido el vidrio en un gran problema.
Corning trabaja en una amplia gama de aplicaciones de vidrio, pero centrémonos en solo una de ellas: los cables de fibra óptica. La mayor parte de la columna vertebral del internet actual está servida por fibra óptica, que están hechas de vidrio de sílice, porque tienen muchas ventajas sobre el cableado de cobre (más antiguo). Por ejemplo, los cables de fibra óptica pueden transportar un ancho de banda mucho mayor en distancias más largas que el cobre, esto significa que se reduce la necesidad de amplificadores de señal, y los cables de fibra óptica también son menos susceptibles a la interferencia de campos electromagnéticos externos por lo que no necesitan blindaje, y finalmente no se rompen abajo o corroen casi tan a menudo así que son mucho menos costosos de mantener. No es de extrañar que las principales compañías estadounidenses como Comcast FiOS y Google Fiber estén trabajando para obtener cables de fibra óptica más allá de ser solo la columna vertebral de Internet, sino literalmente en todos los edificios del país. A diferencia de Corning, del que muchos de nosotros quizás ya hayamos oído hablar, algunas de las principales empresas de fibra óptica son menos conocidas incluso siendo grandes empresas (es decir, ¡muchos trabajos!). Tome OFS Optics, que fabrica cables de fibra óptica para más de 50 espacios de aplicación diferentes. Tienen más\(\$ 250 \mathrm{M}\) ingresos anuales, y en una de sus ofertas de trabajo para un “Ingeniero RD” afirma que están buscando a alguien que, “lidere el desarrollo de procesos de fabricación para la próxima generación de productos de fibra óptica de vidrio”. Fresco.
O qué tal ir internacional a empresas como Prysmian (con sede en Italia), que tiene más\(\$ 1 \mathrm{~B}\) ingresos anuales, tiene un “Programa de Posgrado” para que los recién graduados los sumerjan rápidamente con un programa de mentores y además tiene el nombre más genial para una fibra con su marca “BendBright”. O hay YOFC con sede en China con más de\(\$1 \mathrm{~B}\) /año en ingresos, y un bonito eslogan, “Smart Link Better Life”, o Fujikura con ventas\(\$ 7 \mathrm{~B}\) anuales y un reclamo de ser, “Shaping the Future with Tsunagu Technology”. (eso significa “conectar”). Estas y tantas compañías más están trabajando en la fabricación de cables de fibra óptica de próxima generación, y si profundiza algunas capas en alguna de ellas, verá lo complicada que es la producción de cables de fibra óptica, cuántas formas diferentes se puede hacer hoy y se hará en el futuro, y cuántos trabajos hay que se relacionan directamente con el conocimiento del\(\mathrm{SiO}_2\) vidrio!
No se trata solo de procesar: también hay una investigación química fundamental que se debe hacer sobre el vidrio de sílice. Al dopar el vidrio de sílice con otros elementos, se pueden cambiar sus propiedades. Por ejemplo, al agregar iones de Erbio, el vidrio se transforma de un portador de luz pasivo a un amplificador capaz de hacer que la señal sea varios órdenes de magnitud más alta. Y si te interesa codificar, hay mucho trabajo por hacer para simular cómo viaja la luz en medios como el vidrio, y cómo interactúa con estos dopantes.
Práctica extra
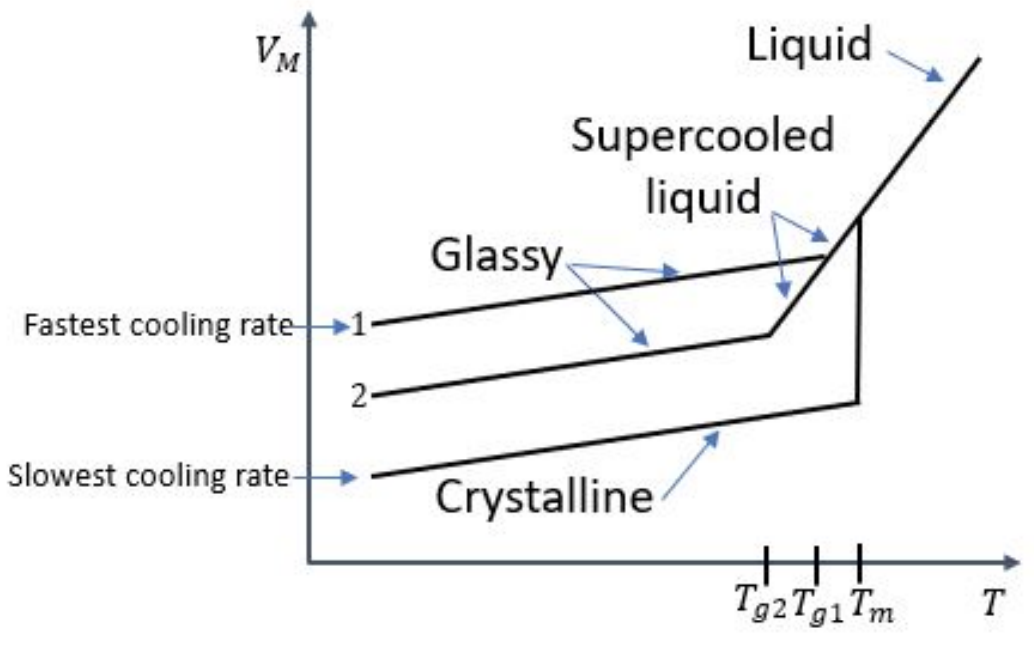
1. Se obtienen las siguientes curvas de volumen libre vs temperatura para un material enfriado a tres velocidades diferentes. Etiquetar todas las instancias de los siguientes fenómenos en la trama (¡y los ejes!) :
a)\(T_g\)
b)\(T_m\)
c) régimen vítreo
d) régimen cristalino
e) velocidad de enfriamiento más rápida
f) velocidad de enfriamiento más lenta
g) líquido
h) líquido superenfriado
- Contestar
-
Conferencia 26: Ingeniería de Propiedades del Vidrio
Resumen
¿Qué significa diseñar vidrio? Puede significar agregar impurezas que cambian propiedades como la temperatura de transición vítrea\(\left(\mathrm{T}_g\right)\), la solubilidad, la durabilidad, etc. lo que une a la mayoría de estos modificadores vítreos es que son donantes de óxido, es decir, renuncian a un\(\mathrm{O}^{2-}\) ion. Esto implica que estos modificadores tienen cationes estables, por lo que a menudo los metales son buenos. Por ejemplo:
\(\mathrm{CaO} \rightarrow \mathrm{Ca}^{2+}+\mathrm{O}^{2-} \quad \mathrm{Na}_2 \mathrm{O} \rightarrow 2 \mathrm{Na}^{+}+\mathrm{O}^{2-} \quad \mathrm{Al}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{Al}^{3+}+3 \mathrm{O}^{2-}\)
El\(\mathrm{O}^{2-}\) ion donado ataca el\(\mathrm{Si} - \mathrm{O} - \mathrm{Si}\) enlace y lo rompe en dos. Es como un cuchillo que corta el enlace de vidrio, y así este proceso se llama escisión de cadena. El\(\mathrm{O}^{2-}\) es capaz de insertarse en el enlace y con sus dos electrones extra satisface el estado de carga de los átomos de oxígeno que ahora “tapan” las cadenas en cada extremo. Entonces tenemos eso\(\mathrm{Si}-\mathrm{O}-\mathrm{Si}+\mathrm{O}^{2-} \rightarrow \mathrm{Si}-\mathrm{O} \mid \mathrm{O}-\mathrm{Si}\) con carga negativa en cada uno\(\mathrm{O}\). Como se muestra en la figura, los\(\mathrm{Na}+\) iones cuelgan alrededor del oxígeno. El efecto de la escisión en cadena sobre las propiedades de las gafas es enorme. Solo toma como ejemplo la temperatura de fusión: para cristalino\(\mathrm{SiO}_2\) (cuarzo) el\(\mathrm{Tm}\) es mayor que\(1200^{\circ} \mathrm{C}\). Para el vidrio de sosa y cal, la temperatura de transición vítrea suele ser de alrededor\(500^{\circ} \mathrm{C}\). Si se cortan las cadenas de silicato, entonces el material es mucho menos viscoso, y puede encontrar mejor empaque más fácilmente, lo que lleva a un menor volumen por mol y también a una menor temperatura de transición vítrea (más sobreenfriamiento).
La química base del sólido, que en el caso descrito anteriormente es\(\mathrm{SiO}_2\), es el formador de red. El donador de óxido se llama modificador de red. Agregar modificadores de red es otra forma de cambiar una curva de enfriamiento de vidrio. Por ejemplo, la curva (b) a la derecha podría obtenerse usando\(\mathrm{SiO}_2\) con\(5 \% \mathrm{PbO}\) y la curva (a) usando\(\mathrm{SiO}_2\) con\(10 \% \mathrm{PbO}\). La razón es que más corte de las cadenas hace que el material sea menos viscoso, lo que significa que puede encontrar un mejor empaque y ser sobreenfriado más.
Se discutieron dos formas en que las propiedades mecánicas son diseñadas en vidrio. Primero, el vidrio se puede templar: el vidrio fundido se enfría con aire y si el exterior del vidrio se solidifica mientras el interior sigue siendo líquido, entonces el exterior tiene un volumen por mol completamente diferente al del interior. el fundido caliente se\(\mathrm{SiO}_2\) solidifica pero como no puede tener el menor volumen que le gustaría tener, pone una presión interna (tensión de compresión) sobre la capa exterior ya sólida. El segundo método de fortalecimiento de vidrio se llama intercambio iónico. Implica el intercambio de iones dejados en el vidrio por modificadores de red con iones de diferente tamaño, lo que crea estrés compresivo.
Por qué esto importa
La capacidad de diseñar vidrio con propiedades de amplio alcance ha llevado a su uso en mucho más que ventanas. Qué tal: puertas, fachadas, platos, tazas, cuencos, aislamiento, almacenamiento de alimentos, botellas, paneles solares, turbinas eólicas, espejos, balaustradas, mesas, tabiques, cocinas, hornos, televisores, computadoras, teléfonos, aviones, barcos, parabrisas, retroiluminación, tecnología médica, vidrio óptico, biotecnología, cables de fibra óptica , barreras de radiación. Y además de eso, el vidrio es casi completamente reciclable. La razón principal por la que el vidrio se ha vuelto tan omnipresente en todas estas diferentes formas es por su masiva tunabilidad química como se discutió en esta conferencia.
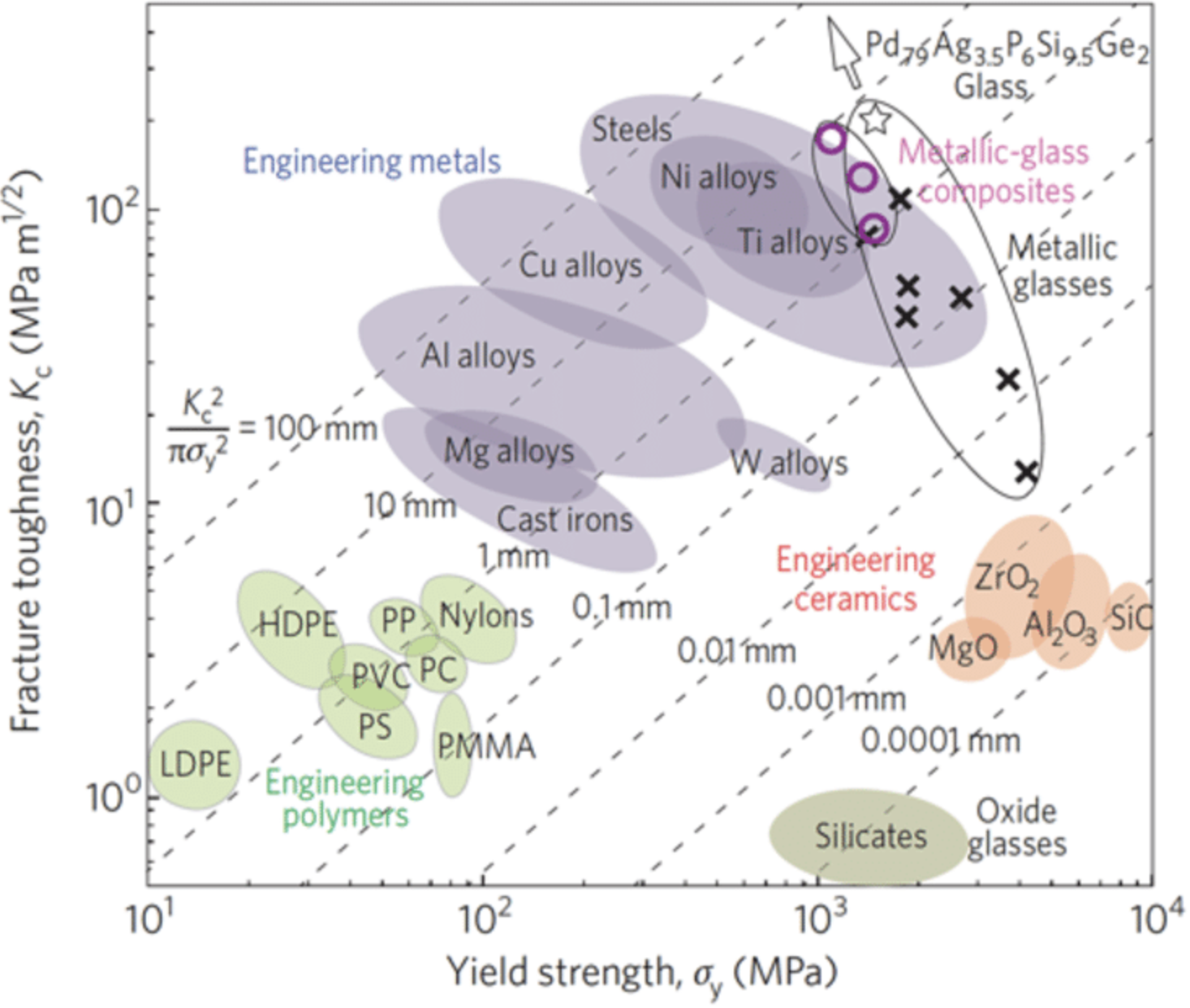
Pero aquí quiero enfocarme en una propiedad en particular: la fuerza. Hablamos hoy sobre el uso del estrés compresivo para hacer que el vidrio sea más fuerte. Pero, ¿y si el vidrio se pudiera hacer más fuerte aún? ¿Y si pudiera hacerse más fuerte que los principales materiales estructurales como el acero? En los laboratorios de investigación, eso es exactamente lo que está sucediendo. Por ejemplo, en un artículo de Nature Materials de 2011 (doi:10.1038/nmat2930), los autores hicieron cierto tipo de vidrio metálico más fuerte que el acero y críticamente también más duro que el acero. Eso significa que no sólo tiene un módulo de Young alto, sino que cuando se rompe puede deformarse plásticamente en lugar de romperse. Crearon este nuevo material a través de su química, al agregar un toque de paladio y una pizca de plata a la mezcla. Ya tenía un poco de fósforo, silicio y germanio, pero al agregar el paladio y la plata, el vidrio pudo superar al acero tanto en dureza como en dureza. Desde entonces, se han hecho muchas más demostraciones de vidrio mecánicamente súper fuerte (a menudo tratando de evitar el paladio que cuesta $50,000 por kg). Aquí hay una gráfica de ese mismo papel, que muestra la tenacidad a la fractura vs. el límite elástico de diferentes materiales. Nuevamente, el rendimiento está relacionado con cuánta fuerza puede soportar el material sin romperse, y la dureza es la cantidad que puede romperse sin romperse. Subir en ambos ejes puede ser muy atractivo para muchas aplicaciones. Me encantan las parcelas como esta (llamadas “parcelas Ashby”) ya que de inmediato podemos comparar un montón de diferentes materiales, en este caso óxidos, cerámicas, polímeros, metales y por supuesto sus propias cosas nuevas (mostradas como marcas “x” en la trama). Tenga en cuenta lo fuertes que son los vidrios de óxido viejos regulares pero también la poca dureza que tienen (cuando dan, se rompen). Pero fíjense también lo mucho más duros que pueden obtener al diseñar su química. ¡Esto podría poner a los materiales amorfos en una trayectoria para convertirse en algunos de los materiales más, si no los más tolerantes al daño, en el mundo!
Por qué esto emplea
En la última conferencia para esta sección enumeré la fabricación de vidrio y las empresas que trabajan en innovar en la química del vidrio. Para este capítulo sobre vidrio de ingeniería, hablemos de inteligencia. En particular, “vidrio inteligente”. Por ahora, esa etiqueta significa un tipo específico de vidrio a base de silicato: vidrio conmutable. Ha existido desde hace mucho tiempo, ya que incluso en la década de 1980 es posible que hayas notado (ok, tus padres pueden haber notado) personas que usaban las gafas de sol que automáticamente se tintaban y destiñían en respuesta al sol (que usaban lo que se llaman materiales “termocrómicos” incrustados en el vidrio, que cambian de color en función de temperatura. Nunca funcionaron tan bien, quedándose un poco demasiado sombreados por dentro y un poco demasiado sin sombra afuera, pero la idea estaba ahí. Pero ahora hemos pasado del vidrio termo a electrocrómico, y las posibilidades son realmente emocionantes. Con un pequeño voltaje aplicado, el vidrio puede diseñarse para ir y venir entre una transparencia casi total y una opacidad casi completa. Además de ser extremadamente genial, este tipo de tecnología puede tener muchos beneficios positivos relacionados con la sostenibilidad, ya que el vidrio se puede programar para que se atenúe e ilumine automáticamente en respuesta a las condiciones de luz exterior, lo que a su vez puede reducir drásticamente las necesidades energéticas de un edificio.
Este tipo de vidrio inteligente todavía está en el lado temprano aunque varias empresas están despegando, y eso significa empleos. Estos serán empleos en startups de rango medio o temprano, pero en algunos casos han cerrado mega (>100 millones de dólares) rondas de recaudación de fondos por lo que definitivamente el crecimiento es fuerte. Algunas empresas en este espacio incluyen Kinestral, Smartglass, View, Suntuitive, Gentex, Intelligent Glass o Glass Apps. Gran parte de la inversión en estas empresas viene de las más grandes como Asahi Glass o Corning, que por supuesto también han iniciado sus propios programas de vidrio inteligente. Tomado en conjunto todo esto hechiza trabajos en el futuro del vidrio. Y su futuro se ve muy brillante, mucho más allá de cambiar el color o la transparencia, ya que las propiedades térmicas, electrónicas y ópticas del material continúan siendo diseñadas. Podemos o no estar viviendo en la “Era del Vidrio”, como le gusta decir a Corning, pero seguro que estamos viviendo en un momento emocionante para este material.
Problemas de ejemplo
1. A continuación se muestra la estructura 2-D del vidrio de cal sodada (utilizado en ventanas).
a) ¿Qué compuestos se utilizaron para hacer este vaso? ¿Estos compuestos sirven como formadores de red o modificadores de red?
- Contestar
-
\(\mathrm{SiO}_2\): formador de red
\(\mathrm{CaO}\): modificador de red
\(\mathrm{Na}_2 \mathrm{O}\): modificador de red
b) ¿Cómo impactan cada uno de los compuestos agregados en la estructura de unión en el vidrio?
- Contestar
-
\(C a_O\): rompe un enlace/crea dos modificadores de red (coordinados con\(1 \mathrm{Ca}^{2+}\) iones)
\(\mathrm{Na}_2 \mathrm{O}\): rompe un enlace/ crea dos modificadores de red (coordinados con\(2 \mathrm{Na}^{+}\) iones)
3. Si se enfrían a la misma velocidad, esperaría que el vidrio de sílice con 14%\(\mathrm{Na}2\mathrm{O}\) o 25%\(\mathrm{Na}2\mathrm{O}\) tuviera un:
¿Mayor volumen molar?
¿Mayor temperatura de transición vítrea?
¿Mayor viscosidad?
- Contestar
-
\(14 \%\)tendría el mayor volumen molar
\(14 \%\) tendría la mayor temperatura de transición vítrea
\(14 \%\) tendría la mayor viscosidad
4. Si un vidrio de sílice es dopado con\(\mathrm{MgO}\), y luego se realiza el intercambio iónico de tal manera que\(\mathrm{Ca}\) los iones reemplazan a\(\mathrm{Mg}\) los iones, ¿cómo cambiarían las propiedades mecánicas del vidrio?
- Contestar
-
\(\mathrm{Ca}\)los iones ocupan más espacio que los\(\mathrm{Mg}\) iones, por lo que el vidrio estará bajo compresión interna (como la caída del Príncipe Rupert)
Conferencia 27: Tasas de reacción
Resumen
Cinética química significa el estudio de las velocidades de reacción, que corresponden a cambios en las concentraciones de reactivos y productos con el tiempo. Algunos términos a conocer: concentración\(=\) moles/litro\(=\) molaridad\(=[]\), tasa\(=\mathrm{d}[] / \mathrm{dt}\), una ley de tasa es alguna ecuación que relaciona la tasa con [], una ley de tasa integrada relaciona la [] a\(\mathrm{t}\) (ime), y la ecuación de Arrhenius nos da la tasa vs.\(\mathrm{T}\) (emperatura)
Tome una reacción simple donde\(a A \rightarrow b B:\) dado que la masa se conserva, A desaparece no más rápido de lo que\(\mathrm{B}\) aparece, por lo que la velocidad de reacción real es\(=1 / \mathrm{b} \mathrm{d}[\mathrm{B}] / \mathrm{dt}=-1 / \mathrm{a} \mathrm{d}[\mathrm{A}] / \mathrm{dt}\). En otras palabras, el cambio en la concentración de\(\mathrm{B}\) debe ser igual al contrario del cambio en la concentración de\(\mathrm{A}\) ponderado por uno sobre el coeficiente molar a o b. podemos tener más de un producto reactivo y la misma idea sostiene. Por ejemplo, supongamos que tenemos 2 de cada:\(a \mathrm{~A}+\mathrm{bB} \rightarrow \mathrm{cC}+\mathrm{dD}\). En este caso la velocidad de reacción sería:
\(\text { rate }=\dfrac{-1}{a} \dfrac{d[A]}{d t}=\dfrac{-1}{b} \dfrac{d[B]}{d t}=\dfrac{1}{c} \dfrac{d[C]}{d t}=\dfrac{1}{d} \dfrac{d[D]}{d t}\)
La forma general de escribir una ecuación para la velocidad para la ecuación anterior es: velocidad\(=\mathrm{k}[\mathrm{A}]^m[\mathrm{~B}]^n\), donde constante de\(\mathrm{k}=\) velocidad y depende de las condiciones (\(\mathrm{T}, \mathrm{P}\), disolvente), m y n son exponentes determinados experimentalmente,\(m+n\) se llama el orden de reacción. Tenga en cuenta que las unidades de tasa deben ser siempre M/s por definición, por lo que esto significa que las unidades de\(\mathrm{k}\) dependen de\(\mathrm{n}\) y\(\mathrm{m}\). Para esta clase cubriremos tres órdenes diferentes de reacciones:\(0^{th}, 1^{st},\) y\(2^{nd}\).
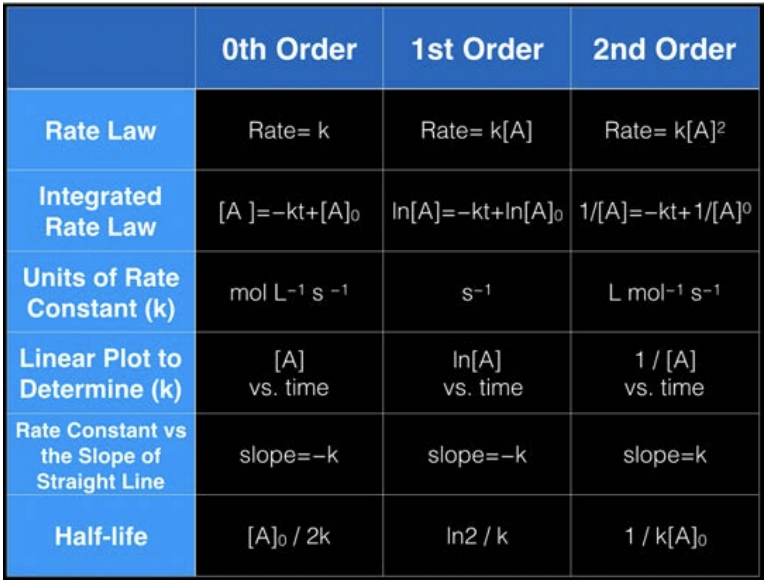
Para conocer el orden de una reacción a partir de tablas de datos como la de abajo, tome dos filas de datos cualesquiera: digamos las\(\mathrm{t}=70 \mathrm{~min}\) filas\(\mathrm{t}=26 \mathrm{~min}\) y. La relación de concentración entre estos dos tiempos es\(0.0020 / 0.0034=0.5882\). La relación de tarifas es\(1.8 / 5.0=0.36\)
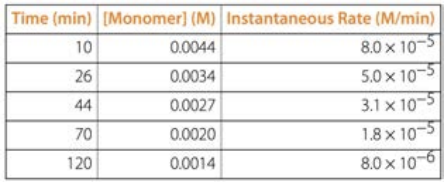
En primer lugar la tarifa está cambiando por lo que no puede ser de orden 0. En segundo lugar, en dos momentos diferentes la relación de concentraciones no es igual a la relación de tasas, por lo que no puede ser de 1er orden. Pero si cuadramos la relación de concentraciones,\((0.0020/0.0034)^2 = 0.35\) que está muy cerca de\(0.36\), entonces ahora tenemos nuestra respuesta: a partir de los datos podemos decir que la reacción es de 2do orden!
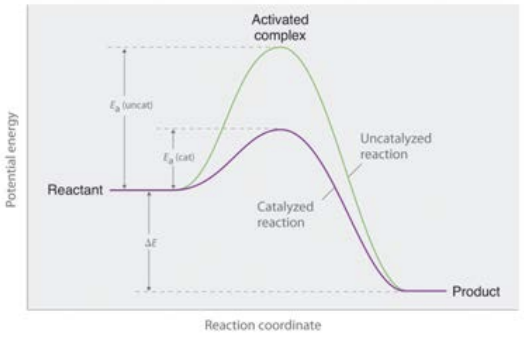
Para conocer el papel de la temperatura en la determinación de las velocidades de reacción, primero debemos aprender sobre la teoría de colisiones. La teoría de colisiones enmarca la reacción entre moléculas, digamos A y B, de la siguiente manera: 1) una reacción solo puede ocurrir cuando A y B chocan, 2) no todas las colisiones dan como resultado la formación de producto, 3) hay dos factores que más importan: la energía de la colisión, y la orientación de la molécula A con respecto a B en el momento de la colisión.
Podemos pensar en la energía requerida\(\mathrm{A}\) para reaccionar con que\(\mathrm{B}\) sea una especie de “energía de activación” o\(\mathrm{E}_a\). Como aprendimos en el capítulo 14 (fases), las moléculas a una temperatura dada tienen una distribución de energías cinéticas siendo esa temperatura la media. Eso significa que algunas moléculas tienen mucha más energía que la media, mientras que otras tienen menos. Las reacciones son similares en que es la parte de la distribución superior a la energía de activación lo que importa. Esta gráfica muestra cómo funciona esto: la distribución de energías para una molécula dada a dos temperaturas diferentes muestra que para una temperatura más alta más moléculas tendrán energías por encima de la energía de activación que para la temperatura más baja.
La ecuación de Arrhenius nos da una expresión que resume el modelo de colisión de la cinética química. Va de la siguiente manera: tasa = (frecuencia de colisión) * (un factor estérico) * (la fracción de colisiones con\(\mathrm{E} > \mathrm{E}_a\)). En términos matemáticos, eso se muestra aquí para la ecuación para rate (\(\mathrm{k}\)).
\(\mathrm{A}=\)el factor de frecuencia y sus unidades dependen del orden de reacción. Por ejemplo si la reacción es de primer orden entonces el factor de frecuencia debe tener unidades de\(s^{-1}\) La energía de activación\(\mathrm{E}_a\),, ya lo hemos discutido. Si se da en unidades por mol, como\(\mathrm{J} / \mathrm{mol}\), usamos\(\mathrm{R}\) como está escrito, donde\(\mathrm{R}\) está la constante de gas ideal\(\mathrm{R}=8.314 \mathrm{~J} / \mathrm{K}^*\) mol. Si la energía de activación se da en unidades de\(\mathrm{eV}\), entonces la constante utilizada sería la constante de Boltzmann en unidades de\(\mathrm{eV}\left(8.61733 \times 10^{-5} \mathrm{eV} / \mathrm{K}\right)\).
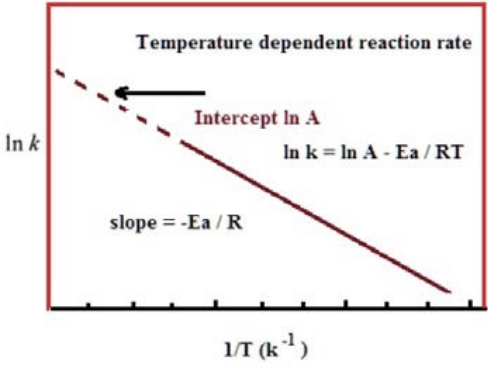
Esta relación significa que si trazamos lo natural\(\log\) de la tasa vs.\(1 / \mathrm{T}\) entonces debería ser una línea recta con pendiente\(=-\mathrm{Ea} / \mathrm{R}\) e intercepción\(=\ln (\mathrm{A})\), como se muestra en la gráfica anterior.
Así que hemos cubierto la concentración, y ahora la temperatura. El último ejemplo de una forma de cambiar la velocidad de una reacción que mencionaremos (y a diferencia de esos otros dos, realmente solo lo mencionaremos y no entraremos en detalles) es el catalizador. Un catalizador es una forma de aumentar la velocidad de una reacción sin tener nada consumido como parte de ella. Es un material que, en el lenguaje de nuestra discusión sobre Arrhenius anterior, baja la energía de activación para la reacción.
Por qué esto importa
Sigamos adelante con el tema catalizador para esta sección. Se estima que\(\approx 90 \%\) de todos los productos químicos producidos comercialmente implican catalizadores en alguna etapa en el proceso de su fabricación! Algunos de estos procesos ya he destacado en otros momentos de Why This Matters, como el proceso de Haber-Bosch para la fijación\(\mathrm{N}_2\), o el agotamiento de\(\mathrm{O}_3\) por CFC. En su momento, no habíamos aprendido sobre las velocidades de reacción ni los catalizadores, así que no entré en ello. Pero en ambos casos el papel del catalizador es absolutamente esencial (de hecho, la gran innovación de Haber-Bosch no fue descubrir la reacción (que se había conocido) sino descubrir un catalizador que disminuyera la temperatura necesaria para hacer que la reacción sucediera económica y a grandes escalas.
Discutamos otra reacción catalíticamente mejorada que cambia el mundo: a saber, la eliminación de la mayoría de las emisiones tóxicas de automóviles y camiones. Lo sé, puede que estés pensando que el tubo de escape de un auto huele bastante tóxico. Y eso es porque lo es, pero es mucho mejor de lo que solía ser, y la razón son los catalizadores que ahora forman parte de cada tubo de escape en forma de lo que se llama el convertidor catalítico. ¿Por qué los necesitábamos en primer lugar? Todo se remonta a la primera reacción que escribimos el primer día de conferencia: la combustión. Un ejemplo que di fue la combustión de metano:
\(\mathrm{CH}_4+2 \mathrm{O}_2 \rightarrow 2 \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_2\)
Es cierto que\(\mathrm{CO}_2\) es perjudicial para el medio ambiente por razones de cambio climático, pero no hay nada tóxico en esos productos... entonces, ¿cuál es el problema?

¡Ah, si tan solo los autos quemaran metano puro! Pero la gasolina está lejos, muy lejos de una fuente de combustible puro. Y además, incluso los motores de automóviles modernos están lejos, lejos de poder quemar el combustible perfectamente sin reacciones secundarias. La gasolina es una mezcla de aproximadamente 150 productos químicos diferentes, y estos incluyen no solo aquellos hidrocarburos que se queman, sino también una gran cantidad de aditivos que van en propósito desde inhibidores de corrosión hasta lubricantes y potenciadores de oxígeno. Dado que esta compleja sopa química no se quema limpiamente, obtenemos tanto productos directos como subproductos que van mucho más allá del caso puro de\(\mathrm{H}_2\mathrm{O}\) y\(\mathrm{CO}_2\). Muchos de estos productos son contaminantes y algunos son realmente malos. Una lista incompleta incluiría: monóxido de carbono (\(\mathrm{CO}\)) que es venenoso, óxidos de nitrógeno (como\(\mathrm{NO}\) y\(\mathrm{NO}_2\), o “\(\mathrm{NOX}\)” como se les llama) que causan smog y tienen muchos efectos adversos para la salud, óxidos de azufre (sí, lo adivinaste, “\(\mathrm{SOX}\)”) que causan lluvia ácida, y sin quemar hidrocarburos o compuestos orgánicos volátiles (COV) que causan cáncer.
Similar a la eliminación de los CFC de los refrigerantes, limpiar el tubo de escape representa un ejemplo fantástico de cómo la política y la regulación pueden mejorar el mundo. Fue la Ley de Aire Limpio que el Congreso aprobó en 1970 la que dio a la recién formada EPA la autoridad legal para regular este lío tóxico que salía de los autos. Como resultado, ¡los autos de hoy tienen\(\approx 99 \%\) menos emisiones en comparación con la década de 1960! Los combustibles también son más limpios (se eliminó el plomo y bajaron los niveles de azufre), y tomados en conjunto las ciudades tienen aire mucho más saludable. Echa un vistazo a esta foto de la ciudad de Nueva York de 1973 (izquierda) en comparación con 2013 (derecha). En la década de 1970, el smog del escape de los automóviles abrumó a la mayoría de las principales ciudades estadounidenses.
La tecnología clave que permitió esta limpieza dramática es el convertidor catalítico. Dentro de un convertidor catalítico hay en realidad múltiples catalizadores, cada uno potenciando diferentes reacciones. La mayoría de los autos hoy en día usan lo que se llama un catalizador de “tres vías”, lo que solo significa que aborda los tres contaminantes más grandes: NOX, hidrocarburos, y\(\mathrm{CO}\). Los materiales clave utilizados como catalizadores son una combinación de platino, paladio y rodio. Dentro de un convertidor catalítico uno normalmente tiene una malla de nido de abeja solo para obtener una gran área de superficie. Dado que la temperatura se vuelve bastante alta (y de hecho necesita ser alta para que los catalizadores funcionen, razón por la cual los motores fríos contaminan más que los calientes), la malla de nido de abeja está hecha de un material cerámico como la alúmina para que pueda manejar\(\mathrm{T}=500^{\circ} \mathrm{C}\) sin agrietarse ni degradarse. El\(\mathrm{Pt}\),\(\mathrm{Pd}\), y\(\mathrm{Rh}\) los metales recubren la\(\mathrm{Al}_2 \mathrm{O}_3\) malla, y el escape fluye a través.
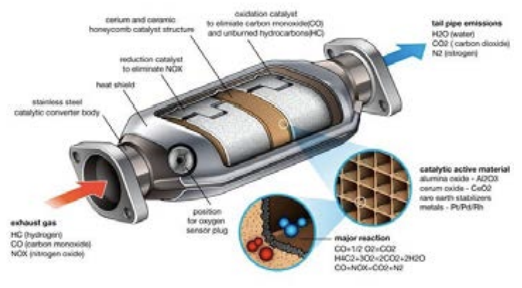
Eche un vistazo a este esquema del convertidor catalítico. Se pueden ver dos cámaras diferentes, una donde el metal actúa como un “catalizador de reducción” para la eliminación de NOx y la otra donde un metal diferente (o combinación de metales) actúa como un “catalizador de oxidación” para tratar\(\mathrm{CO}\) e hidrocarburos no quemados. En la cámara del catalizador de reducción, la reacción que estamos tratando de acelerar es\(2 \mathrm{NO} \rightarrow \mathrm{N}_2+\mathrm{O}_2\). Para hacerlo, el catalizador une la\(\mathrm{NO}\) molécula a él, y luego es capaz de extraer el átomo de nitrógeno\(\mathrm{NO}\) y mantenerlo en su lugar. Entonces otro\(\mathrm{N}\) átomo que también se sacó de una\(\mathrm{NO}\) molécula diferente se pega al catalizador en algún lugar cercano, y esos Del mismo modo, se puede formar el oxígeno\(\mathrm{O})2\). El punto es que el catalizador encuentra una manera diferente de llevar a cabo la misma reacción con barreras mucho menores. El catalizador de oxidación se quema\(\mathrm{CO}\) e hidrocarburos utilizando el\(\mathrm{O} 2\) gas restante, por ejemplo para conseguir que esta reacción vaya:\(2 \mathrm{CO}+\mathrm{O}_2 \rightarrow 2 \mathrm{CO}_2\). Nuevamente, esa reacción no ocurriría normalmente a una velocidad alta, sino que el catalizador la descompone en etapas (como la división\(\mathrm{CO}\)) que ocurren mucho más fácilmente.
Por qué esto emplea
La velocidad de una reacción es, por supuesto, de importancia central para cualquier cosa que uno haga que implique una reacción. Y ¿cuántos tipos diferentes de trabajos hacen algo que implique una reacción? ¡Una tonelada! Podríamos estar hablando de cualquier tipo de trabajo de síntesis química, o en el diseño de medicamentos donde la velocidad de reacción es crucial para la efectividad y seguridad del medicamento, o qué tal hacer alimentos (incluso más allá de la cerveza) donde las tasas determinan cualquier cosa, desde cuánto tiempo dejar que la masa suba hasta qué tan rápido esa masa se dore en un horno vs. las manzanas por dentro volviéndose blanda (acabo de hacer un pastel de manzana por si no se podía decir), a lo rápido que la comida va mal. El punto es que hacer cosas se trata intrínsecamente de tarifas.
Y así, en vez de centrarme en alguna de estas cosas que hacemos, me gustaría usar esta sección Por qué esto emplea para mencionar el hecho de que en casi todo lo que hacemos hoy, se gasta demasiado capital natural, y no tiene que ser así. Un solo chip de computadora toma más de 600 veces más masa para hacerlo y enormes cantidades de agua y energía (incluido el recocido varias veces a temperaturas superiores a 1000° C. El cemento es un material maravilloso (“piedra líquida”) pero se necesita hornear silicato de calcio a temperaturas muy altas para hacer el pequeño partículas llamadas “clinkers” que le dan la capacidad de tomar cualquier forma en un instante y luego secarse y fraguar tan rápidamente después. ¿Por qué es que, una y otra vez, fallamos en hacer lo que la naturaleza hace tan bien? Los animales pueden construir estructuras increíblemente fuertes y complejas sin pasar un solo grado sobre la temperatura ambiente. Las arañas hacen girar la seda más fuerte que el acero sin encender fuego. ¿Cómo podemos hacerlo mejor? Gran parte se reduce a las velocidades de reacción. Usamos estas cantidades masivas de energía y altas temperaturas y productos químicos agresivos porque queremos hacer cosas rápidamente y porque necesitamos hacer cosas en cantidades casi inimaginables. ¡Solo China produjo 2.5 billones de kilogramos de cemento el año pasado!
Hay formas más sostenibles de hacer cosas, especialmente si podemos manejar las velocidades de reacción. Hace diez años recuerdo haber leído artículos sobre la nueva revolución de la “química verde” (echa un vistazo por ejemplo este artículo de 2010 en Scientific American, https://www.scientificamerican. com/article/green-chemistry-benign-by-design/. Recuerdo pensar entonces que este campo estaba listo para despegar. Bueno, en realidad no sucedió con una explosión, pero lenta y estable esta idea de diseño benigno se está afianzando. Si buscas empleos de química verde, encontrarás muchas empresas que ahora invierten sustancialmente en esta área y eso deletrea nuevos empleos. La idea de la química verde en el mercado laboral varía bastante ampliamente, desde encontrar formas de sintetizar materiales sin químicos tóxicos, hasta hacer biodegradable el proceso de descubrimiento de fármacos, hasta bajar las temperaturas necesarias en una etapa de fabricación. Sea lo que sea, se trata de las tarifas.
Problemas de ejemplo
1. El ácido acético se elabora a partir de monóxido de carbono y metanol de acuerdo con la siguiente ecuación:
\(CO(g)+MeOH(g) \rightarrow A c O H(g)\)
Tu empresa quiere saber cómo mejorar esta reacción: te presentan, un consultor químico, con los siguientes datos. Proponer una ley de velocidad para la reacción.
| \(\mathrm{CO}\)presión | \(\mathrm{MeOH}\)presión | Ácido acético formado |
|---|---|---|
| \ (\ mathrm {CO}\) presión">21.5 atm | \ (\ mathrm {MeOH}\) presión">15.0 atm | 980 mol/hora |
| \ (\ mathrm {CO}\) presión">11.1 atm | \ (\ mathrm {MeOH}\) presión">15.0 atm | 499 mol/hora |
| \ (\ mathrm {CO}\) presión">11.1 atm | \ (\ mathrm {MeOH}\) presión">10.0 atm | 502 mol/hora |
- Contestar
-
La tasa es bastante insensible al cambio\(\mathrm{MeOH}\), pero la tasa disminuye aproximadamente a la mitad cuando la presión de\(\mathrm{CO}\) se reduce a la mitad. Por lo tanto, la tasa es de\(0^{th}\) orden en metanol, pero\(1^{st}\) orden en\(\mathrm{CO}\):
\(rate = k[CO]\)
Conferencia 28: Equilibio y Solubilidad
Resumen
Muchos de ustedes probablemente hayan escuchado la expresión, “como se disuelve como”. pero agreguemos un poco más de química a esa frase. Lo que realmente se entiende por la palabra “me gusta” es “enlaces similares”, por lo que también podría decirse la expresión, “enlaces similares disuelven enlaces similares”. La solubilidad es una métrica que nos dice cuánto puede romperse el soluto (el sólido que se está disolviendo) y disolverse en el disolvente (el líquido en el que se disuelve el sólido). Cuando la solubilidad es miscible eso significa que se puede mezclar completamente en cualquier concentración.
Las fuerzas intermoleculares juegan un papel muy importante en la solubilidad. El agua se llama solvente polar (también llamado hidrofílico) porque es un solvente con grandes momentos dipolares, mientras que los hidrocarburos son ejemplos de solventes no polares (también llamados hidrofóbicos) ya que el IMF dominante es Londres. Los disolventes polares son en general inmiscibles con disolventes no polares.
Lo que realmente sucede a la escala de la molécula y sus diversos IMF, es que si una molécula puede disminuir o mantener similar su energía al dar la bienvenida a una molécula diferente en su entorno de unión, entonces lo hará. Si por otro lado la otra molécula no puede unirse de la misma manera (como en el ejemplo del encadenamiento de hidrocarburos más largo que tiene muchas más fuerzas londinenses que capacidad de enlace H) entonces elevaría la energía del sistema para que el disolvente se una a él sobre sí mismo.
Se dice que las partículas en una solución que se vuelven a unir al sólido están precipitando, tanto la disolución como la precipitación ocurren simultáneamente y en el punto de saturación, o solubilidad máxima, ocurren exactamente a la misma velocidad. Esto se llama equilibrio dinámico.
Sabemos por nuestras conferencias anteriores sobre sólidos iónicos que estos son cationes y aniones en el sólido, que es la base del enlace iónico. Cuando se disuelven en agua, también permanecen iones, justo ahora en solución, donde interactúan fuertemente con el agua. Podemos entender por qué, ya que sabemos por nuestra conferencia del FMI que los iones interactuarán con el dipolo de la molécula de agua. La razón por la que existe una tendencia en la solubilidad de estas sales está relacionada con la fuerza del enlace entre los iones en el sólido con respecto a los del líquido. A medida que el enlace iónico se vuelve más fuerte (de más débil\(\mathrm{NaI}\) a más fuerte en\(\mathrm{NaF}\)), menos se disuelve.
Supongamos que la reacción general ya ha alcanzado su equilibrio dinámico:
\(a A+b B \leftrightarrow c C+d D\)
Esto significa que las cuatro concentraciones diferentes,\([\mathrm{A}],[\mathrm{B}],[\mathrm{C}]\), y no\([\mathrm{D}]\) están cambiando a pesar de que la reacción sigue yendo en ambas direcciones. A continuación se muestra una bonita imagen de lo que podría suceder con estas concentraciones en función del tiempo. Al principio durante la reacción las concentraciones cambian, y luego todas se aplanan. En ese punto, cuando todos son planos, el sistema ha alcanzado un equilibrio dinámico. Definimos el cociente de reacción\(\mathrm{Q}\), como la relación de
\(\dfrac{[C]^c[D]^d}{[A]^a[B]^b}\)

Esta expresión para se\(\mathrm{Q}\) puede evaluar en cualquier momento durante la reacción, ya sea que el sistema haya alcanzado el equilibrio o no. \(\mathrm{BUT}\), tenemos una manera especial de llamar\(\mathrm{Q}\) una vez que el sistema está en equilibrio dinámico, y eso es con la letra\(\mathrm{K}\), o la constante de equilibrio para la reacción. A menudo, ponemos un subíndice “eq” en el\(K\) justo para asegurarnos de saber a qué se refiere, entonces\(\mathbf{K}_{e q}=\mathbf{Q}\) (para el cociente de reacción en equilibrio). El Keq para un sólido que se disuelve en agua es el producto de solubilidad\(\left(\mathbf{K}_{s p}\right)\)
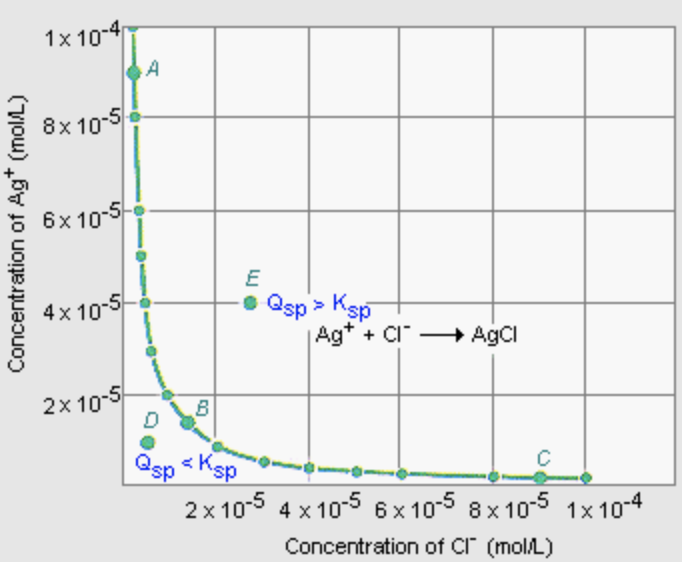
Al comparar el valor de\(\mathrm{Q}\) con la constante de equilibrio\(\mathrm{Keq}\), para la reacción, podemos determinar si se favorecerá la reacción directa o la reacción inversa.
Si\(\mathrm{Q}=\mathrm{K}_{e q}\), la reacción está en equilibrio. Si\(\mathrm{Q}<\mathrm{K}_{e q}\), como en el punto\(\mathrm{D}\), entonces la reacción se moverá hacia la derecha (en la dirección hacia adelante) para alcanzar el equilibrio. Si\(\mathrm{Q}>\mathrm{K}_{\text {eq }}\), como en punto\(\mathrm{E}\), entonces la reacción se moverá hacia la izquierda (en sentido inverso) para alcanzar el equilibrio. ¡Le Chatelier viene a nosotros en forma gráfica!
Por qué esto importa
Al examinar las pequeñas burbujas atrapadas en los núcleos de hielo, sabemos que el nivel de\(\mathrm{CO}_2\) actualmente en la atmósfera es más de lo que ha sido en más de un millón de años, y la cantidad está creciendo exponencialmente. Pero si bien este gas de efecto invernadero increíblemente importante ha recibido una atención tremenda por su papel en el cambio climático, hay un impacto mucho menos discutido que\(\mathrm{CO}_2\) está teniendo en nuestro planeta. A lo mejor es porque está sucediendo en los océanos, en los que no vivimos, así que es más difícil hacer un gran problema sobre los cambios que ocurren. Pero pronto sentiremos estos cambios. El océano ha absorbido más de 500 mil millones\(\mathrm{CO}_2\) de toneladas de la atmósfera, ya que captura silenciosamente aproximadamente una cuarta parte de lo que se emite día tras día (hoy los humanos sacamos 1,200,000 gramos de\(\mathrm{CO}_2\) por segundo). Entonces, ¿por qué importa esto?
El problema con todo ese extra\(\mathrm{CO}_2\) en los océanos es que hace que el agua sea más ácida. Tan solo en los últimos 200 años, el agua del océano se ha vuelto 30 por ciento más ácida. ¡Este cambio en la acidez es más rápido que cualquier cambio conocido en la química oceánica en los últimos 50 millones de años! En términos geológicos, se trata de una perturbación extremadamente abrupta, y sin cambios dramáticos en el comportamiento humano sólo estamos viendo el comienzo.
Desafortunadamente, una de las defensas más importantes para las criaturas oceánicas, la concha, no puede sobrevivir al aumento de la acidez. Aquí te dejamos una imagen de lo que le sucede al caparazón de un pterópodo, un tipo de molusco de solo unos pocos\(\mathrm{cm}\) largos, después de 45 días en una solución de\(\mathrm{pH}=7.8\). Ahora bien, los océanos aún no son tan ácidos (el océano actual\(\mathrm{pH}\) es 8.1), pero están bien en camino. Los pterópodos son uno de los pocos tipos básicos de criaturas marinas que se asientan en el fondo mismo de la cadena alimentaria oceánica, justo encima del plancton y las algas marinas, lo que significa que si se reducen sus números, se impacta todo lo más alto en la cadena alimentaria, desde el krill hasta el salmón, el arenque y las aves, hasta las focas y los osos polares, y por supuesto, a nosotros.
En la bolsa de regalos que va con estas conferencias, podrás ver esta disolución en acción. Hacemos que vaya más rápido que 45 días ya que no quiero que esperes tanto, pero la química en juego es la misma. Quería que tocaras y sintieras esta preciosa pérdida de carbonato de calcio, para que puedas echar un vistazo a lo que está empezando a pasar a 2/3 de nuestro planeta.
Por qué esto emplea
Para que los medicamentos tengan un efecto fisiológico en el cuerpo humano, deben estar en solución. En particular, deben disolverse en solución si empiezan en forma sólida, como hacen las tabletas. Ahora bien, la velocidad de disolución es sumamente importante ya que determina qué tan rápido se absorbe el fármaco en el cuerpo. Las tarifas se discutieron en el último capítulo. Pero la solubilidad misma (es decir, independientemente de lo rápido que se disuelva, ¿cuál es su capacidad para disolverse completamente?) también es de crucial importancia en el diseño de medicamentos. Si el fármaco no es muy soluble, las formulaciones pueden conducir a dificultades en el uso del medicamento que de otra manera podrían tener efectos muy beneficiosos. Si un medicamento tiene baja solubilidad eso significa que probablemente tendrá un nivel bajo de lo que se llama “biodisponibilidad”, lo que básicamente solo significa que no obtendrá suficiente exposición en el cuerpo.
En las compañías farmacéuticas que realizan la mayor parte del desarrollo de nuevos fármacos, se estima que la friolera del 40% de todos los nuevos químicos (posibles nuevos fármacos beneficiosos) son prácticamente insolubles en agua, haciéndolos efectivamente inútiles. Y ¿qué es lo que hacen estas empresas para tratar de incrementar la solubilidad, sobre todo para candidatos que de otra manera serían prometedores? ¡Modificación química, claro! Y así es que todas las grandes compañías farmacéuticas están buscando gente que sepa de solubilidad! En cuanto a dónde buscar empleo, lo que pasa con las empresas de diseño de medicamentos es que no hay que mirar muy lejos. A tan solo 1 milla del campus, hay decenas de empresas grandes y pequeñas especializadas en el diseño de medicamentos. En términos más generales, Kendall Square ahora tiene la mayor industria biotecnológica por pie cuadrado, con más de 120 empresas dentro de una milla.
En cuanto a cuáles de estas empresas tienen trabajos relacionados con la solubilidad, bueno por lo importante que es la solubilidad, son prácticamente todas ellas. Echa un vistazo por ejemplo, a las ofertas de trabajo en Takeda, Novartis, Alnylam, Sanofi, Pfizer y Genentech solo para comenzar, y luego caminar por la calle para ir a conocer más sobre las empresas, lo que hacen, ¡y reúnase con ellas en persona!
Problemas de ejemplo
1. El fluoruro de calcio tiene una\(\mathrm{K}_{sp}\) de\(5.3×10^{-9}\). ¿Cuánto fluoruro de calcio se puede disolver en 1\(\mathrm{L}\) de agua?
- Contestar
-
\[k_{s p}=[C a][F]^2 \nonumber\]
Por cada mol de\(\mathrm{Ca}\) que se disuelve, el doble de moles de\(\mathrm{F}\) mosto se disuelven ya que la fórmula química es\(\mathrm{CaF}_2\). Suponiendo\(\mathrm{x}\) moles de\(\mathrm{Ca}\) disolución:
\ begin {reunió}
K_ {s p} = [x] [2 x] ^2\\
5.3\ veces 1-^ {-9} =4 x^3\
x=0.00109 M\\
78\ dfrac {g} {\ mathrm {~mol}}\ dfrac {0.00109\ mathrm {~mol}} {L} =85.9\ mathrm {mg}/1\ mathrm rm {~L}
\ fin {reunido}
Conferencia 29: Iones y Ácidos/Bases Comunes
Resumen
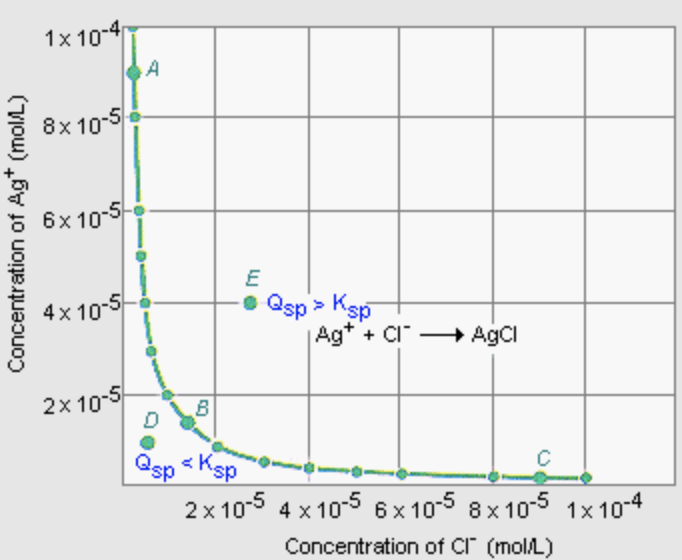
El principio de Le Chatelier establece que la posición de equilibrio se mueve para dar cuenta de los cambios en el sistema, como la introducción de un nuevo ion a una solución. Pero, ¿qué pasa si agregamos un nuevo compuesto que tiene un ion en común con una solución existente? La curva de equilibrio para la\(\mathrm{AgCl}\) disociación se muestra a la derecha. Supongamos que añadimos\(\mathrm{NaCl}\): se disociará completamente en iones\(\mathrm{Na}^{+}(\mathrm{aq})\) y\(\mathrm{Cl}^{-}(\mathrm{aq})\). Podemos usar una tabla ICE para determinar el cambio en el equilibrio: si empezamos en el punto\(\mathrm{B}\) y sumamos\(0.1 \mathrm{M} \mathrm{NaCl}\), podemos usar la constante de equilibrio para\(\mathrm{AgCl}, \mathrm{K}_{s p}=1.7 \times 10^{-10}\). A medida que\(\left[\mathrm{Cl}^{-}\right]\) aumenta,\(\left[\mathrm{Ag}^{+}\right]\) debe disminuir para mantenerse\(\mathrm{K}_{s p}\) constante.
| [\(AgCl\)] | [\(Ag^+\)] | [\(Cl^-\)] | |
|---|---|---|---|
| I | \ (AgCl\)] "> (todo sólido) | \ (Ag^+\)] ">\(1.3 \times 10^{-5}\) | \ (Cl^-\)] ">\(1.3 \times 1^{-5}\) |
| C | \ (AgCl\)] ">+ x precipitados | \ (Ag^+\)] ">\(-x\) | \ (Cl^-\)] ">\(+0.1 - x\) |
| E | \ (AgCl\)] ">Más sólido | \ (Ag^+\)] ">\(1.3 \times 10^{-5} - x\) | \ (Cl^-\)] ">\(+0.1 - x\) |
\ begin {reunió}
K_ {s p} =\ izquierda [\ mathrm {Ag} ^ {+}\ derecha]\ izquierda [\ mathrm {Cl} ^ {-}\ derecha] =( 0.1-x)\ left (1.3\ times 10^ {-5} -x\ right)\
K_ {s p} =0.1\ left (1.3\ times 10^ {-5} -x\ right) =1.7\ veces 10^ {-10}\ quad x=1.7\ veces 10^ {-9}
\ fin {reunidos}
Esto se denomina efecto iónico común: la solubilidad de un constituyente es reprimida por la adición de un segundo soluto.
Para un caso genérico de cualquier ácido, llamarlo “A” escribimos su reacción de disolución de la siguiente manera:\(\mathrm{HA}+\mathrm{H}_2 \mathrm{O} \rightarrow\)\(\mathrm{H}^{+}+\mathrm{A}^{-}+\mathrm{H}_2 \mathrm{O}\). Aunque escribimos\(\mathrm{H}^{+}\) para hacer explícita la disociación de protones, en realidad nunca queremos decir eso si está en el agua. Eso es porque el\(\mathrm{H}^{+}\) ion no es estable en\(\mathrm{H}_2 \mathrm{O}\), en cambio siempre se vuelve\(\mathrm{H}_3 \mathrm{O}^{+}\). La primera persona en definir ácidos y bases en cualquier tipo de manera química más concreta fue el buen viejo Svante Arrhenius. Según él, un ácido es una sustancia que se disuelve en agua para producir\(\mathrm{H}+\) iones, y una base es una sustancia que se disuelve en agua para producir\(\left(\mathrm{OH}^{-}\right)\) iones hidróxido.
Arrhenius definió ácidos y bases en términos de la presencia de\(\mathrm{H}^{+}\) o\(\mathrm{OH}^{-}\) iones en solución: por ejemplo,\(\mathrm{HCl}(a q) \rightarrow \mathrm{H}^{+}(a q)+\mathrm{Cl}^{-}(a q)\) es un “ácido de Arrhenius” mientras que\(\mathrm{NaOH}(s) \rightarrow \mathrm{Na}^{+}(a q)+ O H^{-}(a q)\) una “base de Arrhenius”.
A Sorenson se le ocurrió la escala de “poder del hidrógeno”, o escala de “pH” para abreviar. \(\mathrm{pH}=-\log \left[\mathrm{H}^{+}\right]\). La\(\mathrm{pH}\) escala va de 0 a 14, siendo 0 extremadamente ácida y 14 extremadamente básica. Podemos hacer lo mismo por la concentración de\(\left[\mathrm{OH}^{-}\right]\): el poder de\(\mathrm{OH}^{-}\) en solución, o el “PoH”\(=-\log \left[\mathrm{OH}^{-}\right]\), con la definición opuesta.
Un ácido fuerte como se disocia\(\mathrm{HCl}\) completamente:\(\mathrm{HCl}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{H}^{+}+\mathrm{Cl}^{-}+\mathrm{H}_2 \mathrm{O}\), también lo\(0.1 \mathrm{M} \mathrm{HCl}\) ha hecho\(\left[\mathrm{H}^{+}\right]=0.1\), así lo tiene la\(0.1 \mathrm{M} \mathrm{HCl}\) solución\(\mathrm{pH}=-\log [0.1]=1.0\).
Algunos materiales pueden ser tanto ácidos como bases. ¡Nada menos que el agua misma es uno de esos materiales! Cuando una molécula puede dar\([\mathrm{H}+]\) iones o\([\mathrm{OH}-]\) iones en solución, se llama anfótero: porque\(\mathrm{H}_2 \mathrm{O}(l)+\mathrm{H}_2 \mathrm{O}(l) \leftrightarrow \mathrm{H}_3 \mathrm{O}^{+}(a q)+\mathrm{OH}^{-}(a q) . \mathrm{K}_{s p}\) el agua se llama\(\mathrm{K}_w: K_w=\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{OH}^{-}\right]= 1.0 \times 10^{-14}\). Si se agrega un ácido al agua pura la concentración de iones hidrógeno aumenta (y la concentración de\(\mathrm{OH}\) iones disminuye) Una base va en sentido contrario, agregando iones hidróxido a la solución de agua pura. Todos los trucos que aprendimos para\(\mathrm{K}_{s p}\) aplicarlos\(\mathrm{K}_w\), lo cual es especialmente útil en el contexto de ácidos y bases.
La definición de Arrhenius de ácidos y bases tiene dos limitaciones clave: primero, debido a que los ácidos y bases se definieron en términos de iones obtenidos del agua, la definición de Arrhenius se aplicó solo a moléculas en solución acuosa. Segundo, y más importante, la definición de Arrhenius predijo que solo los materiales que se disuelven en agua para dar\(\mathrm{H}^{+}\) e\(\mathrm{OH}^{-}\) iones pueden tener las propiedades de ácidos y bases. ¡Pero hay muchos ejemplos donde esto no es cierto! Tenemos que ir más allá de Arrhenius para entender algunos ácidos y bases.
Por qué esto importa
Ahora que estamos armados con los conceptos del Efecto Ion Común y el principio de Le Chatelier, podemos entrar en más detalles sobre la química que está causando la posible catástrofe discutida en el anterior Por qué esto importa: la acidificación del océano y su impacto en el destino del carbonato de calcio. Se trata de equilibrio y de cómo lo\(\mathrm{CO}_2\) está cambiando en los océanos. La primera reacción que consideramos es lo que sucede cuando los océanos se encuentran más\(\mathrm{CO}_2\) desde la atmósfera: es decir, el\(\mathrm{CO}_2\) se disuelve en el\(\mathrm{H}_2 \mathrm{O}\) para formar ácido carbónico:
\(\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \leftrightarrow \mathrm{H}_2 \mathrm{CO}_3\)
Entonces, más\(\mathrm{CO}_2\) disolverse en el océano significa que hay más ácido carbónico en el océano, que luego produce iones disociados de la siguiente manera:
\(\mathrm{H}_2 \mathrm{CO}_3 \leftrightarrow \mathrm{HCO}_3^{-}+\mathrm{H}^{+}\)
Pero por otro lado, tenemos sólido\(\mathrm{CaCO}_3\) que es el carbonato de calcio, que está en un buen equilibrio con la siguiente reacción de disociación:
\(\mathrm{CaCO}_3 \leftrightarrow \mathrm{Ca}^{2+}+\mathrm{CO}_3^{2-}\)
La constante de equilibrio para la disolución de\(\mathrm{CaCO}_3\) es\(\mathrm{k}_{s p}=5 \times 10^{-9}\). Eso significa que no mucho se disociará en condiciones oceánicas “normales” (es decir, el último\(>50\) millón de años). La razón por la que este equilibrio se está desprendiendo es que ahora hay\(\mathrm{H}^{+}\) iones extra que provienen de la\(\mathrm{CO}_2\) reacción anterior. Estos\(\mathrm{H}^{+}\) iones consumen (reaccionan con)\(\mathrm{CO}_3^{2-}\) para formar\(\mathrm{HCO}^{3-}\) lo que disminuye la concentración de\(\mathrm{CO}_3^{2-}\). Ah, pero acabamos de enterarnos de eso con el Efecto Ión Común: si agregamos o quitamos alguna molécula que sea parte de un equilibrio equilibrado, entonces impulsaremos ese equilibrio para contrarrestar lo que hayamos hecho. En este caso,\(\mathrm{CO}_3^{2-}\) se está consumiendo más que antes, lo que a su vez impulsa más disolución del\(\mathrm{CaCO}_3\). Por eso las conchas se están disolviendo, y es por eso que quiero que experimentes esta química directamente en tu bolsa de regalos. Lo que están viendo es que esos experimentos son una versión acelerada de lo que está sucediendo en los océanos.
La acidez se mide por "”\(\mathrm{pH}\), que es una escala logarítmica. Desde la Revolución Industrial, el\(\mathrm{pH}\) de los océanos ha disminuido en\(\approx 0.1\) a\(8.07\), lo que equivale a un\(\approx 30 \%\) aumento en la acidez de los océanos. Mostré esa tendencia en la última conferencia de Why This Matters. Se estima que a nuestro ritmo actual de\(\mathrm{CO}_2\) emisiones, la acidez de los océanos alcanzará un estado muchísimo más ácido\(\mathrm{pH}=7.7\) de para 2100. Eso representaría un aumento\(>5\) de la acidez en comparación con los niveles preindustriales, y eso también lo haría prácticamente en términos de acabar con la mayor parte de la vida oceánica.
El océano ha absorbido aproximadamente 525 mil millones de toneladas\(\mathrm{CO}_2\) de la atmósfera en los últimos 200 años, a un ritmo de\(\approx 22\) millones de toneladas por día. El cambio que esto induce es el cambio químico más rápido conocido que el océano ha experimentado en los últimos 50 millones de años y probablemente mucho más largo. Hace alrededor de 250 millones de años, al final de lo que se conoce como la “era Pérmica”, los registros muestran que hubo un cambio repentino en los océanos, y los geólogos se refieren a lo que sucedió como, “El gran moribundo”. Esto se debe a que más\(90 \%\) de toda la vida marina desapareció del registro fósil. La mayoría de los científicos que estudian este tipo de cosas relacionan la extinción masiva con un enorme pico en la actividad volcánica, que puso vastas nubes de polvo ácido a la atmósfera, que luego cayeron a los océanos y elevaron su acidez.
La razón por la que la disolución del carbonato de calcio es tan importante es que es esencial no solo para los pterópodos que mostré antes, sino para tantos otros elementos “base” de la cadena alimentaria del océano, como el fitoplancton, el pez concha (mejillones, ostras, langostas, cangrejos de río, etc), y por supuesto el coral, por nombrar solo algunos ejemplos. Las estructuras de carbonato de calcio en estas criaturas marinas son altamente sensibles a ligeros cambios en la acidez, y sin ellos la salud de los océanos fallará. Terminaré esto Por qué esto importa con una cita que invita a la reflexión de Ken Caldeira quien es un científico del clima en Stanford. Al tratar de ayudar a la gente a tener perspectiva sobre lo que estamos haciendo, dijo: “Bueno, si los romanos se hubieran industrializado, ahora serían dos mil años después. Los mares seguirían subiendo y aún estarían completamente acidificados, y, sí, tal vez habrían conseguido un siglo más o menos de G.D.P. más alto que el que tendrían de otra manera”. El punto es: los cambios deletéreos que estamos en camino de hacer en los océanos no solo afectarán a nuestros hijos, y a los niños de nuestros hijos; impactarán a decenas y más probablemente cientos de generaciones por venir.
Por qué esto emplea
Hablé sobre la acidificación de los océanos en esta conferencia ya que estamos introduciendo ácidos y bases, y lo que está pasando en los océanos es un buen ejemplo de los efectos de la química que ocurre a escala planetaria. Pero, ¿y si realmente quieres trabajar en este problema, como como un trabajo? Bueno, eso no es tan sencillo como podrías pensar, o para el caso puede haber esperado, pero hay algunas cosas que puedes hacer.
Por un lado, hay muchos, muchos programas académicos o estatales que están estudiando química oceánica, y muchos de ellos tienen puestos de trabajo. Esto va desde un proyecto de acidificación oceánica aleatoria en la Universidad Di' Bologna, Italia, hasta el Centro Cooperativo de Ciencias de la Administración Nacional Oceánica y Atmosférica para las Ciencias del Sistema Terrestre y Tecnologías de Teledetección (sí, afortunadamente pasan por NOAA-CESSRST), a otras agencias gubernamentales como la EPA o cualquier agencia que trabaje en conservación y política, al Departamento de Ecología del Estado de Washington, a la Universidad Stony Brook que actualmente está buscando un “Asociado de Monitoreo de Acidificación Oceánica”. Hay muchos puestos de profesores en esta área, y creo que habrá más en el futuro. Entonces, si te interesa tanto este tema como una carrera en la academia, entonces el camino de la investigación en los centros científicos es bueno. Hay una serie de especializaciones diferentes que conducirían a estudiar (¡y ojalá que ayuden a ahorrar!) los océanos, desde biólogo marino hasta ingeniero ambiental y un “oceanógrafo químico”, que es como un oceanógrafo pero especializado en la composición química de los océanos más que en su ecología, vida biológica y geología.
Problemas de ejemplo
1. El ácido fluorhídrico reacciona con el carbonato de calcio de acuerdo con la siguiente ecuación:
\(2 \mathrm{HF}(a q)+\mathrm{CaCO}_3 \rightarrow \mathrm{H}_2 \mathrm{O}(l)+\mathrm{CO}_2(g)+\mathrm{CaF}_2\)
Si\(100 \mathrm{~mL}\) de una\(10 \mathrm{mM}\) solución de\(\mathrm{HF}\) se agrega a\(100 \mathrm{~mL}\) de una\(10 \mathrm{mM}\) solución de\(\mathrm{CaCO}_3\), ¿cuánto\(\mathrm{CaF}_2\) precipitará? Supongamos que la reacción va a su finalización.
- Contestar
-
En este problema, la primera pista es que la reacción “va a su finalización”: esto indica que no necesitamos preocuparnos por el equilibrio. Cuando\(\mathrm{HF}\) se agrega una\(10 m M\) solución de a una\(10 m M\) solución de\(\mathrm{CaCO}_3\), la solución final tiene una concentración diferente.
Las soluciones originales contienen cada una\(1 \mathrm{mmol}\) de material, ya que\(0.1 L * 10 \mathrm{mmol} / L=1 \mathrm{mmol}\). La solución final, por lo tanto, tiene\(1 \mathrm{mmol} \mathrm{Hf}\) y\(1 \mathrm{mmol} \mathrm{CaCO}_3\) entra\(0.2 \mathrm{~L}\) de agua, por lo que la concentración de la solución final está\(5 \mathrm{mM}\) en ambos reactivos.
A continuación, hay que pensar en cuánto\(\mathrm{CaF}_2\) podemos formar: si empezamos con\(1 \mathrm{mmol}\) de\(\mathrm{HF}\) y 1 mmol\(\mathrm{CaCO}_3\), se puede comprobar que el reactivo limitante es\(\mathrm{CaCO}_3\), ya que necesitamos el doble que\(\mathrm{CaCO}_3\) para formar\(\mathrm{CaF}_2\).\(\mathrm{HF}\) Terminaremos con\(0.5 \mathrm{mmol} \mathrm{CaF}_2\), y dejaremos atrás\(0.5 \mathrm{mmol} \mathrm{CaCO}_3\).
A continuación, tenemos que determinar cuánto se disolverá. Podemos usar una tabla ICE y el efecto de iones comunes. Comenzamos con iones\(0.5 \mathrm{mmol}\) de calcio en\(0.2 \mathrm{~L}=0.25 \mathrm{mM}\):
\ [\ begin {array} {c|c|c|c}
&\ mathrm {CaF} _2 &\ mathrm {Ca} ^ {2+} & 2 F^ {-}\\ hline
\ mathrm {I} & 2.5\ mathrm {mM} & 0\ mathrm {mM} & 0\ mathrm {mM}\\ hline\ mathrm {C} & & +\ mathrm {x} & +2\ mathrm {x}\
\\ hline\ mathrm {E}
& & 2.5+\ mathrm {x} & 2\ mathrm {x}
\ end {array}\ nonumber\]\ begin {alineado}
5.3\ veces 10^ {-9} & =( .0025+x) (2 x) ^2\\
x &=0.000649
\ end {alineado}Por lo tanto,\(0.649 \mathrm{mM}\) será soluble, dejando\(2.5 \mathrm{mM}-0.649 \mathrm{mM}=1.85 \mathrm{mM} C a F_2\) precipitará.
\[1.85 \mathrm{mmol} / L * 0.2 L=0.37 \mathrm{mmol} \nonumber\]
\[0.37 \mathrm{mmol} * 78.07 \mathrm{~g} / \mathrm{mol}=28.9 \mathrm{mgCaF} \mathrm{C}_2 \nonumber\]
Por lo tanto,\(28.9 \mathrm{mg}\) de\(\mathrm{CaF}_2\) precipitará.
Conferencia 30: Ácidos/Bases Bronsted-Lowry y Neutralización
Resumen
En esta conferencia, comenzamos considerando qué sucede si combinas un ácido y una base directamente: por ejemplo,\(\mathrm{NaOH}(\mathrm{aq})+\mathrm{HCl}(\mathrm{aq}) \rightarrow \mathrm{H} 2 \mathrm{O}(\mathrm{l})+\mathrm{NaCl}(\mathrm{s})\). Cada uno de estos productos, el agua y la sal, encuentran un equilibrio propio. Entonces la flecha va en ambos sentidos\(\mathrm{H}++\mathrm{OH}-\leftrightarrow \mathrm{H}_2 \mathrm{O}(\mathrm{l})\) y el agua da las concentraciones habituales de iones neutros de\(\mathrm{H}+\) y\(\mathrm{OH}-\). La sal también tendrá su reacción de equilibrio para formar iones\(\mathrm{Na}+\) y\(\mathrm{Cl}-\) en solución. En algún momento los\(\mathrm{Na}+\) e\(\mathrm{Cl}-\) iones llamados “espectadores” cuando están en solución, ya que no participan en hacer que la solución sea ácida o básica. La reacción de un ácido con una base para hacer agua y sal se denomina reacción de neutralización.
Bronsted y Lowry definieron ácidos y bases de manera más amplia: un ácido de Bronsted-Lowry es cualquier cosa que libere\(\mathrm{H}^{+}\) iones. Una base Bronsted-Lowry es cualquier cosa que acepte\(\mathrm{H}+\) iones. Un “par conjugado” es una buena manera de realizar un seguimiento de la transferencia de protones que ocurre en la química ácido/base. Si consideramos la reacción genérica\(\mathrm{HA}+\mathrm{H}_2 \mathrm{O}\), donde etiquetamos la A para “ácido” y a propósito escribimos la\(\mathrm{H}\) por separado ya que conocemos como un ácido estará renunciando a eso\(\mathrm{H}\) como un\(\mathrm{H}^{+}\) ion, la molécula dejó el otro par conjugado después de entregar el\(\mathrm{H}+\) ion en solución, \(\mathrm{A}-\), se llama su par conjugado. Del mismo modo, si reaccionaba con\(\mathrm{H}_2 \mathrm{O}\), entonces el\(\mathrm{H}_2 \mathrm{O}\) ganado el\(\mathrm{H}+\) para convertirse\(\mathrm{H}_3 \mathrm{O}^{+}\), y esas dos moléculas son pares conjugados. Según Bronsted-Lowry, una reacción ácido-base es esencialmente solo una reacción de transferencia de protones.
Una forma general de escribir un ácido mezclando con una base sería:\(\mathrm{HA}+\mathrm{B} \rightarrow \mathrm{BH}^{+}+\mathrm{A}^{-}\) donde aquí está muy claro que el ácido transfiere un protón a la base.
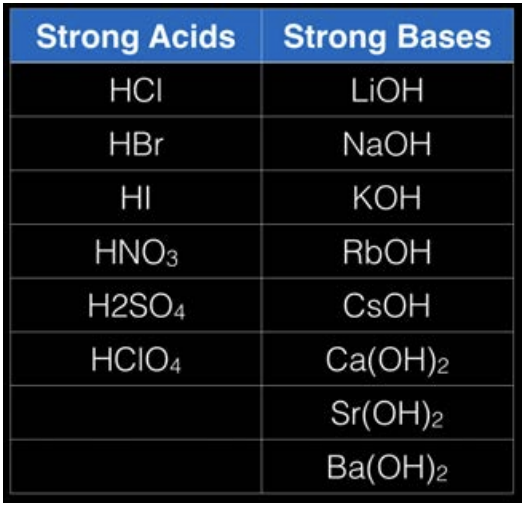
¿Cómo sabemos por qué y cuándo un ácido o base es “fuerte” vs. “débil”? Esta tabla enumera ácidos y bases fuertes comunes. Los ácidos distintos de estos seis son esencialmente todos ácidos débiles. Las únicas bases fuertes comunes son los hidróxidos de los metales alcalinos y las tierras alcalinas más pesadas (\(\mathrm{Ca}, \mathrm{Sr}\), y\(\mathrm{Ba}\); cualquier otra base probablemente sea débil. Podemos cuantificar por qué estas moléculas se consideran “fuertes” considerando sus constantes de disociación ácida. Porque\(\mathrm{HCl}\), la constante de disociación ácida, o en otras palabras la constante de equilibrio para el ácido,\(\mathrm{K}_a=\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{Cl}^{-}\right] /[\mathrm{HCl}]\)\(\approx 106\) - esto es enorme, y significa efectivamente disociación completa. Un ácido fuerte como\(\mathrm{HCl}\) es de hecho fuerte porque se disocia completamente. Y lo contrario también es cierto: si un ácido se disocia completamente, entonces es un ácido fuerte. Lo mismo se aplica para bases fuertes.
Por ejemplo, supongamos que tiene una\(1.0 \mathrm{M}\) solución de\(\mathrm{CH}_3 \mathrm{COOH}\). Eso significa que hay 1 mol de\(\mathrm{CH}_3 \mathrm{COOH}\) en un litro de agua. Ya que\(K_a=10^{-5}\), eso quiere decir que\(\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\) para esta\(1 \mathrm{M}\) solución está alrededor\(0.003\), lo que a su vez significa que el\(\mathrm{pH}\) de\(1 \mathrm{M} \mathrm{CH}_3 \mathrm{COOH}\) se trata\(2.5\). Tenga en cuenta que si hay\(0.003\) moles de\(\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\) esa lata a partir de 1 mol de\(\mathrm{CH}_3 \mathrm{COOH}\), entonces eso significa que solo\(0.3 \%\) de ella se disolvió. ¡Eso no es mucha disolución en comparación con el cercano\(100 \%\) para los ácidos fuertes!
Aquí hay otro ejemplo: ¿la sal formada a partir de la siguiente reacción tendrá un\(\mathrm{pH}\) mayor que, menor que, o igual\(7? \mathrm{CH}_3 \mathrm{COOH}(\mathrm{aq})+\mathrm{NaOH}(\mathrm{s}) \leftrightarrow \mathrm{Na}^{+}+\mathrm{CH}_3 \mathrm{COO}^{-}(\mathrm{aq})+\mathrm{H}_2 \mathrm{O}(\mathrm{l})\) a Para responder a esto ni siquiera necesitamos hacer ninguna matemática. Eso es porque si un ácido débil se mezcla con una base fuerte (como es el caso aquí), automáticamente sabemos que será básico.
En general, cuando se mezclan los siguientes, los resultados son:
- Ácido débil mezclado con base débil:\(\mathrm{pH}<7\) para\(K_a>K_b ; \mathrm{pH}=7\) si\(K_a=K_b ; \mathrm{pH}>7\) para\(K_a<K_b\)
- Ácido fuerte mezclado con base de cuerda:\(\mathrm{pH}=7\)
- Ácido fuerte mezclado con base débil:\(\mathrm{pH}<7\)
- Base fuerte mezclada con ácido débil:\(\mathrm{pH}>7\)
Por qué esto importa
Podría sentirse un poco caliente en\(470^{\circ} \mathrm{C}\), y estarías rodeado de ácido sulfúrico la mayor parte del tiempo. Así sería si vivieras en Venus. Aquí hay una bonita foto de una sonda espacial rusa de allá por la década de 1970 que aterrizó en la superficie, mostrando cómo sería un paseo por allí. Estas temperaturas y atmósferas ácidas pueden sonar locos, pero muchos materiales requieren condiciones similares para su procesamiento. ¡Muchos aspectos de nuestra revolución industrial se han basado efectivamente en reproducir las condiciones de Venus! De hecho, hoy en día se producen casi 250 millones de toneladas de ácido sulfúrico al año, lo que lo convierte en uno de los productos químicos más grandes producidos a nivel mundial. Los\(\mathrm{H}+\) iones liberados de los que provienen\(\mathrm{H} 2 \mathrm{SO} 4\) se ponen en uso en una amplia gama de industrias, desde detergentes hasta baterías de plomo-ácido para automóviles hasta tintes hasta procesamiento de metales, es en la producción de fertilizantes donde domina su uso: ¡aproximadamente\(50 \%\) de todo el ácido sulfúrico se usa para hacer fertilizantes!
En uno de nuestros anteriores Why This Matters, discutimos el proceso Haber-Bosch, que utiliza un catalizador, altas temperaturas (como\(\approx 400^{\circ} \mathrm{C}\)), y altas presiones (como\(\approx 180\) atm.) para fijar\(\mathrm{N}_2\) moléculas y convertirlas en amoníaco,\(\mathrm{NH}_3\). Pero la cosa es que ese es sólo uno de los tres ingredientes más importantes que las plantas necesitan para crecer: los otros dos son el fósforo y el potasio. El fósforo, en particular, se elabora típicamente con grandes cantidades de ácido sulfúrico. ¿Por qué es este el caso? Ya sabes la respuesta, es la química.
encontrados en depósitos sedimentarios, lo que significa que se formaron por deposición de materiales ricos en fosfato en ambientes marinos. Aquí hay una imagen de una formación rocosa de fosfato que se está minando en Utah. Pero si tomas roca de fosfato y la mueles hasta convertirla en un polvo, todavía no será muy soluble en agua (¡ahora tenemos algunos conocimientos sobre lo que eso significa!). Esto significa que si pones el mineral directamente en fertilizante, no será útil para las plantas. Es igual que para el caso de\(\mathrm{N}_2\) en el aire: aunque haya bastantes\(\mathrm{N}_2\), las plantas no tienen forma de absorberlo. Más bien, necesitan trabajar con\(\mathrm{NH}_3\) ellos para poder tomar nitrógeno. Lo mismo ocurre con el fósforo: el fosfato tricálcico\(\mathrm{Ca}_3\left(\mathrm{PO}_4\right)_2\), que es en lo que consiste principalmente la roca fosfática, no es capaz de dar fósforo a las plantas porque no se disuelve lo suficiente en agua. ¡El\(\mathrm{K}_{s p}\) para esta sal iónica es un tremendamente bajo\(2.07 \times 10^{-33}\)! Por cierto, es bastante bueno que esto no se disuelva mucho ya que es un ingrediente clave en huesos y dientes.
Ahí entra el ácido sulfúrico: es una forma bastante sencilla de liberar el ácido fosfórico\(\mathrm{H}_3 \mathrm{PO}_4\) de la roca fosfórica. En particular, el\(\mathrm{H}_2 \mathrm{SO}_4\) de la roca de fosfato. En particular, el\(\mathrm{H}_2 \mathrm{SO}_4\) renuncia a su hidrógeno a cambio del calcio para formar sulfato de calcio, de la siguiente manera:
\(\mathrm{Ca}_3\left(\mathrm{PO}_4\right)_2+3 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow 2 \mathrm{H}_3 \mathrm{PO}_4+3 \mathrm{CaSO}_4\)
Una vez que el ácido fosfórico se produce de esta manera, se puede convertir en diferentes tipos de fertilizantes que ahora son solubles en agua, para que las plantas puedan absorberlo. Estos generalmente se denominan “fosfatos”, o sales de ácido fosfórico, que en el contexto de los fertilizantes incluyen fosfatos de amonio, fosfatos de calcio y fosfatos de sodio. En pocas palabras: ¡alimentamos al mundo por nuestro conocimiento de la química ácida/base!
Por qué esto emplea
Los ácidos y bases se utilizan tanto en la industria y en la vida: no es difícil encontrar trabajos que involucren ácidos y bases. Podrías echar un vistazo a DuPont, por ejemplo, que vende plantas de fertilizantes de fosfato que hacen justo lo que discutimos anteriormente (por ejemplo, ver http://cleantechnologies.dupont.com/ industrias/fosfato-fertilizador/). http://cleantechnologies.dupont.com/...atefertilizer/. BASF fue una de las primeras empresas en fabricar y vender ácido sulfúrico a gran escala, y todavía lo hacen y tienen muchas vacantes relacionadas con la química del ácido. Ahí está Sigma Aldrich, que es una empresa masiva con 10,000 empleados y casi\(\$ 3 \mathrm{~B}\) en ingresos anuales: su categoría “ácidos y bases” muestra cientos de productos (por cierto, otra compañía, Merck, los compró recientemente para\(\$ 17 \mathrm{~B})\). O qué tal Cabot Laboratories, que no fabrica ácidos y bases explícitamente sino que los usa para elaborar cada uno de los productos químicos geniales que hacen, ya sean elastómeros o aerogeles o “carbonos avanzados”.
Podrías tomar cualquiera de los muchos ácidos diferentes, buscar su nombre, y probablemente encontrar un mercado para él, y luego todas las empresas que lo hacen o lo usan, muchas de las cuales tendrán trabajos relacionados con él. Tome ácido fórmico: está recibiendo más interés de una variedad de industrias diferentes porque es más fácil de manejar que otros ácidos (vea por ejemplo este artículo al respecto en C&EN (https://cen.acs.org/ articles/93/i48/Chemical-Makers-Eyes-Formic-Acid.html), y se usa mucho en los textiles industria. BASF y Eastman Chemical son grandes en ácido fórmico, pero muchas otras compañías se están interesando. Hablando de textiles, esa es otra industria que utiliza cantidades masivas de ácidos, incluyendo ácido fórmico pero también ácido cítrico, acético, clorhídrico y nítrico. Los textiles también dependen en gran medida de bases como el hidróxido de sodio y el bicarbonato de sodio para teñir, limpiar e impermeabilizar la ropa, por nombrar algunos usos. Todo solo para decir que los ácidos y bases y verdaderamente una piedra angular de la industria, y saber cómo hacerlos o cómo usarlos conduce a oportunidades laborales masivas.
Problemas de ejemplo
1. Identificar los pares ácido/base conjugados en las siguientes reacciones:
a)\(\mathrm{H}_2 \mathrm{PO}_4^{-}+\mathrm{H}_2 \mathrm{O} \leftrightarrow \mathrm{HPO}_4^{2-}+\mathrm{H}_3 \mathrm{O}^{+}\)
- Contestar
-
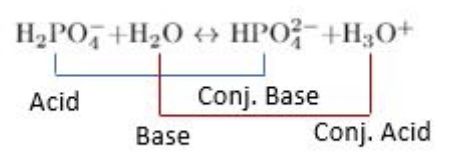
b)\(\mathrm{H}_2 \mathrm{O}+\mathrm{NH}_3 \leftrightarrow \mathrm{OH}^{-}+\mathrm{NH}_4^{+}\)
- Contestar
-
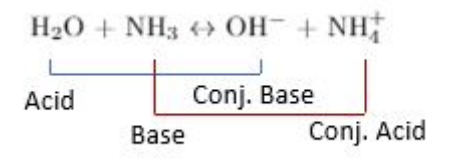
2. Calcular el\(K_a\) de una solución\(0.2 \mathrm{M}\) acuosa de ácido propiónico\(\left(\mathrm{CH}_3 \mathrm{CH}_2 \mathrm{CO}_2 \mathrm{H}\right)\) con un pH de\(4.88\). La disociación se puede expresar como
\(\mathrm{CH}_3 \mathrm{CH}_2 \mathrm{CO}_2 \mathrm{H}+\mathrm{H}_2 \mathrm{O} \leftrightarrow \mathrm{H}_3 \mathrm{O}^{+}+\mathrm{CH}_3 \mathrm{CH}_2 \mathrm{CO}_2^{-}\)
- Contestar
-
Este problema se puede resolver con una mesa ICE:
\ [\ begin {array} {c|c|c|c}
&\ mathrm {CH} _3\ mathrm {CH} _2\ mathrm {CO} _2\ mathrm {H} &\ mathrm {H} _3\ mathrm {O} ^ {+} &\ mathrm {CH} _3\ mathrm {CH} _2\ mathrm {CO} _2^ {-}\
\ hline\ mathrm {I} & 0.2 & 0 & 0\
\ hline\ mathrm {C} & -\ mathrm {x} & +\ mathrm {x} & +\ mathrm {x}\\
\ hline\ mathrm {E} & 0.2-\ mathrm {x} &\ mathrm {x} &\ mathrm {x}
\ end {array}\ nonumber\]\ begin {reunió}
-p H=\ log\ left [H_3 O^ {+}\ derecha] =-4.88\
\ izquierda [\ mathrm {H} _3\ mathrm {O} ^ {+}\ derecha] =10^ {-4.88} =1.32\ times 10^ {-5} =x\
k_a=\ frac {\ left [\ mathrm {H} _3\ mathrm {O} ^ {+}\ derecha]\ izquierda [\ mathrm {CH} _3\ mathrm {CH} _2\ mathrm {CO} _2^ {-}\ derecha]} {\ izquierda [\ mathrm {CH} _3\ mathrm {CH} _2\ mathrm {CO} _2\ mathrm {H}\ derecha]} =\ frac {x^2} {0.2-x} =\ frac {\ izquierda (1.32\ veces 10^ {-5}\ derecha) ^2} {0.2-1.32\ veces 10^ {-5}} =8.69\ veces 10^ {-10}
\ fin {reunidos}
Lectura adicional
Conferencia 21: Ley de Bragg y difracción de rayos X
• Más Ley de Bragg:
• Cómo hacer un experimento XRD:
https://serc.carleton.edu/research_education/geochemsheets/ techniques/XRD.html
• Historia de la ciencia: Rosalind Franklin, Difracción de rayos X, y la estructura del ADN:
https: //doi-org.stanford.idm.oclc.org/10.1119/1.5020051
Conferencia 22: De la difracción de rayos X a la estructura cristalina
• Condición Laue (más allá del alcance de 3.091):
http://www.physics.udel.edu/~yji/PHYS624/ Chapter3.pdf
• Bonitas visualizaciones:
http://web.pdx.edu/~pmoeck/phy381/Topic5a-XRD.pdf
Conferencia 23: Defectos puntuales
• Defectos de Schottky y Frenkel, además de algunas cosas más allá del alcance:
http://ww2.chemistry.gatech. edu/class/6182/wilkinson/nonstoi.pdf
• Cómo los defectos le dan a las diferentes piedras preciosas su aspecto distintivo:
https://www.tf.uni-kiel.de/ matwis/amat/iss/kap_6/advanced/t6_1_1.html
Conferencia 24: Defectos de línea y curvas de tensión-deformación
• Resumen de defectos:
https://chemed.chem.purdue.edu/genchem/topicreview/bp/materials/ defects3.html
• Animación de dislocación de borde móvil:
https://www.tf.uni-kiel.de/matwis/amat/def_en/ kap_5/illustr/a5_1_1.html
• Video sobre curvas de tensión-deformación:
Conferencia 25: Materiales amorfos: Sólidos vítreos
• Sólidos cristalinos vs. amorfos:
• Registro para imagen del vidrio más delgado:
https://news.cornell.edu/stories/2013/09/shattering-records-thinnest-glass-guinness-book
Conferencia 26: Ingeniería de Propiedades del Vidrio
• Dentro de una fábrica de Corning:
https://www.youtube.com/watch?v=gZPeyErbqz4
• Vidrio de impresión 3D:
https://www.youtube.com/watch?v=IvcpbtpWpGY
Conferencia 27: Tasas de reacción
• Resumen de las velocidades de reacción:
• Más sobre convertidores catalíticos:
Conferencia 28: Equilibrio y solubilidad
• Práctica de productos de solubilidad:
https://www.chem.purdue.edu/gchelp/howtosolveit/Equilibrium/ Solubility_Products.htm
• Un método para hacer más medicamentos solubles:
Conferencia 29: Iones y Ácidos/Bases Comunes
• Ejemplo elaborado de efecto iónico común:
• Video sobre pH:
Conferencia 30: Ácidos/Bases Bronsted-Lowry y Neutralización
• El concepto Bronsted de ácidos y bases:
• Ácidos y bases en la cocción:
https://www.livestrong.com/article/431096-acids-bases-in-cooking/


