6.20: Formadores de vidrio y modificadores de red
- Page ID
- 79862
Formadores de vidrio
En\(3.091\), nos enfocamos en el vidrio de sílice. La composición química de la sílice es\(\mathrm{SiO}_2\): ahora está bien equipado para comprobar que este compuesto es de carga neutra. Aunque las cargas están equilibradas, si tuvieras que dibujar un diagrama de puntos de Lewis para\(\mathrm{SiO}_2\), podrías notar que hay muchos pares solitarios de electrones que no están involucrados en la unión. También puede recordar que el silicio, con sus cuatro electrones de valencia, típicamente forma enlaces coordinados tetraédricamente (o\(\mathrm{sp}^3\)). Lo que termina sucediendo cuando la sílice líquida se solidifica es que los átomos de oxígeno se comparten entre los átomos de silicio, actuando como puentes: estos se denominan oxígenos puente. Si tuviéramos que aplanar la sílice cristalina para representarla en 2D, podría verse algo así (no una proyección verdadera):
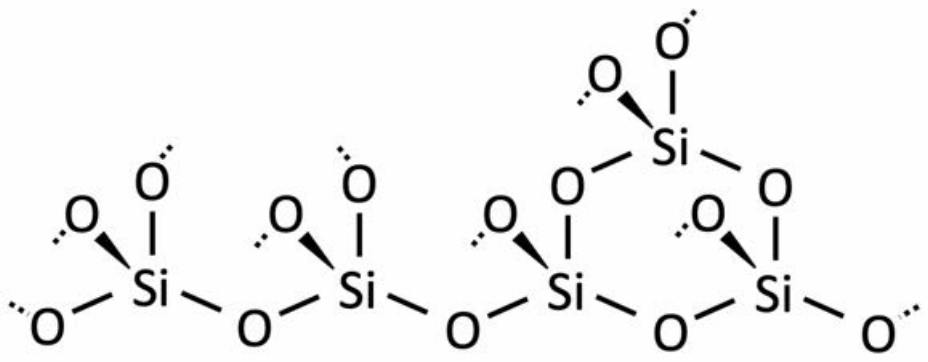
Aquí, las líneas punteadas representan medios enlaces que continuarían en todo el\(3 \mathrm{D}\) espacio. Cada átomo de oxígeno es un oxígeno puente, porque se comparte entre átomos de silicio adyacentes. Aunque la estequiometría es\(\mathrm{SiO}_2\), se puede pensar en la estructura tetraédrica como grupos de silicato\(\left(\left[\mathrm{SiO}_4\right]^{4-}\right)\) donde los iones de oxígeno luego se comparten con los\(\mathrm{Si}\) iones vecinos, produciendo un compuesto de carga neutra.
\(\mathrm{Si}+4\left(\dfrac{1}{2} \mathrm{O}\right)=\mathrm{Si}+2 \mathrm{O}=\mathrm{SiO}_2\)
A pesar de que he mostrado una representación cristalina arriba, el mismo concepto se aplica para los vidrios: la diferencia es que en un vaso, la disposición de los enlaces no es perfectamente tetraédrica. En conferencia y en la recitación 19, hablamos de diversos métodos de procesamiento que producen materiales más desordenados (vítreos) o más ordenados (cristalinos). Generalmente, cuando se forma un vidrio en lugar de un cristal, los enlaces no tienen suficiente tiempo (o energía) para organizarse en tetraedros puros: en cambio, se rotan, se estiran y la estructura de largo alcance generalmente es amorfa. La química, sin embargo, sigue siendo la misma: para el vidrio de sílice, hay átomos de oxígeno puente que conectan átomos de silicio vecinos, y una relación 2:1 de átomos de oxígeno a átomos de silicio. El vidrio resultante es como una gran red de\(\mathrm{Si}-\mathrm{O}\) enlaces dispuestos al azar: por esta razón, la sílice se llama un formador de red.
Modificadores de red
A diferencia de un formador de red, también puede haber modificadores de red: defectos elementales introducidos en la masa fundida que alteran la red de sílice altamente conectada. Algunos ejemplos incluyen\(\mathrm{Na}_2 \mathrm{O}, \mathrm{CaO}_2\) y\(\mathrm{Al}_2 \mathrm{O}_3\). Estos óxidos iónicos se disocian dentro del vidrio, y los cationes fuertemente electropositivos tienen afinidad por los átomos de oxígeno electronegativos. Aquí hay un ejemplo usando\(\mathrm{Na}_2 \mathrm{O}\):
Centrémonos en un puente de oxígeno. Si lo pensamos como una reacción química, podemos agregar una serie de unidades de\(\mathrm{Na}_2 \mathrm{O}\).
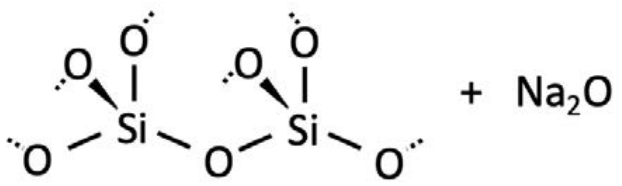
Cada uno\(\mathrm{Na}_2 \mathrm{O}\) en la masa fundida se disocia en dos átomos de sodio y un átomo de oxígeno. Uno de los enlaces covalentes que conectan el átomo de oxígeno puente está roto por los átomos de sodio. Por supuesto, la masa se conserva, y el oxígeno procedente\(\mathrm{Na}_2 \mathrm{O}\) puede formar un nuevo enlace covalente con el\(\mathrm{Si}\) cuyo enlace se rompió. En el estado final, los\(\mathrm{Na}^{+}\) átomos forman enlaces iónicos con los átomos de oxígeno recién no puenteantes. La red de sílice se ha dividido.
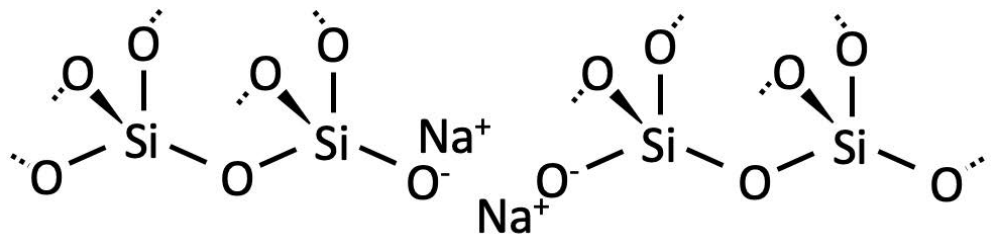
Para otras sales iónicas, se puede pensar en cada una\(\mathrm{O}_2^{2-}\) que se agrega como romper un enlace, pero creando dos átomos de oxígeno no puente. Cuanto más modificador de red se agrega, más ocurre este proceso, ¡y más cortas se vuelven las cadenas continuas de sílice! A medida que las cadenas se hacen cada vez más cortas, pueden deslizarse entre sí más fácilmente durante el enfriamiento. Es más difícil para ellos enredarse. Por lo tanto, cuanto más modificador de red se agrega, menor es el volumen libre del vidrio que resulta (manteniendo todos los demás factores constantes), porque las cadenas más cortas pueden empacar de manera más eficiente que el desorden desordenado del vidrio de sílice puro.
Ejemplo: Dibuje una curva de enfriamiento de vidrio comparando un vidrio con mucho modificador de red agregado a un vidrio con poco modificador de red agregado, asumiendo que la velocidad de enfriamiento es la misma para ambos.
- Responder
-
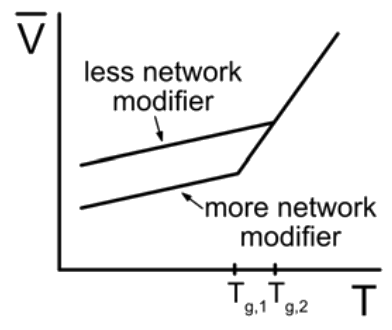
Tenga en cuenta que el vidrio con más modificador de red tiene un menor\(\mathrm{T}_g\)!

