1.2: Teoría de los Bonos de Valencia- Estructuras de Punto Lewis, Regla del Octeto, Carga Formal, Resonancia y Principio Isoelectrónico
- Page ID
- 72320
Átomos y moléculas
El atomismo, por ser descartado por Aristóteles, disfrutó de un largo sueño en el discurso científico hasta que fue reconsiderado por Galileo, Decarts y Gassendi en el siglo XVII. Dalton postuló la teoría atómica moderna en 1808 basándose en su observación de que elementos como el hidrógeno y el oxígeno se combinaban en proporciones específicas (la Ley de Proporciones Definidas), pero la teoría atómica permaneció polémica durante la mayor parte del siglo XIX. Thompson, Rutherford, Bohr y otros alrededor del cambio del siglo XX establecieron que la materia estaba compuesta de hecho por átomos que contenían núcleos pesados y electrones ligeros, y que los átomos podían existir en estados excitados que podrían interpretarse como excitaciones de sus electrones a diferentes niveles de energía. Sin embargo, la teoría atómica no proporcionó una explicación sencilla para los estados unidos de los átomos en las moléculas.
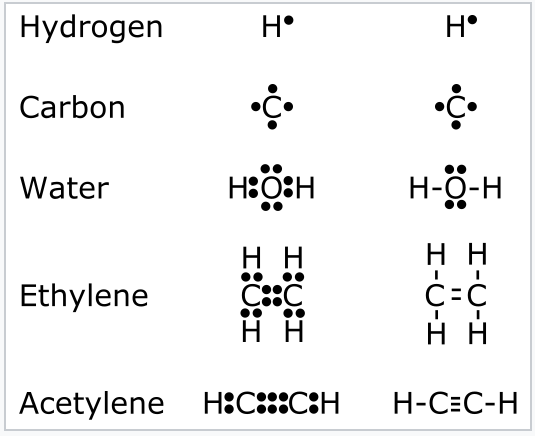
En 1916, aún más de una década antes de que la teoría cuántica moderna describiera adecuadamente las formas de los orbitales atómicos, Lewis propuso la teoría del octeto basada en las reglas de valencia observadas empíricamente, es decir, las relaciones de combinación de átomos en las moléculas. [1] Esta teoría, en retrospectiva, puede racionalizarse para los elementos del bloque s y p observando que los átomos del grupo principal pueden usar sus cuatro orbitales de valencia (s, p x, p y y pz) para acomodar hasta ocho electrones, algunos o todos los cuales pueden ser compartidos con otros átomos. En el modelo de Lewis, los electrones de valencia de un átomo estaban situados en las esquinas de un cubo, y los cubos podían compartir bordes o caras para completar sus octetos. Lewis desarrolló una notación taquigráfica para estas estructuras basada en puntos que representaban los electrones de valencia, como se ilustra en la Fig. \(\PageIndex{1}\). Un par de electrones compartidos entre átomos constituye un enlace químico, y también se puede representar como una línea que une los átomos. Cuatro electrones compartidos entre átomos, representados por dos líneas, es un doble enlace, y así sucesivamente. Cualquier par de electrones no involucrados en la unión forma “pares solitarios” que pertenecen a un solo átomo y, por lo tanto, no están involucrados en la unión.
El cuadro de Lewis es potente en su simplicidad. Se puede usar fácilmente para racionalizar o predecir las relaciones de combinación de átomos, para clasificar estructuras plausibles e improbables para moléculas (incluidas las grandes) y para racionalizar las propiedades ácido-base de muchas moléculas. Es importante recordar que el modelo está construido sobre una descripción mecánica inestable, precuántica de los átomos y así con él, cometeremos errores. Sin embargo, es útil ver hasta dónde podemos llegar con el modelo Lewis.
Construyendo la imagen de enlace de valencia octeto para una molécula
Podemos construir una imagen de octeto para cualquier molécula usando el método N-V:
- Número de electrones necesarios para hacer octetos separados alrededor de todos los átomos = N
- (N = 8 para átomos que no son H, N = 2 para H)
- Número de electrones de valencia = V (suma usando números de grupo; no olvide sumar o restar para cargas en iones)
- Número de electrones compartidos = S = N-V; y por lo tanto el número de enlaces = S/2
- Rellenar pares solitarios en todas partes para completar octetos
Ejemplo: anión nitrato, NO 3 -
- N = 4 átomos x 8 electrones = 32
- V = 5 + 6 + 6 + 6 + 1 = 24 (N + O + O + O + carga)
- S = 32-24 = 8 electrones compartidos = 4 enlaces
- El número de pares solitarios se obtiene por diferencia: (V-S) /2 = (24-8) /2 = 8
- Ahora dibuja la molécula, comenzando con los cuatro enlaces y agregando ocho pares solitarios para completar los octetos:
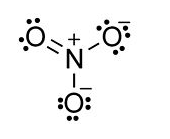
- Cuente los electrones compartidos y no compartidos alrededor de cada átomo en el ion nitrato y verá que todos los átomos son octeto y que el número total de electrones de valencia (V) es 24. Si haces el cálculo N-V de acuerdo con las reglas anteriores, siempre debes obtener una estructura de octeto.
|
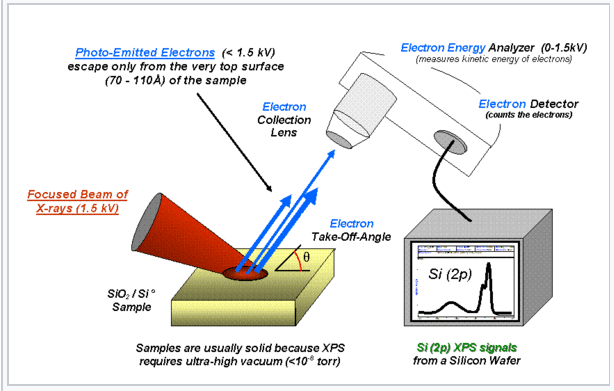
Las cargas en los átomos en una molécula (o un sólido extendido como SiO 2) se pueden estimar a partir de espectros fotoelectrónicos de rayos X (XPS). Los rayos X energéticos ionizan los átomos expulsando electrones de sus orbitales centrales. Por conservación de energía, la energía cinética (KE) de un electrón emitido se relaciona con su energía de unión (BE) y la energía del fotón de rayos X entrante (hν) por BE = hν - KE. Los electrones son más difíciles de eliminar de los átomos cargados positivamente (BE superior), y más fáciles de eliminar de los átomos cargados negativamente (BE inferior), en relación con el elemento neutro. |
La distribución formal de carga se asigna dividiendo los electrones compartidos (de enlace) por igual entre átomos. Así, los átomos de O unidos individualmente poseen cada uno 7 electrones, y debido a que O está en el grupo 6, su carga formal es -1. El O doblemente enlazado tiene un cargo formal de cero. El átomo de N tiene una carga formal de +1 porque “posee” 4 electrones de valencia y está en el grupo 5.
Tenga en cuenta que la carga formal no es lo mismo que el número de oxidación (o estado de oxidación). En el ion nitrato, el estado de oxidación del nitrógeno es +5 y el estado de oxidación del oxígeno es -2. La carga formal suele estar más cerca de la carga “real” en el átomo (medida, por ejemplo, mediante espectroscopía fotoelectrónica de rayos X). Los estados de oxidación son un útil dispositivo de contabilidad para realizar un seguimiento de las reacciones de oxidación-reducción, como se discutirá en el Capítulo 4. Al igual que los estados de oxidación, las cargas formales sobre los átomos en una molécula o ion deben sumarse a su carga general.
De manera similar podemos dibujar la estructura de Lewis para el amoníaco como se muestra a continuación:
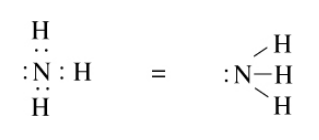
Cuando dividimos los electrones compartidos por igual entre los átomos, vemos que el átomo de N tiene cinco electrones y cada átomo H tiene uno. Estos son los mismos que sus números de grupo, y así, todas las cargas formales en la molécula de amoníaco son cero.
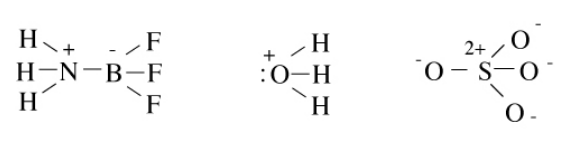
A continuación se muestran las estructuras de octeto del aducto ácido-base de Lewis NH 3 BF 3, el ion hidronio H 3 O + y el anión sulfato SO 4 2-. En este caso (y en muchas estructuras de Lewis dibujaremos), dejamos fuera los pares solitarios implícitos alrededor de los átomos periféricos. Intente calcular el número de enlaces en cada una de estas moléculas usando el método N-V, y rellene los pares solitarios que no se dibujan explícitamente.
En los casos en que sea posible más de una estructura de bonos de valencia, podemos usar cargos formales para decidir qué estructuras deben ser más o menos estables. Las reglas son:
- Las cargas formales sobre los átomos se minimizan en estructuras estables, siendo cero el mejor de los casos.
- Los cargos formales negativos deben ser colocados sobre el átomo (s) más electronegativo (s).
- Las cargas formales positivas deben colocarse sobre el átomo o átomos menos electronegativos.
- Es desfavorable colocar cargas similares (++ o —) en átomos vecinos en una molécula.
A continuación se muestran ejemplos de estas reglas para estructuras alternativas de BF 3 y ONF.
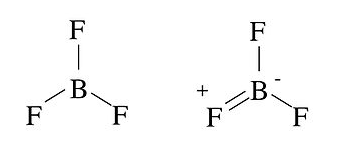
En el caso BF 3, la estructura de la izquierda no es octeto, porque solo hay seis electrones (tres enlaces) en la capa de valencia de B. Tales estructuras se dice que son deficientes en electrones. Se puede dibujar una estructura de octeto (derecha), pero coloca una carga formal positiva sobre F, el átomo más electronegativo de la molécula. Por lo tanto, ninguna estructura es completamente “feliz”, pero las reglas formales de carga nos dicen que la estructura deficiente en electrones de la izquierda es más estable. La deficiencia de electrones de BF 3 lo convierte en un potente ácido de Lewis.
En el caso de ONF, la estructura de la izquierda es desfavorable por dos razones. Primero, coloca una carga formal positiva sobre F, el átomo más electronegativo. Segundo, hay otra estructura posible (derecha) que tiene carga formal cero, que es preferible a una con cargo distinto de cero. Esto quiere decir que la estructura de la derecha, con un doble enlace entre N y O, es más razonable.

|
La vida fuera del océano debe su existencia a la presencia de ozono (O 3) en la estratosfera. El ozono absorbe la luz ultravioleta en el espectro solar, lo que de otro modo provocaría daños catastróficos al ADN y otras moléculas biológicas. Debido a que el ozono se produce fotoquímicamente a partir del O 2, que a su vez es generado por la fotosíntesis, la firma espectroscópica del ozono en la atmósfera de planetas distantes es una forma posible de buscar vida extraterrestre. |
Estructuras de resonancia
La molécula de ozono (O 3) tiene dos estructuras de octeto equivalentes, que se muestran a continuación:
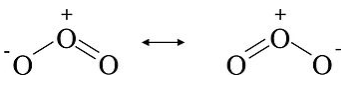
En ambos casos, el diagrama de puntos de Lewis sugiere que hay tres tipos de átomos de oxígeno en la molécula, con +1, 0 y -1 cargas formales. Estas estructuras también sugieren que el ozono debe tener un enlace simple y otro doble. Experimentalmente (por difracción de electrones), sin embargo, encontramos que la molécula es simétrica, con ambas longitudes de enlace O-O iguales. La estructura real (instantánea) es el promedio de las dos formas, como se muestra a continuación. En el cuadro clásico de Lewis de la molécula, podemos racionalizar la resonancia observando que los electrones, al ser miles de veces más ligeros que los núcleos de los átomos, se mueven muy rápido en la escala de tiempo de las vibraciones moleculares. Así, en el tiempo que tardan los átomos de oxígeno en ajustar sus posiciones, los electrones pueden moverse de un lado a otro muchas veces. En la imagen MO mecánica cuántica (Capítulo 2), veremos que la resonancia involucra electrones que están completamente deslocalizados sobre los átomos en la molécula. Representamos estructuras de resonancia con una flecha de doble punta para significar que la única diferencia entre las estructuras de Lewis es la distribución de electrones.
|
Susan Solomon descubrió el mecanismo catalítico heterogéneo mediante el cual el ozono es descompuesto por clorofluorocarbonos (freones), creando el agujero de ozono antártico. Su trabajo formó la base del Protocolo de Montreal de la ONU, un acuerdo internacional para proteger la capa de ozono mediante la regulación de productos químicos dañinos. |
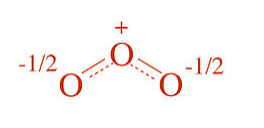
En la estructura instantánea del ozono, la carga formal (-) se comparte entre los dos átomos de oxígeno terminales y por lo tanto cada uno tiene una carga formal de -1/2. Los enlaces O-O son el promedio de un enlace simple y uno doble, es decir, cada orden de enlace O-O es 1.5.
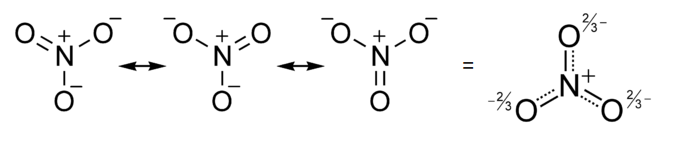
De manera similar, el anión nitrato tiene tres estructuras de resonancia, y experimentalmente (por cristalografía de rayos X de sales de nitrato) encontramos que todos los enlaces N-O en el ion son iguales. En este caso, en la estructura promediada, cada átomo de O tiene una carga formal de -2/3 y el orden de enlace N-O es 4/3 (=1.33...).
Estructuras de resonancia inequivalentes
Las reglas de resonancia también se aplican a estructuras inequivalentes, que en general tendrán diferentes energías entre sí. En este caso la estructura de la molécula representa un promedio ponderado de las estructuras de baja energía. Un buen ejemplo es el ion cianato, OCN -. Podemos escribir tres estructuras de octeto inequivalentes para la molécula:
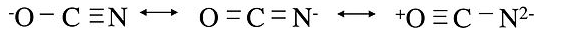
Las dos primeras son estructuras de resonancia razonables, aunque sospechamos que la de la izquierda es la mejor porque pone la carga formal negativa en el átomo más electronegativo. El último es claramente una mala estructura de resonancia, porque las cargas formales son altas y hay una carga positiva en el átomo de oxígeno. La estructura real es así un promedio ponderado de los dos primeros.
Resonancia sin enlace
Un tipo interesante y útil de estructura de resonancia inequivalente es aquella en la que existe un orden de enlace de cero entre dos de los átomos. Este concepto de resonancia sin enlace es importante para comprender el enlace en muchos compuestos que contienen halógeno e hidrógeno. La idea se ilustra a continuación para la molécula genérica X-Y-Z, donde Z podría ser un átomo de halógeno electronegativo como F. Al mover los electrones de unión del enlace Y-Z al átomo Z, y mover un par solitario de X al enlace X-Y, generamos la estructura de resonancia que se muestra a la derecha en la que todos los átomos permanecen octeto, pero no hay vínculo entre Y y Z.
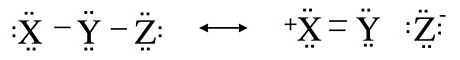
Es importante reconocer en este ejemplo que la forma sin enlace es solo una estructura de resonancia, y por lo tanto el átomo Z todavía está unido a Y. Si las dos estructuras de resonancia en este ejemplo tienen la misma energía, esperaríamos que el orden del enlace X-Y sea 1.5 y el orden de enlace Y-Z sea 0.5. Por lo tanto, el enlace Y-Z debe ser más largo que en un compuesto donde el orden de enlace es uno, y debería ser relativamente fácil romper el enlace Y-Z.
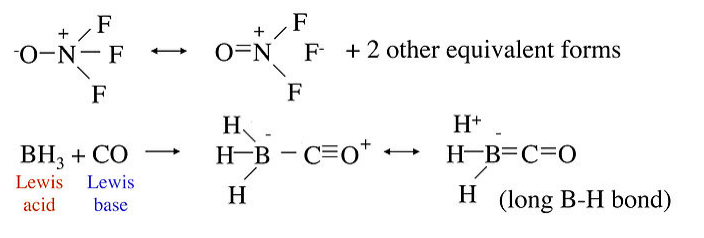
A continuación se muestran algunos ejemplos moleculares de resonancia sin enlace. En la molécula ONF 3, el enlace N-F es inusualmente largo con relación al enlace N-F en NF 3, en el que el orden de enlace es 1. Esto puede explicarse por las formas de resonancia sin enlace que se muestran a la derecha. De manera similar, en el aducto ácido-base de Lewis formado al combinar BH 3 con CO, podemos explicar los enlaces B-H largos usando formas de resonancia sin enlace que colocan una carga positiva parcial en los átomos de H.
La resonancia sin enlace se usa a menudo para proporcionar una imagen de enlace de octeto para los llamados compuestos hipervalentes, que son compuestos que parecen tener más de 8 electrones de valencia en la capa de unión del átomo central. Por ejemplo, podemos considerar dos estructuras de enlace de valencia diferentes para el ion triyoduro, I 3 -, que se forma por reacción de I - con I 2 en agua:
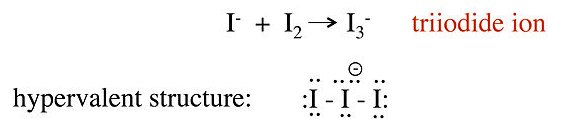
En esta estructura, el átomo central de yodo tiene 10 electrones en su caparazón de valencia, en violación de la regla del octeto. Los espectros Raman del ion triyoduro muestran que el enlace I-I es más débil que el enlace sencillo I-I en I 2, lo que sugiere que esta imagen no es una descripción precisa de la unión. Una mejor representación de I 3 - se puede obtener con estructuras de resonancia sin enlace, como se muestra a continuación. Veremos que este panorama es congruente con la descripción MO de I 3 - en el Capítulo 2:
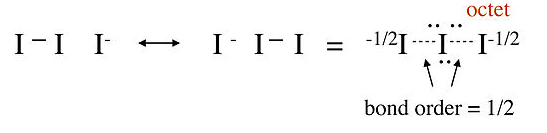
|
El color azul profundo de las soluciones de almidón-yodo resulta de la complejación de iones poliyoduro lineales (I n -) por la hélice zurda de almidón (amilosa). El interior de la hélice es hidrofóbico. En disolventes donadores de electrones como etanol y agua, I 2 y sales de I 3 - tienen un color marrón, resultado de una interacción de transferencia de carga entre el disolvente y el soluto. [2] [3]
|
Podemos dibujar una imagen similar para la molécula xEF 2, que tiene el mismo número de electrones de valencia que I 3 -. Esta imagen es consistente con los datos de XPS, que muestran una carga negativa parcial en los átomos F, así como espectros vibracionales, que muestran que el enlace Xe-F es más débil en XeF 2 que en el catión unido-unido Xe-F +.
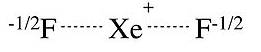
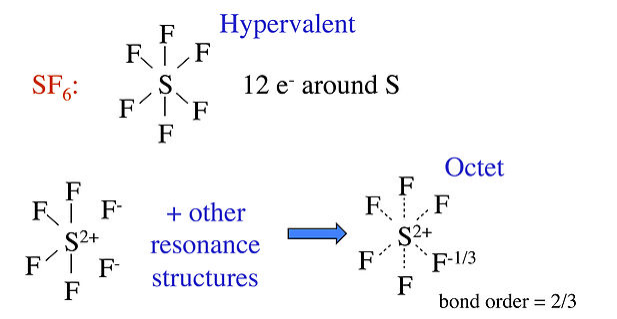
Otros ejemplos bien conocidos de compuestos hipervalentes son PF 5, P (CH 3) 5 y SF 6, así como oxiácidos como H 2 SO 4 y HClO 4. La estructura hipervalente a menudo se dibuja para estas moléculas, con la explicación de que los orbitales d en el átomo central contribuyen a la unión en híbridos dsp 3 y d 2 sp 3 para moléculas de 5 y 6 coordenadas, respectivamente. Sin embargo, los cálculos orbitales moleculares realistas muestran que los orbitales 3d de fósforo y azufre son demasiado altos en energía para contribuir significativamente a la unión en PF 5 y SF 6. Para estas moléculas, podemos usar resonancia sin enlace para hacer estructuras de octeto razonables que predicen enlaces polares entre el átomo central y F.
|
Modelo de llenado de espacio de hexafluoruro de azufre. El SF 6 es sorprendentemente no reactivo con el agua, en relación con otros compuestos que contienen enlaces S-F. El empaquetamiento apretado de los átomos F alrededor del S previene el ataque nucleofílico por el agua. |
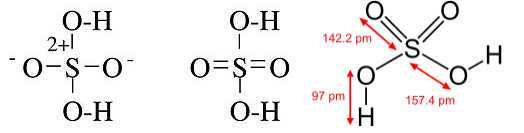
En otros casos, como P (CH 3) 5, la estructura del octeto no es razonable porque sugiere un enlace polar entre P y C, con una carga negativa parcial sobre C. Además, en el caso de oxiácidos como H 2 SO 4 y HClO 4, datos cristalográficos de rayos X establecer que los enlaces S-O y Cl-O son más cortos para los átomos de oxígeno no unidos al hidrógeno, lo que es más consistente con el cuadro hipervalente:
La cuestión de si la hipervalencia y la regla del octeto son realmente útiles descripciones de la unión en estos compuestos ha sido considerada en varios estudios computacionales, que han utilizado cálculos mecánicos cuánticos cada vez más precisos para determinar el número de electrones asociados con la central átomo. En un estudio de 2002, Gillespie y Silvi [4] encontraron que la población de la cubierta de valencia es mayor a ocho para compuestos con ligandos electropositivos, como P (CH 3) 5, y menos de ocho para compuestos como PF 5. Concluyeron que estas poblaciones de conchas de electrones de valencia dependen principalmente de los números de coordinación y electronegatividades de los átomos centrales y sus ligandos, y que no hay diferencia fundamental entre el enlace en moléculas hipervalentes y no hipervalentes (octeto de Lewis). Esto nos recuerda que la regla del octeto no es una ley de la naturaleza, sino una regla empírica que es útil dentro de ciertos límites.
El principio isoelectrónico
Al calcular las estructuras de octeto de las moléculas usando el método N-V, necesitábamos conocer solo el número de átomos y el número de electrones, no las identidades de los átomos mismos. Esto significa que obtendremos la misma respuesta (y el mismo conjunto de estructuras de octeto y resonancia) para cualquier molécula o ion que contenga (a) el mismo número de átomos que no sean hidrógeno, y (b) el mismo número total de electrones de valencia. Se dice que tales moléculas son isoelectrónicas. Esta es una conclusión poderosa porque, una vez que hemos determinado la estructura electrónica de una molécula, podemos anotar la misma solución para todas las demás moléculas que son isoelectrónicas. Por ejemplo, señalamos anteriormente que I 3 - y xEF 2, que ambos tienen 22 electrones de valencia, tienen la misma estructura de enlace de valencia. Podemos esperar además que las moléculas isoelectrónicas tengan las mismas formas y, muy a menudo, propiedades físicas similares.
Las cuatro moléculas e iones por debajo de todos contienen tres átomos que no son hidrógeno y 16 electrones de valencia. Todas ellas son moléculas lineales con dos dobles enlaces. Las cuatro moléculas e iones que se muestran a continuación contienen cuatro átomos distintos de hidrógeno y 24 electrones de valencia. Estos cuatro tienen una forma plana trigonal. Si bien BF 3 es miembro de esta serie isoelectrónica, no la escribimos en la forma de resonancia que contiene un doble enlace B=F, porque eso pondría una carga formal positiva sobre F.
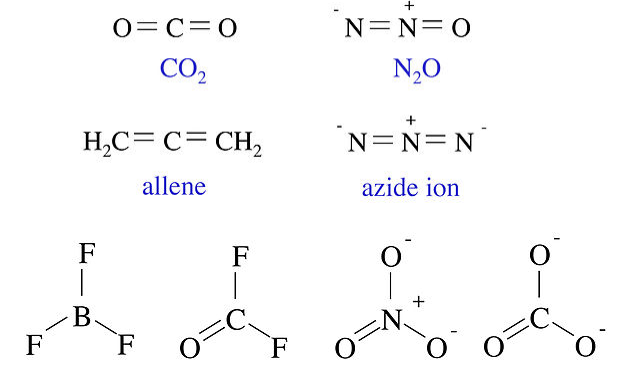
De igual manera podemos demostrar que CH 4, NH 3, NH 4 +, H 2 O, H 3 O +, HF, F -, y OH - son todos isoelectrónicos con un átomo no H y ocho electrones de valencia. En la siguiente sección veremos que esto da lugar a formas electrónicas casi idénticas para estas moléculas.
|
El óxido nitroso (N 2 O), o gas de risa, es isoelectrónico con CO 2. Las dos moléculas tienen la misma forma (lineal) y propiedades físicas similares. El CO 2 se sublima a -78 °C, mientras que el N 2 O se funde a -91 °C y hierve a -88 °C. |
Sólidos isoelectrónicos
El principio isoelectrónico funciona no solo para moléculas sino también para sólidos extendidos. Un conjunto tecnológicamente importante de sólidos isoelectrónicos son los semiconductores p-block. El grupo 14 elemento Si es el semiconductor más utilizado para la electrónica, pero, como discutiremos más adelante, no es un buen emisor de luz. Los diodos emisores de luz (LED), que se utilizan en láseres, iluminación de alta eficiencia y tecnologías de visualización, están hechos de compuestos que son isoelectrónicos con Si y Ge, especialmente GaAs, GaP, AlAS y GaN (todos contienen cuatro electrones de valencia por átomo). CdTe y CuIn 1-x Ga x Se 2 (CIGS) son prometedores materiales de células solares que también tienen el mismo número de electrones de valencia por átomo. Al igual que el Si y Ge, estos compuestos tienen estructuras unidas tetraédricamente en estado sólido y absorben la luz en la mayor parte del espectro solar, como discutiremos con más detalle en los Capítulos 8 y 10.
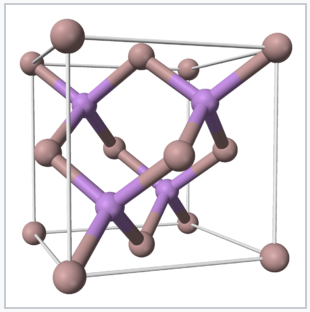
El principio isoelectrónico es también una herramienta poderosa en la investigación de materiales, ya que brinda orientación sobre dónde buscar nuevos materiales con propiedades similares y quizás mejoradas. Por ejemplo, el descubrimiento de que 8.5% de células solares de capa delgada eficientes podrían hacerse con el compuesto CsSnI 3 [5] estimuló la exploración de muchos compuestos isoelectrónicos ABX 3 con la misma estructura cristalina de perovskita. Muy recientemente células solares de película delgada basadas en absorbentes de luz de esta familia estructural (MA) pBi 3-x Cl x y FA x MA 1−x PbBr y I 3−y (MA + = metilamonio, CH 3 NH 3 +; FA + = formamidinio, HC (NH 2) 2 +) se han reportado con eficiencias tan altas como 22%. [6] [7] [8]