8.2: Empaque cerrado y sitios intersticiales
- Page ID
- 71882
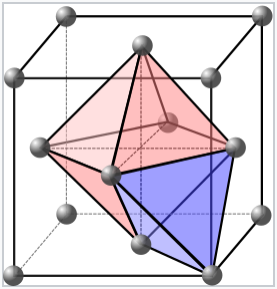
Muchos cristales inorgánicos comunes tienen estructuras que están relacionadas con empaquetamientos de esferas cúbicas empaquetadas (cúbicas centradas en la cara) o hexagonales. Estas celosías de empaquetamiento contienen dos tipos de sitios o “agujeros” que llenan los átomos intersticiales, y la geometría de coordinación de estos sitios es tetraédrica u octaédrica. Un átomo intersticial que llena un agujero tetraédrico se coordina a cuatro átomos de empaquetamiento, y un átomo que llena un orificio octaédrico se coordina a seis átomos de empaquetamiento. En las celosías hexagonales empaquetadas y cúbicas, hay un agujero octaédrico y dos orificios tetraédricos por átomo de empaque.
Pregunta: ¿Serían mejores aniones o cationes como átomos empacadores?
Podríamos esperar que los aniones, que a menudo son más grandes que los cationes, se adapten mejor a las posiciones de los átomos empaquetadores. Si bien esto suele ser cierto, existen muchos ejemplos de estructuras en las que los cationes son los átomos empaquetadores, y otros en los que la distinción es arbitraria. La estructura de NaCl es un buen ejemplo de esto último.
|
Un sitio octaédrico y otro tetraédrico en una celda unitaria cúbica centrada en la cara. Cada celda contiene cuatro átomos de empaquetamiento (gris), cuatro sitios octaédricos (rosa) y ocho sitios tetraédricos (azul). |
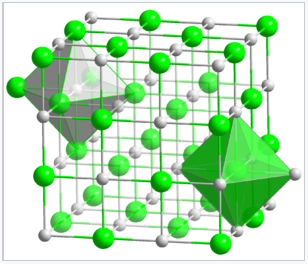
En la estructura de NaCl, mostrada a la derecha, las esferas verdes son los iones Cl - y las esferas grises son los iones Na +. Los agujeros octaédricos en una celosía cúbica centrada en la cara se pueden encontrar en coordenadas fraccionarias (1/2 1/2 1/2), (1/2 0 0), (0 1/2 0) y (0 0 1/2). Hay cuatro de estos agujeros por celda, y son llenados por los iones cloruro. Los átomos empaquetadores (Na +) tienen coordenadas (0 0 0), (0 1/2 1/2), (1/2 1/2 0) y (1/2 0 1/2) y (1/2 0 1/2). Obsérvese que cada una de las posiciones Na + está relacionada con una posición Cl - por una traslación de (1/2 0 0). Otra forma de afirmar esto es que la estructura consiste en dos celosías fcc interpenetrantes, las cuales están relacionadas entre sí por una traslación de la mitad de la celda unitaria a lo largo de cualquiera de los tres ejes cartesianos. Podríamos haber colocado de manera equivalente los iones Cl en los puntos de la red fcc y los iones Na en los agujeros octaédricos simplemente traduciendo el origen de la celda unitaria en (1/2 0 0). Así, la distinción entre átomos empaquetados e intersticiales en este caso es arbitraria.
|
Estructura cristalina de NaCl. Tanto los iones Na + como Cl - están coordinados octaédricamente. |
El NaCl es interesante porque es un tablero de ajedrez tridimensional, y así no hay “moléculas” de NaCl que existan en la estructura. Cuando esta estructura fue originalmente resuelta (en 1913 mediante difracción de rayos X) por W. L. Bragg, su interpretación encontró resistencia de químicos que pensaban que las estequiometrías enteras precisas eran consecuencia de la valencia de los átomos en las moléculas. El químico alemán P. Pfeiffer señaló en 1915 que 'la noción ordinaria de valencia no parecía aplicar', y catorce años después, el influyente químico H. E. Armstrong todavía encontró la estructura propuesta de Bragg de cloruro de sodio 'más que repugnante al sentido común, ¡no al grillo químico'! Sin embargo, Bragg y su padre, W. H. Bragg, perseveraron y utilizaron la entonces nueva técnica de difracción de rayos X para determinar las estructuras de otros compuestos, incluyendo diamante, zincblende, fluoruro de calcio y otros haluros alcalinos. Estos experimentos dieron a los químicos su primera mirada real a la estructura atómica de los sólidos, y sentaron las bases para experimentos de difracción de rayos X que luego dilucidaron las estructuras del ADN, las proteínas y muchos otros compuestos. Por su trabajo en difracción de rayos X los Braggs recibieron el premio Nobel de Física en 1915.
|
Las dimensiones de la red y las posiciones de los átomos en cristales como el NaCl se deducen de los patrones de difracción. |
Dado que cada tipo de átomo en la estructura de NaCl forma una red cúbica centrada en la cara, hay cuatro átomos de Na y cuatro de Cl por celda unitaria de NaCl. Es por esta relación que el NaCl tiene una estequiometría 1:1. Las estructuras bipiramidales verdes y grises sombreadas en la red de NaCl muestran que los iones Na + están coordinados a seis iones Cl -, y viceversa. La estructura de NaCl se puede dibujar alternativamente como un apilamiento de planos de capa empaquetados, AcBACBBA... a lo largo de la diagonal del cuerpo de la celda unitaria. Aquí las letras mayúsculas representan los átomos empaquetados, y las letras minúsculas son los átomos intersticiales. Este empaque en capas se ilustra a continuación:
Estructura de NaCl
- — A
- - - -c- - - -
- — B
- - - -a- - - -
- — C
- - - -b- - - -
- — A
- - - -c- - - -
- — B
- - - -a- - - -
- — C
- - - -b- - - -
- — A
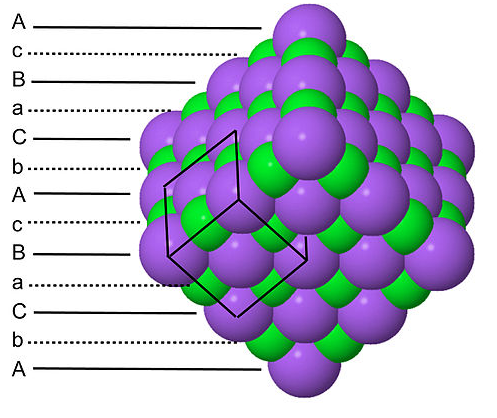
Obsérvese que tanto los átomos de empaquetamiento como los intersticiales se apilan en la secuencia A-B-C-A-B-C..., de acuerdo con el hecho de que cada uno forma una red cúbica muy empaquetada.
La estructura de NaCl es bastante común entre los compuestos iónicos:
- Haluros alcalinos (excepto CsCl, CsBr y CSi)
- Monóxidos de Metales de Transición (TiO, VO,..., NiO)
- Óxidos y Sulfuros Alcalinotérreos (MgO, CaO, Bas... excepto BeO y MgTe)
- Carburos y nitruros (TiC, TiN, ZrC, NbC) -estos son aleaciones intersticiales refractarias muy estables (metálicas)
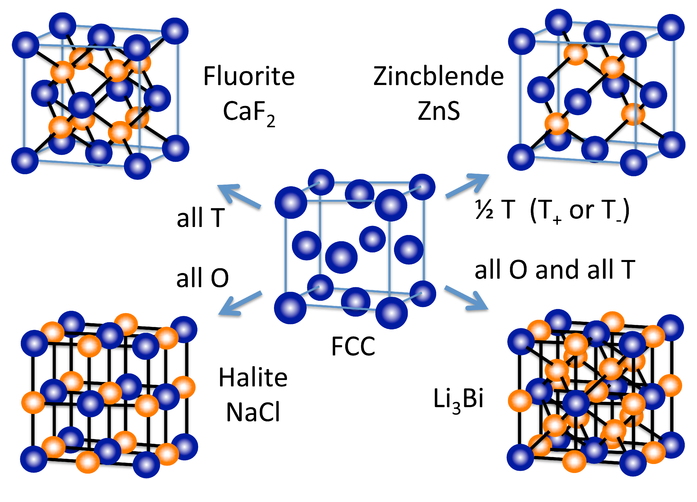
Varias otras estructuras cristalinas inorgánicas se forman (al menos conceptualmente) rellenando agujeros octaédricos y/o tetraédricos en celosías empaquetadas. La figura de la derecha muestra algunas de las estructuras más comunes (fluorita, halita, zincblenda) así como una bastante rara (Li 3 Bi) que derivan de la red fcc. A partir de la celosía hcp, podemos hacer los NIs y las estructuras de wurzita, que son los parientes hexagonales de NaCl y zincblenda, respectivamente.
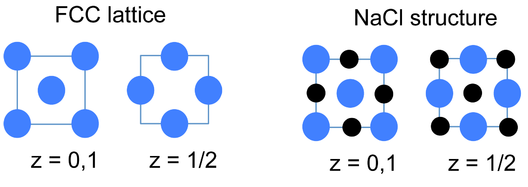
Una forma alternativa y muy conveniente de representar estructuras cristalinas inorgánicas (especialmente estructuras complejas como Li 3 Bi) es dibujar la celda unitaria en rodajas a lo largo de uno de los ejes de la celda unitaria. Este tipo de representación se muestra a la izquierda para la celosía fcc y la estructura de NaCl. Dado que todos los átomos en estas estructuras tienen coordenadas z de 0 o 1/2, solo esas secciones necesitan ser dibujadas para describir el contenido de la celda unitaria. Es un ejercicio útil para dibujar algunas de las estructuras compuestas fcc (arriba) en secciones.