8.3: Estructuras relacionadas con NaCl y NIs
- Page ID
- 71892
Hay una serie de compuestos que tienen estructuras similares a la del NaCl, pero tienen una simetría menor (generalmente impuesta por la geometría del anión) que el propio NaCl. Estos compuestos incluyen:
- FeS 2 (pirita, “oro tontos”): S 2 2- (disulfuro) y Fe 2+
- CaC 2 (un carburo similar a la sal): Ca 2+ y aniones C 2 lineales
- CaCo 3 (calcita, piedra caliza, mármol): Ca 2+ y CO triangular 3 2-.
|
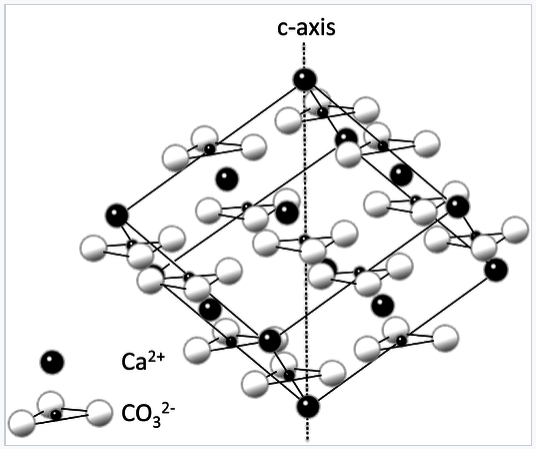
La célula unitaria romboédrica de la estructura cristalina de calcita. Se muestra el eje C hexagonal. |
La estructura cristalina de calcita (CaCo 3) se muestra arriba. Los iones triangulares CO 3 2- llenan agujeros octaédricos entre los iones Ca 2+ (esferas negras) en una red de NaCl distorsionada. Al igual que en el NaCl, cada ion está coordinado por seis de la otra clase. A partir de esta imagen podemos ver por qué la estructura de CaCo 3 tiene una simetría menor que la del NaCl. La simetría de rotación cuádruple de la celda unitaria de NaCl se pierde cuando los iones Cl esféricos son reemplazados por iones triangulares CO 3 2-. Debido a esta disminución de la simetría, los cristales transparentes de calcita son birrefringentes, como se ilustra a continuación.
|
Los cristales de calcita son birrefringentes, lo que significa que sus índices de refracción son diferentes en las dos direcciones principales del cristal. Esto da lugar al fenómeno de la doble refracción. |
Estructura de NIs
La estructura de NaCl se puede describir como una celosía cúbica centrada en la cara con todos los agujeros octaédricos llenos. ¿Y si comenzamos con una celosía empaquetada de cierre hexagonal en lugar de una celosía cúbica centrada en la cara?
|
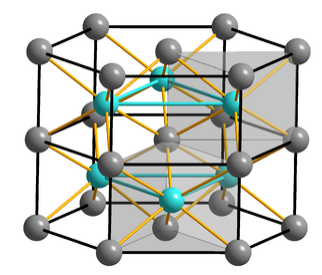
Estructura cristalina de arseniuro de níquel. Los prismas trigonales Ni 6 As son de color gris sombreado. En el centro de la figura se muestra un octaedro de seis átomos As que rodean un átomo de Ni. |
Esta es la estructura adoptada por los NIs y muchos otros sulfuros, fosfuros y arsenidos de metales de transición. Los cationes se muestran en gris mientras que los aniones son de color azul claro en la figura de la derecha. Los cationes están en coordinación octaédrica, por lo que cada catión se coordina a seis aniones. Los aniones también se coordinan a seis cationes, pero ocupan sitios prismáticos trigonales. En términos de apilamiento de capas, la estructura de NiAs es acBCACBC..., donde los sitios A y B (la red hcp) están ocupados por los átomos As, y los sitios c, que son eclipsados a lo largo del eje de apilamiento de capas, están ocupados por Ni. A diferencia de la estructura de NaCl, donde los sitios aniónicos y catiónicos son intercambiables, los NIs tienen sitios aniónicos y catiónicos únicos. La secuencia de apilamiento de capas para NIs se muestra a continuación:
- — A
- - - -c- - - -
- — B
- - - -c- - - -
- — A
- - - -c- - - -
- — B
- - - -c- - - -
La estructura de los NIs no puede ser adoptada por los compuestos iónicos debido a los cationes eclipsantes, porque las repulsiones catión-catión serían desestabilizadoras internamente para un compuesto iónico. Esta estructura es adoptada principalmente por compuestos MX covalentes y polares covalentes, típicamente con aniones X “blandos” (S, Se, P, As,...) y cationes de metales de transición de baja valencia. Por ejemplo, algunos compuestos con la estructura de NiAs son: MS, MSe, MTe (M=Ti, V, Fe, Co, Ni). A menudo se trata de estequiométricas no estequiométricas o estequiométricas complejas con vacantes ordenadas (Cr 7 S 8, Fe 7 S 8).