8.6: Unión en estructuras de TiS₂, MoS₂ y Pirita
- Page ID
- 71890
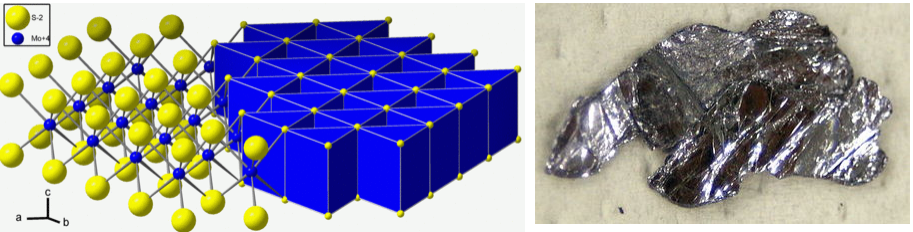
Muchos dialcogenidos en capas, como TiS 2 y ZrS 2, tienen la estructura de CdI 2. En estos compuestos, como hemos señalado anteriormente, los iones metálicos son coordinados octaédricamente por S. Curiosamente, las estructuras de MoS 2 y WS 2, si bien también están en capas, son diferentes. En estos casos, el metal está rodeado por un prisma trigonal de átomos de azufre. Los NbS 2, TaS 2, MoSe 2, MoTe 2 y WSe 2 también tienen la estructura de molibdenita prismática trigonal, que se muestra a continuación junto a un cristal laminar de MoS 2.
La coordinación de los iones metálicos por un prisma trigonal de iones calcogenuro es estericamente desfavorable en relación con la coordinación octaédrica. Hay contactos cercanos entre los iones calcogenuro, los cuales son eclipsados en la secuencia de apilamiento ABA/bab/ABA/bab... (donde “/” indica la brecha de van der Waals entre capas). ¿Qué estabiliza esta estructura?
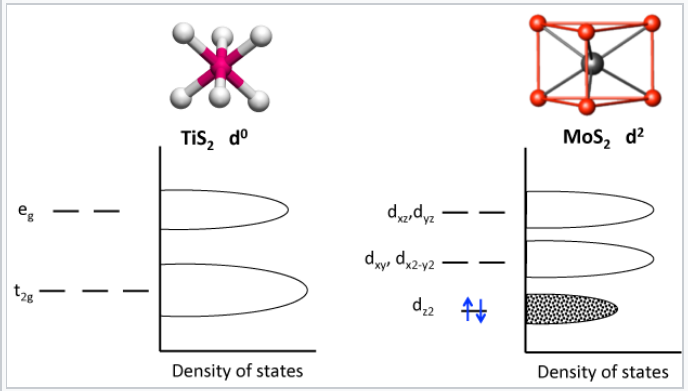
La estructura de molibdenita se presenta con mayor frecuencia en compuestos MX 2 con un recuento de electrones d 1 o d 2. La siguiente figura compara la división de energías d-orbitales en los entornos de coordinación octaédrica y prismática trigonal:
La estructura prismática trigonal se estabiliza en MoS 2 llenando la banda de energía más baja, la d z2. El orbital d z2 que apunta verticalmente a través de las caras triangulares superior e inferior del prisma trigonal, tiene la menor interacción con los ligandos de sulfuro y por lo tanto la energía más baja. Los orbitales d xz y d yz, que apuntan a los ligandos, tienen la mayor energía. El orbital d z2 es menor en energía en esta estructura que los orbitales t 2g en la estructura octaédrica de TiS 2.
|
divisiones orbitales d y bandas de energía en TiS 2 y MoS 2. MoS 2 es un semiconductor con un espacio de 1.3 eV entre sus bandas llenas y vacías. |
Debido a que tiene una banda t 2g sin llenar, TiS 2 es relativamente fácil de reducir por intercalación con Li. Por esta razón, LiTIS 2 fue uno de los primeros compuestos de intercalación estudiados por Stanley Whittingham, quien desarrolló el concepto de la batería de iones de litio no acuosa a principios de la década de 1970. [3] Debido a que tiene una banda d z2 llena, MoS 2 es más difícil de reducir, pero es puede intercalarse por reacción con el potente agente reductor n-butillitio para hacer Li x MoS 2 (x < 1). Los átomos en los planos van der Waals de estos compuestos son relativamente poco reactivos, lo que le da a MoS 2 su buena estabilidad oxidativa y permite su aplicación como lubricante de alta temperatura. Sin embargo, los átomos en los bordes de los cristales son más reactivos y de hecho son catalíticos. MoS 2 de alta superficie, que tiene una alta densidad de planos de borde expuestos, se utiliza como catalizador de hidrodesulfuración y también es de interés creciente como electrocatalizador para la reducción de agua a hidrógeno.
Los dialcogenidos metálicos en capas, incluidos los MoS 2, WS 2 y SnS 2, pueden formar nanoestructuras cerradas que toman la forma de cebollas de paredes múltiples y tubos de paredes múltiples. Estos materiales fueron descubiertos por el grupo de Reshef Tenne en 1992, poco después del descubrimiento de nanotubos de carbono. Desde entonces, los nanotubos se han sintetizado a partir de muchos otros materiales, incluidos los óxidos de vanadio y manganeso.
|
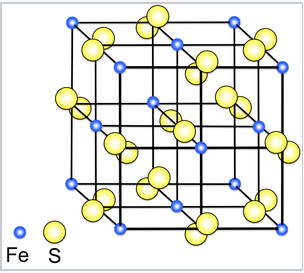
La estructura cristalina de pirita (FeS 2). La estructura está relacionada con el NaCl, con iones Fe 2+ y S2 2 - ocupando los sitios catiónicos y aniónicos. |
Aunque los disulfuros de metales de transición tempranos (TiS 2) y tardíos (PTs 2) tienen estructuras estratificadas, varios compuestos de MS 2 en la mitad de la serie de transición, como MnS 2, FeS 2 y RUs 2, tienen estructuras unidas tridimensionalmente. Por ejemplo, FeS 2 tiene la estructura de pirita, la cual está relacionada con la estructura de NaCl. La razón es que FeS 2 no es Fe 4+ (S 2-) 2, sino que en realidad es Fe 2+ (S 2 2-), donde S2 - es el anión disulfuro (que contiene un enlace sencillo como el anión peróxido O 2 2-). S 2- es un agente reductor demasiado fuerte para existir en el mismo compuesto con Fe 4+, que es un agente oxidante fuerte. Debido a que FeS 2 es en realidad Fe 2+ (S 2 2-), es un compuesto 1:1 y adopta una estructura 1:1.