8.5: Estructuras en capas y reacciones de intercalación
- Page ID
- 71867
Las estructuras en capas se caracterizan por enlaces fuertes (y típicamente covalentes) entre átomos en dos dimensiones y enlaces más débiles en la tercera. Una amplia gama de compuestos que incluyen halogenuros metálicos, óxidos, sulfuros, selenuros, boruros, nitruros, carburos y alótropos de algunos elementos puros (B, C, P, As) existen en formas estratificadas. Estructuralmente, la más simple de estas estructuras (por ejemplo, halogenuros y sulfuros metálicos binarios) puede describirse como que tiene alguna fracción de los sitios octaédricos y/o tetraédricos que se rellenan en las celosías fcc y hcp. Por ejemplo, la estructura CDCl 2 se forma llenando todos los sitios octaédricos en capas alternas de la red fcc, y la estructura CdI 2 es la relativa de esta estructura en la red hcp.
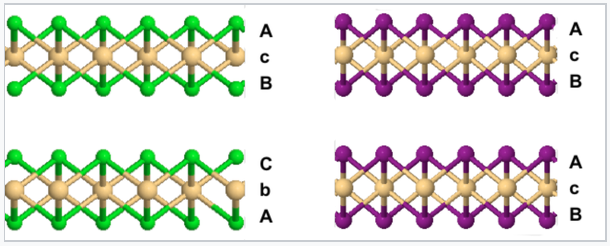
En la estructura CDCl 2, la secuencia de apilamiento de capas aniónicas es ABCABC...
En la estructura CdI 2, la secuencia de apilamiento de aniones es ABAB..., y todos los cationes son eclipsados a lo largo del eje de apilamiento.
|
Comparación de las estructuras cristalinas de CdCl 2 (izquierda) y CdI 2 (derecha) |
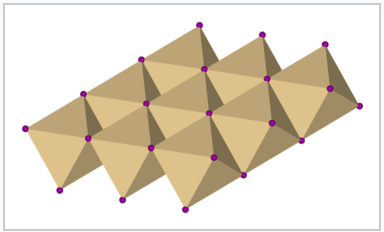
Estos son ejemplos de estructuras 6-3, porque los cationes están coordinados por un octaedro de seis aniones, y los aniones están coordinados por tres cationes para hacer una pirámide trigonal (como NH 3). Otra forma de describir estas estructuras es decir que los octaedros MX 6 comparten cada uno seis bordes en las hojas MX 2.
|
Dibujo poliédrico de una capa de la estructura CDCl 2 o CdI 2 que muestra octaedros MX 6 de bordes compartidos |
Debido a que estas estructuras colocan los átomos empaquetadores (los aniones) en contacto directo de van der Waals, son más estables para compuestos relativamente covalentes. De lo contrario, la repulsión electrostática entre los aniones en contacto desestabilizaría la estructura energéticamente. Más compuestos iónicos MX 2 tienden a adoptar las estructuras de fluorita (CaF 2) o rutilo (TiO 2), las cuales no están estratificadas.
A pesar de que estos dos tipos de estructura son los mismos a nivel de iones vecinos más cercanos y siguientes, la estructura de CdI 2 es mucho más común que la estructura de CdCl 2.
Estructura de CdCl 2:
McL 2 (M = Mg, Mn, Fe, Co, Ni, Zn, Cd)
NiBr 2, NiI 2, ZnBr 2, ZnI 2
Estructura de CDI 2:
McL 2 (M = Ti, V)
MBr 2 (M = Mg, Fe, Co, Cd)
MI 2 (M = Mg, Ca, Ti, V, Mn, Fe, Co, Cd, Ge, Pb, Th)
M (OH) 2 (M = Mg, Ca, Mn, Fe, Co, Ni, Cd)
MS 2 (M = Ti, Zr, Sn, Ta, Pt)
MSe 2 (M = Ti, Zr, Sn, V, Pt)
MTe 2 (M = Ti, Co, Ni, Rh, Pd, Pt)
Físicamente, los compuestos en capas son suaves y resbaladizos, porque los planos de capa se deslizan uno al otro fácilmente. Por ejemplo, el grafito, el MoS 2 y el talco (un silicato) son compuestos estratificados que se utilizan ampliamente como lubricantes y aditivos lubricantes.
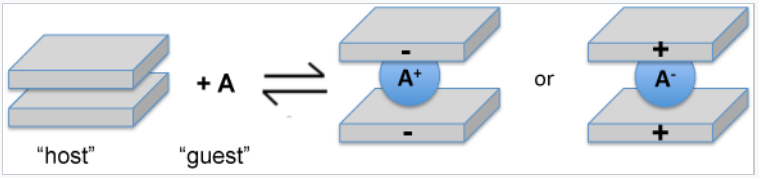
Una reacción importante de los compuestos estratificados es la intercalación. En las reacciones de intercalación, las moléculas huésped y los iones ingresan a las galerías que separan las láminas, generalmente con expansión de la celosía a lo largo del eje de apilamiento. Esta reacción es típicamente reversible si no perturbe la unión dentro de las láminas. A menudo, la fuerza impulsora de la intercalación es una reacción redox, es decir, la transferencia de electrones entre el huésped y el huésped. Por ejemplo, el metal litio reacciona con TiS 2, MoS 2 y grafito para producir LiTIS 2, Li x MoS 2 (x < 1) y LiC 6. En estos compuestos, el litio se ioniza a Li + y las láminas están cargadas negativamente. Los agentes oxidantes como Br 2, FeCl 3 y AsF 5 también reaccionan con grafito. En los compuestos de intercalación resultantes, las láminas están cargadas positivamente y las especies intercaladas son aniónicas.
Las reacciones de intercalación son especialmente importantes para el almacenamiento de energía electroquímica en baterías secundarias, como baterías de iones de litio, baterías de níquel-hidruro metálico y baterías de níquel-cadmio. La naturaleza reversible de la reacción de intercalación permite que los electrodos se carguen y descarguen hasta varios miles de veces sin perder su integridad mecánica. En las baterías de iones de litio, el material del electrodo negativo es típicamente grafito, que está intercalado por litio para hacer LiC 6. Varios óxidos y fosfatos diferentes que contienen iones de metales de transición activos redox (Mn, Fe, Co, Ni) se utilizan como materiales de electrodo positivo.
|
La intercalación oxidativa o reductiva implica la colocación de aniones o cationes entre láminas. |
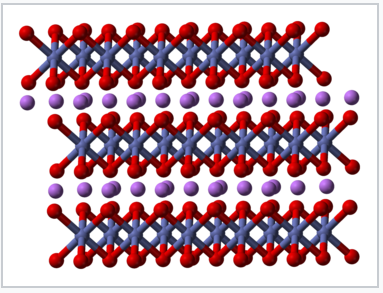
Las baterías de iones de litio basadas en CoO 2 fueron descritas por primera vez en 1980 [1] por el grupo de investigación de John B. Goodenough en Oxford. En baterías basadas en CoO 2, que tiene la estructura CDi 2, la semireacción del electrodo positivo es:
\[\ce{LiCoO2 \leftrightharpoons Li_{1-x}CoO_{2} + xLi^{+} + xe^{-}}\]
La media reacción del electrodo negativo es:
\[\ce{xLi^{+} + xe^{-} + xC_{6} \leftrightharpoons xLiC6}\]
La batería está completamente cargada cuando el electrodo positivo está en la forma CoO 2 y el electrodo negativo está en la forma LiC 6. La descarga implica el movimiento de iones Li + a través del electrolito, formando Li x CoO 2 y grafito en los dos electrodos.
|
Placa azul erigida por la Royal Society of Chemistry conmemorando el desarrollo de materiales catódicos para la batería de iones de litio |
|
Estructura cristalina de LiCoO 2 [2] |
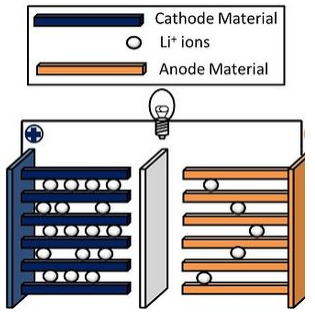
La batería de iones de litio es una batería de “mecedora”, llamada así porque cargar y descargar implica mover iones Li + de un lado a otro. CoO 2 es un ejemplo de un material de electrodo positivo que se ha utilizado en baterías de iones de litio. Tiene una alta densidad energética, pero las baterías basadas en CoO 2 tienen poca estabilidad térmica. Los materiales más seguros incluyen fosfato de hierro y litio (LiFePo 4) y LiMo 2 (M = una mezcla de Co, Mn y Ni). Estas baterías se utilizan ampliamente en computadoras portátiles, electrónica portátil, teléfonos celulares, herramientas inalámbricas y vehículos eléctricos e híbridos.
Una reacción de intercalación similar ocurre en baterías de níquel-cadmio y baterías de níquel-hidruro metálico, excepto en este caso la reacción implica el movimiento de protones dentro y fuera de la red de Ni (OH) 2, que tiene la estructura CDi 2:
\[\ce{NiO(OH) + H2O + e^{-} -> Ni(OH)2 + OH^{-}}\]
Hay muchos compuestos estratificados que no pueden ser intercalados por reacciones redox, típicamente porque se forma algún otro producto estable. Por ejemplo, la reacción de CdI 2 en capas con Li produce LiI (estructura NaCl) y Cd metal.