8.7: Estructuras de Espinela, Perovskita y Rutilo
- Page ID
- 71860
Hay tres estructuras más, que se derivan de celosías empaquetadas, que son particularmente importantes debido a las propiedades materiales de sus compuestos. Se trata de la estructura de espinela, en la que se basan las ferritas y otros óxidos magnéticos, la estructura de la perovskita, que es adoptada por los óxidos ferroeléctricos y superconductores, y la estructura del rutilo, que es una estructura binaria común 6:3 adoptada por óxidos y fluoruros.
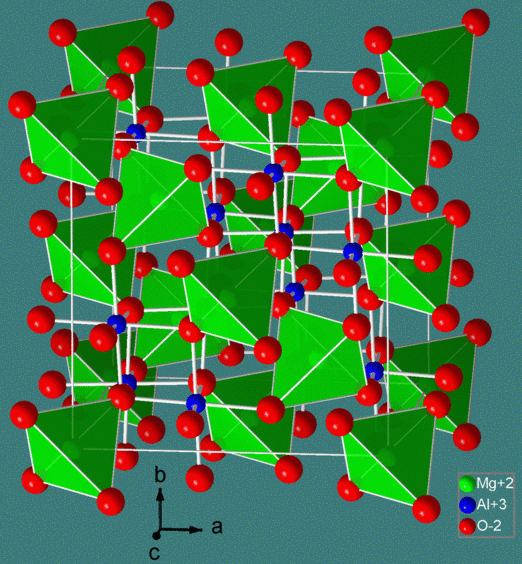
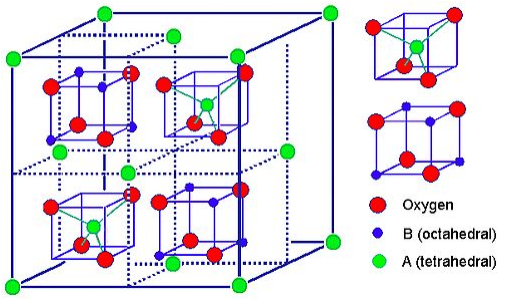
La estructura de espinela se formula MM' 2 X 4, donde M y M' son cationes coordinados tetraédricamente y octaédricamente, respectivamente, y X es un anión (típicamente O o F). La estructura lleva el nombre del mineral MgAl 2 O 4, y las espinelas de óxido tienen la fórmula general AB 2 O 4.
En la estructura normal de la espinela, hay una matriz de aniones muy empaquetada. Los cationes del sitio A llenan 1/8 de los agujeros tetraédricos y los cationes del sitio B llenan 1/2 de los agujeros octaédricos. A la izquierda se muestra una vista poliédrica de la celda unitaria de espinela normal, y arriba se muestra una vista simplificada (con el contenido de la mitad posterior de la celda eliminado para mayor claridad). Cada celda unitaria contiene ocho unidades de fórmula y tiene una composición A 8 B 16 O 32.
Las espinelas inversas tienen una estructura estrechamente relacionada (con la misma celda unitaria grande) en la que los iones del sitio A y la mitad de los iones del sitio B cambian de lugar. Las espinelas inversas se formulan así B (AB) O 4, donde los iones AB entre paréntesis ocupan sitios octaédricos, y los otros iones B están en sitios tetraédricos. También hay espinelas mixtas, las cuales son intermedias entre la estructura normal e inversa de la espinela.
Algunas combinaciones de espinela y espinela inversa AB son:
A 2+ B 3+, por ejemplo, MgAl 2 O 4 (espinela normal)
A 4+ B 2+, p. ej., Pb 3 O 4 = Pb II (Pb II Pb IV) O 4 (espinela inversa)
A 6+ B +, por ejemplo, Na 2 WO 4 (espinela normal)
Muchos óxidos magnéticos, como Fe 3 O 4 y CoFe 2 O 4, son espinelas.
Estructura de espinela normal frente a inversa
Para las espinelas de óxido de metal de transición, la elección de la estructura de espinela normal vs. inversa es impulsada principalmente por la energía de estabilización del campo cristalino (CFSE) de los iones en los sitios tetraédrico y octaédrico. Para las espinelas que contienen elementos 3d como Cr, Mn, Fe, Co y Ni, la configuración electrónica es típicamente de alto espín porque O 2- es un ligando de campo débil.
Como ejemplo, podemos considerar la magnetita, Fe 3 O 4. Este compuesto contiene un Fe 2 + y dos iones Fe 3 + por unidad de fórmula, por lo que podríamos formularlo como una espinela normal, Fe 2 + (Fe 3 +) 2 O 4, o como espinela inversa, Fe 3 + (Fe 2 + Fe 3 +) O 4. ¿Cuál tendría la energía más baja?
|
diagrama de energía d-orbital para Fe 2 + |
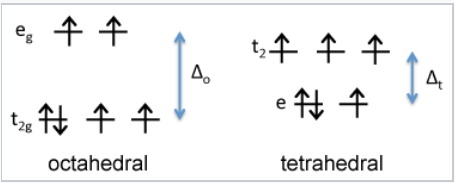
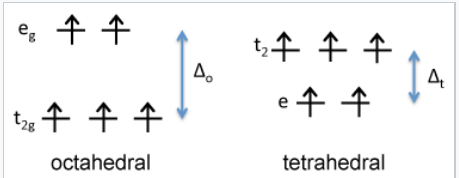
Primero consideramos la energía del campo cristalino del ion Fe 2 +, que es d 6. Comparando los diagramas tetraédricos y octaédricos de alto espín, encontramos que el CFSE en un campo octaédrico de iones O 2- es\([(4)(\frac{2}{5}) - (2)(\frac{3}{5})]\Delta_{o} - P = \mathbf{0.4 \Delta_{o} - P}\). En el campo tetraédrico, el CFSE es\([(3)(\frac{3}{5}) - (3)(\frac{2}{5})]\Delta_{t} -P = \mathbf{0.6\Delta_{t} - P}\). Dado que Δ o es aproximadamente 2.25 veces mayor que Δ t, la disposición octaédrica tiene un CFSE mayor y se prefiere para Fe 2 +.
|
diagrama de energía d-orbital para Fe 3 + |
En contraste, es fácil demostrar que Fe 3 +, que es d 5, tendría un CFSE de cero en la geometría octaédrica o tetraédrica. Esto significa que Fe 2 + tiene preferencia por el sitio octaédrico, pero Fe 3 + no tiene preferencia. En consecuencia, colocamos Fe 2 + en sitios octaédricos y Fe 3 O 4 es una espinela inversa, Fe 3 + (Fe 2 + Fe 3 +) O 4.
Las ferritas son compuestos de fórmula general M II Fe 2 O 4. Podemos ver que la magnetita es un ejemplo de una ferrita (con M = Fe). Otros metales divalentes (M = Mg, Mn, Co, Ni, Zn) también forman ferritas. Las ferritas pueden ser espinelas normales o inversas, o espinelas mixtas, dependiendo del CFSE del ion M II. Con base en su CFSE, Fe 2 +, Co 2 + y Ni 2 + tienen una fuerte preferencia por el sitio octaédrico, por lo que todos esos compuestos son espinelas inversas. ZnFe 2 O 4 es una espinela normal porque el ion Zn 2 + pequeño (d 10) encaja más fácilmente en el sitio tetraédrico que Fe 3 + (d 5), y ambos iones tienen cero CFSE. MgFe 2 O 4 y MnFe 2 O 4, en los que todos los iones tienen cero CFSE y ninguna preferencia de sitio, son espinelas mixtas. Las espinelas de cromita, M II Cr 2 O 4, son siempre espinelas normales porque el ion d 3 Cr 3 + tiene una fuerte preferencia por el sitio octaédrico.
Ejemplos de estructuras espinela normales e inversas:
MgAl 2 O 4 es una espinela normal ya que tanto Mg 2 + como Al 3 + son iones de metales no de transición y por lo tanto CFSE = 0. El ion Al 3 + con mayor carga prefiere el sitio octaédrico, donde está rodeado por seis átomos de oxígeno cargados negativamente.
Mn 3 O 4 es una espinela normal ya que el ion Mn 2 + es un sistema de alto spin d 5 con CFSE cero. Los dos iones Mn 3 + son de alto spin d 4 con mayor CFSE en los sitios octaédricos (3/5 Δ O) que en el sitio tetraédrico (2/5 Δ t ~ 1/5 Δ O).
Fe 3 O 4 es una espinela inversa ya que el ion Fe 3 + es un sistema de alto spin d 5 con CFSE cero. Fe 2 + es un sistema d 6 de espín alto con más CFSE en un sitio octaédrico que en uno tetraédrico.
NiFe 2 O 4 vuelve a ser una espinela inversa ya que Ni 2 + (un ion d 8) prefiere el sitio octaédrico y el CFSE de Fe 3 + (un ion d 5) es cero.
FeCr 2 O 4 es una espinela normal ya que Fe 2 + es un ion de alto spin d 6 con\(CFSE= [4(\frac{2}{5}) - 2(\frac{3}{5})] \Delta_{o} = \frac{2}{5} \Delta_{o}\) un sitio octaédrico, y Cr 3 + es un ion d 3 con CFSE = 3 (2/5) Δ O = 6/5 Δ O. De ahí que sea más energéticamente favorable que Cr 3 + ocupe ambos sitios octaédricos.
El Co 3 O 4 es una espinela normal. Incluso en presencia de ligandos oxo de campo débil, el Co 3 + es un ion d 6 de espín bajo con CFSE muy alto en los sitios octaédricos, debido a la alta carga y pequeño tamaño del ion Co 3 +. De ahí que los iones de Co 3 + ocupan ambos sitios octaédricos, y el Co 2 + ocupa el sitio tetraédrico.
Magnetismo de espinelas de ferrita
Las espinelas de ferrita son de interés tecnológico por su ordenamiento magnético, que puede ser ferrimagnético o antiferromagnético dependiendo de la estructura (normal o inversa) y la naturaleza de los iones metálicos. Fe 3 O 4, CoFe 2 O 4 y NiFe 2 O 4 son todas espinelas inversas y son ferriimanes. Estos dos últimos compuestos se utilizan en medios de grabación magnética y como imanes de deflexión, respectivamente.
|
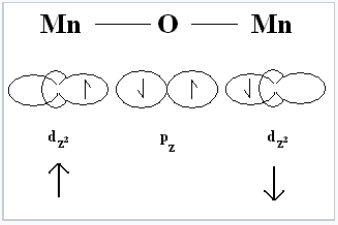
Ilustración del superintercambio antiferromagnético entre dos cationes de metales de transición a través de un átomo de oxígeno compartido. |
Para entender el magnetismo de las ferritas, necesitamos pensar en cómo los espines desapareados de los iones metálicos se acoplan en óxidos. Si un ion óxido es compartido por dos iones metálicos, puede mediar el acoplamiento de espines por superintercambio como se muestra a la derecha. El acoplamiento puede ser antiferromagnético, como se muestra, o ferromagnético, dependiendo del llenado orbital y la simetría de los orbitales involucrados. Las reglas de Goodenough-Kanamori predicen el ordenamiento magnético local (ferromagnético vs. antiferromagnético) que resulta del acoplamiento de superintercambio de los espines electrónicos de iones de metales de transición. Para las ferritas, el acoplamiento más fuerte es entre iones en sitios tetraédricos y octaédricos vecinos, y el orden de los espines entre estos dos sitios es confiablemente antiferromagnético.
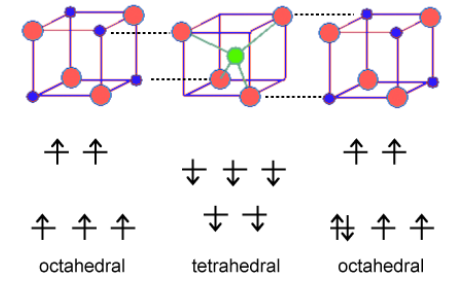
Debido a que todos los sitios tetraédricos y octaédricos en un cristal de espinela o espinela inversa se acoplan de manera idéntica, resulta que los iones en los sitios tetraédricos tendrán todos una orientación (por ejemplo, giro hacia abajo) y los iones en todos los sitios octaédricos tendrán la orientación opuesta (por ejemplo, centrifugado). Si el número de giros en los dos sitios es el mismo, entonces el sólido será antiferromagnético. Sin embargo, si el número de espines es desigual (como en el caso de Fe 3 O 4, CoFe 2 O 4 y NiFe 2 O 4) entonces el sólido será ferrimagnético. Esto se ilustra anteriormente para Fe 3 O 4. Los giros en los sitios Fe 3 + cancelan, porque la mitad de ellos están arriba y la mitad están abajo. Sin embargo, los cuatro electrones desapareados en los iones Fe 2 + están todos alineados de la misma manera en el cristal, por lo que el compuesto es ferrimagnético.
Las perovskitas son óxidos ternarios de fórmula general ABO 3. Más generalmente, la fórmula de perovskita es ABX 3, donde el anión X puede ser O, N o halógeno. Los iones A son típicamente iones grandes tales como Sr 2 +, Ba 2 +, Rb +, o un ion lantánido 3+, y los iones B son iones de metales de transición más pequeños tales como Ti 4 +, Nb 5 +, Ru 4 +, etc. El mineral después del cual se nombra la estructura tiene la fórmula CaTiO 3.
La estructura de perovskita tiene simetría cúbica simple, pero está relacionada con la red fcc en el sentido de que los cationes del sitio A y los tres átomos de O comprenden una red fcc. Los cationes del sitio B llenan 1/4 de los agujeros octaédricos y están rodeados por seis aniones óxido.
|
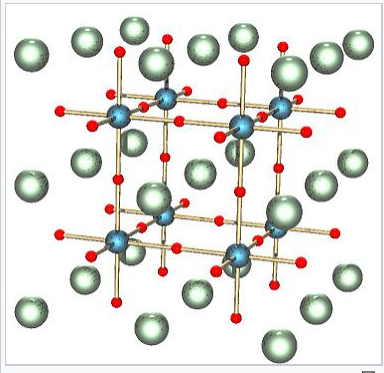
Estructura de perovskita ABX 3. A, B y X son blancos, azules y rojos, respectivamente. |
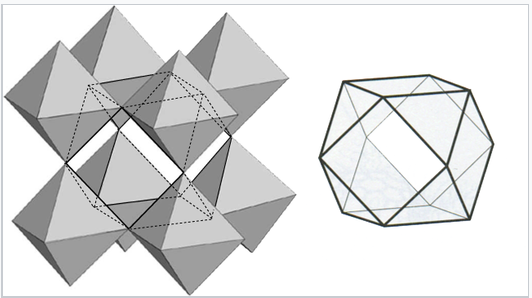
La coordinación de los iones A en la perovsita y la disposición de los octaedros BO 6 se entiende mejor observando la estructura ReO 3, que es la misma estructura pero con los cationes del sitio A eliminados. En la representación poliédrica de la estructura mostrada a la derecha, se puede observar que los octaedros comparten todos sus vértices pero no comparten ningún borde octaédrico. Esto hace que las estructuras ReO 3 y perovskita sean flexibles, como bastidores de vino tridimensionales, ya que los octaedros pueden rotar e inclinarse cooperativamente. Ocho de estos octaedros rodean una gran cavidad cuboctaédrica, que es el sitio de los iones A en la estructura de la perovskita. Los cationes en estos sitios están coordinados por 12 iones óxido, como se esperaba de la relación entre las redes de perovskita y fcc.
|
Representación poliédrica de la estructura ReO 3 que muestra la gran cavidad cuboctaédrica rodeada por 12 átomos de oxígeno |
Debido a que el sitio A está vacío en la estructura ReO 3, los compuestos con esa estructura pueden ser intercalados reversiblemente por pequeños iones como Li + o H +, que luego ocupan sitios en la cavidad cuboctaédrica. Por ejemplo, las ventanas inteligentes que se oscurecen a la luz solar brillante contienen el material electrocrómico WO 3, que tiene la estructura ReO 3. En la luz solar, una célula fotovoltaica impulsa la intercalación reductora de WO 3 de acuerdo con la reacción:
\[\ce{xH^{+} + xe^{-} + WO3 \leftrightharpoons H_{x}WO3}\]
El documento WO 3 es un compuesto amarillo claro que contiene d 0 W (VI). En contraste, H x WO 3, que es de valencia mixta W (V) -W (VI) = d 1 -d 0, tiene un color azul profundo. Dicha coloración es típica de los complejos de metales de transición de valencia mixta porque sus electrones d pueden excitarse a niveles de banda de conducción deslocalizados mediante luz roja. Debido a que el proceso de intercalación-desintercalación electroquímica es alimentado por una célula solar, el tinte de las ventanas puede ajustarse automáticamente al nivel de luz solar.
Perovskitas ferroeléctricas
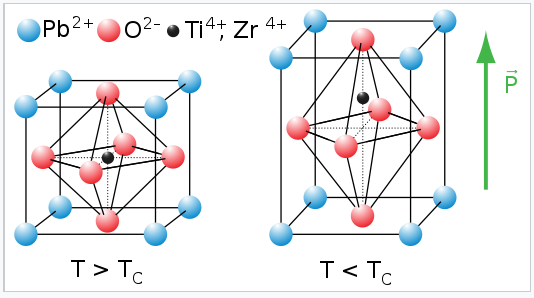
La flexibilidad de la red de octaedros BO 6 que comparten esquinas también es muy importante en los óxidos ferroeléctricos que tienen la estructura de perovskita. En algunas perovsitas con pequeños cationes de sitio B, como Ti 4 + y Nb 5 +, el catión es demasiado pequeño para encajar simétricamente en el octaedro BO 6. El octaedro se distorsiona, permitiendo que el catión se mueva descentrado. Estas distorsiones pueden ser tetragonales (como en el ejemplo mostrado a la derecha), romboédricas u ortorrómbicas, dependiendo de si el catión se mueve hacia un vértice, cara o borde del octaedro BO 6. Mover el catión descentrado en el octaedro crea un dipolo eléctrico. En ferroeléctricos, estos dipolos se alinean en celdas unitarias vecinas mediante rotación cooperativa e inclinación de octaedros. El cristal adquiere así una polarización eléctrica neta.
|
Distorsión tetragonal de la celda unitaria de perovskita en el óxido ferroeléctrico PZT, PBTi x Zr 1 -x |
La ferroelectricidad se comporta de manera análoga al ferromagnetismo, salvo que la polarización es eléctrica más que magnética. En ambos casos, existe una temperatura crítica (T c) por encima de la cual desaparece la polarización espontánea del cristal. Por debajo de T c, la polarización eléctrica de un ferroeléctrico se puede conmutar con un campo coercitivo, y el bucle de histéresis de polarización vs. campo se asemeja al de un ferroimán. Por encima de T c, el cristal es paraeléctrico y tiene una alta permitividad dieléctrica.
Los óxidos ferroeléctricos y paraeléctricos (junto con los piezoeléctricos y piroeléctricos) tienen una amplia variedad de aplicaciones como interruptores, actuadores, transductores y dieléctricos para capacitores. Los capacitores ferroeléctricos son importantes en los dispositivos de memoria (FRAM) y en los circuitos de sintonización de teléfonos celulares. Los multiferroicos, que son materiales que son simultáneamente ferroeléctricos y ferromagnéticos, son raros y ahora se están investigando intensamente debido a sus posibles aplicaciones en la memoria magnética eléctricamente direccionable.
Las perovskitas halogenuros (ABX 3, X = Cl, Br, I) se pueden elaborar combinando sales de iones A monovalentes (A + = Cs +, NH 4 +, RNH 3 +) y sales de metales divalentes como PbCl 2 o PbI 2. Estos compuestos han despertado interés reciente como absorbentes de luz para células solares de película delgada que producen electricidad a partir de la luz solar. Las perovskitas de plomo y haluro de estaño pueden cultivarse como películas delgadas a partir de precursores de solución o por evaporación térmica a temperaturas relativamente bajas. En algunas perovskitas de haluro de plomo, la movilidad de electrones y agujeros es muy alta, comparable a la de los semiconductores III-V más caros como el GaAs, que deben cultivarse como monocristales muy puros a altas temperaturas para su uso en células solares. Debido a su alta movilidad portadora, algunas perovskitas de haluro de plomo también son electroluminiscentes y son de interés como materiales económicos para diodos emisores de luz (LED).
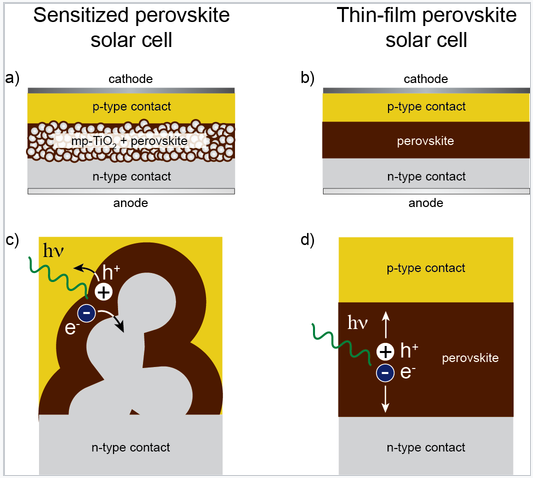
Las perovskitas de estaño y haluro de plomo se estudiaron por primera vez en la década de 1990 como materiales para electrónica de película delgada, [4] y más recientemente como absorbedores de luz en células solares sensibilizadas por colorante. Poco después de que se reportaran los resultados sobre las células de perovskita sensibilizadas por colorante, se descubrió que las perovskitas de haluro también podrían usarse en células solares de estado sólido de película delgada. Las estructuras de estas células solares se muestran esquemáticamente a la derecha. Las mayores eficiencias de conversión de energía solar reportadas de las células solares de perovskita han saltado de 3.8% en 2009 [5] a 10.2% en 2012 [6] y un 20.1% certificado en 2014. [7]. Las células de mayor rendimiento hasta la fecha contienen plomo divalente en el sitio del catión de la perovskita B y una mezcla de iones metilamonio y formamidinio en el sitio del catión de la perovskita A.
|
a) Arquitectura de célula solar en la que un absorbente de perovskita de haluro de plomo recubre una capa de anatasa nanocristalina TiO 2. b) Célula solar de película delgada, con una capa de perovskita de haluro de plomo intercalada entre dos contactos selectivos. c) Generación y extracción de carga en la arquitectura sensibilizada y d) en la arquitectura de película delgada. |
A pesar de su impresionante eficiencia, las células solares de perovskita son estables durante períodos de tiempo relativamente cortos y son sensibles al aire y la humedad. La investigación actual se centra en comprender los mecanismos de degradación de estas células solares y mejorar su estabilidad en condiciones de operación.
La estructura del rutilo es una importante estructura MX 2 (X = O, F). Se trata de una estructura 6:3, en la que los cationes están coordinados octaédricamente por aniones, y como tal es intermedio en polaridad entre las estructuras CaF 2 (8:4) y SiO 2 (4:2). El rutilo mineral es uno de los polimorfos del TiO 2, los otros (anatasa y brookita) también son estructuras 6:3.
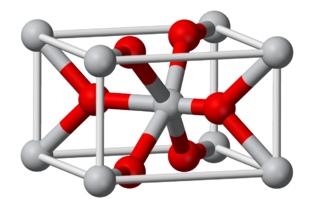
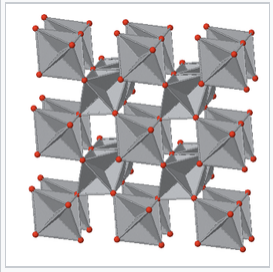
La estructura del rutilo puede describirse como una versión distorsionada de la estructura de los NIs con la mitad de los cationes eliminados. Recordemos que los compuestos con la estructura de NIs eran típicamente metálicos porque los iones metálicos son eclipsados a lo largo del eje de apilamiento y por lo tanto están en contacto relativamente cercano En el rutilo, los octaedros MO 6 comparten bordes a lo largo del eje c tetragonal, por lo que algunos óxidos de rutilo, como NbO 2, RuO 2 e iRO 2, también son metálicos debido a la superposición orbital d a lo largo de ese eje. Estos compuestos son importantes como catalizadores de electrolizador y soportes de catalizador porque combinan una alta actividad catalítica con una buena conductividad electrónica.
|
Ver abajo el eje c tetragonal de la celosía de rutilo, mostrando octaedros MO 6 de bordes compartidos. |
El rutilo TiO 2, debido a su alto índice de refracción, es el pigmento base para la pintura blanca. Es un semiconductor de banda ancha que también ha sido ampliamente investigado como electrodo para células solares que dividen el agua y como fotocatalizador (principalmente como polimorfo anatasa) para la degradación de contaminantes en el aire y el agua. El vidrio autolimpiante explota las propiedades fotocatalíticas de una película delgada de TiO 2 para eliminar sustancias oleosas de la superficie del vidrio y mejorar las propiedades humectantes del vidrio.