9.9: Energía de Resonancia de Metales
- Page ID
- 72151
La solución al problema anterior debe considerar la naturaleza mecánica cuántica del electrón. Los electrones de valencia en el metal Na están en orbitales que están deslocalizados sobre todo el cristal. Sin embargo, en la forma Na + e - “sal”, los electrones se localizan en sitios aniónicos específicos. Esta localización imparte una energía cinética adicional (a través del efecto "partícula en una caja") que se suma a la energía total. A partir del resultado mecánico cuántico para una partícula en una caja unidimensional, obtenemos
\[KE= \frac{h^{2}n^{2}}{8mL^{2}}\]
donde:
- h = Constante de Plank = 6.626 x 10 -34 J s
- n = nivel de energía, se supone que es el más bajo, n = 1
- m = masa electrónica = 9.109 x 10 -31 kg
- L = tamaño de la caja
Si aproximamos el tamaño de la “caja” electrónica como 3 Å (3 x 10 -10 m), obtenemos:
\[KE= \frac{(6.626 \cdot 10^{-34})^{2}(6.022 \cdot 10^{23})}{8 \cdot (9.1 \cdot 10^{-31})(3 \cdot 10^{-10})^{2}} = 4.04 \cdot 10^{5} \frac{J}{mol} = + 404 \frac{kJ}{mol}\]
Esta energía cinética extra hace que el Na + e - “sal” sea inestable en relación con el metal deslocalizado de electrones.
|
El sodio debe sus propiedades metálicas a la estabilización por resonancia de sus electrones de valencia deslocalizados. |
El cálculo no es muy preciso porque la energía cinética electrónica no es cero en el metal, y porque el tamaño de la “caja” no está tan bien definido. Sin embargo, sí ilustra que la deslocalización de electrones tiene un efecto sustancial en la estabilización termodinámica de metales. La situación es totalmente análoga a la estabilización de moléculas aromáticas por deslocalización electrónica. En moléculas como el benceno, la resonancia es también un efecto de energía cinética cuántica mecánica. En general, la energía de estabilización de resonancia es significativamente mayor en los metales que en las moléculas orgánicas π-deslocalizadas. Por ejemplo, la energía de resonancia de los seis electrones π en benceno es aproximadamente 151 kJ/mol, menos de la mitad del valor que hemos calculado (por electrón) en sodio metal.
Curiosamente, varios de los metales alcalinos (y otros elementos metálicos) se transforman a presiones ultraaltas en fases aislantes ópticamente transparentes en las que se localizan los electrones de valencia. [10] [11] Estas fases eléctricas de alta presión desafían la regla general (que encontraremos en el Capítulo 10) de que los aisladores se transforman en metales con densidad suficientemente alta. Ilustran cómo la estructura estable de un elemento puede depender del equilibrio entre la energía reticular de una estructura de electrido iónico y la energía de resonancia de un metal deslocalizado de electrones.
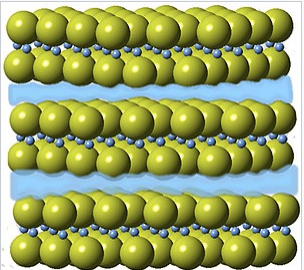
|
Estructura cristalina de Ca 2 N, con capas de electrones 2D mostradas esquemáticamente en azul. |
Además de los electridos similares a sales que se forman complejando metales alcalinos con ligandos de éter corona, hay una serie de nitruros y óxidos de estado sólido recientemente descubiertos, como Ca 2 N y Ca 24 Al 28 O 64, que se formulan más adecuadamente como eléctricos, es decir, como [Ca 2 N +] (e -) [12] y [Ca 24 Al 28 O 64] 4+ (e −) 4. [13] En estos compuestos los átomos de Ca, Al, O y N tienen sus estados de oxidación de octeto ordinarios (+2, +3, -2 y -3, respectivamente), y los electrones actúan como aniones, rellenando huecos o capas similares a jaulas en el cristal. Por ejemplo, Ca 2 N adopta la estructura anti-CDCl 2, como se muestra a la derecha, con espacios vacíos entre capas que están ocupadas por un gas 2D de electrones. Al igual que otros materiales en capas, Ca 2 N se puede deslaminar fácilmente en nanoláminas delgadas mientras conserva su estructura y propiedades como un electrido. [14] Estos compuestos son poderosos agentes reductores y también tienen una actividad interesante como catalizadores. [15]